奶牛乳房炎大肠杆菌新疆分离株系统分群及其耐药特性与毒力因子分布研究
2017-11-01于伟伟乔军孟庆玲彭叶龙张金生王辉胜才学鹏陈创夫
于伟伟,乔军,孟庆玲,,彭叶龙,张金生,王辉胜,才学鹏,陈创夫
(1.石河子大学动物科技学院,石河子 832003;2.中国农业科学院兰州兽医研究所,兰州 730046;3.新疆沙湾县畜牧兽医站,沙湾 832100;4.新疆沙湾县乌兰乌苏镇畜牧兽医站,沙湾 832100; 5.阿克苏地区动物疫病控制诊断中心,阿克苏 843000)
奶牛乳房炎大肠杆菌新疆分离株系统分群及其耐药特性与毒力因子分布研究
于伟伟1,乔军1,孟庆玲1,2,彭叶龙5,张金生3,王辉胜4,才学鹏2,陈创夫1
(1.石河子大学动物科技学院,石河子 832003;2.中国农业科学院兰州兽医研究所,兰州 730046;3.新疆沙湾县畜牧兽医站,沙湾 832100;4.新疆沙湾县乌兰乌苏镇畜牧兽医站,沙湾 832100; 5.阿克苏地区动物疫病控制诊断中心,阿克苏 843000)
本研究利用PCR技术对奶牛乳房炎大肠杆菌新疆临床分离株进行种系分群、耐药基因和毒力基因检测,并测定大肠杆菌对16种抗菌药物的敏感性。从1 068份奶牛乳房炎样品中分离出124株大肠杆菌,分离率为11.6%,其中A群(占58.8%)分布较多,其次是B1群(占16.1%)和D群(占13.7%)及B2群(占11.3%)。药敏结果显示,分离株对常用抗生素表现出不同程度的耐药性,其中对多黏菌素B和氨苄西林的耐药率最高,分别为76.6%和75.8%;多重耐药株中以3~7耐药株较多,最多对15种抗菌药物耐药,药敏表型与基因型基本一致。在分离株中携带的主要毒力基因为irp2(29.8%),其次是astA(21.7%)、iucD(14.5%)、afa8E(9.6%)、ehxA(7.2%)、saa(5.6%)和tsh(1.6%),其中毒力基因Irp2在A群的出现频率要高于其他种群,而在A群中出现3种以上的毒力基因组合则少于其他种群。
奶牛乳房炎;大肠杆菌;系统进化分群;耐药性;毒力基因
乳房炎是造成奶牛养殖业经济损失最为严重的疾病之一[1],它常常会引起牛奶产量和乳制品质量的下降,甚至还会影响食品安全[2,3]。目前,引起奶牛乳房炎的主要病原菌包括大肠杆菌、金黄色葡萄球菌和链球菌等,其中大肠杆菌性奶牛乳房炎在我国很多地区广泛流行[4]。Clennont等根据大肠杆菌的进化标志基因将大肠杆菌分为A、B1、B2和D群,其中B2群和D群属于肠道外大肠杆菌[5,6],而A群则属于共生性大肠杆菌,一般分布于宿主体内,在某些条件下会导致奶牛乳房炎的发生[7]。
目前,在兽医临床上使用抗菌药物是治疗奶牛乳房炎的主要方法[8]。然而,随着抗菌药物的大量使用,大肠杆菌耐药菌株不断出现,给该病的有效防治带来了极大的困难,同时超广谱耐药性大肠杆菌通过动物性食品传递给人群的风险也在不断增加,给卫生安全也带来了极大的威胁[9]。近年来,随着新疆畜牧业的快速发展,奶牛养殖业规模不断扩大,规模化牛场奶牛乳房炎的发病率不断增加,成为制约奶业快速发展的瓶颈。为了解奶牛乳房炎大肠杆菌的耐药特性和分子特征,本研究采集了新疆地区规模化奶牛场中国荷斯坦牛的乳房炎奶样,对分离到的大肠杆菌进行了种系进化群分型和耐药特性及毒力基因分析,以期为奶牛乳房炎治疗的临床合理用药提供科学依据。
1 材料与方法
1.1 菌株来源
2015年10月~2016年9月,从新疆五家渠、石河子、塔城、阿克苏等地区的规模化奶牛场采集临床型乳房炎和隐性乳房炎的牛奶样本1 068份。样本采集方法:先使用75%酒精对乳头进行消毒,弃前三把奶,收集到灭菌离心管,放于冰盒中带回实验室立即进行细菌分离鉴定。质粒转化使用的受体菌株E.coli DH5α由本实验室提供。
1.2 试剂和培养基
LB营养琼脂、伊红美蓝培养基、麦康凯培养基、药敏试验MH培养基均购自北京奥博星生物技术有限公司;16种药敏片购自杭州滨和微生物试剂有限公司;PCR反应试剂、pMD19-T载体、DNA Marker均购自宝生物工程(大连)有限公司;质粒小量提取试剂盒和小量琼脂糖凝胶DNA回收试剂盒购自诺维森(北京)生物科技有限公司。
1.3 大肠杆菌分离及鉴定
将50μL奶样均匀涂布于LB固体培养基,置于培养箱37℃过夜培养。根据菌落培养特征,挑取大肠杆菌疑似菌落进行纯化和鉴定。将纯化的细菌进行革兰氏染色,接种于麦康凯固体培养基和伊红美蓝固体培养基观察菌落特征;初步鉴定为阳性者,然后按照参考文献[10]建立的16S rRNA基因测序法,进行16S rDNA PCR扩增和测序验证。引物合成和测序均由北京六合华大基因科技股份有限公司完成,引物序列见表1。纯化和鉴定好的大肠杆菌菌株置于含有25%甘油的LB肉汤培养基中-80℃冻存备用。
1.4 大肠杆菌系统进化分群
根据Clennont等[5]的报道合成3对引物,引物序列见表1。PCR采用25μL反应体系:ddH2O 12μL,2×PCR Mix10 μL,模板2 μ L,上、下游引物各0.5μL,补水至25μL;反应条件:95℃预变性4min,95℃变性30s,59℃退火30s,72℃延伸30s,30个循环;最后72℃延伸10min。反应结束后取10μL PCR产物用2.5%琼脂糖凝胶电泳,并照相记录结果。引物均由北京六合华大基因科技股份有限公司合成。
1.5 药物敏感性试验
对奶牛乳房炎大肠杆菌新疆分离株进行16种常用药物的药敏试验,所选药物见表1,按照CLSI推荐的K-B法进行。根据CLSI (2012)的标准判定其耐药性。

表1 本研究所用引物及目标基因
1.6 毒力基因和耐药基因的检测
根据参考文献[11,12]确定16种毒力基因和3种耐药基因的引物序列(表1)。毒力基因PCR反应体系为20μL:ddH2O 7μL,2×PCR Mix10μL,模板2μL,上、下游引物各0.5μL;反应条件:95℃预变性5min,95℃变性30s,x℃(不同毒力基因的退火温度)退火30s,72℃延伸75s,30个循环;最后72℃延伸10min。耐药基因PCR反应体系见1.4;反应条件:94℃预变性5min,94℃变性30s,54℃退火30s,72℃延伸1min,30个循环;最后72℃延伸10min。PCR产物用1%琼脂糖凝胶电泳检测并切胶纯化,克隆于pMD19-T质粒中,由北京六合华大基因科技股份有限公司测序,序列结果用NCBI-BLAST比对后确定毒力基因和耐药基因。
2 结果与分析
2.1 细菌的分离鉴定
从1 068份奶牛乳房炎样品中共分离出124株大肠杆菌,分离率为11.6%。大肠杆菌在LB固体培养基呈白色、湿润、闪光、不透明的圆形菌落;在麦康凯平板上长出红色、圆形、扁平、表面光滑、湿润不透明菌落;在伊红美蓝培养基上形成黑色或深紫色带金属光泽的菌落;细菌革兰氏染色后镜检呈两端钝圆、红色、粗短的小杆菌(图1);用引物扩增16S rDNA 基因后,分离菌株扩增产物均获得202bp的目的片段(图2),经测序,与GenBank上的大肠杆菌16S rDNA序列同源性均为99%~100%。

图1 细菌革兰氏染色镜检(100×)

图2 部分大肠杆菌16S rDNA PCR扩增
2.2 大肠杆菌临床分离株的系统进化分群
对124株大肠杆菌进行系统进化分群鉴定,判定标准为:A群(chuA-、yjaA-、TSPE4.C2-或chuA-、yjaA+、TSPE4.C2-),B1群(chuA、TSPE4.C2+),B2群(chuA+、yjaA+),D群(chuA+、yjaA-)。PCR产物经凝胶电泳可观察到chuA(279bp)、yiaA(211bp)和(或)TspE4.C2(152bp)的特异电泳条带。根据PCR条带确定奶牛乳房炎大肠杆菌菌株的系统进化分群结果(图3)。其中A群73株(58.8%),B1群21株(16.1%),D群17株(13.7%),B2群14株(11.3%)。
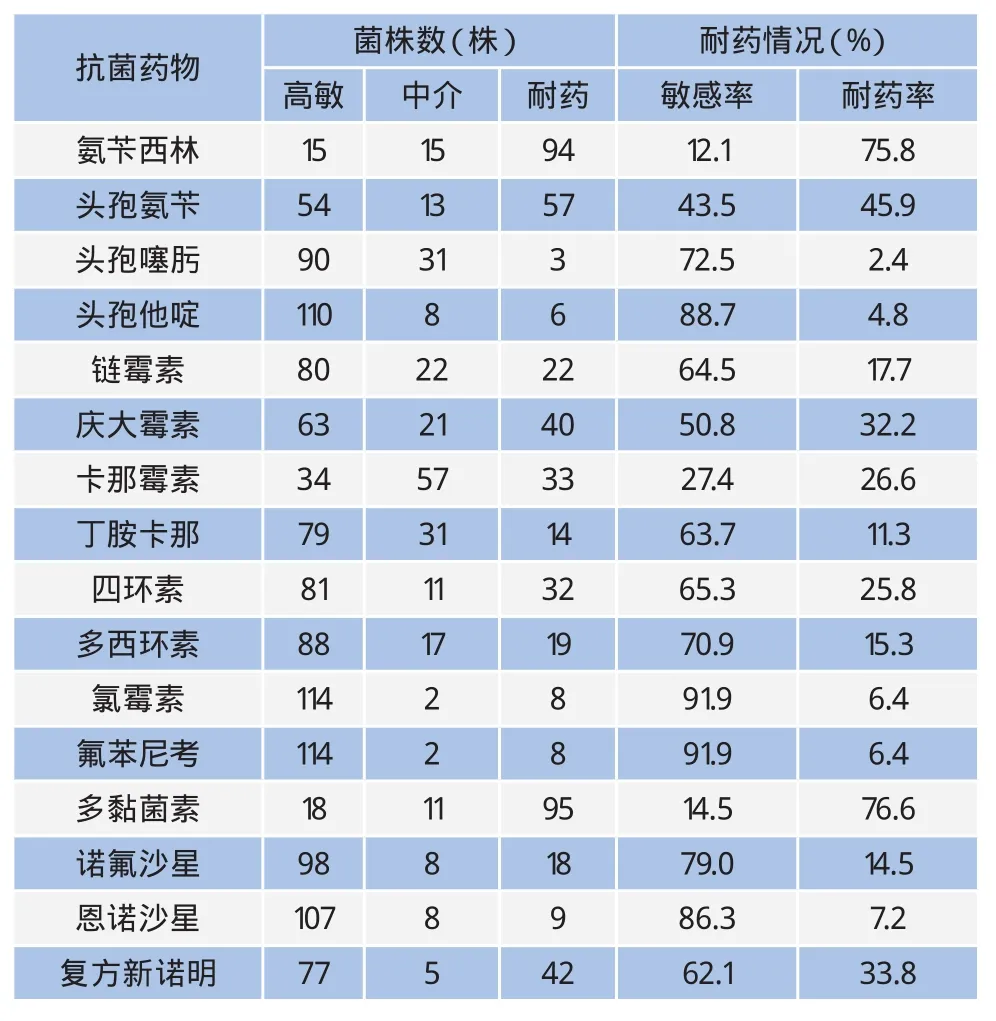
表2 大肠杆菌药物敏感性试验结果
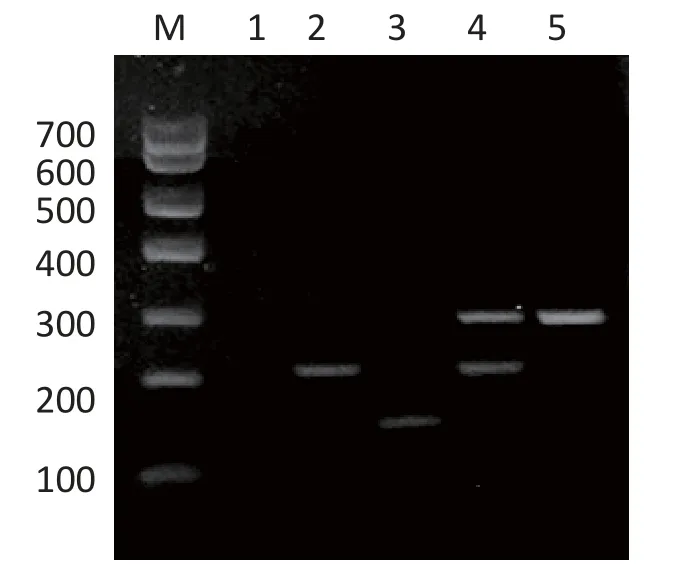
图3 三重PCR进行大肠杆菌分群扩增
2.3 大肠杆菌临床分离株抗生素耐药表型
对124株大肠杆菌进行临床常用抗菌药的敏感性检测,结果95株大肠杆菌对多 菌素B耐药,耐药率最高,为76.6%,其次是氨苄西林,为75.8%。对氯霉素、氟苯尼考、头孢他啶、恩诺沙星、诺氟沙星高度敏感,敏感率分别为91.9%、91.9%、88.7%、86.3%和79.0%(表2)。
2.4 大肠杆菌临床分离株blaTEM、blaSHA和blaOXA-1基因的检测
利用3重PCR对94株耐氨苄西林的菌株进行耐药基因的检测,并对目的条带进行了回收并克隆到pMD19-T载体中,测序鉴定以验证耐药基因。其中84株携带有blaTEM和blaOXA-1基因,占所有菌株的67.7%,有82株(66.1%) 携带了blaTEM基因,19株(15.3%)携带了blaOXA-1基因,有些菌株含有blaTEM和blaOXA-1两个基因,所有耐氨苄西林菌株中没有检测到blaSHA基因(图4)。

图4 大肠杆菌分离株blaTEM、blaSHA和blaOXA-1基因的PCR扩增
2.5 大肠杆菌临床分离株多重耐药性分析
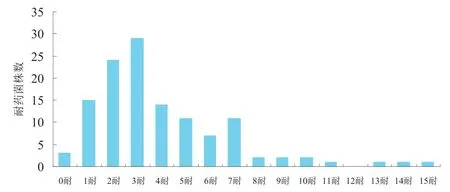
图5 大肠杆菌分离株对16种抗菌药物的多重耐药性
本次试验分离的124株大肠杆菌对所有抗菌药物都敏感的菌株有3株,仅对一种药物耐药的有15株。多重耐药株中以3~7耐药株较多,最多的对15种抗菌药物耐药(图5)。
2.6 大肠杆菌临床分离株毒力基因的检测
对124株大肠杆菌进行PCR扩增,结果共检测出7种毒力基因,扩增条带与预期目的条带大小相符(图6),并对目的条带进行了回收并克隆到pMD19-T载体中,测序鉴定以验证毒力基因。结果,有69株表达毒力基因,其中以irp2(29.8%)基因检出率最高,且在A群的出现频率要高于其他种群,其次是astA(21.7%)、 iucD(14.5%)、afa8E(9.6%)、ehxA(7.2%)、saa(5.6%)和tsh(1.6%),而fl7A、papC、sfaD、eaeA、iss、cnf2、vat、stxl和stx2则没有检测到(表3)。

图6 7种毒力基因PCR扩增
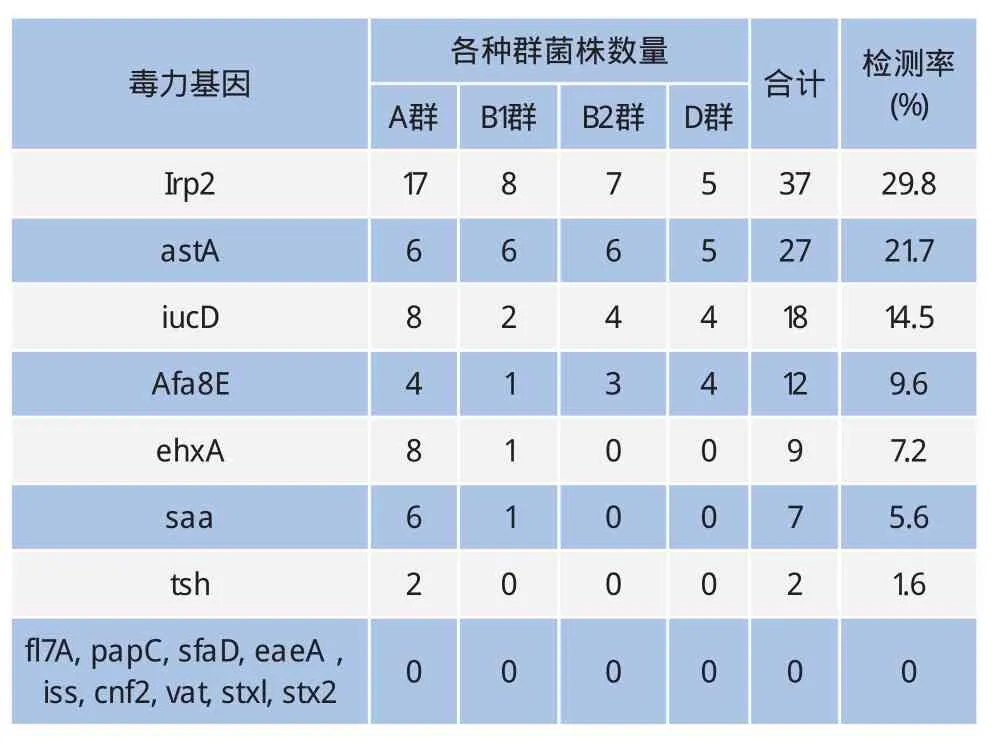
表3 奶牛乳房炎源性大肠杆菌毒力因子分布状况
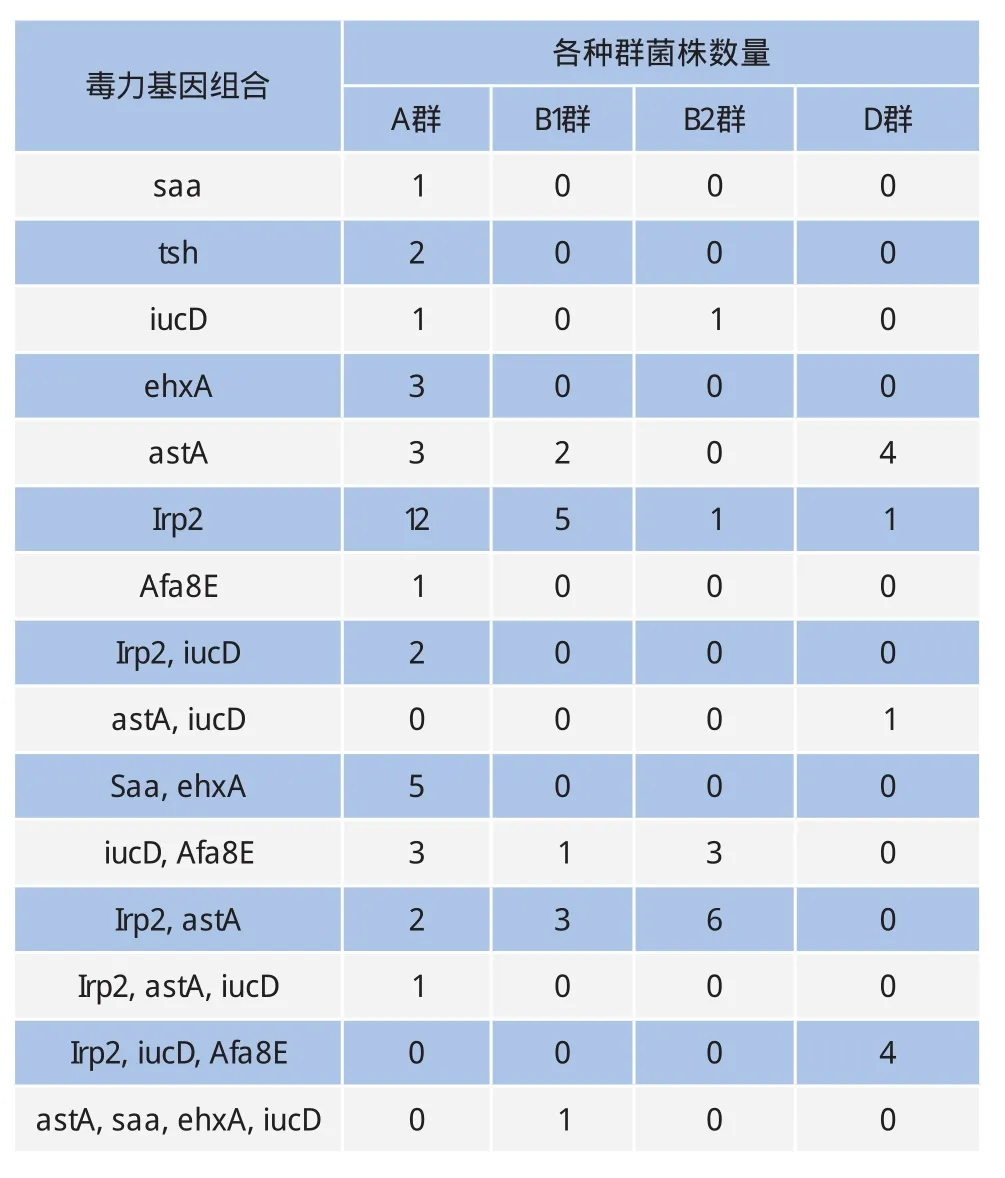
表4 奶牛乳房炎源性大肠杆菌毒力基因分布和组合模式
毒力基因的分布具有多样性,A群有36株含有毒力基因,有12种不同的毒力基因组合,其中多以1种或2种的毒力基因组合为主,且A群中的毒力基因分布更广泛;B1群有12株含有毒力基因,出现了5种不同的毒力基因组合且有1株菌含有4种毒力基因;B2群有11株含有毒力基因,有4种不同的组合;D群有10株含有毒力基因,有4种不同的毒力组合(表4)。
3 讨论
大肠杆菌是奶牛乳房炎的重要病原菌之一。国内外研究认为,奶牛乳房炎可由共生性大肠杆菌的继发感染所导致。王登峰等对新疆奶牛乳腺炎样品中的大肠杆菌进行系统发育组分析,发现造成奶牛乳房炎的大肠杆菌主要集中于A 群和B1群,没有发现B2和D群[13]。Leena Suojala等对芬兰南部奶牛乳房炎144株大肠杆菌进行系统发育组分析,结果显示主要集中在A群(119;82.6%),其次为D群(16;11.1%)、B1群(7;4.9%)和B2群(2;1.4%)[14]。而在本研究中,奶牛乳房炎大肠杆菌分离菌株主要集中在A群(73;58.8%),其次是B1群(20;16.1%)、D群(17;13.7%)和B2群(14;11.3%),与前人研究结果存在差异,可能因地理分布差异所造成。研究发现,大肠杆菌的致病性与系统发育群的类型不完全相关,在多数情况下因外源大肠杆菌感染并造成奶牛乳房炎的情况并不常见,通常是由共生性的大肠杆菌在一定条件下导致奶牛乳房炎发生。本试验中A群大肠杆菌与奶牛乳房炎的患病显著相关,相比其他种群大肠杆菌,A群大肠杆菌对奶牛乳房炎可能有更强的致病性。
药敏试验结果表明,奶牛乳房炎大肠杆菌新疆分离株对多 菌素B、氨苄西林具有一定的耐药性,而对头孢他啶、氯霉素、氟苯尼考、诺氟沙星、恩诺沙星等药物的耐药率较低,且存在多重耐药菌株,因此在临床用药中要尽量避免使用多 菌素B和氨苄西林。在对耐氨苄西林的耐药基因检测中共扩增出了blaTEM、blaOXA-1 两种耐药基因,其中以blaTEM基因检出率最高,占耐氨苄西林菌株的87.2%。底丽娜等已报道分离自新疆的牛源大肠杆菌对β-内酰胺类药物的耐药情况,其中blaTEM基因的检出率最高,占15.63%[15],还有相关报道称肉牛源大肠杆菌中blaTEM基因的流行率最高[16]。
大肠杆菌的致病性依赖于其表达的毒力因子[17],毒力因子在其致乳房炎发生与发展中起着重要作用[18]。大肠杆菌在建立感染过程中,首先要 附到宿主细胞,这种结合机制由细菌的 附素启动。在本研究中,afa8E基因(编码AFA8非菌毛 附素)检出率为9.6%;saa基因(编码自凝集 附素)检出率为5.6%,而f17A、papC、sfaD和eaeA基因(分别编码F17菌毛、P菌毛、S菌毛和紧密连接素)则没有检测到。irp2基因作为耶尔森菌强毒力岛HPI核心区基因,检出率为29.8%,这与徐继英等报道的基本一致[19]。astA基因(编码肠聚集性耐热毒素)检出率为21.7%。tsh基因(编码温度敏感性血凝素)表达受温度的调控[20],仅检测出2株。iucD基因(编码气杆菌素)的检出率为14.5%,且在4个种系群中广泛分布。产志贺毒素型大肠杆菌(STEC)的致病性主要通过其携带毒力基因的编码产物来发挥作用,包括编码志贺毒素的 stx 基因、位于LEE 毒力岛上编码 附素的eae基因和位于60Mu 致病性大质粒上编码溶血素(ehxA)基因等[21]。在本研究中并没有检测到志贺毒素1(Stx1)和志贺毒素2(Stx2)两种毒力基因,但检测到有8株携带溶血素(ehxA)基因。
[1]Halasa T, Huijps K, Qsteras o, et al. Economic effects of bovine mastitis and mastitis management:A review[J]. Veterinary quarterly, 2007, 29(1):18-31.
[2]Ma Y, Ryan C, Barbano D M, et al. Effects of somatic cell count on quality and shelf-life of pasteurized fluid milk[J]. Journal of dairy science, 2000, 83(2):264-274.
[3]Momtaz H, Safarpoor Dehkordi F, Taktaz T, et al. Shiga Toxin-Producing Escherichia coli Isolated from Bovine Mastitic Milk:Serogroups,Virulence Factors, and Antibiotic Resistance Properties[J]. The ScientificWorld Journa Volume,2012,2012:618709.
[4]王桂琴, 吴聪明, 宋丽华, 等. 奶牛乳房炎大肠杆菌的血清型及耐药性调查研究 [J]. 中国兽医杂志, 2006, 42(12):19-20.
[5]Clermont O, Bnacorsi S, Bingen E. Rapid and Simple Determination of the Escherichia coli Phylogenetic Group[J]. Applied and environmental microbiology, 2000, 66(10):4555-4558.
[6]Clermont O, Christenson J K, Denamur E, et al.The Clermont Escherichia coli phylo-typing method revisited: improvement of specificity and detection of new phylo-groups[J]. Environmental microbiology reports, 2013, 5(1):58-65.
[7]Ghanbarpour R, Oswald E. Phylogenetic distribution of virulence genes in Escherichia coli isolated from bovine mastitis in Iran[J].Res Vet Sci, 2010, 88(1):6-10.
[8]Gaze W, O''Neill C, Wellington E, et al. Antibiotic resistance in the environment, with particular reference to MRSA[J]. Advances in Applied Microbiology, 2008, 63:249-280.
[9]张星星, 乔军, 孟庆玲, 等. 新疆犊牛源大肠杆菌系统进化及其耐药特性[J]. 家畜生态学报, 2016, 37(6):60-64.
[10]羊云飞. 牦牛、牧民源大肠杆菌分离鉴定、耐药基因检测、PFGE分析及耐药性传递的研究[D]. 雅安:四川农业大学, 2011.
[11]刘永夏. 奶牛乳房炎大肠杆菌F17A-MF59疫苗免疫学特性研究 [D]. 北京:中国农业大学, 2015.
[12]ColomK, PerezJ, AlonsoR, et al. Simple and reliable multiplex PCR assay for detection of blaTEM, bla(SHV) and blaOXA-1 genes in Enterobacteriaceae[J].FEMS Microbiol Lett,2003,223(2):147-151.
[13]王登峰, 王治才, 李建军. 新疆奶牛乳房炎大肠杆菌种系分类群和基因相似性研究[J]. 中国预防兽医学报, 2009, 31(1):42-16.
[14]Suojala L, Pohjanvirta T, Simojoki H, et al. Phylogeny, virulence factors and antimicrobial susceptibility of Escherichia coli isolated in clinical bovine mastitis[J]. Veterinary microbiology, 2011,147(3):383-388.
[15]底丽娜, 南海辰, 夏利宁, 等. 新疆牛羊源耐药大肠杆菌β-内酰胺酶及16S rRNA甲基化酶基因检测[J].中国农学通报, 2014,35:87-92.
[16]Sunde M, Norstrom M. The prevalence of, associations between and conjugal transfer of antibiotic resistance genes in Escherichia coli isolated from Norwegian meat and meat products[J].Antimicrob Chemother, 2006, 58(4):741-747.
[17]Blum SE, Leitner G. Genotyping and virulence factors assessment of bovine mastitis Escherichia coli[J]. Veterinary microbiology,2013, 163(3):305-312.
[18]Lehtolainen T, PohjanvirtaT, Pyorala S, et al. Association between virulence factors and clinical course of Escherichia coli mastitis[J].Acta Veterinaria Scandinavica, 2003, 44(3-4):203-205.
[19]徐继英, 杨志强, 陈化琦, 等. 奶牛乳腺炎源大肠杆菌中耶尔森菌强毒力岛相关基因的检测及序列分析[J]. 中国农业科学,2012, 45(6):1199-1205.
[20]Dozois CM, DhoMoulin M, Bree A, et al. Relationship between the Tsh autotransporter and pathogenicity of avian Escherichia coli and localization and analysis of the Tsh genetic region[J]. Infection and Immunity, 2000, 68(7):4145-4154.
[21]罗霞, 徐建国. 产志贺毒素型大肠杆菌的研究进展[J]. 疾病监测, 2006, 21(4):217-210.
Phylogenetic Grouping, Antimicrobial Resistance and Virulence Factors of Escherichia coli Isolated from Bovine Mastitis in Xinjiang
YU Wei-wei1, QIAO Jun1, MENG Qing-ling1,2, PENG Ye-long5, ZHANG Jin-sheng3, WANG Hui-sheng4,CAI Xue-peng2, CHEN Chuang-fu1
(1. Department of Animal Science and Technology, Shihezi University, Shihezi 832003; 2.Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046; 3.Institute of Veterinary of Shawan County, Shawan 832100; 4.Ulanwusu Veterinary Station of Shawan, Shawan 832100; 5.The Center of Animal Disease Control and Diagnosis in Aksu Area, Aksu 843000)
The objectives of this study were to investigate phylogenetic group, drug resistance and virulence genes of Escherichia coli isolated from bovine mastitis in Xinjiang. The antimicrobial resistance of Escherichia coli to 16 drugs was determined by the methods of K-B and the phylogenetic group and virulence genes and drug resistance genes were detected by PCR. The results showed that totally 124 E. coli isolates recovered from 1068 bovine mastitis samples. The isolation rate was 11.6%. Based on the presence of the speci fi c genes chuA, yjaA and TspE4.C2, these isolates were found to belong to four different groups: group A(58.8%), group B1(16.1%), group B2(11.3%) and group D(13.7%). The drug sensitivity results showed that the resistance rate of polymyxin was the highest and it achieved 76.6%. Further-more, the resistance rates of ampicillin were about 75.8%. Multi drug resistant strains were resistant to 3~7, most of which were resistant to 15 kinds of antibiotics. The drug resistance phenotype was consistent with the genotype. The results of virulence genes detection showed that the detection rates of virulence genes irp2, astA, iucD, afa8E, ehxA, saa , tsh were 29.8%, 21.7%, 14.5%, 9.6%, 7.2%, 5.6% and 1.6%respectively. The irp2-coding gene was more often detected in group A than in other groups isolates. In contrast,three or more virulence genes were identi fi ed more often in other group isolates.
Bovine mastitis; Escherichia coli; Phylogenetic grouping; Drug resistance; Virulence gene
S858.23
A
1004-4264(2017)10-0030-06
10.19305/j.cnki.11-3009/s.2017.10.008
2017-02-27
兵团中青年科技创新领军人才计划(2016BC001);十三五国家重点研发计划子课题(2016YFD0500900);乌鲁木齐市科学技术局现代服务业促进计划(F141310002)。
于伟伟(1990-),男,山东即墨人,硕士,主要从事预防兽医学研究工作。
孟庆玲(1969-),女,江苏徐州人,教授,研究方向为动物寄生虫学。
