楸毒素抗E-4031所致豚鼠离体心脏和心肌细胞LQT2作用的研究
2017-11-01潘莹莹尹永强娄建石
潘莹莹,韩 钰,杨 帆,尹永强,康 毅,娄建石
(天津医科大学基础医学院药理学系,天津 300070)
楸毒素抗E-4031所致豚鼠离体心脏和心肌细胞LQT2作用的研究
潘莹莹,韩 钰,杨 帆,尹永强,康 毅,娄建石
(天津医科大学基础医学院药理学系,天津 300070)
目的观察楸毒素(mallotoxin, MTX)对E-4031诱发豚鼠离体心脏和心肌细胞LQT2的作用。方法采用Langendorff逆行主动脉灌流法对豚鼠离体心脏进行灌流,采集离体心脏表面Ⅱ导联心电图以考察低、中、高3个浓度MTX及其在应用hERG通道阻断剂E-4031条件下,对QT/QTc间期、跨室壁离散度、电生理平衡指数的影响;酶解法分离豚鼠单个心室肌细胞,应用全细胞膜片钳技术分别在正常和hERG通道阻断剂E-4031存在条件下,记录低、中、高3个浓度的MTX对动作电位时程的影响。结果MTX缩短豚鼠离体心脏QT间期,降低跨室壁离散度,减小电生理平衡指数。MTX可逆转E-4031诱发的QT间期延长、跨室壁离散度增加和电生理平衡指数增大。MTX缩短豚鼠心室肌细胞动作电位复极时程,降低APD90、APD60、APD30,加速复极。MTX可逆转E-4031诱发的动作电位复极时程延长。结论MTX缩短QT间期,降低复极跨室壁离散度,减小电生理平衡指数和缩短动作电位复极时程,具有抗 E-4031所致LQT2的作用。
楸毒素;长QT间期综合征;hERG通道;QT间期;跨室壁离散度;动作电位时程
长QT综合征(long QT syndrome, LQTS)是一类以心室复极化明显延长为主要特点的疾病,在心电图上通常表现为QT间期延长,T波复极跨室壁离散度(transmural dispersion of repolarization, TDR)增大[1]。截至目前,人类至少已发现15种类型的LQTS[2]。刘杰等[3]对我国19个省的77个遗传性LQTS家系进行筛查证实,LQT2为我国最常见的LQTS类型,占LQTS的54.5%,因此,对LQT2的研究是我国近些年LQTS研究的热点。LQT2发生涉及到快速激活延迟整流钾电流(rapidly activating delayed outward potassium current, IKr)通道[4]。IKr是心肌细胞复极3期的主要钾电流,在心肌细胞复极过程中起关键作用[5]。hERG (human ether-a-go-go)钾通道是心肌产生IKr的分子基础,其功能异常与QT间期异常综合征有关[6]。
遗传、低钾、药物不良反应等因素均可抑制IKr电流,导致LQT2。之前治疗包括LQT2在内的LQTS的一个直接方法就是通过药物激活钾通道,增加复极电流,例如ATP敏感性钾电流激动剂吡那地尔增强外向钾电流,缩短QT间期,但其同时又增大TDR,这反而不利于从根源上减少LQTS所导致的恶性心律失常[7]。因此,寻找一类更为有效的钾通道激动剂成为当前的一种研究方向,近年来,hERG通道激动剂对于LQT2的作用备受瞩目。楸毒素(mallotoxin, MTX)是目前发现的一个天然hERG通道特异性开放剂[8]。MTX也称为卡马拉素,在自然界中源于大戟科植物粗糠柴果实毛茸和腺毛,具有抗生育和驱杀绦虫的作用。但以往MTX的研究通常关注其在抗心肌缺血/再灌注损伤和抗肿瘤等特性上[9],鲜见其抗LQTS方面的应用考察。因此,本研究将初步考察MTX对QT间期,尤其是TDR的作用,以探究其是否具有抗LQT2的可能性。
1 材料与方法
1.1材料
1.1.1实验动物 健康成年豚鼠,♂,体质量(270±20)g,购自北京维通利华实验动物技术有限公司。
1.1.2药品与试剂 MTX、胶原酶Ⅱ、MgATP、HEPES,均购自美国Sigma公司;E-4031购自美国Santa Cruz公司。
1.1.3仪器 GL-2 Langendorff灌流装置、超级恒温水浴,成都泰盟软件有限公司;PHS-3C酸度计,上海精密科学仪器有限公司;16通道多导生理记录仪,美国BIOPAC公司;Digidata 1440A数-模转换器、Multi Clamp 700B膜片钳放大器、MP-225三维操纵仪,美国Axon公司;IX51倒置显微镜,日本OLYMPUS公司。
1.1.4液体的配制 K-H灌流液(mmol·L-1):NaCl 118.06、KCl 4.69、KH2PO41.18、NaHCO325、MgSO41.18、Glucose 11.11、CaCl22.5。预先通入混合氧气(95%O2+5%CO2) 20 min后,调节pH值至7.4。 无钙台式液(mmol·L-1):NaCl 140、KCl 5.4、MgCl21、HEPES 10、Glucose 10, 通纯氧20 min后,用NaOH调节pH值至7.3。 细胞保存液(KB液,mmol·L-1):L-谷氨酸 50、KOH 80、KCl 40、KH2PO425、MgSO43、牛磺酸 20、EGTA 0.5、Glucose 10, 通纯氧20 min后,用KOH调节pH值至7.3。 记录豚鼠心室肌细胞动作电位的细胞外液(mmol·L-1):NaCl 132、CaCl21.8、KCl 4、MgCl21.2、HEPES 10、Glucose 10, 通纯氧20 min后,用NaOH调节pH值至7.4。 电极内液(mmol·L-1):KCl 140、MgCl21、MgATP 4、EGTA 5、HEPES 10, 通纯氧20 min后,用KOH调节pH值至7.3。
1.2方法
1.2.1离体心脏Langendorff灌流法 用25%的乌拉坦麻醉豚鼠,随后仰卧位固定于鼠台之上,快速剪开胸腔暴露心脏,将主动脉根部剪断,并取出心脏放入预冷的4℃生理盐水中,轻轻按压,帮助泵出残留血液,并去除脂肪及结缔组织。将预留出的主动脉于灌流装置末端进行插管,以37℃恒温、预通混合氧的K-H液灌流,灌注压为8~9 kPa左右,初期排尽残血,整个过程控制在1 min以内,以减少缺血对心脏组织造成的损伤。待心脏搏动稳定后,将心电图记录电极的正、负极分别贴附至心脏的心尖和主动脉根部,以记录心电图。
1.2.2单个豚鼠心室肌细胞的分离 用25%的乌拉坦麻醉豚鼠,取出心脏置于4℃台氏液中,去除脂肪及结缔组织。将心脏连接于Langendorff灌流装置上,经主动脉逆行灌流。首先,以无钙台氏液连续灌流5 min,待洗尽残血,心脏停止跳动后,改用30 mL含12 mg胶原酶Ⅱ的无钙台氏液进行循环灌流。随着灌流的进行,流出液变得黏稠,心肌的颜色逐渐变浅、透亮,心脏体积逐渐变大、松软。剪取酶解的心脏左心室部分,投入纯氧饱和10 mL KB液中剪碎,细胞室温放置1 h,沉降存活的心肌细胞,更换新鲜KB液以备电生理实验使用。
1.2.3动作电位电生理记录 在室温25℃将细胞悬液滴于1 mL浴槽中,待细胞贴壁后,使用细胞外液以1 mL·min-1的恒速灌流。选取饱满且横纹清晰的梭杆状细胞进行实验。将阻抗为2~4 MΩ、充填电极内液的微电极与细胞膜表面形成1GΩ以上的高阻封接,在此基础上击破细胞膜,补偿串联电阻、细胞膜电容和漏电流形成全细胞膜片钳记录方式,在电流钳模式下进行测定。动作电位记录程序刺激方案为首先电流钳制在0 pA,随后向细胞内注入2 000 pA的电流,时间维持在4 ms,最后再落回0 pA,频率设定在1 Hz进行采集记录。信号经MultiClamp 700B膜片钳放大器、Digidata 1440A数模转换器采集、贮存并由Pclamp 10.0等软件分析。
1.2.4实验分组 正常给药组:① 空白对照组;② 0.2 μmol·L-1MTX组;③ 0.4 μmol·L-1MTX组;④ 0.6 μmol·L-1MTX组。E-4031(10 nmol·L-1)造模组:① 空白对照组;② 10 nmol·L-1E-4031组;③ 10 nmol·L-1E-4031+0.2 μmol·L-1MTX组;④ 10 nmol·L-1E-4031+0.4 μmol·L-1MTX组;⑤ 10 nmol·L-1E-4031+0.6 μmol·L-1MTX组。
1.2.5观测指标及方法
1.2.5.1QT/QTc间期 QT间期以1个心动周期中Q波起始至T波终止的时程计量,矫正的QT(corrected QT, QTc)间期采用较为符合豚鼠心脏心率与QT间期变化关系的公式QTc=QT×(333/RR)0.601进行计算[10]。
1.2.5.2TDR TDR以T波波峰至T波终止的时程(Tpeak-Tend, Tp-e)计量[11]。矫正后的Tp-e用rTp-e表示,矫正公式:rTp-e= (Tp-e/QT) ×100%。
1.2.5.3电生理平衡指数 电生理学平衡指数(index of cardiac electrophysiological balance, iCEB)应用Lu等[12]实验中采用的无创伤性方法,即iCEB=QT/QRS计算。
1.2.5.4动作电位时程 动作电位时程(action potential duration, APD)的测量是量取需进行处理的动作电位幅度(action potential amplitude, APA),并以APA数值分别降低90%、60%、30%后所对应的复极时间段变化作为APD90、APD60、APD30,APD90-30是APD90与APD30的差值。
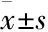
2 结果
2.1MTX对豚鼠离体心脏心电图各指标的影响如Fig 1所示,与空白对照组相比,MTX加速心室复极,缩短QT/QTc间期,0.2、0.4、0.6 μmol·L-1MTX分别缩短QT间期约9%、20%、24% (P<0.05,P<0.01);分别缩短QTc间期约7%、20%、25% (P<0.01);MTX降低TDR,0.4、0.6 μmol·L-1MTX分别减小Tp-e约42%和22% (P<0.01,P<0.05),0.4 μmol·L-1MTX减小rTp-e约28%(P<0.01);MTX降低iCEB,0.2、0.4、0.6 μmol·L-1MTX分别减小iCEB约8%、19%、23% (P<0.05,P<0.01)。
2.2MTX抗E-4031所致QT间期延长等作用Fig 2结果显示,10 nmol·L-1E-4031延长QT/QTc间期约21%/12% (P<0.01);0.4、0.6 μmol·L-1MTX使延长的QT间期分别缩短约15%和29% (P<0.01);0.2、0.4、0.6 μmol·L-1MTX使延长的QTc间期分别缩短约7%、13%、30% (P<0.05,P<0.01),使增大的Tp-e分别减小约22%、19%、50% (P<0.05,P<0.01);0.6 μmol·L-1MTX使增大的rTp-e减小约30% (P<0.01);0.4、0.6 μmol·L-1MTX使增加的iCEB分别减小13%和27% (P<0.01)。
2.3MTX对豚鼠心室肌细胞动作电位复极时程的影响0.4、0.6 μmol·L-1MTX分别缩短APD90约17%和23% (P<0.01);0.2、0.4、0.6 μmol·L-1MTX分别缩短APD60约7%、17%、24% (P<0.05,P<0.01),分别缩短APD30约8%、22%、32% (P<0.05,P<0.01)。在本实验条件下,0.4、0.6 μmol·L-1MTX可增加APD90-30(P<0.05),使动作电位图形趋于三角形化(Fig 3)。
2.4MTX抗E-4031诱发的动作电位复极时程延长作用如Fig 4所示,与空白对照组相比,10 nmol·L-1E-4031可明显延长APD90(P<0.01);0.2、0.4、0.6 μmol·L-1MTX分别使延长的APD90缩短约7%、12%、20% (P<0.05,P<0.01)。
3 讨论
对于正常豚鼠离体灌流心脏,MTX缩短其QT间期,表明豚鼠心室复极速率受MTX影响而加速,MTX增加其复极储备。考虑到在实验研究中许多化合物还会影响RR间期和心率,所以QT间期需要根据心率的变化而进行校正。本实验选用较为符合豚鼠心脏心率与QT间期变化关系的公式QTc=QT×(333/RR)0.601进行计算[10]。
心脏TDR是一个反映药物抗/致心律失常特性的重要指标。心脏由心内膜下、心外膜下心室肌细胞和心室壁中层M细胞组成。这3种细胞电生理特性不同,这为TDR的发生提供了基础。TDR增大是触发早后除极的基础。TDR增大表明心室肌复极离散度增大、电生理不稳定性增加,容易形成折返与传导阻滞,从而诱发各种室性心律失常[13]。实验结果显示,MTX可使TDR减小,表明MTX通过加速复极,减少早后除极发生率,从而产生一定抗心律失常的作用。
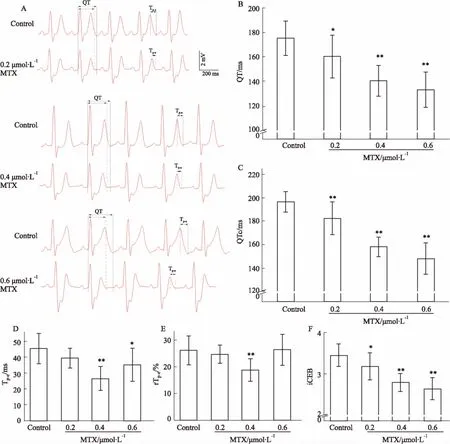
Fig 1 Effects of MTX on electrophysiological index in isolated hearts of guinea pig (±s, n=6)
A: Effects of MTX on ECG waveform; B, C: Effects of MTX on QT interval; D, E: Effects of MTX on TDR; F: Effects of MTX on iCEB.*P<0.05,**P<0.01vscontrol group
iCEB即QT/QRS的比值,可以预测尖端扭转型室性心动过速或非尖端扭转型室性心动过速样室速/室颤的发生[14]。iCEB的适当增加或减少即轻度失衡可产生抗心律失常特性,但过度改变会造成心脏电生理严重失衡,导致心律失常的发生。实验结果显示,MTX减小iCEB,表明MTX使iCEB的天平向加速复极化的方向倾斜,具备一定的扭转药物所致复极延迟性失衡的作用。
对于急性分离的正常豚鼠单个心室肌细胞,各浓度MTX均减短APD,即体现出加速动作电位复极的特性。另一方面,中、高浓度(0.4、0.6 μmol·L-1)MTX增大APD90-30,提示MTX尚存在着一定致心律失常特性,因为APD90-30可反映晚期复极过程,APD90-30的增大可使动作电位图形趋向于三角形[15],而目前研究普遍认为动作电位三角形化可预测心律失常的发生。
hERG通道阻断剂E-4031延长QT/QTc间期,增大TDR和iCEB,延长APD,即体现出致LQT2的作用。而给予MTX可以逆转以上指标的恶化,表明MTX可以通过缩短QT/QTc间期和APD,减小iCEB,降低TDR,从而产生抗LQT2的作用。ATP敏感性钾电流激动剂吡那地尔增强外向电流,缩短APD和QT间期,也具有抗LQTS的作用。但是,吡那地尔缩短心室复极时增大TDR[7],而TDR增大会引起折返和传导阻滞,从而发生室性心律失常[13]。而MTX可以降低TDR,减少早后除极发生的可能性,因此,MTX在抗LQTS作用上可能比吡那地尔更有优势。
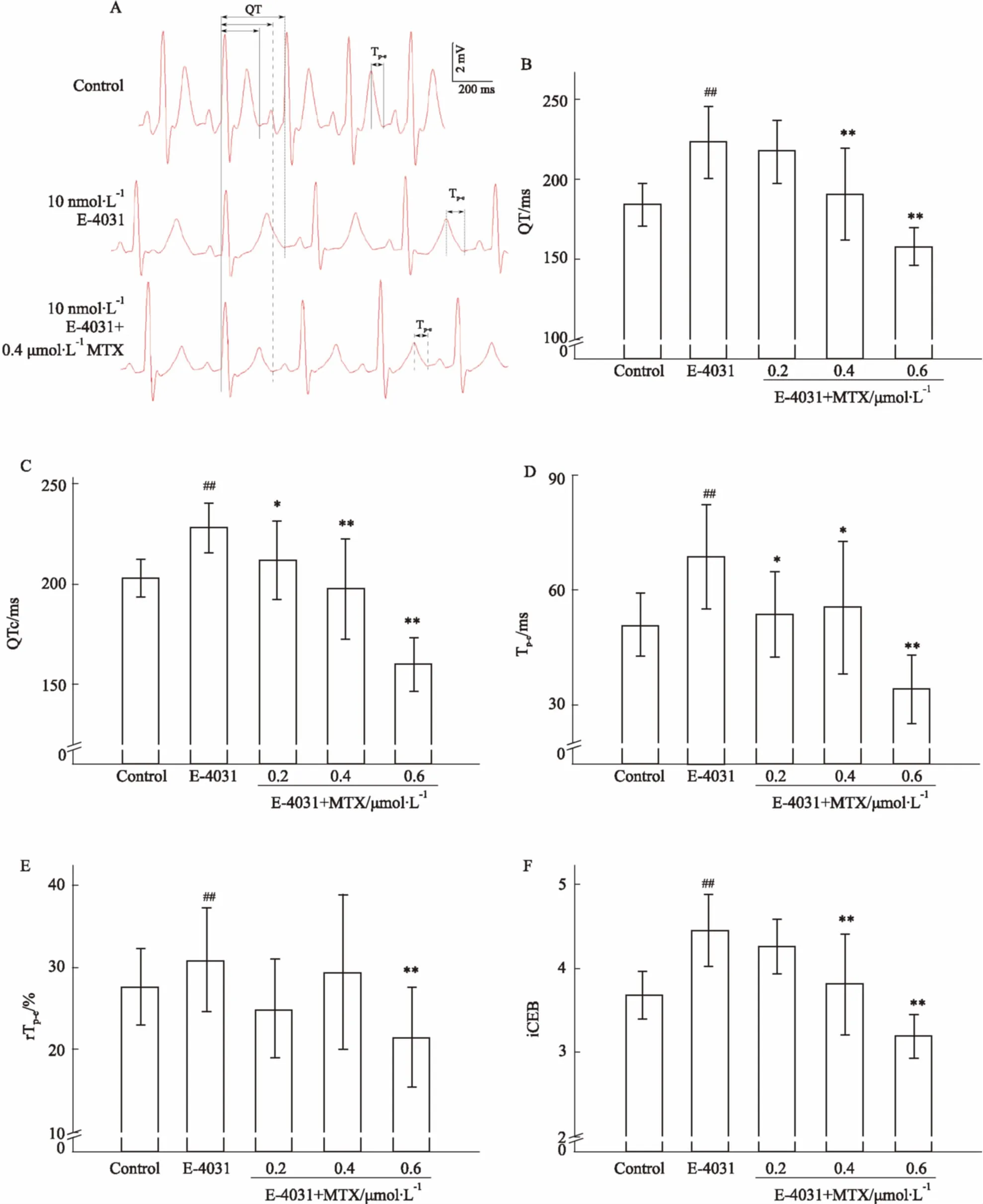
Fig 2 Effects of MTX on prolonged repolarization induced by E-4031 (±s, n=6)
A: Effects of MTX on ECG waveform; B, C: Effects of MTX on prolonged QT interval; D, E: Effects of MTX on increased TDR; F: Effects of MTX on increased iCEB.##P<0.01vscontrol group;*P<0.05,**P<0.01vsE-4031 group.
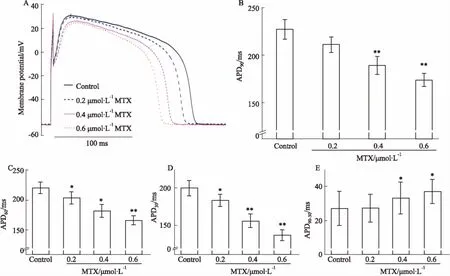
Fig 3 Effects of MTX on APD measured in guinea pig ventricular myocytes(±s, n=6)
A: Effects of MTX on traces of action potentials; B: Effects of MTX on APD90; C: Effects of MTX on APD60; D: Effects of MTX on APD30; E: Effects of MTX on APD90-30.*P<0.05,**P<0.01vscontrol group
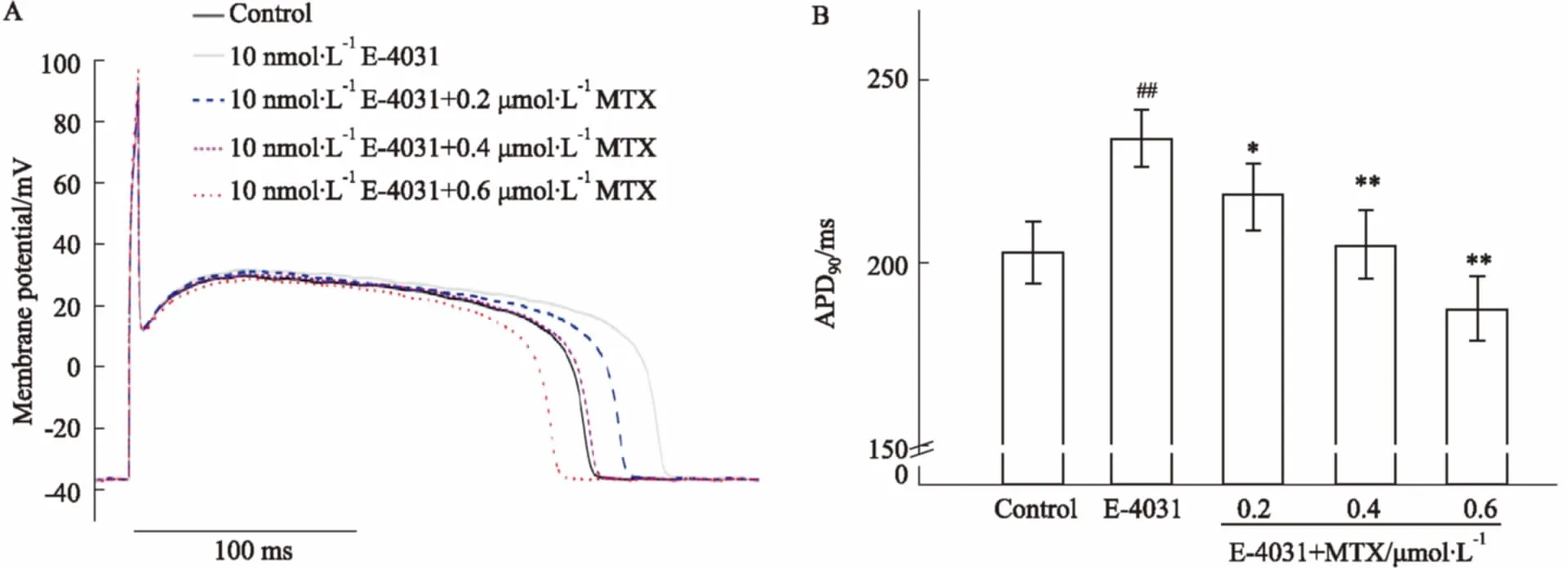
Fig 4 Effects of MTX on prolonged APD90 induced by E-4031 in guinea pig ventricular myocytes (±s, n=6)
A: Effects of MTX on traces of action potentials; B: Effects of MTX on prolonged APD90.##P<0.01vscontrol group;*P<0.05,**P<0.01vsE-4031 group.
总之,本实验证实了MTX可通过缩短QT/QTc间期和APD、减小iCEB,尤其是降低TDR来逆转E-4031导致的获得性LQT2。另外,复极不稳定性对于预测尖端扭转型室性心动过速/室颤的发生具有重要意义。因此,今后还将研究MTX对复极不稳定性的影响,以及能否逆转LQTS造成的复极不稳定性增大。
[1] Viitasalo M, Oikarinen L, Swan H, et al. Effects of beta-blocker therapy on ventricular repolarization documented by 24h electrocardiography in patients with type 1 long-QT syndrome[J].JAmCollCardiol, 2006,48(4):747-53.
[2] Mizusawa Y, Horie M, Wilde A A. Genetic and clinical advances in congenital long QT syndrome[J].CircJ, 2014,78(12): 2827-33.
[3] 刘 杰, 胡大一, 刘文玲, 等. 国人II型长QT综合征临床特点及KCNH2基因变异[J]. 科学技术与工程, 2006,6(11): 1529-33.
[3] Liu J, Hu D Y, Liu W L, et al. Clinical characters and mutation analysis of potassium channel genes KCNH2 in 77 pedigrees of Chinese with long QT syndrome[J].SciTechnolEng, 2006,6(11):1529-33.
[4] Vandenberg J I, Perry M D, Perrin M J, et al. hERG K+channels: structure, function, and clinical significance[J].PhysiolRev, 2012,92(3):1393-478.
[5] 汪和贵, 王 森, 陈艳红, 等. β1-AR对心衰心室肌细胞快激活延迟整流钾电流的调控机制[J]. 中国药理学通报, 2014,30(6):857-62.
[5] Wang H G, Wang S, Chen Y H, et al. Modulation effect of β1-adrenergic receptor on rapid component of the delayed rectifier potassium current in ventricular myocytes of chronic heart failure[J].ChinPharmacolBull, 2014,30(6):857-62.
[6] 何发忠, 张 伟. HERG钾通道与QT综合征的药物基因组学研究进展[J].中国药理学通报, 2012,28(10):1337-41.
[6] He F Z, Zhang W. Research advances in pharmacogenomics of QT syndrome associated with HERG[J].ChinPharmacolBull, 2012,28(10):1337-41.
[7] Antzelevitch C, Oliva A. Amplification of spatial dispersion of repolarization underlies sudden cardiac death associated with catecholaminergic polymorphic VT, long QT, short QT and Brugada syndromes[J].JInternMed, 2006,259(1):48-58.
[8] Zeng H, Lozinskaya I M, Lin Z, et al. Mallotoxin is a novel human ether-a-go-go-related gene (hERG) potassium channel activator[J].JPharmacolExpTher, 2006,319(2):957-62.
[9] Huang M, Tang S N, Upadhyay G, et al. Rottlerin suppresses growth of human pancreatic tumors in nude mice, and pancreatic cancer cells isolated from Kras(G12D) mice[J].CancerLett, 2014,353(1):32-40.
[10] Cheng H C, Incardona J, McCullough B, et al. Isolated perfused and paced guinea pig heart to test for drug-induced changes of the QT interval[J].JPharmacolToxicolMethods, 2006,54(3):278-87.
[11] Liu T, Brown B S, Wu Y, et al. Blinded validation of the isolated arterially perfused rabbit ventricular wedge in preclinical assessment of drug-induced proarrhythmias[J].HeartRhythm, 2006,3(8):948-56.
[12] Lu H R, Yan G X, Gallacher D J. A new biomarker-index of cardiac electrophysiological balance (iCEB)-plays an important role in drug-induced cardiac arrhythmias: beyond QT-prolongation and torsades de pointes (TdPs)[J].JPharmacolToxicolMethods, 2013,68(2):250-9.
[13] Watanabe N, Kobayashi Y, Tanno K, et al. Transmural dispersion of repolarization and ventricular tachyarrhythmias [J].JElectrocardiol, 2004,37(3):191-200.
[14] Robyns T, Lu H R, Gallacher D J, et al. Evaluation of index of cardio-electrophysiological balance (iCEB) as a new biomarker for the identification of patients at increased arrhythmic risk[J].AnnNoninvasiveElectrocardiol, 2016,21(3):294-304.
[15] Tisdale J E, Overholser B R, Wroblewski H A, et al. The influence of progesterone alone and in combination with estradiol on ventricular action potential duration and triangulation in response to potassium channel inhibition[J].JCardiovascElectrophysiol, 2011,22(3): 325-31.
EffectofmallotoxinagainstLQT2inducedbyE-4031
inisolatedguineapigheartsandcardiomyocytes
PAN Ying-ying, HAN Yu, YANG Fan, YIN Yong-qiang, KANG Yi, LOU Jian-shi
(DeptofPharmacology,BasicMedicalCollege,TianjinMedicalUniversity,Tianjin300070,China)
AimTo investigate the effect of mallotoxin (MTX) on LQT2 induced by E-4031 in isolated guinea pig hearts and ventricular myocytes.MethodsThe isolated guinea pig heart underwent retrograde perfusion using Langendorff technique. In order to determine the effects of different concentrations of MTX on QT/QTc interval, transmural dispersion of repolarization (TDR) and index of cardiac electrophysiological balance (iCEB) in the absence and presence of hERG channel blocker E-4031, the electrocardiogram of isolated guinea pig hearts was recorded using Biopac physiological record. Single ventricular myocytes were isolated from guinea pig heart by enzymatic dissociation. Effects of MTX on action potential duration (APD) in the absence and presence of E-4031 were recorded by current clamp mode using whole patch clamp technique.ResultsMTX shortened the QT interval, reduced TDR, and decreased iCEB in isolated guinea pig heart. MTX could reverse the prolongation of QT interval and the increased TDR induced by E-4031. MTX shortened the action potential duration and decreased APD90, APD60and APD30in isolated guinea pig ventricular myocytes. MTX could reverse the prolongation of action potential repolarization duration induced by E-4031.ConclusionMTX shortens QT interval, decreases TDR, reduces iCEB, as well as shortens APD, thus reversing LQT2 induced by E-4031.
mallotoxin; LQT; hERG channel; QT interval; transmural dispersion; action potential duration
A
1001-1978(2017)11-1523-07
R-332;R284.1;R322.11;R331.31;R541.7022
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.020.html
10.3969/j.issn.1001-1978.2017.11.010
2017-08-03,
2017-09-06
国家自然科学基金资助项目(No 81373410);天津市自然科学基金青年基金项目(No 14JCQNJC13700)
潘莹莹(1992-),女,硕士生,研究方向:心血管药理学,E-mail:pan_ying0701@163.com; 娄建石(1954-),男,硕士,教授,博士生导师,研究方向:心血管药理学,通讯作者,Tel:022-83336860,E-mail: jianshilou@126.com
