苦豆子总黄酮对乙肝病毒复制的影响
2017-11-01新疆维吾尔自治区昌吉州人民医院新疆昌吉800新疆维吾尔自治区药物研究所新疆乌鲁木齐80004中国医学科学院北京协和学院医药生物技术研究所北京00050
*.新疆维吾尔自治区昌吉州人民医院,新疆 昌吉 800;.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 80004;.中国医学科学院北京协和学院医药生物技术研究所,北京 00050
苦豆子总黄酮对乙肝病毒复制的影响
赵义勇1杨巧丽2李壮3刘燕2黄华2*
1.新疆维吾尔自治区昌吉州人民医院,新疆 昌吉 831100;2.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004;3.中国医学科学院北京协和学院医药生物技术研究所,北京 100050
目的观察苦豆子总黄酮提取物(KDH)在体内、外对乙肝病毒复制的影响。方法采用乙型肝炎病毒HBV转染人肝癌细胞HepG2的2.2.15细胞系,检测KDH对乙肝病毒DNA(HBV-DNA)复制及表面抗原(HBsAg)、e抗原(HBeAg)分泌的影响;采用鸭乙肝病毒DHBV感染的雏鸭模型观察KDH对鸭乙型肝炎的治疗作用。结果KDH (125-500)μg/mL浓度在2.2.15细胞培养中对HBV-DNA的复制有明显的抑制作用,其500μg/mL浓度对HBsAg、HBeAg的分泌有一定的抑制作用;其25mg/kg剂量口服可持续降低鸭乙肝模型血清中DHBV-DNA水平。结论KDH可有效干预乙肝病毒的复制。
苦豆子;总黄酮;乙肝病毒;
乙型肝炎是世界性的性流行病,我国是高地方性流行区,在全球3.5亿HBV感染者中,中国人占三分之一。在乙肝患者漫长的治疗中,应用抗乙肝药物控制和缓解病情,对延长生存期和改善生活质量起着至关重要的作用。临床经验表明,长期治疗和多方位的药效是使病情获得持续缓解的有效途径。我国传统的中医中药在治疗乙型肝炎的应用中有其独到之处,一些经典复方,如茵陈蒿汤、小柴胡汤等,在临床常用于急、慢性肝炎的对症治疗,在缓解症状、改善病情方面起到了积极的作用[1]。一般认为,中药主要是通过调节机体的免疫功能而发挥间接的抗病毒作用,但近年来的研究表明,中药不仅能通过调节免疫功能帮助机体清除病毒,还可能直接抑制病毒复制。据报道,许多单味药材的提取物,如叶下珠、黄芪、扯根菜、台湾细叶油柑等药材的提取物,可有效抑制乙肝病毒的复制[2-5]。此外,一些民间验方有直接抑制乙肝病毒的作用,如复方六月雪、愈肝胶囊等[6-7]。在当今抗乙肝药物的研究中,传统中药的优势受到越来越多的关注,从中药宝库中寻找天然抗病毒活性部位或活性成分,已成为发掘新药的重要途径之一。
苦豆子(SophoraalopecuroidesL.)为豆科槐属多年生草本植物,广泛分布于我国西北地区,是维吾尔医的传统用药,主要以地上部分或种子入药。研究报道,苦豆子中含有丰富的化学成分,其中主要的两大类为生物碱类和黄酮类[8-9],以往对其生物碱类成分研究较多[10],并发现了一些有效成分[11-13],而对其黄酮类成分的研究较少,尤其是对黄酮类成分生物活性的研究还未见报道。本课题采用大孔树脂和聚酰胺树脂联用的方法[14]对新疆地产苦豆子药材中的黄酮类成分进行分离纯化,得到苦豆子总黄酮提取物(KDH),并进行体内、外抗乙肝病毒活性的初步研究,现将结果报告如下。
1 仪器与材料
1.1 样品 KDH(出膏率2.5%)由新疆维吾尔自治区药物研究所提供,制备方法:取苦豆子种子粗粉,加8倍量的70%乙醇提取3次,每次1h,合并提取液,提取液过滤、放冷、离心,上清液减压浓缩至无醇味,并用蒸馏水定容至溶液浓度为0.4g(生药)/mL,取上述浓缩液调pH值为7,上大孔树脂-聚酰胺混合柱,柱径高比为1∶7,用4 BV水洗脱去除水溶性杂质,再用5 BV 50%乙醇洗脱,收集乙醇洗脱液,减压浓缩,50℃烘干。拉米夫定原料药(3TC,批号NDS0061105,北京诺德恒信化工技术有限公司),4℃保存。
1.2 细胞及动物 乙型肝炎病毒(HBV)DNA克隆转染人肝癌细胞(Hep G2)的2.2.15细胞由中国医科院生物技术研究所病毒室提供。用含胎牛血清10%,3%谷氨酰胺1%,G418 380μg/mL,卡那霉素50U/mL的Eagle’s MEM培养液,在37℃ 5% CO2温箱中培养,大约每周传代1次。鸭乙型肝炎病毒DNA(DHBV-DNA)强阳性血清,采自上海麻鸭,-70℃保存;1日龄北京鸭,购自北京前进种鸭场。
1.3 仪器 LIOHTCYCLER2.0型PCR全自动荧光定量系统(美国通用罗氏公司);TGL-16M高速台式冷冻离心机(长沙湘仪离心机仪器有限公司);HH-CP-01型二氧化碳培养葙(上海福玛实验设备有限公司);BHC-1300ⅡA/B3生物安全柜(苏净集团安泰公司);MDF-382E低温冰箱(SANYO Electric);BIO-RAO 3550型酶标仪、γ-计数仪(美国DPC公司);
1.4 试剂 MEM培养基(GiBco,Invitrogen Corporation);胰酶(北京三博远志生物技术有限公司);小牛血清、HEPES(中国医科院生物医学工程研究所);乙肝病毒核酸定量检测试剂盒cPCR-荧光探针(中山大学达安基因股份有限公司);HBsAg、HBeAg固相放射免疫测定盒(中国同位素公司北方免疫试剂研究所);放射性同位素α-32PdCTP(亚辉生物医学工程公司,比活度:111 TBq/nmol);探针标记用随机引物试剂盒(Promerga公司);缺口翻译试剂盒(Promega Co.);Sephadex G-50、Ficoll PVP(Pharmacia公司);SDS(Merck公司);鱼精DNA、牛血清白蛋白(中国科学院生物物理所);0.45μm硝酸纤维素膜(Amersham公司)。
2 方法与结果[15]
2.1 荧光定量PCR法检测 对HBV-DNA表达的抑制作用 KDH用含DMSO的营养液配成4000μg/mL的原液,4℃保存,临用时以2.2.15细胞培养液稀释成所需浓度。取2.2.15细胞接种96孔培养板,待细胞长成单层时,取原液以培养液作2倍稀释,取(2000~250)μg/mL四个浓度加样,每浓度4孔,于37℃ 5% CO2条件培养,第4天各组换相应浓度的药液,同时设细胞对照。第8天显微镜下观察细胞病变情况,完全破坏为4;75%为3;50%为2;25%为1;无病变为0。观察计算最大无毒浓度(TC0)和半数有毒浓度(TC50)。该部分研究重复了2批实验,2批实验结果表明KDH在2.2.15细胞培养内的毒性:TC50和TC0分别为1000μg/mL和500μg/mL。
2.2.15细胞(约50万个/mL)接种96孔板培养板,每孔100(L,37℃ 5% CO2条件下培养48h左右加药,KDH TC0及以下的两个2倍稀释度,每浓度3孔,设细胞对照组,于37℃、5% CO2条件培养,第3天换1次药液,继续培养,加药第6d收取细胞,用试剂盒提取DNA,实时荧光定量PCR检测HBV- DNA表达量(拷贝/mL),计算样品对HBV-DNA的抑制率,结果苦豆子提取物(125-500)μg/mL浓度在2.2.15细胞中可明显降低HBV-DNA表达量。结果见表1。

表1 KDH对HBV-DNA表达量的影响
2.2 斑点杂交法检测对HBV DNA复制的抑制作用 2.2.15细胞接种96孔细胞培养板(约10 万个/mL),每孔200μL,37℃、5% CO2条件培养,观察细胞长成单层后,KDH取无毒浓度及其以下的4个2倍稀释度,共5个浓度组,每浓度3孔, 同时设细胞对照组。加样后于37℃,5% CO2条件培养,第3天换原浓度样品溶液继续培养,于第6d取各样品组及细胞对照组的上清液和细胞,按分子克隆实验技术方法提取其HBV-DNA,进行斑点杂交、放射自显影,测量各杂交点的A值后,计算抑制率,并按Reed&Muench法计算半数抑制浓度(IC50),结果表明苦豆子提取物在2.2.15细胞中对HBV-DNA的复制有明显的抑制作用。结果见表2。
HBV DNA抑制百分率(%)=(细胞对照组A值-给药组A值)/细胞对照组A值×100。
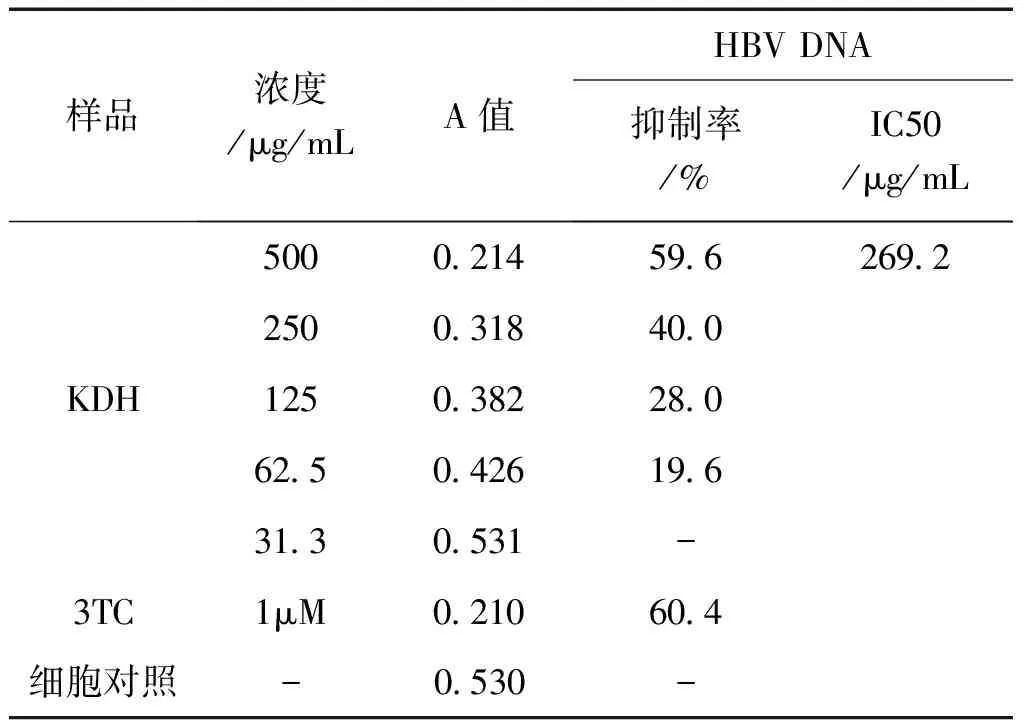
表2 KDH对HBV-DNA的抑制作用
2.3 对2.2.15细胞分泌HBeAg、HBsAg的抑制作用 每毫升10万个2.2.15细胞接种96孔细胞培养板, 每孔200μL,37℃ 5% CO2培养24h,样品取最大无毒浓度及以下4个2倍稀释度,共5个浓度,每浓度4孔,37℃ 5% CO2条件下培养,每4天换原浓度药液培养,第8天时收获培养液,-20℃冰冻保存。
实验设HBsAg、HBeAg 阳性和阴性对照及细胞对照。用 HBsAg和HBeAg固相放射免疫试剂盒按说明书方法测定HBsAg和HBeAg, 用γ-计数仪测定每孔放射强度值,3个平行孔取均值后,计算抑制率。按Reed&Muench法计算半数有效浓度(IC50)。
抗原抑制百分率(%)=(细胞对照组放射强度值-给药组放射强度值)/细胞对照组放射强度值×100。
结果,苦豆子总黄酮提取物最大无毒浓度对在2.2.15细胞中分泌HBsAg和HBeAg有一定的抑制作用。结果见表3、4。
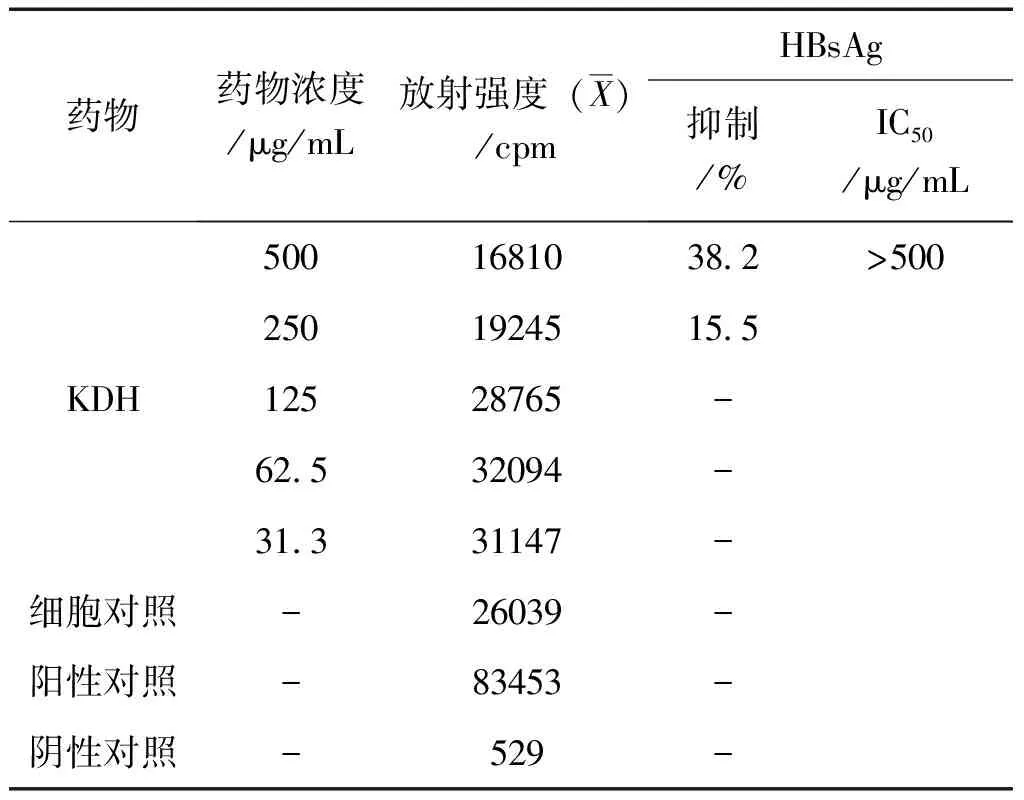
表3 KDH在2.2.15细胞中第8d对HBsAg的抑制作用
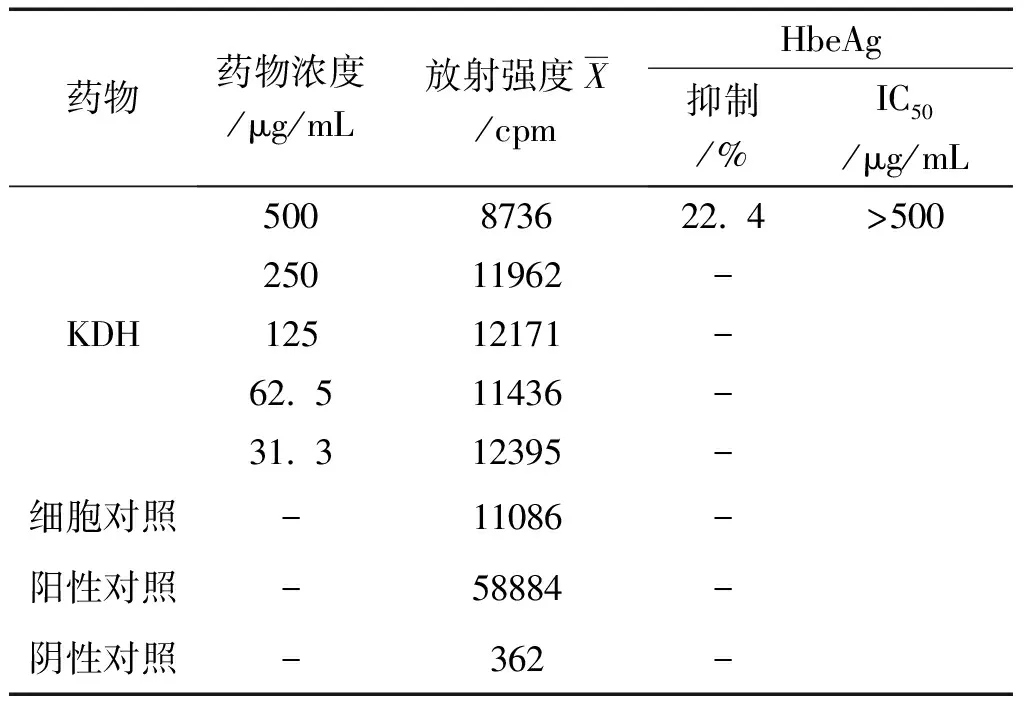
表4 KDH在2.2.15细胞中第8天对HBeAg的抑制作用
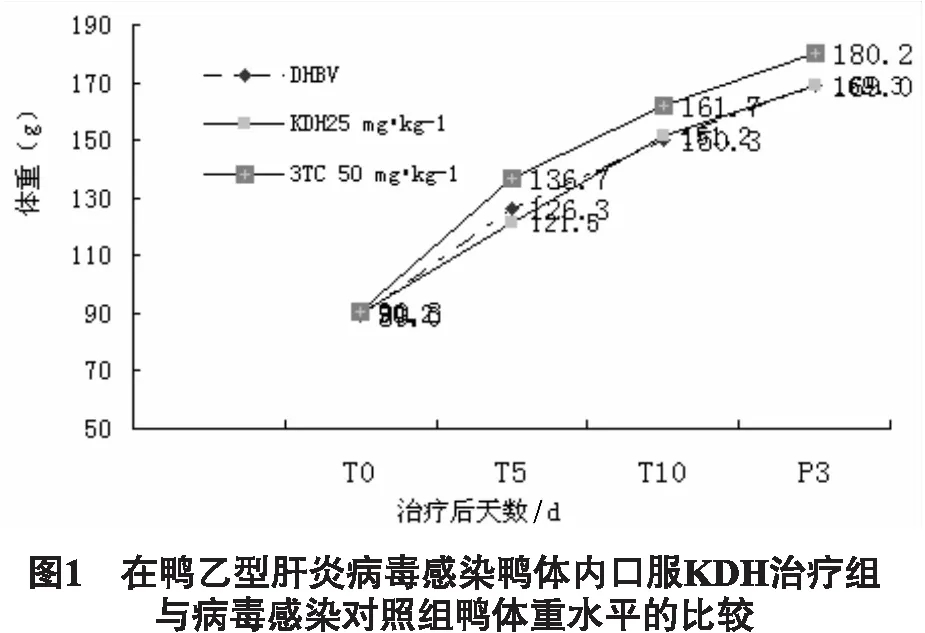
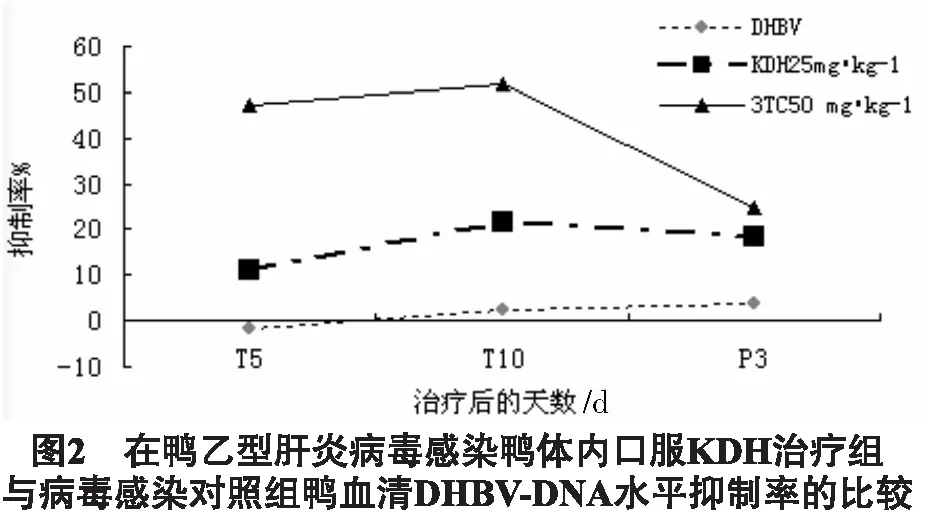
2.4 对鸭乙肝模型的治疗效应 取1日龄北京鸭,自鸭腿胫静脉注射上海麻鸭DHBV-DNA阳性鸭血清,0.2 mL/只,感染7d后随机分组进行药物治疗实验,每组6只,苦豆子提取物组以25 mg/kg剂量口服给药,病毒对照(DHBV)组给予等体积的生理盐水,阳性对照组给予50 mg/kg的3TC,每天给药2次,连续10d,分别于DHBV感染后第7天即用药前(T0),用药第5天(T5),用药第10天(T10)和停药后第3天(P3),自鸭腿胫静脉取血,分离血清,-70℃保存待检。取上述待检鸭血清,同时点膜,测定鸭血清中DHBV-DNA水平的动态。按缺口翻译试剂盒说明书方法,用32P标记DHBV-DNA探针,作鸭血清斑点杂交,放射自显影膜片斑点在酶标仪(490nm)测定吸光度A,以A值作为标本DHBV-DNA水平值,计算每组动物不同时间(T5、T10)和停药后第3天(P3)血清DHBV-DNA的抑制率,比较各组鸭血清DHBV-DNA的抑制率的动态。
DNA抑制率=(给药前(T0)A值-给药后(T5,T10,P3)A值)/给药前(T0)A值×100%
结果,3组动物在实验期体重水平无统计学差异。结果如图1所示。KDH在给药期及停药后3d对DHBV-DNA有持续的抑制作用,且停药3d后抑制率下降不明显,而3TC在停药后抑制率明显下降,提示KHD的抑制作用比较稳定。结果如图2所示。
3 讨论
2.2.15细胞模型和鸭乙肝模型是目前抗乙肝病毒药物筛选和评价的主要手段,随着这两种模型在中药抗HBV研究中的应用,许多传统中药的提取部位或化学成分被证实有抗HBV活性,为从天然产物中寻找抗病毒药物提供了有效途径。在药用植物成分中,研究报道较多的主要有黄酮类、糖苷类和生物碱类[16-17]。
由于苦豆子中的生物碱类含量很高,在过去几十年,对苦豆子的研究开发一直集中于其生物碱类成分,其黄酮类成分的生物活性则从未引起关注。随着对中草药抗病毒物质基础的认识不断深入,黄酮类成分在该领域的重要性得到公认,并且已发现许多植物黄酮类成分具有广谱抗病毒活性[18]。由此推测,苦豆子中的黄酮类成分有可能是潜在的抗病毒活性物质。
研究对苦豆子总黄酮提取物展开体内、外抗病毒作用的研究,旨在为进一步探明苦豆子黄酮类单体成分的抗HBV活性奠定基础。研究显示苦豆子总黄酮在细胞培养中明显抑制HBV-DNA的表达,并呈现一定的量效关系,其IC50值约为269.2μg/mL,表明其体外抗病毒活性较强。体内实验中苦豆子总黄酮在给药期可明显降低鸭血清中DHBV-DNA水平,其抑制作用虽不及阳性对照药拉米夫定,但可平稳持续至停药后第3天;而拉米夫定对病毒的抑制率在给药期间较高,停药后则大幅下降,提示苦豆子总黄酮对鸭乙肝的治疗效应比西药更为稳定。上述研究结果初步印证了课题组的预期,苦豆子中的黄酮类成分也是其重要的抗病毒物质基础。目前从苦豆子中分离得到的黄酮类化合物已有5种[19],这些黄酮类成分的抗HBV活性及作用机理还有待进一步研究。
在2.2.15细胞培养中,荧光定量PCR和斑点杂交法检测均表明苦豆子总黄酮(125~500)μg/mL浓度明显抑制HBV-DNA的表达;放射免疫法测定其500μg/mL浓度对HBsAg、HBeAg的分泌也有一定的抑制作用;在鸭乙肝模型治疗实验中,苦豆子总黄酮提取物以25mg/kg剂量口服可持续降低模型动物血清中DHBV-DNA水平。该结果提示苦豆子总黄酮提取物在体内、外均可有效干预乙肝病毒的复制。
[1]陈压西,郭树华,张定凤,等.不同产地叶下珠及其联合用药抗鸭乙型肝炎病毒的实验研究[J].中国中西医结合杂志,1999,15(4):225-227.
[2]陈压西,郭树华,齐珍元,等.广西叶下珠抗鸭乙型肝炎病毒的实验研究[J].重庆医科大学学报,2000,25(1):39-40.
[3]邹宇宏,杨雁,吴强,等.黄芪提取物的体外抗乙肝病毒作用[J].安徽医科大学学报,2003,38(4):267-269.
[4]赵建勤,杨明,赵连三,等.扯根菜及其系统提取物抗乙型肝炎病毒体外实验研究[J].中西医结合肝病杂志,2002,12(1):26-27.
[5]黄正昌,邓学龙,朱宇同,等.台湾细叶油柑体内外抗乙肝病毒作用研究[J].广西中医药大学学报,2000,17(3):260-263.
[6]张士军,林兴,林军,等.复方六月雪含药血清对HepG2.2.15细胞和HBVDNA的抑制作用[J].中成药,2007,29(6):805.
[7]谭行华,王建,吴茂盛,等.愈肝胶囊对2.2.15细胞分泌HbsAg、HBeAg的抑制作用[J].中西医结合肝病杂志,2004,14(3):158.
[8]吐尔孙阿衣·克力木,努尔麦麦提·如则,阿依努尔·阿不来提.维药苦豆子研究近况[J].中国民族医药杂志,2016,22(5):66-68.
[9]段龙,李学钊,田启会.苦豆子生物碱药理学研究现状[J].畜牧兽医杂志,2015,34(4):38-40.
[10]游菁菁,李月英,沙碧莹,等.中药苦豆子生物碱的研究进展[J].江西中医药大学学报,2015,27(2):109-113,116.
[11]李常青,刘妮,李小犟,等.苦参碱脂质体抗乙型肝炎病毒的体外实验研究[J].热带医学杂志,2003,3(1):19-21.
[12]李继强,陈荣喧,曾民德,等.氧化苦参碱抗乙型肝炎病毒的体外实验研究[J].中华消化杂志,2001,21(9):550-552.
[13]许斌,周双宸,黄玉仙,等.氧化苦参碱在鸭原代肝细胞中抗鸭乙肝病毒(DHBV)作用的研究[J].病毒学报,2006,22(5):369-374.
[14]王淑华,王淑杰,勾建斌.苦豆种子中总黄酮提取工艺的研究[J].宁夏工程技术,2004,3(4):358-359.
[15]陈鸿珊,张兴权.抗病毒药物及其研究方法[M].北京:化学工业出版社,2006:497-499.
[16]赖进科,钟振国,李舒.中草药抗乙肝病毒有效成分的研究进展[J].中国现代医药杂志,2009,11(12):132-134.
[17]王东亮,黄勇,王凤山,等.中药体外抗乙肝病毒活性的研究进展[J].中国病原生物学杂志,2010,5(6):462-465.
[18]龚金炎,张英,吴晓琴.黄酮类化合物抗病毒活性的研究进展[J].中草药,2008,39(4):623-627.
[19]卞海涛,赵军,黄华,等.苦豆子化学成分的研究[J].中药材,2014,37(1):72-73.
TheInhibitoryEffectoftheTotalFlavonoidsErtractsfromSophoraalopecuroidesL.onReplicaionofHepatitisBVirus
ZHAO Yiyong1YANG Qiaoli2LI Zhuang3LIU Yan2HUANG Hua2*
1.The Hospital of Changji Hui Autonomous Prefecture,Changji 831100,China;2.The XinJiang Institute of Materia Medic, Urumqi 830004,China;3.Institute of Medicinal Biothechnology Chinese Academy of Medical Sciences,Beijing 100050,China
ObjectiveTo observe the effect of KDH on the replicaion of hepatitis B virus.MethodsHBV-transfected HepG 2.2.15 cells as the vitro model, The antiviraI activity of KDH was examined by detecting the levels of HBsAg and HBeAg in the supernatant and extracellular HBV-DNA. Andinvivomodel, BeiJing brown spotted ducks infected with the DHBV-DNA were randomly divided into three groups: model group, positive group, KDH group. Blood was collected respectively to determine the content of DHBV-DNA, before and at the fifth, tenth day during treatment, and at the third day after finishing the treatment.ResultsKDH at the concentration of(125~500)μg/mL showed an inhibitory effect on HBV-DNA, The KDH 500μg·mL-1dose suppressed HBsAg and HBeAg expressions. And, The KDH 25mg/kg dose of oral sustainably reduced DHBV-DNA levels in the serum of duck hepatitis B virus model.ConclusionThe study suggested that KDH has a strong effect against HBV replication.
SophoraalopecuroidesL.; Total Flavonoid; Hepatitis B Virus
R285
A
1007-8517(2017)17-0021-04
2017-07-07 编辑:陶希睿)
赵义勇(1967-),男,汉族,本科,研究方向为临床药学。E-mail:zhaoyiyong@sina.cn
黄华(1965-),女,汉族,硕士研究生,研究员,研究方向为中药药理学研究。E-mail:huangh6505@163.com
