采用(NH4)2SO4焙烧镍铁渣提取MgO
2017-11-01赵昌明蔡永红宁哲王国承亢淑梅张崇民翟玉春
赵昌明,蔡永红,宁哲,王国承,亢淑梅,张崇民,翟玉春
采用(NH4)2SO4焙烧镍铁渣提取MgO
赵昌明1, 2,蔡永红1, 3,宁哲1, 2,王国承1, 2,亢淑梅1,张崇民1,翟玉春4
(1. 辽宁科技大学材料冶金学院,辽宁鞍山,114051;2. 辽宁省化学冶金工程重点实验室,辽宁鞍山,114051;3. 攀钢集团成都钢钒有限公司,四川攀枝花,617000;4. 东北大学材料冶金学院,辽宁沈阳,110004)
针对镍铁渣传统处理工艺污染严重、资源浪费等不足,提出(NH4)2SO4焙烧镍铁渣循环工艺。通过单因素实验考察焙烧温度、(NH4)2SO4与镍铁渣质量比(即铵矿比)、焙烧时间对镍铁渣中MgO浸出率的影响,并在此基础上使用正交设计优化工艺条件。研究结果表明:优化实验条件为焙烧温度450 ℃,铵矿比3.5:1.0,焙烧时间 120 min;在上述优化实验条件下进行多次重复实验,MgO浸出率稳定在90%以上;本工艺是绿色环保工艺,具有生产成本低、低污染等优点。
镍铁渣;硫酸铵;焙烧;红土镍矿
镍是一种重要的战略金属,具有优良的物理化学性质,被广泛应用于军工、机械、医疗等领域[1−2]。近年来,随着红土镍矿火法冶炼镍铁合金规模逐步扩大,红土镍矿冶炼镍铁废渣(简称镍铁渣)的排放量逐渐增多。2015年,镍铁渣的总排放量将接近1亿t,超过铜渣、锰渣等冶金渣的排放总量,约占到冶金渣总排放量的1/5[3−4]。与其他冶金渣相比,镍铁渣不仅排渣量大、占用土地、危害环境,且渣中有价金属回收价值低,已逐步成为冶金废渣处理的一大难题。因此,针对镍铁渣进行高附加值绿色化研究,符合发展循环经济、建设环境友好型社会的发展方向。但镍铁渣成分复杂且结构致密,严重影响了镍铁渣的广泛应用。目前,国内外镍铁渣处理仅限于生产建筑材料[5]、水泥[6]、微晶玻璃[7]等方面,大量渣仍采用堆砌处理或深海填埋等处理方式[8],不能有效控制有毒元素Cr的扩散,而且渣中Ni和Fe等有价元素作为废弃物处理也会造成资源损失。因此,研究处理镍铁渣的新工艺和新技术,对镍铁工业的可持续性发展具有重要意义。硫酸铵焙烧法是在较低温度(300~600 ℃)下,采用(NH4)2SO4与矿物原料进行混合焙烧,将矿中目标金属元素转变为可溶性硫酸盐,实现有价金属的提取[9−14]。本文作者采用硫酸铵法焙烧镍铁渣的工艺,考察焙烧温度、(NH4)2SO4与镍铁渣质量比、焙烧时间对镍铁渣中MgO浸出率的影响,从而确定优化焙烧工艺。该工艺与其他处理工艺相比具有生产成本低、低污染、生产设备腐蚀程度低、反应介质(NH4)2SO4可以循环使用等优点[15−18];而且焙烧后熟料溶出所得溶液可作为生产镁质化工产品的原料,脱镁渣则可用于生产镍铁原料。
1 实验
1.1 实验原料
实验所用镍铁渣由辽宁省某镍铁加工企业提供,其化学成分如表1所示,由表1可知渣中MgO和SiO2质量分数较高,极具综合利用价值。X线衍射及扫面电镜分析结果如图2和图3所示。由图2和图3可知:镍铁渣表面成不规则块状形体,结构疏松,粒度不均匀,其主要物相为MgSiO3和Mg1.8Fe0.2(SiO4);实验中所用(NH4)2SO4为工业级,纯度大于等于99%;水为去离子水。

表1 镍铁渣的化学组成(质量分数)

图1 镍铁渣的SEM谱图
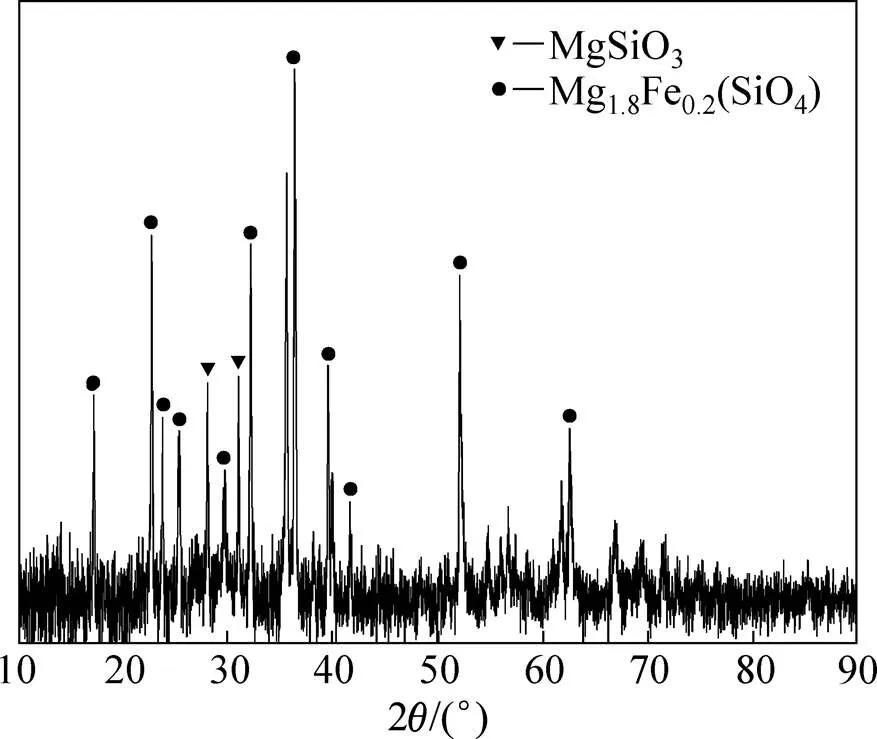
图2 镍铁渣的XRD谱图
1.2 实验装置和仪器
主要实验仪器:DHG-9070A型烘箱;ACS-1AL电子天平;SHZ-D(Ⅲ) 循环水式真空泵。
反应装置如图3所示。反应器由不锈钢制成,采用加热套加热,通过KWT型控制器控温,用镍铬−镍硅热电耦测温,温控精度为±2 ℃;反应釜上装有回流冷凝管和尾气回收装置,其接口处、采样口以及釜盖均采取密封措施。
采用日本理学公司Rigaku Ultima IV线衍射仪(XRD)和日本电子株式会社JSM-6390A型扫面电镜(SEM)分析镍铁渣和焙烧产物的形貌与结构。
1.3 实验原理
将(NH4)2SO4与镍铁渣混合,焙烧过程中发生如下反应:
MgSiO3+(NH4)2SO4=MgSO4+SiO2+H2O+2NH3↑ (1)
Mg1.8Fe0.2(SiO4)+3.1(NH4)2SO4+0.05O2=
0.9(NH4)2Mg2(SO4)3+0.2FeNH4(SO4)2+
SiO2+2.1H2O+4.2NH3↑ (2)
(NH4)2Mg2(SO4)3=2MgSO4+(NH4)2SO4(3)
(NH4)2SO4=2NH4HSO4+NH3↑ (4)
2NH4HSO4=3(NH4)2S2O7+H2O (5)
3(NH4)2S2O7=2NH3+2N2+6SO2↑+9H2O↑ (6)
2FeNH4(SO4)2=Fe2(SO4)3+(NH4)2SO4(7)
Fe2(SO4)3=Fe2O3+3SO3(8)
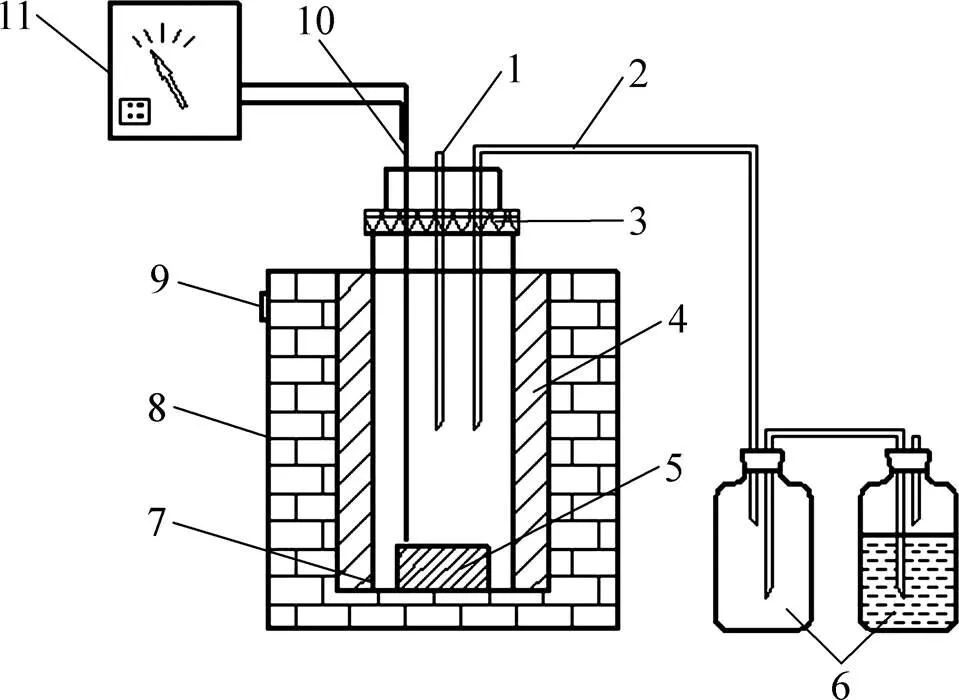
1—进气口;2—出气口;3—密封圈;4—衬套;5—耐火砖;6—集气瓶;7—反应釜;8—加热套;9—接线柱;10—热电偶;11—控温仪。
图4所示为(NH4)2SO4与镍铁渣混合焙烧的TG-DSC曲线。由图4可知:当体系温度升温至300 ℃时,(NH4)2SO4质量开始损失;当体系温度高于400 ℃时,(NH4)2SO4质量损失速率增加;480 ℃时硫酸铵质量损失已达80%。图4中温度为323 ℃和350 ℃时分别出现1个吸热峰,表明当焙烧温度高于300 ℃时,(NH4)2SO4发生分解并与渣中主要成分MgSiO3和Mg1.8Fe0.2(SiO4)发生反应(体系中发生式(1)~(6)反应);当温度大于400 ℃时发生式(7)~(8)反应[19]。通过焙烧步骤,(NH4)2SO4可以将镍铁渣中稳定的硅酸盐转化为可溶性的硫酸盐。图5所示为镍铁渣SEM谱图。由图5可见:焙烧后产物与原渣相比颗粒变小且呈疏松状结构,表面侵蚀较强,说明(NH4)2SO4与镍铁渣发生了反应。为保证焙烧反应过程中渣中MgO浸出率达到最大,结合(NH4)2SO4的分解温度[20],本实验反应温度设为450~500 ℃。
1.4 实验步骤
首先将镍铁渣干燥并破碎(95%过74 μm分子筛),之后按一定铵矿比(即(NH4)2SO4与镍铁渣质量比)定量称取(NH4)2SO4与镍铁渣,均匀混合后置于镍坩埚内并放入反应器中。在一定温度下焙烧,焙烧过程产生的NH3和SO2等污染气体通过气体回收装置回收。工艺流程如图6所示。
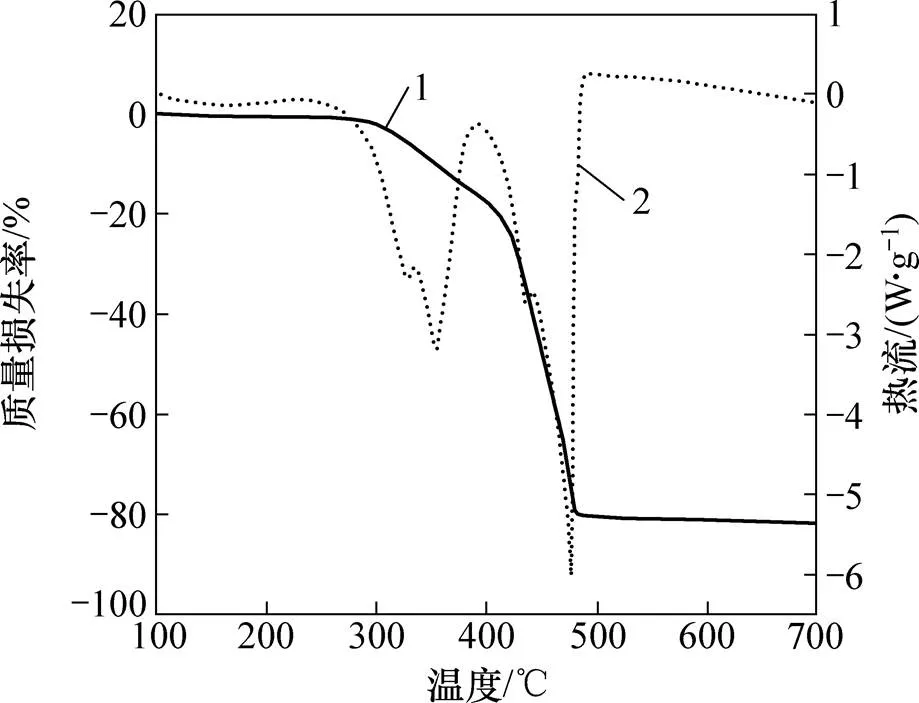
1—TG;2—DSC。

(a) 焙烧前;(b) (NH4)2SO4混合焙烧
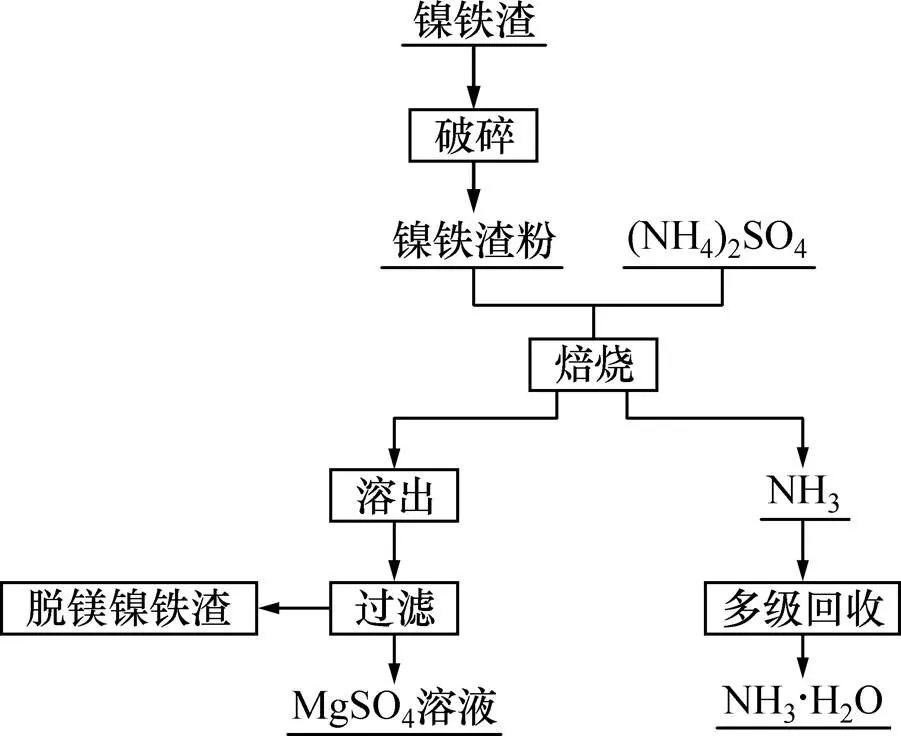
图6 工艺流程
反应结束后,将焙烧产物放入1 000 mL烧杯中,加入去离子水,在50 ℃恒温水浴中搅拌溶出1 h后过滤,滤液冷却后用于检测,滤渣中加入500 mL去离子水进行2次洗涤,采用EDTA滴定法[21]分别测量2次滤液中Mg的含量, 计算其浸出率并相加。浸出率计算公式如下:
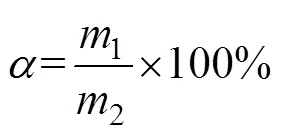
式中:为MgO的浸出率;1为滤液中MgO的质量;2为镍铁渣中所含MgO的质量。
2 结果与讨论
2.1 单因素实验
2.1.1 焙烧温度对MgO浸出率的影响
在铵矿比为3.5:1.0,焙烧时间为120 min时,考察焙烧温度对镍铁渣中MgO 浸出率的影响,结果如图7所示。由图7可知:随着焙烧温度升高,MgO浸出率逐渐提高,并在450 ℃时达到最大,随后反应趋于平稳。(NH4)2SO4与镍铁渣混合焙烧反应为吸热反应,当反应温度升高时,(NH4)2SO4开始分解生成NH4HSO4,生成的NH4HSO4能够形成小液滴,使固−固反应变为液−固反应,且升高温度可提高溶质在小液滴中的扩散能力,加快分子运动速度,有利于金属氧化物的硫酸化过程;但当温度超过450 ℃时,MgO浸出率无明显变化,而且温度升高会导致(NH4)2SO4加速分解,使得参与反应的(NH4)2SO4减少,降低(NH4)2SO4使用率,因此,将焙烧温度控制为450 ℃。
2.1.2 铵矿比对MgO浸出率的影响
在焙烧时间为120 min,反应温度为450 ℃时,考察铵矿比对镍铁渣中MgO浸出率的影响,结果如图8所示。由图8可知:随着铵矿比增加,MgO浸出率先逐渐增大而后下降,当铵矿比为3.5:1.0时,镁浸出率达到89.14%。随着体系中(NH4)2SO4的用量增加, (NH4)2SO4与镍铁渣之间的传质作用加快,有利于反应进行;当铵矿比大于3.5:1.0时,焙烧后熟料间粘度增加,在浸出过程中会造成溶液中NH4+和SO42−浓度过高,使得浸出液过滤性能下降,导致MgO浸出率下降,因此,铵矿比控制为3.5:1.0为宜。
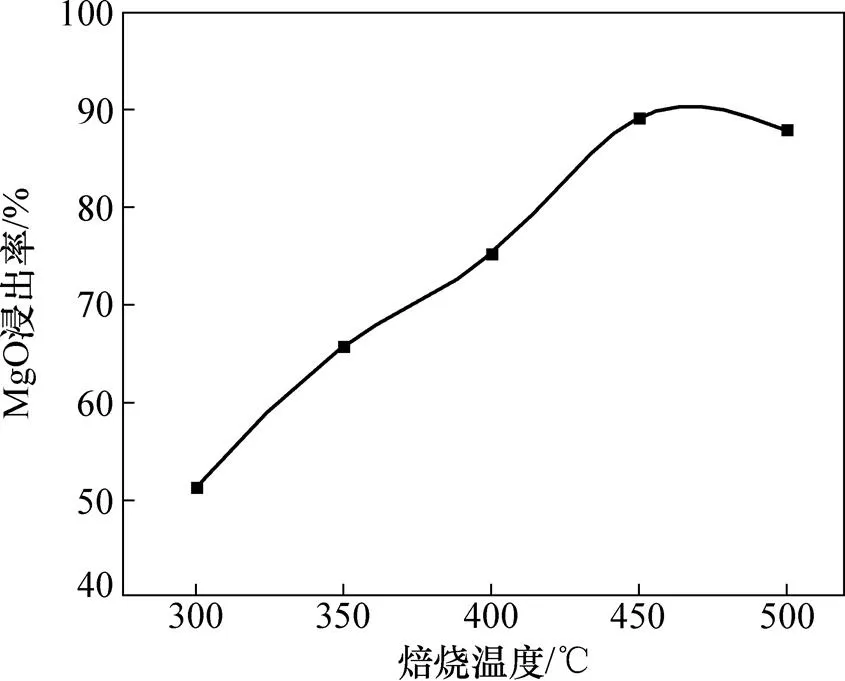
图7 焙烧温度对MgO浸出率的影响
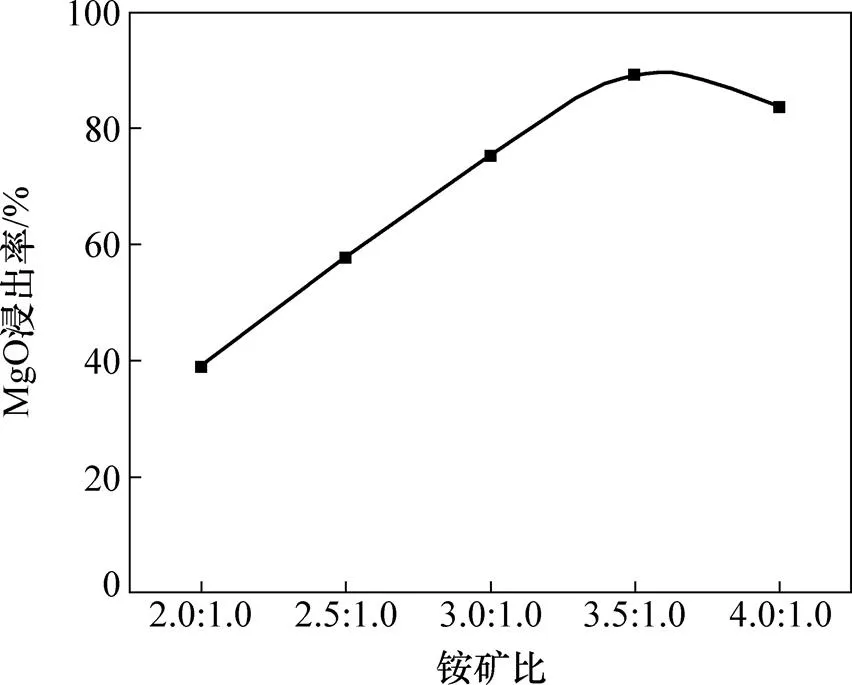
图8 铵矿比对MgO浸出率的影响
2.1.3 焙烧时间对MgO浸出率的影响
在焙烧温度为450 ℃,铵矿比为3.5:1.0时,考察焙烧时间对镍铁渣中MgO浸出率的影响,结果如图9所示。由图9可知:当焙烧时间从60 min增至120 min时,MgO浸出率逐渐增加;当焙烧时间达到120 min时,MgO浸出率最大。随着焙烧时间的延长,体系中参与反应的(NH4)2SO4逐渐减少,当反应时间超过120 min时,MgO浸出率无明显改变。在保证较高金属浸出率的前提下,应尽可能降低焙烧时间以减少能耗,因此,反应时间控制在120 min较适宜。
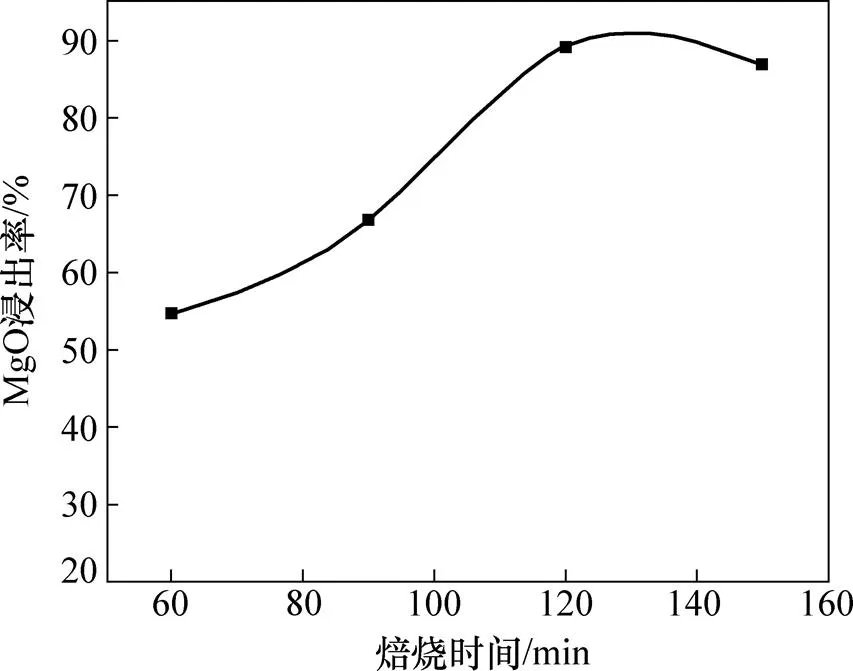
图9 焙烧时间对MgO浸出率的影响
2.2 正交实验
在单因素试验的基础上设计了正交试验,采用正交表L9(34)设计实验,取焙烧温度、焙烧时间和铵矿比为3个正交因素,以MgO的浸出率为指标,各因素和水平的参数见表2。考察不同影响因素同时作用时对镍铁渣中MgO浸出率的影响,并确定镍铁渣与(NH4)SO4焙烧体系中浸出过程的优化条件。正交实验结果见表3。
通过极差法分析试验结果可知:1) 根据极差,各因素在选定范围内影响MgO浸出率的主次关系由大至小为焙烧温度、铵矿比、焙烧时间,即焙烧温度的影响最显著,其次是铵/矿比和焙烧时间;2) (NH4)SO4焙烧镍铁渣提取MgO优化实验条件为焙烧温度 450 ℃,铵矿比3.5:1.0,焙烧时间120 min。在优化实验条件下进行多次验证实验,实验结果如表4所示,MgO浸出率稳定在90%以上。
2.3 对镍铁渣在(NH4)2SO4焙烧体系中水浸渣分析
在优化实验条件下,对镍铁渣在(NH4)2SO4体系中焙烧不同时间所得渣进行XRD和SEM分析,分别如图10和图11所示。由图10可知:随着焙烧时间延长,镍铁渣中主要赋存物相MgSiO3和Mg1.8Fe0.2(SiO4)的衍射峰逐渐减弱,部分弱衍射峰也逐渐消失;反应2 h时,经(NH4)2SO4处理后的镍铁渣渣相中只剩下Fe2O3和SiO2两相衍射峰,说明反应趋于完全,渣中MgSiO3和Mg1.8Fe0.2(SiO4)在(NH4)2SO4作用下已完全分解,含镁矿物衍射峰消失,达到脱除渣中镁的目的。
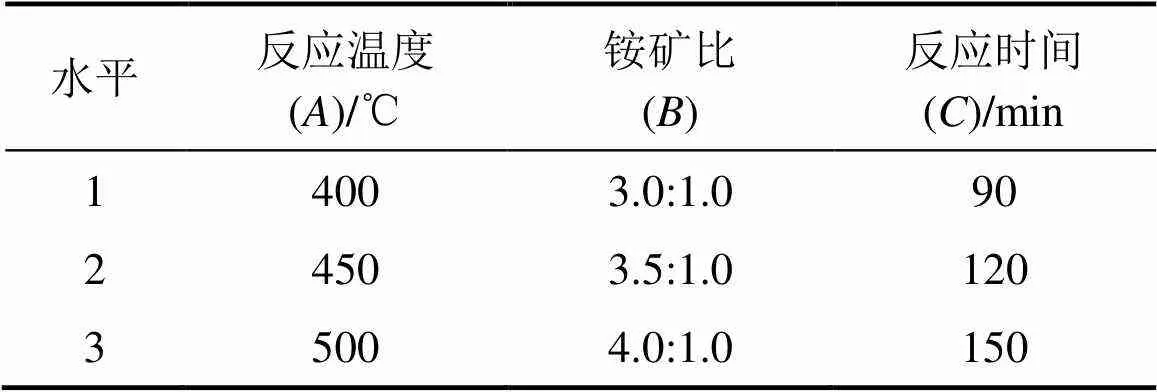
表2 因素水平表
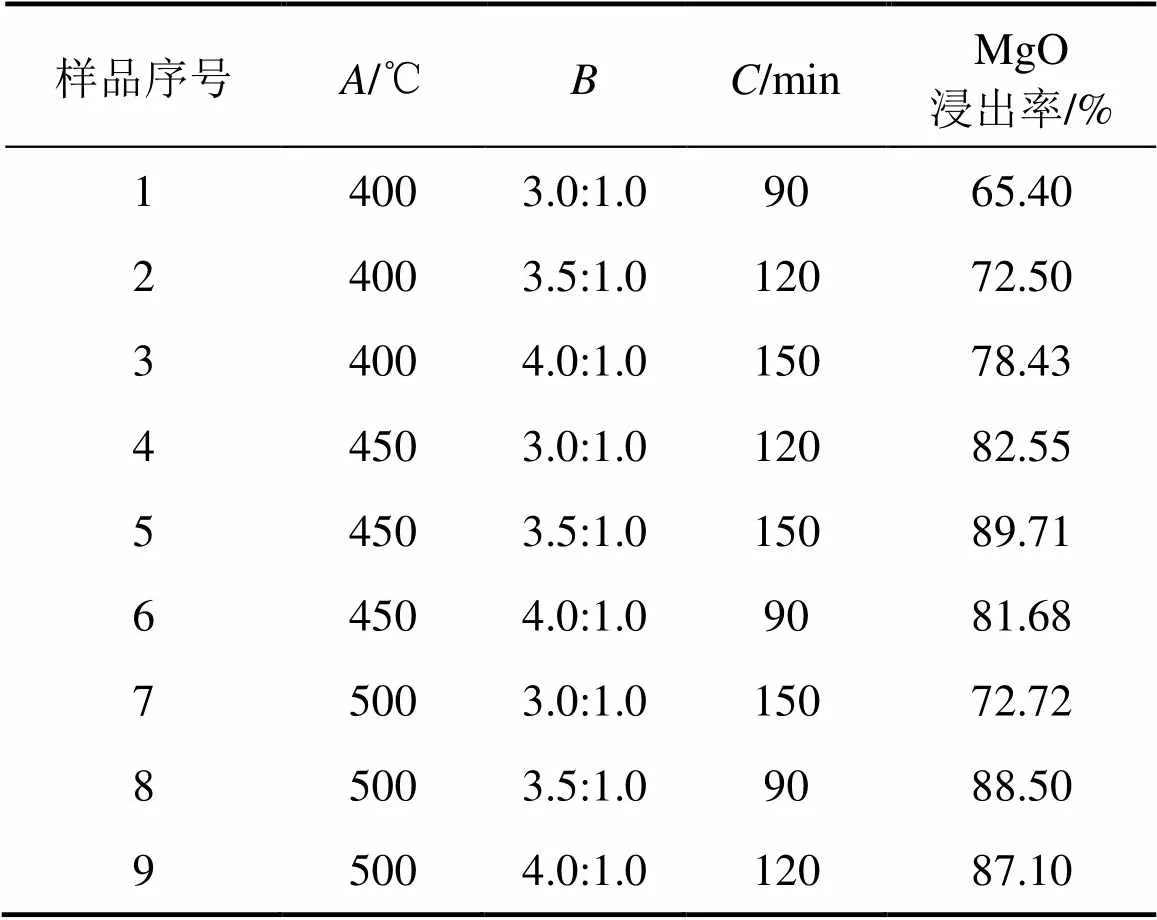
表3 正交实验结果
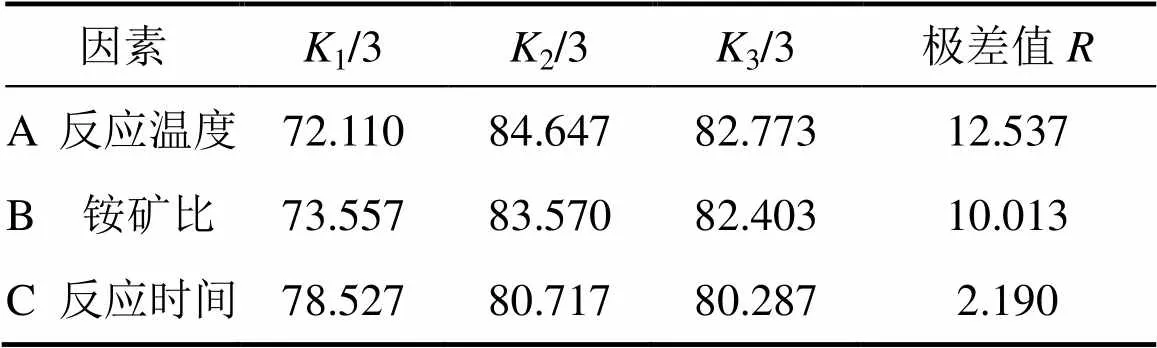
表4 极差分析结果
注:1,2和3分别表示3个正交因素在各个水平下的MgO浸出率总和;等于3个正交因素在各个水平下的最大平均值减去最小平均值。
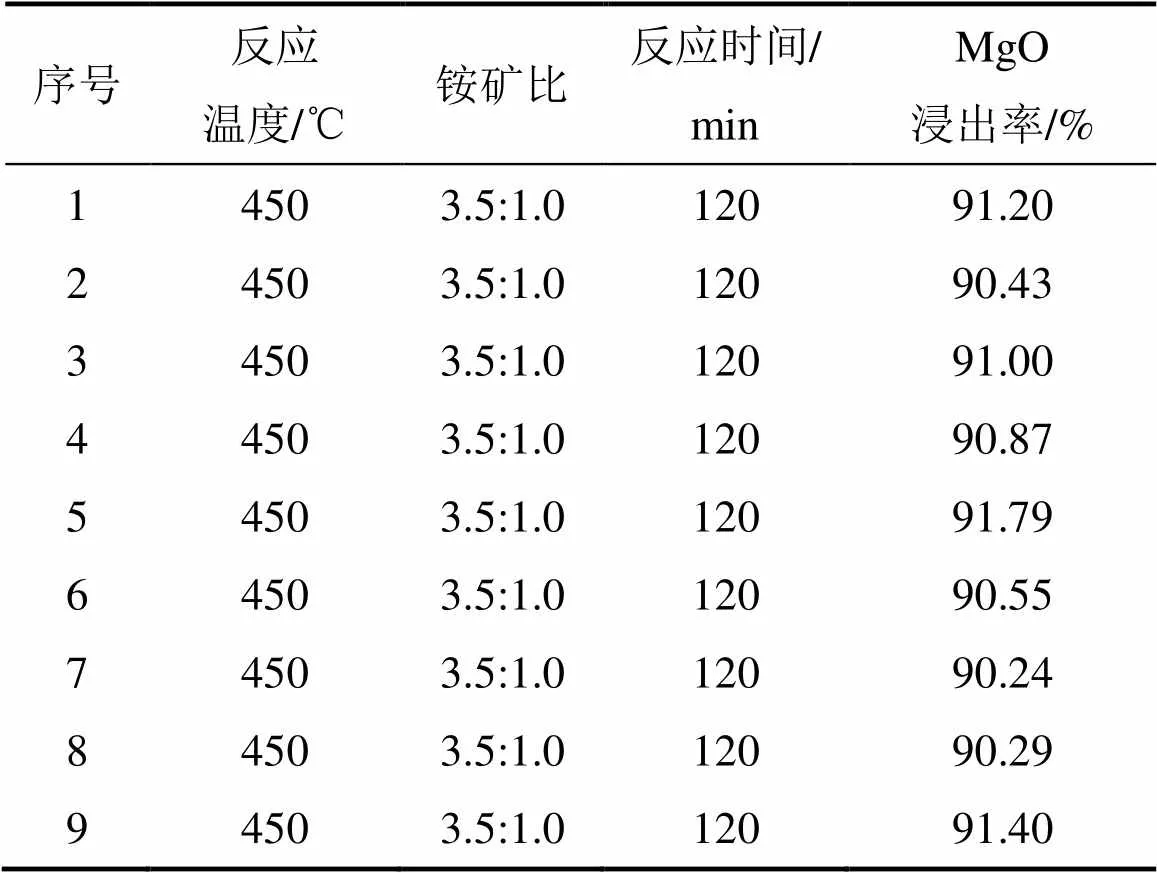
表5 多次验证实验结果
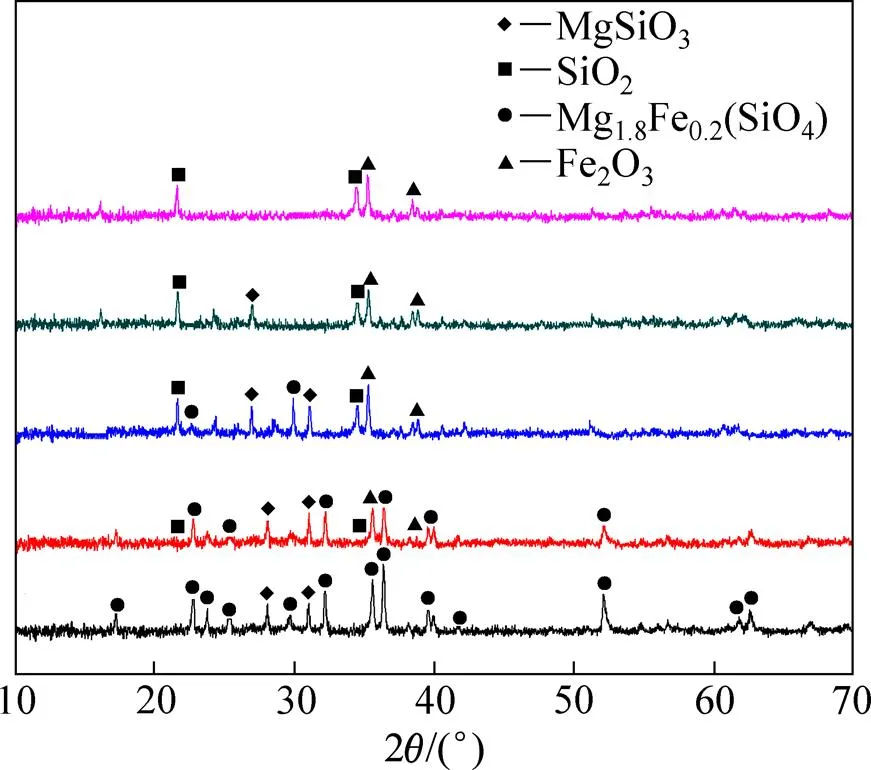
图10 焙烧不同时间所得镍铁渣的XRD图

焙烧时间/min:(a) 30;(b) 60;(c) 120
由图11可以看出:焙烧处理前,镍铁渣呈不规则状,粒度分布不均;随着焙烧时间延长,在(NH4)2SO4作用下镍铁渣表面逐步变得疏松,粒度逐渐变小,其主要原因是( NH4)SO4中存在较高活性的SO42−,对渣中MgSiO3和Mg1.8Fe0.2(SiO4)可起到有效的分解作用,破坏其稳定的硅酸盐结构,生成可溶性MgSO4进入溶液。
3 结论
1)通过单因素实验和正交实验得到镍铁渣在(NH4)SO4焙烧体系中浸出过程的优化条件为:焙烧温度450 ℃,铵矿比3.5:1.0,焙烧时间120 min。在优化实验条件下进行多次重复实验,MgO浸出率稳定在90%以上。
2) 在(NH4)2SO4作用下的镍铁渣渣相中,MgSiO3和Mg1.8Fe0.2(SiO4)已完全分解,焙烧后的渣中只富集Fe2O3和SiO2两相,浸出液中获得含镁溶液,达到脱除渣中镁的目的,为后续镁的提取创造了有利条件。
[1] ZHAO Changming, WANG Guocheng. The melting reaction mechanism of NaOH in decomposing Ca2SiO4[J]. Mineral Processing and Extractive Metallurgy Review, 2015, 36(6): 385−390.
[2] ZHAO Changming, WANG Guocheng, LI Shengli, et al. Reaction pathway led by silicate structure transformation on decomposition of CaSiO3in alkali fusion process using NaOH[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(11): 3827−3833.
[3] 孔令军, 赵祥麟, 刘广龙. 红土镍矿冶炼镍铁废渣综合利用研究综述[J]. 铜业工程, 2014, 128(4): 42−46.KONG Lingjun, ZHAO Xiangling, LIU Guanglong. Briefly discussion on studying properties and comprehensive utilization of ferro-nickel slag[J]. Copper Engineering, 2014, 128(4): 42−46.
[4] FIDANCEVSKA E, VASSILEV V, MILOSEVSKI M, et al. Composites on the base of industrial wastes Ⅲ: production of composites of Fe-Ni slag and waste glass[J]. Journal of the University of Chemical Technology and Metallurgy, 2007, 42(3): 285−290.
[5] KOMNITSAS K, ZAHARAKI D, PERDIKATSIS V. Geopolymerisation of low calcium ferronickel slags[J]. Journal of Materials Science, 2006, 42(9): 3073−3082
[6] KOMNITSAS K, ZAHARAKI D, PERDIKATSIS V. Effect of synthesis parameters on the composites strength of low-calcium ferronickel slag inorganic polymers[J]. Journal of Hazardous Materials, 2009, 161(2/3): 760−768.
[7] BODAS M G, AKERKAR D D. Extraction of nickel and cobalt from over-burden sample of chromite ore mines of orissa mining corporation[J]. Transactions of the Indian Institute of Metals, 1991, 44(6): 433−440.
[8] KARB B, SWAMY Y V. Some aspects of nickel extraction from Chromitiferous overburden by sulphatization roasting[J]. Minerals Engineering, 2000, 13(14/15): 1635−1640.
[9] 石剑锋, 王志兴, 胡启阳, 等. 硫酸氢铵硫酸化焙烧法红土镍矿提取镍钴[J]. 中国有色金属学报, 2013, 23(2): 510−515. SHI Jianfeng, WANG Zhixing, HU Qiyang, et al. Recovery of nickel and cobalt from nickel laterite ore by sulfation roasting method using ammonium bisulfate[J].The Chinese Journal of Nonferrous Metals, 2013, 23(2): 510−515.
[10] 段华美, 吕晓姝, 宁志强, 等. 利用硫酸铵焙烧工艺提取硼精矿中的硼[J]. 东北大学学报(自然科学版), 2011, 32(12): 1724−1728. DUAN Huamei, LÜ Xiaoshu, NING Zhiqiang, et al. Boron extraction from boron-concentrate ore by ammonium sulfate roasting method[J]. Journal of Northeastern University (Natural Science), 2011, 32(12): 1724−1728.
[11] 彭兵, 李燕春, 柴立元, 等. 锌浸渣硫酸铵焙烧−选择性浸出回收锌[J]. 中国有色金属学报, 2015, 25(9): 2596−2603.PENG Bing, LI Yanchun, CHAI Liyuan, et al. Recovery of zinc from zinc leaching residue by ammonia sulfate roasting-selective leaching[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(9): 2596−2603.
[12] ZHANG Mingzhu, ZHU Guocai, ZHAO Yuna, et al. A study of recovery of copper and cobalt from copper-cobalt oxide ores by ammonium salt roasting[J]. Hydrometallurgy, 2012, S129/130(3): 140−144.
[13] CHEN Ciyun, WEN Shuming, ZHAO Hefei, et al. Using of roasting leaching methods for copper recovery from a flotation concentrate of Yangla copper ore[J]. Advanced Materials Research, 2013, 868: 403−407.
[14] LIU Xinwei, FENG Yali, LI Haoran, et al. Recovery of valuable metals from a low-grade nickel ore using an ammonium sulfate roasting-leaching process[J]. International Journal of Minerals, Metallurgy and Materials, 2012, 19(5): 377−383.
[15] 刘欣伟, 冯雅丽, 李浩然, 等. 硫酸铵焙烧法浸出镍磁黄铁矿中有价金属[J]. 中国有色金属学报, 2012, 22(5): 1520−1526. LIU Xinwei, FENG Yali, LI Haoran, et al. Leaching of valuable metals from nickel pyrrhotite by ammonium sulfate roasting method[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(5): 1520−1526.
[16] 冯强, 崔雯雯, 张盈, 等. 硫酸铵焙烧与浸出提取碳素铬铁冶炼渣中有价金属[J]. 过程工程学报, 2014(4): 573−579. FENG Qiang, CU1 Wenwen, ZHANG Ying, et al. Extraction of valuable metals from smelting slag of carbon ferrochrome by (NH4)2SO4roasting and leaching[J]. The Chinese Journal of Process Engineering, 2014(4): 573−579.
[17] 晋新亮, 彭同江, 孙红娟. 硫酸铵焙烧法提取粉煤灰中氧化铝的工艺技术研究[J]. 非金属矿, 2013, 36(2): 59−63. JIN Xinliang, PENG Tongjiang, SUN Hongjuan. Techniques of alumina extraction from coal fly ash by ammonium sulfate activation[J]. Non-metallic Mines, 2013, 36(2): 59−63.
[18] SALEH H I, HASSAN K M. Extraction of zinc from blast-furnace dust using ammonium sulfate[J]. Journal of Chemical Technology and Biotechnology, 2004, 79(4): 397−402.
[19] GUO X, LI D, PARK K, TIAN Q, WU Z. Leaching behavior of metals from a limonitic nickel laterite using a sulfation- roasting-leaching process[J]. Hydrometallurgy, 2009, 99(3/4): 144−150.
[20] 刘科伟, 陈天朗. 硫酸铵的热分解[J]. 化学应用与研究, 2002, 14(6): 737−738. LIU Kewei, CHEN Tianlang. Studies on the thermal decomposition of ammonium sulfate[J]. Chemical Research and Application, 2002, 14(6): 737−738.
[21] 张建珍, 樊晓红, 薛丽华. EDTA络合滴定法连续测定铁矿石中钙和镁[J]. 冶金分析, 2011, 31(8): 74−78. ZHANG Jianzhen, FAN Xiaohong, XUE Lihua. Continuous determination of calcium and magnesium in iron ore by EDTA complexometric titration[J]. Metallurgical Analysis, 2011, 31(8): 74−78.
(编辑 伍锦花)
Recovery of MgO from laterite nickel slag through roasting by ammonium sulfate
ZHAO Changming1, 2, CAI Yonghong1, 3, NING Zhe1, 2, WANG Guocheng1, 2,KANG Shuming1, ZHANG Chongmin1, ZHAI Yuchun4
(1. School of Materials and Metallurgy, University of Science and Technology Liaoning, Anshan 114051, China;2. Key Laboratory of Chemical Metallurgy Engineering of Liaoning Province, Anshan 114051, China;3. Pangang Group Chengdu Iron & Steel Co., Ltd., Panzhihua 617000, China;4. School of Materials and Metallurgy, Northeastern University, Shenyang 110004, China)
The circulation process of sulfation roasting laterite nickel slag using ammonium sulfatewas designed to overcome the defects of traditional process, such as severe environmental pollution and resource waste. Through single factor experiment, the effects of roasting temperature, mass ratio of ammonium sulfateto ore, and roasting time on the extracting rate of MgO from the laterite nickel slagwere investigated. Furthermore, the optimum technological conditions were determined by orthogonal experiment. The results show that the optimum technological conditions are as follows: roasting temperature of 450 ℃, mass ratio of ammonium sulfate to ore of 3.5:1.0 and roasting time of 120 min. The extracting rate of MgO is stably over 90% under the optimum conditions. The process is proved to be significant in exploitation and utilization of laterite nickel slag, which has some advantages, such as environmental friendly, low production cost and low pollution.
laterite nickel slag; ammonium sulfate; roasting; nickel laterite ore
10.11817/j.issn.1672−7207.2017.08.002
TF822
A
1672−7207(2017)08−1972−07
2016−08−10;
2016−10−12
国家重点基础研究发展规划(973计划)项目(2007CB613603);辽宁省化学冶金工程重点实验室开放课题基金资助项目(USTLKFSY201502)(Project(2007CB613603) supported by the National Basic Research Development Program (973 Program) of China; Project(USTLKFSY201502) supported by the Open Research Fund of Key Laboratory of Chemical Metallurgy Engineering of Liaoning Province)
赵昌明,博士,副教授;从事冶金物理化学研究;E-mail:lnzhaochangming@163.com
