检测血清肿瘤型丙酮酸激酶在子宫内膜癌中的临床意义
2017-11-01刘婉敏张伟健练晓勤魏继红
钟 倩,牛 刚,刘 芳,刘婉敏,张伟健,练晓勤,魏继红
(1.江门市中心医院 妇科,广东 江门529000;2.中山大学附属第一医院)
检测血清肿瘤型丙酮酸激酶在子宫内膜癌中的临床意义
钟 倩1,牛 刚2,刘 芳1,刘婉敏1,张伟健1,练晓勤1,魏继红1
(1.江门市中心医院 妇科,广东 江门529000;2.中山大学附属第一医院)
目的检测正常子宫内膜、子宫内膜增生症(单纯型增生、复杂型增生、不典型增生)和子宫内膜癌患者的血清肿瘤型丙酮酸激酶(Tu M2-PK),探讨其在子宫内膜癌发生发展中的作用,并初步分析其在子宫内膜癌中的临床意义。方法选取2009年8月至2010年8月在江门市中心医院妇科行子宫切除术或诊断性子宫内膜刮除术的患者140例,其中正常子宫内膜患者30例,子宫内膜增生症55例(单纯型增生15例,复杂型增生20例,不典型增生20例),子宫内膜癌55例,采用酶联免疫吸附试验(ELISA方法)检查其血清中的Tu M2-PK的浓度水平。结果①正常子宫内膜、子宫内膜增生症患者中的血清Tu M2-PK水平差异无统计学意义(P>0.05),但与子宫内膜癌患者比较有显著性差异(P<0.01);②子宫内膜癌患者血清Tu M2-PK水平与手术分期及病理分级有相关性,即手术分期Ⅲ与分期Ⅰ-Ⅱ、病理分级G3与G1-G2之间差异有统计学意义(P<0.05;P<0.01),但与患者年龄、术前血清CA125值、肌层浸润深度、腹水细胞学无相关性(P>0.05)。结论子宫内膜良性病变的患者与子宫内膜癌患者的血清Tu M2-PK水平比较有显著性差异(P<0.01),子宫内膜癌患者血清Tu M2-PK水平与手术分期及病理分级密切相关,提示其有望成为子宫内膜癌临床诊断的生物学标志之一,对临床诊断治疗有一定作用。
子宫内膜癌;肿瘤型丙酮酸激酶(Tu M2-PK);血清
(ChinJLabDiagn,2017,21:1701)
在我国,根据区域的不完全统计,子宫内膜癌的发病率和死亡率呈现上升趋势[1]。由于子宫内膜癌的确切病因不明,临床上无法针对病因对子宫内膜癌进行早期诊断。本文采用酶联免疫吸附试验(ELISA方法)检查正常子宫内膜(NE)、子宫内膜增生症内膜(EH)、子宫内膜癌(EC)患者血清中Tu M2-PK的浓度水平探讨其在子宫内膜癌发生发展中的作用,并初步分析其与子宫内膜癌临床、病理因素的关系,报道如下。
1 对象与方法
1.1研究对象选取2009年8月至2010年8月在江门市中心医院妇科行子宫切除术或诊断性子宫内膜刮除术的患者140例,其中正常子宫内膜患者30例(增生期、分泌期各15例)。子宫内膜增生症55例(单纯型增生15例,复杂型增生20例,不典型增生20例)。子宫内膜癌55例(G110例,G224例,G321例),其中内膜样腺癌49例,其余类型6例(其中腺棘癌、腺鳞癌各3例)。病理分期按2009年FIGO标准:其中Ⅰ期25例(IA期14例,IB期11例),Ⅱ期15例,Ⅲ期15例,其中III期患者包括只侵及盆腔淋巴结者11例、只侵及阴道者1例、侵及浆膜或输卵管者3例。
1.2临床特点(1)临床表现:正常内膜患者中月经异常20例(66.7%),不孕10例(33.3%);子宫内膜增生症患者中月经紊乱者34例(61.3%),经期延长、经量增多者19例(34.5%),绝经后阴道流血2例(3.6%);子宫内膜癌患者中月经紊乱25例 (45.4%),绝经后阴道流血29例(52.7%),阴道排液1例(1.8%)。(2)年龄:正常子宫内膜患者为24岁-54岁,平均年龄为38岁;子宫内膜增生症患者年龄为38岁-62岁,平均年龄为45岁;子宫内膜癌患者年龄为32-73岁,平均年龄为50岁;(3)生育史:正常内膜患者未孕10例,生育1胎6例,生育二胎及以上14例;子宫内膜增生症患者中3例未孕,仅生育1胎20例,生育二胎或以上32例;内膜癌患者中未孕5例,生育1胎4例,生育二胎或以上46例;(4)高血压、糖尿病病史:正常子宫内膜患者合并高血压病2例,糖尿病1例,无合并症27例;子宫内膜增生症患者合并高血压病3例,糖尿病2例,同时合并高血压病和糖尿病2例,无合并症48例;内膜癌患者同时合并高血压、糖尿病有4例,单纯合并高血压者为9例、合并糖尿病者7例,无糖尿病或高血压病合并症35例。
1.3方法所有病例均早晨空腹抽取外周静脉血2 ml,静置待血液凝固后,1-2 h内3 500 r/min离心10 min,分离血清后于-70℃冰箱保存,所有标本同批测定完毕。检测过程按操作说明书进行。
1.4结果判断30分钟内在波长450 nm的酶标仪上读取个孔的OD值,根据标准品OD值描标准曲线,用样本OD值直接代入标准曲线得出样本浓度。
1.5统计学方法采用Prisom4统计软件及简明统计分析软件10.32分析统计,计数资料采用χ2检验,计量资料采用t检验,非正态分布的数据采用秩和检验,P<0.05有统计学意义。ROC曲线采用SPSS11.5软件分析处理。
2 结果
2.1血清TuM2-PK值相对于良恶性的诊断界点(cut-offpoint)
ROC曲线下面积0.844,标准误0.035,渐进显著性水平0.000,P<0.01,渐进95%置信区间(0.775,0.913),cut-off值7.175,灵敏度74.5%,特异度80%。见图1。
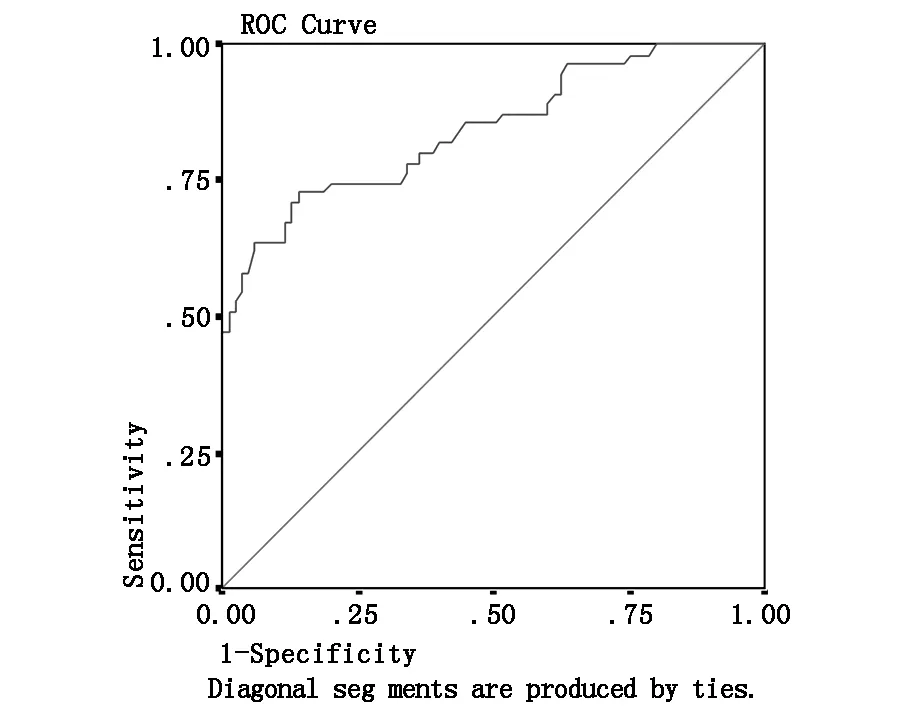
图1 血清Tu M2-PK的ROC曲线
2.2血清TuM2-PK在正常子宫内膜、子宫内膜增生症、子宫内膜癌患者中比较
通过统计学分析,血清Tu M2-PK在正常子宫内膜、子宫内膜增生症、子宫内膜癌患者中水平比较具有显著性差异(P<0.01)(见表1)。四组间两两比较,正常子宫内膜、子宫内膜增生症患者中的血清Tu M2-PK水平差异无统计学意义(P>0.05),但与子宫内膜癌患者比较有显著性差异(P<0.01)(见表2)。
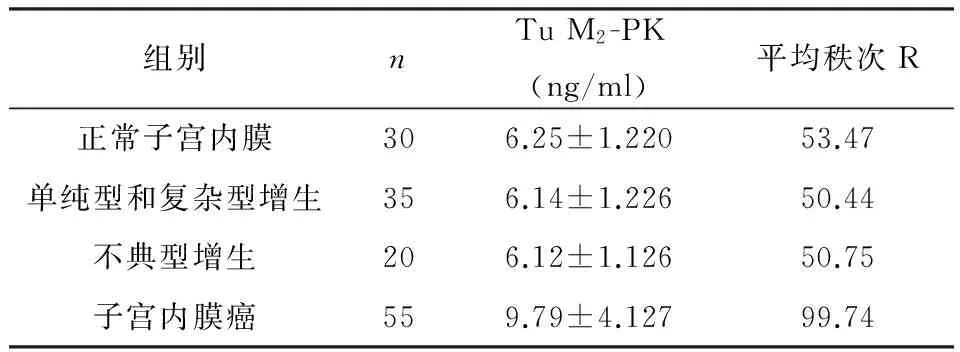
表1 各组患者血清Tu M2-PK值比较
Hc=47.176,P<0.01

表2 各组患者血清Tu M2-PK值两两比较
2.3子宫内膜癌患者术前术后血清TuM2-PK比较
子宫内膜癌患者术前与术后第二天血清Tu M2-PK比较无统计学意义(P>0.05)(见表3)。
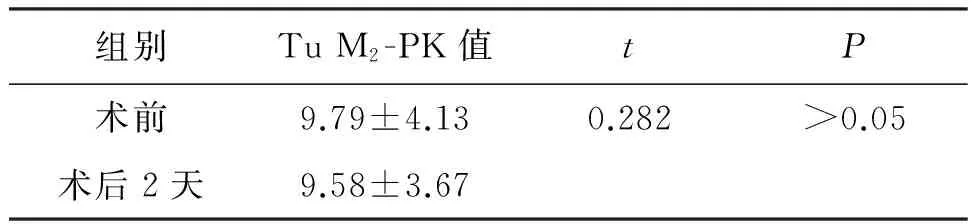
表3 子宫内膜癌患者术前术后血清Tu M2-PK值比较
2.4血清TuM2-PK水平与子宫内膜癌患者临床病理特征的关系
子宫内膜癌患者血清Tu M2-PK水平与临床分期、病理分级密切相关(P<0.01),即临床分期Ⅲ与分期Ⅰ-Ⅱ有显著性差异(P<0.01),病理分级G3与G1-G2差异有统计学意义(P<0.01)。Tu M2-PK与患者年龄、术前血清CA125水平、肌层浸润深度、腹水细胞学无相关性(P>0.05)。见表4,5。
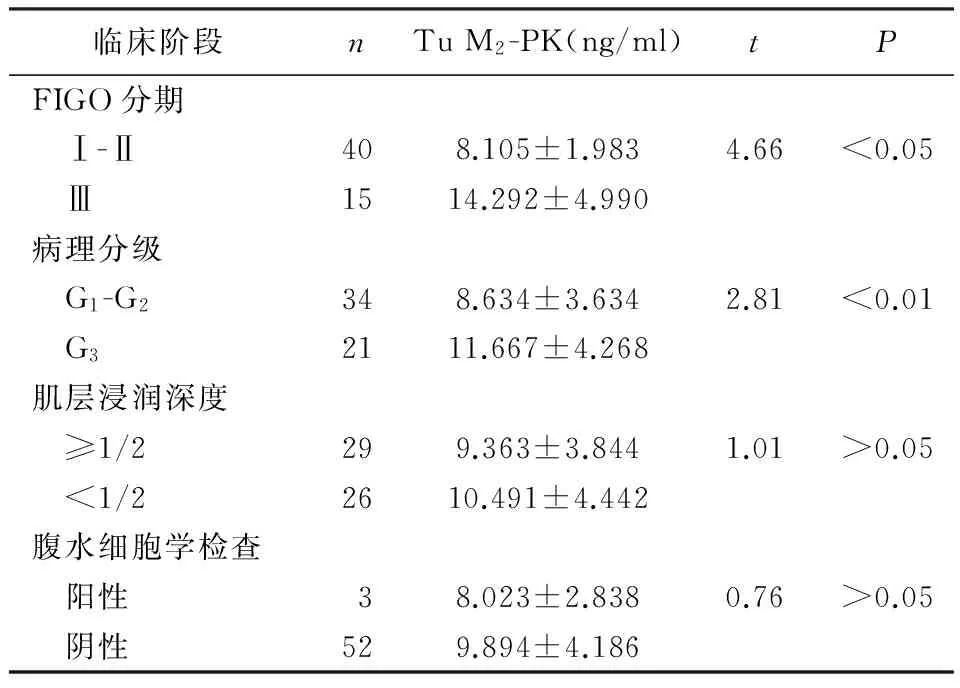
表4 子宫内膜癌患者血清Tu M2-PK与病理特征的关系
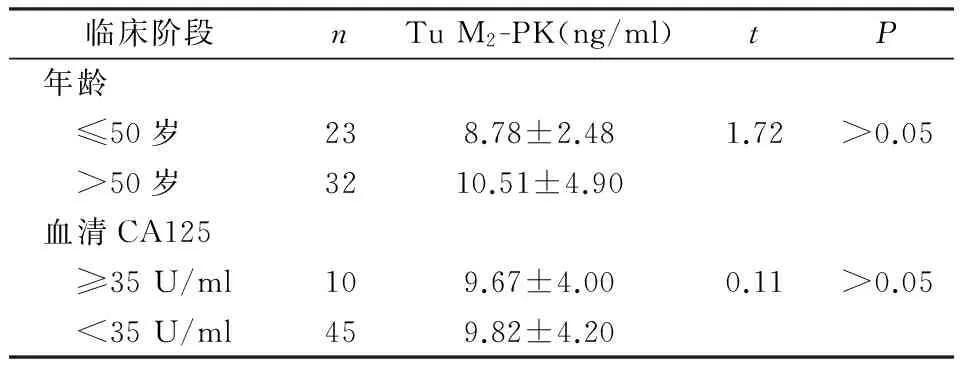
表5 子宫内膜癌患者血清Tu M2-PK与临床指标的关系
3 讨论
丙酮酸激酶(PK)是糖酵解途径的一个关键酶,它有四种同工酶(L-PK、R-PK、M1-PK、M2-PK),通常以酶的活性四聚体形式存在,分布表达具有组织特异性。M2-PK主要分布于肠、肺、胚胎以及增殖或未分化的组织中。在肿瘤细胞中,四聚体的M2-PK亚型裂解,主要为二聚体形式,而二聚体形式的M2-PK对磷酸烯醇式丙酮的亲和力较弱,在肿瘤细胞中这些二聚体形式M2-PK的浓度明显升高,呈现出过度表达状态,导致大量糖酵解磷酸代谢物的积聚,以保证肿瘤细胞内能量的供给[2]。
本文结果发现,血清TuM2-PK水平子宫内膜癌患者与正常子宫内膜、子宫内膜增生症患者差异有统计学意义,但正常子宫内膜、子宫内膜增生症患者之间无统计学意义(P>0.05),而且Tu M2-PK蛋白表达水平与血清Tu M2-PK浓度水平相关系数为0.551,有中等正相关关系。这提示Tu M2-PK可能在诊断子宫内膜癌有重要的临床意义。Schneider 等[3]的研究亦证实,肺癌患者癌组织及血浆中的M2-PK表达水平均显著高于正常人;周娟等[4]认为Tu M2-PK在胰腺癌诊断方面检测价值与CA199 相仿;KoigasJ等[5]认为Tu M2-PK对肾细胞癌诊断有意义。本研究结果表明:Tu M2-PK与子宫内膜癌的手术分期及病理分级有密切相关性,即手术分期Ⅲ期与Ⅰ-Ⅱ期、病理分级G3与G1-G2差异有统计学意义。
本研究中,子宫内膜癌Ⅲ期患者主要表现为淋巴结转移,这间接提示Tu M2-PK与淋巴结是否有转移有关。患者发生子宫内膜癌时,促进糖异生的关键酶活性可能下降,而促进糖酵解的PK等酶的表达及活性则升高,使ATP失去对糖酵解的调节作用,从而使糖酵解易于进行,有利于肿瘤组织的生长,随着肿瘤的发展,肿瘤逐渐增大,肿瘤细胞增多,合成的Tu M2-PK也随逐渐增多,出现了Tu M2-PK的表达增加。当子宫内膜癌的肿瘤细胞分化程度越低,其增殖越快,肿瘤细胞代谢越旺盛,Tu M2-PK阳性表达率越高,这反映了肿瘤细胞的生物学代谢特征[6]。因此检测子宫内膜癌患者血清Tu M2-PK水平和组织中Tu M2-PK蛋白对其诊断和判断预后可能具有非常重要的临床意义。肿瘤组织学类型、分化程度、肌层浸润深度、FIGO分期是公认影响早期子宫内膜癌预后的独立因素[7],术后一般应行辅助治疗,这说明Tu M2-PK检测对患者病情的评估及治疗可能有较大的临床作用。
血清CA125水平是子宫内膜癌最有用的肿瘤标志物[8]。Nobuhiro[9]等认为在子宫内膜癌中,CA125随手术分期增加而上升,郭梦凡等[10]研究显示CA125蛋白表达随着组织分级的增加而升高,但本研究中,Tu M2-PK与CA125无相关性。可能因为样本例数少,或者统计学方法比较单一,未能显现两者之间的关系,或者还需要大样本研究确定两者是否有相关性。
本文结果发现,子宫内膜癌患者术前与术后第二天血清Tu M2-PK值无统计学意义(P>0.05),这可能与术后血细胞反应性的增加有关,淋巴细胞和粒细胞释放Tu M2-PK所导致的[11,12]。Wechsel 等[13]报道发现外科手术后,大部分手术成功的肾细胞癌患者的M2-PK水平在六周内恢复正常,这启示我们,最好不要在术后几天内复查Tu M2-PK值,以免错误判断预后,造成过度治疗。
本研究中,血清Tu M2-PK的cut-off值为7.175 ng/ml,低于一般诊断值15 U/ml,可能与实验方法不同有关,本研究采用竞争ELISA方法,标本为血清,不同于夹心ELISA方法和标本为血浆,至于子宫内膜癌的Tu M2-PK阳性界值是否为7.18 ng/ml,应该还需要大样本的研究。
[1]王春芳,张 果,魏丽慧.子宫内膜癌与代谢性疾病的关系[J].中华妇产科杂志,2010,45(12):946.
[2]Mazurek S.Pyruvate kinase type M2 :a key regulator within the tumour metabolome and a tool for metabolic profiling of tumours[J].Ernst Schering Found Symp Proc,2007,4:99.
[3]Schneider J,Peltri G,Bitterlich N,et al.Fuzzy logic—based tumor marker profiles including a new marker tumor M2-PK imp roved sensitivity to the detection of progression in lung cancer patients[J].Anticancer Res,2003,23(2A):899.
[4]周 娟,王 东,陈连周,等.肿瘤型M2丙酮酸激酶与癌类抗原199联合检测在胰腺癌诊断中的应用[J].实用医学杂志,2005,21 (20):2252.
[5]Koigas J.Tumor M2pyruvate Kinase in plasma of patients with urological tumor [J].Tumour Biol,2001,22 (5):282.
[6]Mazurek S,Boschek C B,Hugo F.Pyruvate kinase type M2and its role in tumor growth and spreeding [J].Semin Cancer Biol,2005,15(4):300.
[7]王 刚,董 霞.早期子宫内膜癌术后补充治疗及晚期患者非手术治疗[J].中国实用妇科与产科杂志,2010,26(3):179.
[8]谯兴强,董颜颜.CA125、CA153联合检测对诊断子宫内膜癌的意义[J].国际检验医学杂志,2006,27(3):222.
[9]Takeshima N,Shimizu Y,Umezawa S,et al.Combined assay of serum levels of CA125 and CA199 in endometrial cancinoma[J].GynecolOncol,1994,54(3):321.
[10]郭梦凡,王 抒,孟庆媛, 等.CA125在子宫内膜癌的表达及临床意义[J].黑龙江医药科学,2008,31(1):83.
[11]Hugo F,Fischer G,Eigenbrodt E.Quantitative detection of tumor M2-PK in serum and plasma[J].Anticancer Res,1999,19:2753.
[12]Oehler R,Weingartmann G,Manhart N,et al.Polytrauma induces increased expression of pyruvate kinase in neutrophils[J].Blood,2000,95:1086.
[13]Wechsel HW.Marker for Renal Cell Carcinoma (RCC):The Dimeric Form of Pyruvate Kinase Type M2(Tu M2-PK)[J].Anticancer Research,1999,19:2583.
PreliminaryinvestigationoftheclinicalsignificanceserumleveloftumorM2-pyruvatekinaseinendometrialcarcinoma
ZHONGQian,NIUGang,LIUFang,etal.
(JiangmenCenterHospital,Jiangmen529000,China)
ObjectiveThe expression of serum level of tumor M 2 -pyruvate kinase(Tu M2-PK) in patients of normal endometrial,endometrial hyperplasia (simple hyperplasia,complex hyperplasia,atypical hyperplasia) and endometrial carcinoma will be tested in this paper.Thereby we can analyze the effect of development of Tu M2-PK on endometrial carcinoma and discuss its clinical significance in endometrial cancer.MethodsWe selected 140 patients who accepted the hysterectomy or endometrial biopsy from August 2009 to August 2010 in the Gynecology at Jiangmen Central Hospital.In our sample,there are 30 cases of normal endometrial tissues,55 endometrial hyperplasia (15 simple hyperplasia,20 complex hyperplasia,20 atypical hyperplasia) and 55 endometrial carcinoma.the patients’ serum level of Tu M2-PK was examined by ELISA (Enzyme-Linked Immunosorbnent Assay).Results①There was no significant difference between the patients’ serum level of Tu M2-PK in normal endometrial group and endometrial hyperplasia group (P>0.05),except endometrial carcinoma group (P<0.01).②The serum level of Tu M2-PK were positive related to clinical FIGO staging and histological grade of endometrial carcinoma.That is the differences between FIGO stage III and stage I-II,histological grade 3 and grade 1-2 were significant (P<0.05;P<0.01).But Tu M2-PK had no relationship with the patients’ age,the serum level of CA125 before operation,the depth of invasion and peritoneal cytology(P>0.05).3The diagnostic cutoff value for Tu M2-PK was 7.175.The expression of Tu M2-PK in tissues and the serum level of Tu M2-PK had a moderate positive correlation that the correlation coefficient is 0.551.ConclusionThe serum level of Tu M2-PK have close relationship with clinical FIGO staging and histological grade of endometrial carcinoma.Tu M2-PK may be a useful biomarker to detect the early carcinogenesis of endometrial carcinoma,and play a certain role in the diagnosis and treatment of endometrial carcinoma.
endometrial carcinoma;tumor M2-pyruvate kinase;serum
R737.33
A
2016-03-03)
1007-4287(2017)10-1701-04
