CNN1在结直肠癌中的表达及意义
2017-11-01谢春英董宇贺徐雪松何成彦孙景春黄丽红
谢春英,董宇贺,徐雪松,何成彦,孙景春,黄丽红
(吉林大学中日联谊医院 检验科,吉林 长春130033)
CNN1在结直肠癌中的表达及意义
谢春英,董宇贺,徐雪松*,何成彦,孙景春,黄丽红
(吉林大学中日联谊医院 检验科,吉林 长春130033)
目的探讨钙调蛋白Ⅰ(CNN1)在结直肠癌及癌旁组织中的表达及意义。方法采用液质联用技术检测结直肠癌中的差异蛋白,并用免疫印迹试验验证差异蛋白的表达。结果以配对癌旁正常组织为依据,本实验共筛选出结直肠癌差异蛋白44个,下调蛋白23个,CNN1即为下调表达的蛋白之一。结论CNN1的低表达与多种癌症相关,包括结直肠癌,因此CNN1可能作为一种癌症抑制因子发挥作用。
结直肠癌;CNN1;液质联用技术;免疫印迹
(ChinJLabDiagn,2017,21:1679)
结肠直肠癌是癌症死亡的第四大常见原因,占所有癌症死亡的8%[1]。在我国,结直肠癌的死亡率仅次于肺癌、胃癌、肝癌、食管癌居第五位[2],其发病率仍逐渐上升,尤其在发展中国家的年轻人当中上升最快[3],严重威胁着人类的健康。在过去的几十年中,结直肠癌的发病机制一直是研究的热点,但是很多的术后患者、肿瘤转移患者的预后并不理想,因此早期诊断依然是治疗结直肠癌的关键。研究发现钙调蛋白Ⅰ(CNN1)在多种恶性肿瘤中低表达,是一种潜在的具有肿瘤诊断价值的广谱标记物。本研究检测了吉林大学中日联谊医院44例结直肠癌组织及癌旁正常组织中CNN1的表达情况,探讨CNN1与结直肠癌的关系,以期能为结直肠癌的早期诊断、治疗等提供新的有价值的理论依据。
1 材料和方法
1.1标本来源
本实验所用的结直肠癌组织标本均经病理学检查证实为腺癌,癌旁正常组织均取自癌组织上缘10 cm外,患者手术前均未接受任何方式的治疗。依据上述标准,收集从吉林大学中日联谊医院接受手术治疗的结直肠癌组织标本44例,手术即时冲洗取材,液氮速冻保存。
1.2方法
1.2.1主要试剂及仪器 TMED、苯甲基磺酰氟(PMSF) 、十二烷基磺酸钠(SDS)、超纯水购于Sigma公司。二硫代苏糖醇(DTT)、DNA酶、RNA酶、测序级胰蛋白酶等购自Promeg公司。碘代乙酰胺(IAM) 、蛋白质定量试剂盒购于Bio-Rad公司。安捷伦1200series液相色谱仪,赛默飞世尔的 LTQXL质谱仪。
1.2.2样本总蛋白的提取 ①取结直肠癌组织及癌旁正常组织各50 mg,研磨裂解至匀浆。②RCF:12 000 g,4℃离心1 h,取上清备用。③测定蛋白质含量:考马斯亮蓝染色,于595 nm处测蛋白浓度。④检测结束,-80℃分装保存。
1.2.3水解多肽混合物的制备 ①冻存总蛋白平衡至室温,NH4HCO3溶解稀释。②DTT调定至20 mmol/L的终浓度,56℃避光1 h。③室温时加入IAM,混匀调定至50 mmol/L的终浓度,避光30 min。④按蛋白∶胰酶=50∶1的比例加入胰酶,37℃水浴箱过夜。⑤-80℃保存酶切产物。
1.2.4液质联用分析及数据检索 ①缓冲液A溶解样品,取50 μg上样,赛默飞世尔的LTQXL质谱仪检测反相色谱洗脱的多肽。②质谱二级扫描应用数据依赖方式:以Thermo Fisher的Bioworks 3.3.1SP1软件进行质谱数据的分析,Sequest算法检索Uniprot_sprot数据库,比较分析鉴定差异蛋白质。
1.2.5Western blot 通过SDS-PAGE凝胶电泳、转膜、封闭等操作来验证目标蛋白CNN1在结直肠癌和癌旁组织的表达情况。免疫印迹所用CNN1单抗购于Santa Cruz公司,其内参为β-actin。

2 结果
2.1液质联用分析差异蛋白
蛋白质丰度使用谱图数来评价,对于丰度有差异的蛋白质,谱图数需要同时满足以下两个条件:①蛋白谱图数的差值在两个样品中要大于或等于72;②两样品中蛋白谱图数的比值要大于或等于1。按照以上标准得到结直肠癌与癌旁组织的差异蛋白44个,其中上调表达蛋白21个,下调蛋白23个。本文着重探讨下调表达的CNN1,CNN1的质谱图见图1。
图1 CNN1的质谱图
2.2Westernblot
免疫印迹试验验证了CNN1在结直肠癌组织和配对的癌旁组织中的表达情况,如图2,可见CNN1在癌组织的表达水平明显低于配对的癌旁组织。
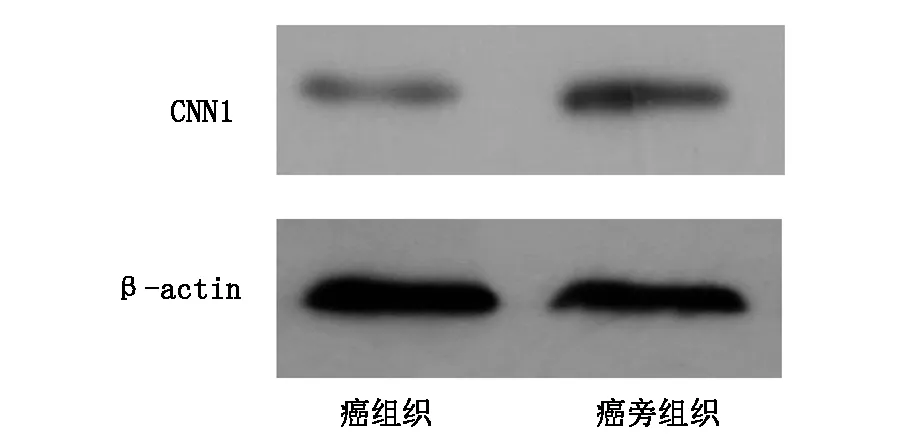
图2 CNN1的免疫印迹图
3 讨论
CNN1(basic calponin or calponin h1)被称为钙调蛋白1,也被称为心肌和平滑肌的分化标记[4],是钙调蛋白三个亚型之一,编码该蛋白的基因在人类19号染色体(19p13.2-p13.1)上[5]。CNN1是分子量为34 kDa的线性分子,首次发现于牛的主动脉和鸡的平滑肌中,后来被证明在大多数脊椎动物的平滑肌中都存在着CNN1。CNN1在生理状态下与肌动蛋白、原肌球蛋白和钙调蛋白结合,参与平滑肌收缩的调控和细胞增殖[6];在各种病理状态下,比如异常的胃肠蠕动[7]、缺氧[8]等都会引起CNN1表达的异常。
肿瘤的生长、转移和传播都依赖于血管,由于不成熟的微血管是不规则的、弯曲的、渗漏的,与成熟血管相比肿瘤细胞可能更容易进入微血管,从而导致肿瘤转移。CNN1在血管的成熟过程中扮演着重要的角色,CNN1能稳定肌动蛋白并抑制细胞运动[9]。肿瘤细胞中的CNN1能够抑制肿瘤的增殖、克隆以及致瘤性,同时抑制肿瘤细胞的运动性和侵入性[10]。有研究证明敲除编码CNN1的基因,会导致血管、腹膜等组织形态上的脆性,从而加速肿瘤的血管转移和腹膜转移[11]。大量的研究证明CNN1在多种肿瘤组织中都低表达,比如膀胱癌[12]、恶性黑色素瘤[13]、肝细胞癌[14]、卵巢癌[15]、乳腺癌[16]等,并且在肾细胞癌[17]中的低表达与肿瘤的大小、类型、浸润程度等相关,而且有研究表明CNN1在癌前病变中也低表达[18],这些临床病理结果都提示我们CNN1作为一种可靠的肿瘤标志物的有效性和可探索性。本研究通过液质联用技术检测到了CNN1在结直肠癌中的低表达,并通过免疫印迹试验进行了验证,与上述肿瘤中CNN1的表达情况一致。究竟CNN1能不能成为结直肠癌早期诊断的标志物还有待于进一步的探索研究。
[1]Drew JE,Farquharson AJ,Mayer CD,et al.Predictive Gene Signatures:Molecular Markers Distinguishing Colon Adenomatous Polyp and Carcinoma [J].Colon Pathology Gene Signature,2014,9(11):1.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115.
[3]Printz C.Colorectal cancer incidence increasing in young adults[J].Cancer,2015,121(12):1912.
[4]Miano JM ,Olson EN.Expression of the smooth muscle cell calponin gene marks the early cardiac and smooth muscle celllineages during mouse embryogenesis[J].J Biol Chem,1996,271:7095.
[5]Miano JM,Krahe R,Garcia E,et al.Expression,genomic structure and high resolution mapping to 19p13.2 of the human smooth muscle cell calponin gene[J].Gene,1997,174:215.
[6]Jiang Z,Grange RW,Walsh MP,et al.Adenovirus-mediated transfer of the smooth muscle cell calponin gene inhibits proliferation of smooth muscle cells and fibroblasts[J].FEBS Lett,1997,413(3):441.
[7]Wang X,Wu K,Zhang Z,et al.The effect of calponin and caldesmon in regulation of the gastrointestinal motility during pathophysiological adaptation[J].Zhonghua Nei Ke Za Zhi,2001,40:459.
[8]Bodong Lv ,Jianfeng Zhao ,Fan Yang,et al.Phenotypic transition of corpus cavernosum smooth muscle cells subjected to hypoxia[J].Cell Tissue Res,2014,357:823.
[9]Takeoka M,Ehara T,Sagara J,et al.Calponin h1 induced a flattened morphology and suppressed the growth of human fibrosarcoma HT1080 cells[J].Eur J Cancer,2002,38:436.
[10]Kaneko M,Takeoka M,Oguchi M,et al.Calponin h1 suppresses tumor growth of Src-induced transformed 3Y1 cells in association with a decrease in angiogenesis[J].Jpn J Cancer Res,2002,93: 935.
[11]Taniguchi S,Takeoka M,Ehara T,et al.Structural fragility of blood vessels and peritoneum in calponin h1-deficient mice,resulting in an increase in hematogenous metastasis and peritoneal dissemination of malignant tumor cell[J].Cancer Res,2001,61:7627.
[12]韩 冬,刘成华,高亚萍,等.膀胱癌相关基因的筛选及初步验证[J].解放军医学院学报,2017,389(4):323.
[13]Koganehira Y,Takeoka M,Ehara T,et al.Reduced expression of actin-binding proteins,h-caldesmon and calponin h1,in the vascular smooth muscle insidemelanoma lesions: an adverse prognostic factor for malignant melanoma[J].Br J Dermatol,2003,148:971.
[14]Sasaki Y,Yamamura H,Kawakami Y,et al.Expression of smooth muscle calponin in tumor vessels of human hepatocellular carcinoma and its possible association with prognosis[J].Cancer,2002,94:1777.
[15]Yamane T,Asanoma K,Kobayashi H,et al.Identification of the Critical Site of Calponin 1 for Suppression of Ovarian Cancer Properties[J].Anticancer Res,2015,35:5993.
[16]Martín de las Mulas J,Reymundo C,Espinosa de los Monteros A,et al.Calponin expression and myoepithelial cell differentiation in canine,feline and human mammary simple carcinomas[J].Vet Comp Oncol,2004,2(1):24.
[17]Islam AH,Ehara T,Kato H,et al.Calponin h1 expression in renal tumor vessels: Correlations with multiple pathological factors of renal cell carcinoma[J].J Urol,2004,171:1319.
[18]Liu CG,Zhang L,Jiang Y,et al.Modulation of Gene Expression in Precancerous Rat Esophagus by Dietary Zinc Deficit and Replenishment[J].Cancer Res,2005,65(17):7790.
TheExpressionandSignificanceofCNN1inColorectalcancer
XIEChun-ying,DONGYu-he,XUXue-song,etal.
(China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
ObjectiveTo investigate the expression and significance of CNN1 in colorectal cancer and adjacent tissues.MethodsTwo-dimensional chromatography and mass spectrometry were used to detect the different proteins of colorectal cancer,in addition,the expression of diferential proteins were verified by Western blot.ResultsForty-four differentially expressed proteins were detected in colorectal cancer based on the corresponding non-tumor normal tissues,and 23 of them were down-regulated,in which,CNN1 was one of the down regulated proteins.ConclusionThe low expression of CNN1 has a relationship with a varity of cancers ,including colorectal cancer,so CNN1 may play a role as a cancer suppressor.
colorectal cancer;CNN1;Two-dimensional chromatography and mass spectrometry;western blot
R735.3+5 R735.3+7
A
2016-10-08)
国家自然科学基金(81572082);吉林省科学技术厅项目(2011713,20150414015GH,20150101153JC);吉林省财政厅项目(SCZSY201517)
*通讯作者
1007-4287(2017)10-1679-03
