不同浓度过氧化氢对Peroxiredoxin II与血红蛋白结合的影响
2017-10-31于佳斌韩英浩金美华
于佳斌,韩英浩,金美华
不同浓度过氧化氢对Peroxiredoxin II与血红蛋白结合的影响
于佳斌,韩英浩,金美华
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
为探究不同浓度的过氧化氢对抗氧化蛋白(Peroxiredoxin II)与血红蛋白结合的影响,利用蛋白质体外结合实验,将带有GST标签的鼠重组Prx II蛋白和鼠血红蛋白进行结合,以及利用蛋白质免疫印迹法检测目的蛋白,检验在不同浓度的过氧化氢存在时,Peroxiredoxin II(Prx II)与血红蛋白的结合情况。结果表明,随着过氧化氢浓度的增加,Prx II与血红蛋白的结合程度受到抑制,同时发现血红蛋白只与Prx II的二聚体形式结合。为过氧化氢存在时Prx II保护血红蛋白提供了基础理论。
蛋白质体外结合实验;蛋白质免疫印迹;Peroxiredoxin II;血红蛋白;二聚体
蛋白质是构成生命活动的基本单元,主要由碳,氢,氧等元素组成[1-2],它调节着生物体内诸多的生理活动过程[3]。随着科学研究的深入,人们发现许多蛋白质并不是独立完成物质运输,信息传递等生理过程的,而是通过蛋白质之间的相互作用完成[3]。其相互作用通常分为两种,一种是物理相互作用,一种是遗传相互作用,物理相互作用指由于结构上互补或存在相互吸引的作用力,两个蛋白质相互结合在一起,或多个蛋白质形成蛋白质复合体,蛋白质分子通过与其他蛋白质相互结合来参与细胞中的各种生理过程,从而行使相应的功能[4]。据文献报道,许多疾病也是由于蛋白质分子结合异常引起的[5],对蛋白质之间结合情况的研究,不仅可以了解蛋白质的功能,也可以对研究许多疾病的机理,以及疾病的预防、治疗、新药开发提供理论基础[6-8]。
研究蛋白质之间相互结合有多种不同的方法,其中蛋白质体外结合实验(Pull down assay)是一个行之有效的实验技术,它可以验证两个或两个以上的蛋白质之间的相互结合情况[9-10]。蛋白质体外结合实验有两种常见的方法。实验采用带有GST标签的鼠重组Prx II蛋白质和纯化的鼠血红蛋白在试管中进行结合反应,利用GST标签能特异性的与谷胱甘肽结合的特性[11-12],将含有目的蛋白的溶液过柱,可从中捕获与之相互作用的“捕获蛋白”(目的蛋白),洗脱结合物后,通过SDS-PAGE分析,从而证实两种蛋白间的相互作用[13-15]。
Peroxiredoxins(Prxs)是一类过氧化物还原酶,它可以通过控制细胞的氧化水平调节机体平衡,保护细胞免受损伤[16-17]。Prxs家族分为六个成员,分别是Prx I-Prx VI,它们广泛存在于哺乳动物体内[18-19],其中Prx II在细胞膜上大量表达。研究显示Prx II在红细胞膜上的含量远远高于同家族的其他过氧化物还原酶,并且,血红蛋白与其的联系非常密切[20-21]。实验利用蛋白质体外结合实验以及蛋白质免疫印迹法检测不同浓度过氧化氢对Prx II与血红蛋白结合的影响,探究过氧化氢对两者相互结合的影响作用,为过氧化氢存在时Prx II保护血红蛋白提供基础理论。
1 材料与方法
1.1 试剂
TEMED,生物工程(上海)有限公司;Tris、考马斯亮蓝R-250、过硫酸铵、甲叉双丙烯酰胺均为Sigma公司;GST agarose沉降蛋白、Prx II一抗、血红蛋白一抗、鼠源二抗均为Santa公司,Prx II重组蛋白,武汉优尔生商贸有限公司。
1.2 材料仪器
紫外可见分光光度计,T6,北京普析通用仪器有限公司;垂直板电泳槽,SE260-10A-75,通用电气医疗系统贸易发展(上海)有限公司;稳压稳流电泳仪,18113001 EPS 301,上海天能仪器厂;小型台式冷冻离心,1-15K,Sigma公司;化学免疫荧光成像系统,AI600,GE 公司;冷冻真空干燥机,F0-1B-55,北京博医康实验仪器有限公司。抗凝管,EDTA-K2,三力有限公司。
1.3 实验动物
129/SvJ野生型小鼠,129/SvJ Prx II基因敲除型小鼠,由黑龙江八一农垦大学,疾病模式动物研究中心提供。
1.4 细胞
129/SvJ野生型小鼠红细胞,129/SvJ Prx II基因敲除型小鼠红细胞。
1.5 方法
1.5.1 小鼠眼眶取血
取周龄为6周的野生型及Prx II基因敲除型129/SvJ小鼠各3只进行眼眶静脉丛取血。采血者的左手拇指和食指从小鼠背部握住小鼠的颈部,使其头部固定,拇指和食指压迫小鼠颈部两侧,使右侧眼球突出,眼眶后侧静脉丛充血,此时将毛细管以45度夹角旋转刺入小鼠眼眶后侧,插入深度2~3 mm,取血同时放松手指,使血液顺利流到抗凝管,取血300 μL[22-23]。
1.5.2 血红蛋白的提取与分离
取小鼠血液300 μL加入1.5 mL离心管中,离心,5 867×g,5 min,上层为透明的淡黄色血浆,下层为红色的红细胞,将上层血吸出弃去,在此离心管中加入 1 mL 磷酸盐缓冲液,混匀,离心,5 867×g,5 min,洗涤红细胞3~4次,直至上清液不再浑浊。洗涤后加入1 mL无菌去离子水,充分吹打,混匀,使红细胞破裂,离心,5 867×g,10 min,收集上清液,用 0.22 μm细胞筛过滤,得到血红蛋白溶液,加入饱和(NH4)2SO4溶液,并搅拌,直至溶液变浑浊,离心,5 867×g,15 min,去上清,得到血红蛋白,干燥备用[24]。
1.5.3 蛋白质体外结合实验
实验分为GST-Prx II组,Prx II基因敲除小鼠的血红蛋白与GST-Prx II混合组,Prx II基因敲除小鼠的血红蛋白组,以及分别以0.2,0.5,1.0 μM浓度的过氧化氢处理Prx II基因敲除小鼠的血红蛋白与GST-Prx II的混合蛋白,过氧化氢溶液现用现配。将1 μM重组Prx II蛋白和7 μM血红蛋白在5 mM磷酸缓冲液(pH 8.0)中进行混合,37℃孵育10 min后加入GST agarose沉降蛋白,得到GST-Prx II,将Prx II基因敲除小鼠的血红蛋白与GST-Prx II混合组溶液注入含有谷胱甘肽琼脂糖的柱子内,再用洗脱液将柱子内结合的蛋白洗出[25],2 292×g,离心 5 min,用磷酸缓冲液清洗3遍,沉淀混合物后加入样品缓冲液并定容至20 μL,95℃变性处理后进行Western blot检测[11-13]。
1.5.4 蛋白质免疫印迹
实验分为β-ME处理组,与过氧化氢处理组,以2%,4%,6%浓度的 β-ME 和 0.2,0.5,1.0 μM 浓度的过氧化氢处理重组Prx II蛋白,β-ME及过氧化氢均现用现配。准备相应1.5 mL离心管,加入800 μL无菌去离子水,200 μL考马斯亮蓝,1 βM重组Prx II样品,混匀,A595测定光度值,确定样品蛋白质含量,进行12%SDS-PAGE电泳检测,溴酚蓝前沿跑至底部约1 cm时,关闭电源,停止电泳。转膜后剪下Prx II蛋白相对应的条带,孵育Prx II一抗与鼠源二抗,ECL显色照相,确定Prx II结构,分析结果[20-21]。
2 结果
2.1 重组Prx II蛋白与血红蛋白相互结合的鉴定
蛋白质体外结合实验结果显示在GST agarose沉淀的混合物中,均可检出Prx II和血红蛋白,表明Prx II与血红蛋白具有相互结合的特性。由于血红蛋白提取分离于Prx II基因敲除小鼠的红细胞中,因此在血红蛋白样品中并无Prx II蛋白的检出(图1)。此结果证明正常小鼠的血红蛋白可以与Prx II相互结合。
2.2 不同浓度过氧化氢对Prx II与血红蛋白结合程度的影响
蛋白质体外结合实验以及蛋白质免疫印迹结果显示,血红蛋白的含量相同时,随着过氧化氢浓度的升高,Prx II与血红蛋白的结合程度随之降低(图2)。结果证明过氧化氢的浓度可以影响Prx II与血红蛋白之间的结合,过氧化氢浓度越高,与血红蛋白结合的Prx II量越少。
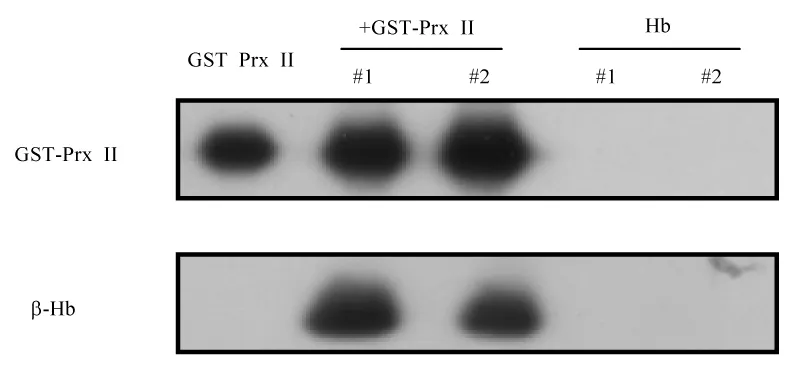
图1 蛋白质体外结合实验检测Prx II与血红蛋白结合情况Fig.1 Binding of Prx II with Hb examined by in vitro binding assay of protein
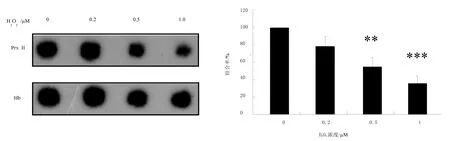
图2 蛋白质体外结合实验检测不同浓度过氧化氢处理后Prx II与血红蛋白的结合程度Fig.2 Binding extent of Prx II with Hb after hydrogen peroxide treatment of different concentration by in vitro binding assay of protein
2.3 β-ME和过氧化氢对Prx II单体和二聚体构型的影响
经蛋白质免疫印迹结果分析显示,β-ME处理组的重组Prx II全部处于单体形式,过氧化氢处理组的重组Prx II蛋白全部处于二聚体形式(图3)。结果表明,Prx II单体和二聚体结构的形成受到过氧化氢和还原条件的影响。
2.4 Prx II的单体和二聚体结构与血红蛋白结合的程度
实验分为GST-Prx II组,未经β-ME处理的Prx II基因敲除小鼠的血红蛋白与GST-Prx II混合组,β-ME处理的Prx II基因敲除小鼠的血红蛋白与GST-Prx II混合组,蛋白质体外结合实验结果显示,未经β-ME处理的Prx II可以与血红蛋白结合,而处理β-ME的Prx II不可以与血红蛋白结合(图4)。蛋白质体外结合实验结果表明,Prx II二聚体形式才能与血红蛋白结合。
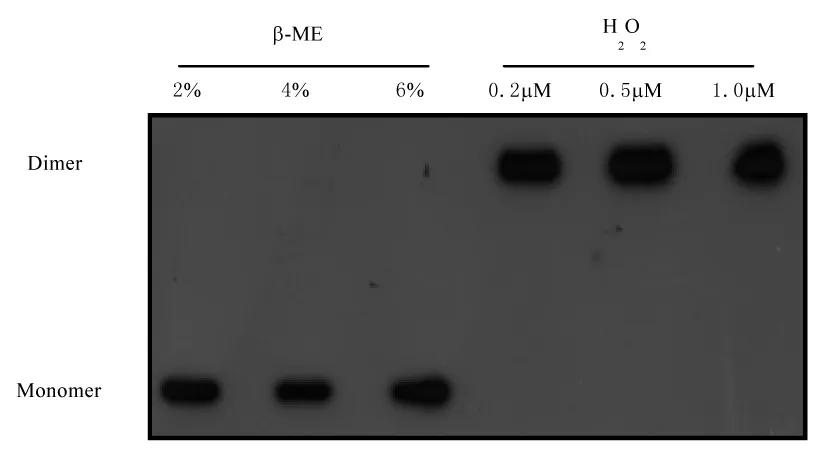
图3 蛋白质免疫印迹检测β-ME和过氧化氢处理后Prx II的构型转换Fig.3 Configuration transition of Prx II after β-ME and hydrogen peroxide treatment by Western blotting
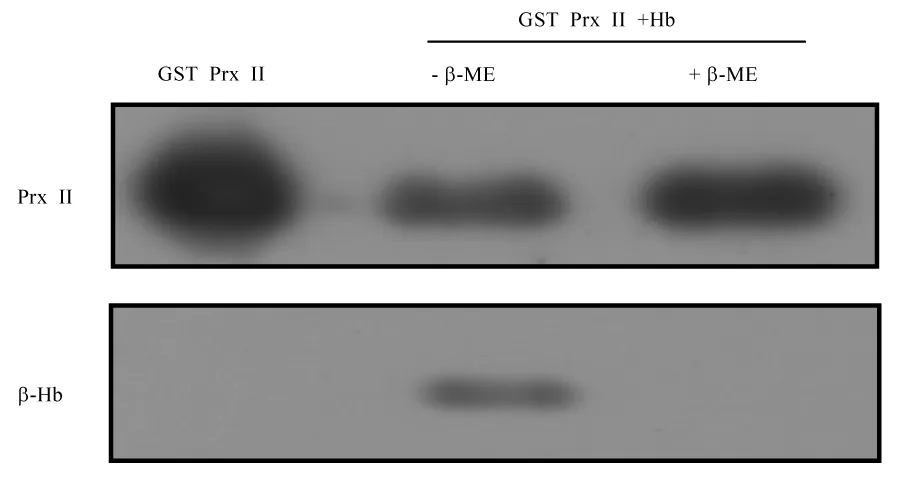
图4 蛋白质体外结合实验检测二种构型的Prx II与血红蛋白的结合程度Fig.4 Binding extent of two forms of Prx II with Hb by in vitro bindingassay of protein
3 讨论
蛋白质与蛋白质之间的相互结合是实现细胞生物功能的基础,在生物的发育过程中起着重要的作用,几乎在所有细胞活动中蛋白质与蛋白质之间的相互结合都有着关键性的作用,深入研究其机理对疾病的诊断和治疗有着重大的意义,如果能掌握蛋白质之间相互结合产生的现象及机理,就可以更透彻的了解蛋白质的功能,进而了解生命活动的基础,这更有利于对许多疾病的诊断,研究与治疗。对药物的筛选也有重要的意义[6-8]。
Prxs是研究非常广泛的抗氧化蛋白家族,其中Prx II在红细胞中被检测出大量表达,在前期研究中发现Prx II与血红蛋白的结合对溶血性贫血的发生有着重要的影响,Prx II基因敲除小鼠红细胞中血红蛋白易变性,进而形成海因茨小体,导致溶血性贫血的发生。地中海贫血病人的红细胞中Prx II与血红蛋白结合明显减少,使其更易受到活性氧的攻击,导致氧化损伤的积累。种种现象表明,Prx II对血红蛋白的保护有重要意义。同时在前期研究中发现,Prx II与血红蛋白的结合可以维持血红蛋白的稳定,保护血红蛋白免受活性氧的攻击[20],但Prx II如何维持血红蛋白的稳定,其中的机制尚未明确,实验利用蛋白质体外结合实验以及蛋白质免疫印迹法检测不同浓度过氧化氢对Prx II与血红蛋白结合的影响,探究过氧化氢对两者相互结合的影响作用,为过氧化氢存在时Prx II保护血红蛋白提供基础理论。
蛋白质的结构是影响蛋白质行使功能的重要因素,Prx II存在着两种不同的结构,一种是单体形式,另一种是二聚体形式,不同的结构导致Prx II行使不同的生理功能,对生物体产生不同的影响,其中影响PrxII结构最主要的因素是氧化剂和还原剂,实验表明,加入还原剂后,使Prx II维持在单体形式,不能与血红蛋白结合,加入氧化剂后,使Prx II维持在二聚体形式,可以与血红蛋白结合。
蛋白质体外结合实验可以有效,准确的在体外检测出蛋白质之间的相互作用,Prx II以二聚体的形式和血红蛋白的结合受到过氧化氢浓度的影响,过氧化氢浓度越高,Prx II与血红蛋白的结合程度越低,而没有过氧化氢的情况下Prx II与血红蛋白也是不结合的,说明Prx II与血红蛋白的结合受到过氧化氢浓度的调控。这种调控是根据Prx II的结构来决定的。这一研究为维护血红蛋白提供了基础思路。
[1] Bultinck J, Lievens S,Tavernier J, et al.Protein-protein interactions:network analysis and applications in drug discovery[J].Curr Pharm Des.,2009,18(30):4619-4629.
[2] Casado-Vela,co-Zorrilla.Screening of protein-protein and protein-DNA interactions using microarrays:applications in biomedicine[J].Adv Protein Chem Struct Biol., 2014,95:231-281.
[3] 李文钊.蛋白质结构和动力学的分子动力学模拟[D].长春:吉林大学,2013.
[4] 倪青山.蛋白质相互作用与功能预测方法研究[D].北京:国防科学技术大学,2009.
[5] 沈瑶瑶,严庆丰.蛋白质相互作用研究进展[J].生命科学, 2013(3):269-274.
[6] 王明强,武金霞,张玉红,等.蛋白质相互作用实验技术的最新进展[J].遗传, 2013(11):1274-1282.
[7] Hu Z.Analysis strategy of protein-protein interaction networks[J].Mol Biol., 2013, 939:141.
[8] De Las Rivas J, Fontanillo C.Protein-protein interaction networks:unraveling the wiring of molecular machines within the cell[J].Brief Funct Genomics,2012,11(6):489-496.
[9] Suzuki H.In vitro pull-down assay without expression constructs[J].Biotechniques,2004,37(6):918-920.
[10] Einarson M B,Pugacheva E N, OrlinickJ R.Identification of Protein-Protein Interactions with Glutathione-STransferase (GST)Fusion Proteins [J].CSH Protoc.,2007,11:117-126.
[11] Smith D B, Johnson K S.Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase[J] Gene,1988,67(1):31-40.
[12] 柴政斌,张更林,韩金祥.GST-pulldown技术在蛋白质相互作用中的应用[J].中国生物制品学杂志,2004(10):1354-1358.
[13] 温丽娟,王桂华,侯喜林,等.共表达ETEC K99、K88菌毛蛋白重组干酪乳杆菌的构建[J].黑龙江八一农垦大学学报,2011,23(3):34-39.
[14] Choi S.Probing protein complexes inside living cells using a silicon nanowire-based pull-down assay [J] .Nanoscale,2016, 22(8):11380-11384.
[15] Tanemura Y.Easy and rapid binding assay for functional analysis of disulfide-containing peptides by a pull-down method using a puromycin-linker and a cell-free translation system[J] .Biology,2015(1):161-172.
[16] Sambrook J, RussellD W.Detection of Protein-Protein Interactions Using the GST Fusion Protein Pulldown Technique[J] .CSH Protoc., 2006(1):275-276.
[17] Kang SW.Mammalian peroxiredoxin isoforms can reduce hydrogen peroxide generated in response to growth factors and tumor necrosis factor-alpha[J].Biol Chem., 1998,273(11):6297-302.
[18] Kang SW.2-Cys peroxiredoxin function in intracellular signal transduction:therapeutic implications[J].Trends Mol Med.,2005, 11(12):571-578.
[19] Rinalducci S.Oxidative stress-dependent oligomeric status of erythrocyte peroxiredoxin II(Prx II) during storage under standard blood banking conditions.[J].Biochimie,2011,93(5):845-853.
[20] Wood Z A.Structure,mechanism and regulation of peroxiredoxins[J].Trends Biochem Sci.,2003,28(1):32-40.
[21] 李田田,王士霞,毕莹,等.BVDV P7蛋白的原核表达及其生物信息学分析[J].黑龙江八一农垦大学学报,2016,28(6):69-73.
[22] Han YH.Peroxiredoxin II is essential for preventing hemolytic anemia from oxidative stress through maintaining hemoglobin stability[J].Biochem Biophys Res Commun,2012, 426(3):427-432.
[23] Johnson R M.Hemoglobin autoxidation and regulation of endogenous H2O2levels in erythrocytes[J].Free Radic Biol Med.,2005, 39(11):1407-1417.
[24] 车兆义,邹悦,宋清斌.大鼠实验中几种常用的采血方法探讨[J].局解手术学杂志,2008(2):84-85.
[25] 邢文,何尚斌.几种哺乳动物眼眶后静脉丛取血法[J].生理科学进展,1958(4):441-443.
[26] 唐晓明.血红蛋白的提取和分离实验改进的研究[J].生物学通报, 2015(1):53-54+63.
[27] 柴政斌.利用GST-pull down方法筛查PAD4相互作用蛋白的初步研究.[D].济南:济南大学,2014.
Effect of Hydrogen Peroxide of Different Concentration on the binding of Peroxiredoxin II with Hemoglobin
Yu Jiabin,Han Yinghao,Jin Meihua
(College of Life Science and Technology, Heilongjiang Bayi Agricultural University, Daqing 163319)
In vitro binding assay of protein was used to explore the effect of hydrogen peroxide of different concentration on the binding of Peroxiredoxin II (Prx II) with hemoglobin.The GST label mouse’s recombinant Prx II protein was combined with rat hemoglobin,Western blotting was used to detect the interest protein,the binding of Prx II with hemoglobin was tested by hydrogen peroxide of different concentration.The results showed that the binding of Prx II and Hb was inhibited with the concentration of hydrogen peroxide increasing,and Hb only bound with the dimer of the Prx II.It provided the fundamental theory for Prx II protecting hemoglobin in the presence of hydrogen peroxide.
in vitro binding assay of protein;Western blotting;Peroxiredoxin II;hemoglobin;dimer
R285
A
1002-2090(2017)05-0049-05
10.3969/j.issn.1002-2090.2017.05.013
2016-10-25
黑龙江八一农垦大学校科研启动计划项目(XYB2013-17)。
作者介绍:于佳斌(1993-),女,黑龙江八一农垦大学生命科学技术学院2013级生物科学专业本科生。
金美华,女,讲师,E-mail:meihuajin@byau.edu.cn。
