α-SMA与TGF-β1在大鼠肝纤维化中的表达及相互关系
2017-10-31原冬伟刘秋瑾刘宏睿王晓雅张佳韧范文禄
原冬伟,刘秋瑾,刘宏睿,王晓雅,张佳韧,范文禄
α-SMA与TGF-β1在大鼠肝纤维化中的表达及相互关系
原冬伟,刘秋瑾,刘宏睿,王晓雅,张佳韧,范文禄
(黑龙江八一农垦大学动物科技学院,大庆 163319)
为明确α-SMA和TGF-β1在肝脏纤维化过程中的作用和相互关系,研究首先利用CCl4腹腔注射的方法建立肝脏纤维化大鼠模型,通过组织学、免疫组织化学及蛋白组学方法检测肝脏纤维化过程中病理组织结构变化、α-SMA和TGF-β1的表达情况。结果显示肝脏纤维化模型造模成功,肝脏组织呈现明显纤维化病变特征,α-SMA和TGF-β1的表达呈阳性,且与肝脏纤维化程度呈正相关。α-SMA和TGF-β1是肝脏纤维化过程中的重要细胞因子,能够促进肝脏纤维化的形成,并可能协同参与。
肝脏纤维化;CCl4;α-SMA;TGF-β1;大鼠
肝脏纤维化是以肝脏损伤后细胞外基质沉淀为特征,是肝实质细胞被进展性增生细胞外基质所替代的过程,最终导致肝脏小叶结构改变及血管紊乱[1,2]。肝脏纤维化发生过程中沉积细胞外基质可来源于不同类型的细胞,肝星状细胞(Hepatic stellate cell,HSC)是肝脏纤维化过程中最关键的效应细胞[3]。HSC在多种细胞因子的作用下被激活,进而转化为具有促纤维化、增生、趋化等功能的肌成纤维样细胞[4]。细胞因子的作用可以影响肝脏纤维化的发生发展,特别是与HSC活化相关的α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)和促纤维化效应转化生长因子-β1(transforming growth factor-β1,TGF-β1)。α-SMA是HSC活化的标志,HSC活化产生的TGF-β1是最重要的致纤维化因子[5]。通检测大鼠肝脏纤维化模型中α-SMA和TGF-β1的表达情况,阐明二者在纤维化过程中的作用和相互关系。
1 材料和方法
1.1 主要试剂和设备
无水乙醇、二甲苯、40%甲醛溶液、CCl4均购自哈尔滨赛特生物技术有限公司。爱德士生化分析仪专用试剂片、HE染色试剂盒均购自哈尔滨佰杰斯生物科技公司。浓缩型SABC-DyLight 488(大鼠IgG)试剂盒、DAB显色试剂盒购自博士德生物工程有限公司。TGF-β1、α-SMA抗体购自Sigma公司。橄榄油为市售。梅特勒电子天平(ME1002TE),徕卡自动载玻片染色机(Leica ST5010)购自黑龙江省海金兰科技发展有限公司;生物组织脱水机(KD-TS3A),生物组织冷冻包埋机(KD-BM、BL),转轮式石蜡切片机(KD-2258),生物组织摊烤片机(KD-T),购自浙江金华科迪仪器设备有限公司;爱德士生化分析仪(IDXX VetTest8008),购自北京爱德士元亨生物科技有限公司;麦克奥迪光学显微镜(BA310)及成像系统,购自北京元业伯乐科技发展有限公司。
1.2 肝纤维化模型制备
清洁级雄性SD大鼠20只,体重200~220 g,按体质量随机分成2组:对照组和模型组。模型组大鼠腹腔注射 40%CCl4橄榄油溶液 3 mL·kg-1,3 次·wk-1[6],造模8周,基础饲料饲喂,矿物水饮水。对照组同模型组等剂量腹腔注射生理盐水,基础饲料饲喂,自来水饮水。实验期间观察各组大鼠一般情况,包括精神状态、活动情况、皮毛光泽度、食量、存活率等。在造模第4、8周分别取各组大鼠各5只,乙醚麻醉后打开腹腔下腔静脉采全血分离血清,同时观察肝脏外观变化并摘取部分肝脏组织置于10%甲醛溶液固定,部分肝脏组织-70℃冻存。实验过程中死亡大鼠同样进行剖检取材。
1.3 肝脏功能指标检测
全血分离血清后送检黑龙江八一农垦大学动物医院化验室,检测指标包括:反映肝脏细胞蛋白合成代谢的总蛋白(TP)、白蛋白(ALB);反映肝脏细胞受损的谷丙转氨酶(ALT)、谷草酸转氨酶(AST)、伽马谷氨酰胺转肽酶(GGT)。
1.4 病理组织学观察及蛋白免疫印迹检测
按照常规方法制备高质量肝脏组织切片[7]。苏木素-伊红(H.E.)和AZAN染色显微镜观察肝小叶结构变化及纤维化程度判定。SABC免疫组织化学法和Western-blot法检测肝脏组织中α-SMA和TGF-β1的表达情况。
1.5 统计学处理
采用SPSS16.0进行统计分析,计量数据采用x¯±s表示,试验结果数据的比较采用t检验进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 实验结果
2.1 大体观察
对照组大鼠毛发光泽,活泼好动,食欲正常,体重增加,对外界反应敏感。模型组大鼠毛发疏松无光泽,精神不振,不愿走动,食欲差,体重增长缓慢。各组大鼠体重变化情况见表1。实验期间模型组大鼠在第7周、第8周各死亡1只。

表1 实验组大鼠体重变化情况(g)Table 1 Changes of body weight of rats in experimental group(g)
2.2 肝功指标监测
模型组大鼠血清中ALT、AST指标在第4周、第8周与对照组比较明显升高,呈极显著性差异(P<0.01)。模型组大鼠血清中GGT指标也明显升高,与对照组比较呈显著性差异(P<0.05)。模型组大鼠血清中ALB、TP与对照组比较指标降低,与同期对照组比较呈显著性差异(P<0.05)。数据详见表2,表3,所有数据表明模型组大鼠肝脏明显受损。

表2 实验组大鼠4周血清肝功指标Table 2 Liver function of experimental rats at 4 weeks
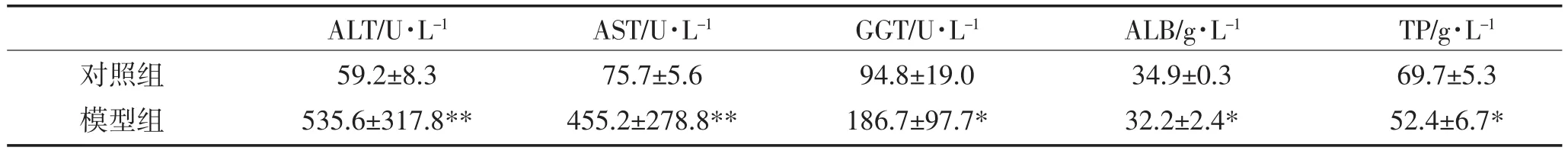
表3 实验组大鼠8周血清肝功指标Table 3 Liver function of experimental rats at 8 weeks
2.3 病理组织学观察及蛋白免疫印迹检测
对照组大鼠肝脏组织未见明显结构改变,模型组大鼠肝脏的病理学改变大致分为:炎症反应、间质细胞增生及弥漫性纤维化。H.E.染色结果显示,对照组肝脏组织肝脏细胞大小正常,小叶结构清晰,细胞核圆,胞质丰富。模型组4周时肝脏组织肝细胞结构基本正常,肝细胞脂肪变性,汇管区结构清晰,小叶间纤维结缔轻度增生(图1);8周时肝脏细胞脂肪变性变轻,可见肝细胞坏死,小叶内可见成纤维样细胞,汇管区和小叶间纤维结缔组织增生,少量炎性细胞浸润(图1)。AZAN染色结果显示,对照组肝脏组织无胶原纤维异常沉积现象。模型组4周和8周时在小叶周边、门脉区、小叶内均可见胶原纤维沉积现象(图1)。免疫组织化学染色结果显示,α-SMA在大鼠肝脏中表达在小叶周、门脉区及增生的纤维组织,且随造模时间延长表达量逐渐增加;TGF-β1在大鼠肝脏中表达在肝窦状隙边缘肝枯否细胞和肝星状细胞的胞浆中,表达水平也随时间延长逐渐增加(图2)。蛋白组学结果与免疫组化结果一致,α-SMA和TGF-β1蛋白表达量在模型组大鼠肝脏组织中逐渐升高,且二者也呈现正相关情况(图3)。
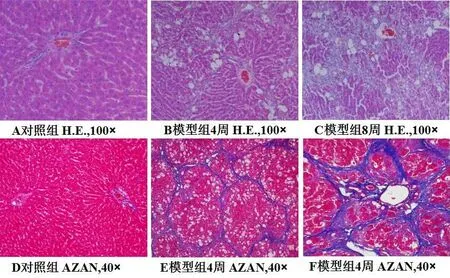
图1 大鼠肝脏病理组织学观察Fig.1 Histopathological observation of rat liver
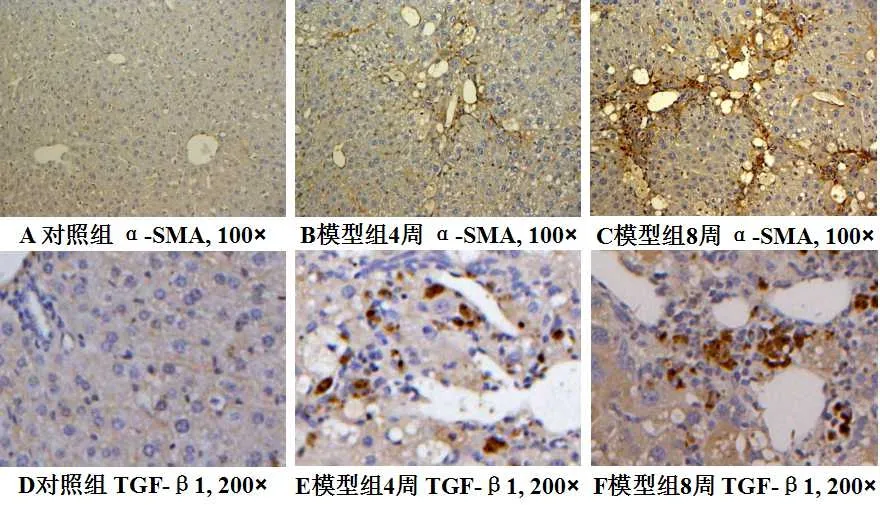
图2 α-SMA和TGF-β1在大鼠肝脏组织中的表达Fig.2 Expression of α-SMA and TGF- β1 in rat liver tissue
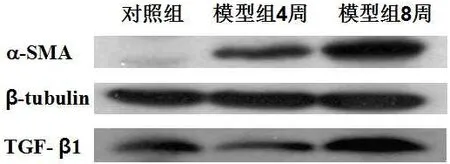
图3 α-SMA和TGF-β1蛋白在大鼠肝脏组织中的表达Fig.3 Expression ofα-SMA and TGF- β1 protein in rat liver tissue in vivo
3 讨论
肝纤维化是许多肝脏慢性疾病共有的病理改变,是各种原因引起肝脏损伤后的疤痕修复反应,其表现为肝功能下降,肝内广泛纤维组织增生和细胞外基质的重塑[8,9]。目前肝纤维化造模方法很多而且发展成熟,主要被应用在研究其发病机制和筛选有效治疗药物等方面。CCl4经腹腔注射法制备大鼠肝纤维化动物模型是一种经典的动物模型制备方法[6],以其制模方便、时间短、成模率高的特点被广泛应用在临床和实验研究上。研究参考已有文献报道造模方法,以低剂量CCl4腹腔注射,经门静脉系统吸收入血引起肝纤维化形成。实验结果显示肝纤维化动物模型造模成功,大鼠肝脏发生肝细胞的变性、坏死,小叶间和门脉区结缔组织增生,造模8周形成明显的假小叶结构,大量胶原纤维和细胞外基质形成,ALT、AST等肝功指标的明显变化。
肝纤维化形成与多种细胞和细胞因子的动态改变密切相关,影响肝脏细胞外基质的沉积,调控着肝纤维化的发生、发展[10]。HSC是肝脏纤维化过程中最关键的效应细胞,主要分布于Disse间隙内,包绕在肝窦周围,而多种细胞因子可调控HSC的活化,是调控肝纤维化的主要手段[11]。HSC在多种细胞因子的作用下被激活,可分泌TGF-β1等细胞因子,通过自分泌进一步维持自身的活化状态并激活临近HSC,活化的HSC增殖,进而转化为具有促纤维化、增生、趋化等功能的成纤维样细胞/肌成纤维细胞[12]。α-SMA是活化的成纤维细胞的标志,参与合成Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白等多种细胞外基质成分,促进肝纤维化的发生。TGF-β1是肝纤维化形成过程中的关键细胞因子,TGF-β1信号通路的激活能促进肝损伤、炎症因子的产生及HSC的活化,也可通过诱导肝细胞的凋亡和抑制肝细胞增生促进肝纤维化的产生[13]。所以近年来TGF-β1及其Smad信号通路和α-SMA等成为纤维化疾病研究的热点,该信号通路在肝脏纤维化进程中发挥了重要作用。研究通过实验证实在肝脏纤维化过程中α-SMA和TGF-β1表达,并伴随纤维化程度的加重而表达逐渐增多,说明α-SMA和TGF-β1与肝脏纤维化的形成密切相关。α-SMA和TGF-β1表达呈现正相关性也可说明TGF-β1的分泌能够活化HSC,刺激成纤维样细胞的增殖,加强α-SMA的表达。
总之,α-SMA和TGF-β1是肝脏纤维化形成过程中重要细胞因子,并可能协同参与肝脏纤维化的形成,因此抑制α-SMA和TGF-β1的表达或阻断相应细胞信号通路都将为临床肝脏纤维化治疗提供理论依据。
[1] 卢玮,刘学恩,庄辉.肝纤维化相关细胞因子和信号通路研究进展[J].中国病毒病杂志,2016(5):385-390.
[2] Hernandez-Gea V,Friedman SL.Pathogenesis of liver fibrosis[J].Ann Rev PatholMech Dis,2011(6):425-456.
[3] Mederacke I,Hsu CC,Troger JS,et al.Fate tracing reveals hepatic stellate cells as dominant contributors to liver fibrosis independent of its aetiology [J].Nat Commun,2013(6):2823.
[4] Forbes SJ,Parola M.Liver fibrogenie cells [J].Best Pract Res ClinGastroenterol,2011,25(2):207-217.
[5] 武希润,吕敏和,王琦,等.α平滑肌肌动蛋白表达及血浆转化生长因子β1变化在肝纤维化发生发展中的作用[J].中华肝脏病杂志,2004,12(7):400-402.
[6] 张云巍,胡亚卓,徐丽娟,等.四氯化碳法制备肝硬化大鼠模型中重要脏器的病理改变[J].世界华人消化杂志,2014,22(1):74-79.
[7] 李钰,刘佳,韦丹丹,等.动物病理组织切片制作方法改良的探讨[J].黑龙江畜牧兽医,2014(15):154-157.
[8] 肖颖,杨涛涛,周卫民,等.TGF-β/Smad与 Wnt/β-catenin在博莱霉素致大鼠肺纤维中的表达及相互作用[J].中国比较医学杂志,2014,24(2):63-69.
[9] 曾志萍,郭津生.肝纤维化发生机制及治疗进展[J].世界华人消化杂志,2017,25(7):569-575.
[10] 黄艳,黄成,李俊.肝纤维化过程中Kupffer细胞分泌细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[11] Duval F,Moreno-Cuevas JE,Gonzalez-Garza MT,et al.Liverfibrosisand protection mechanismsaction of medicinal plants targeting apoptosis of hepatocytes and hepatic stellate cells [J].AdvPharmacolSci,2014(7):373295.
[12] 武淑琴,吴丹丹,王新,等.不同剂量对乙酰氨基酚诱导大鼠急性肝损伤的研究[J].黑龙江八一农垦大学学报,2015,27(3):40-43.
[13] Tu X,Zhang H,Zhang J,et al.MicroRA-101 suppresses liver fibrosis by targeting the TGF-β signalling pathway[J].J Pathol,2014,234(1):46-59.
Expression and Relationship between α-SMA and TGF-β1 in Rat Liver Fibrosis Model
Yuan Dongwei,Liu Qiujin,Liu Hongrui,Wang Xiaoya,Zhang Jiaren,Fan Wenlu
(College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
To make clear the effect and relationship between α-SMA and TGF-β1 in liver fibrosis,intraperitoneal injection of CCl4was usedto make liver fibrosis model in rats,and then histopathological changes were detectedand α-SMA and TGF-β1were expressedby histopathological method,immunohistochemistry and proteomics method in the process of liver fibrosis.The results showed that the model was successfully built and pathological characteristics were obviously observed.The expression of α-SMA and TGF-β1 was positive and showedpositively correlated with liver fibrosis process.α-SMA and TGF-β1 were important cytokines which could promote the liver fibrosis process,and mightcooperate in formation of liver fibrosis.
liver fibrosis;CCl4;α-SMA;TGF-β1;rat
S852.34
A
1002-2090(2017)05-0033-04
10.3969/j.issn.1002-2090.2017.05.009
2017-04-13
黑龙江八一农垦大学大学生创新创业训练计划项目(xc2014020)。
原冬伟(1980-),男,讲师,韩国国立庆北大学兽医科大学,现主要从事动物疾病病理机制及诊断方面的研究工作。
