鸭瘟强毒人工感染雏鸭的显微和超微病理学变化
2017-10-27刘忠伟杨颖江楠
刘忠伟 杨颖 江楠
摘要:为了解鸭瘟病毒(DPV)人工感染雏鸭后的组织器官病变规律、感染后病毒分布情况及细胞超微结构变化,试验以 DPV GZ 强毒株人工感染 90羽15 日龄健康雏鸭,分别在感染后 3、6、10、18、30、48、72、96、108 h 剖杀,采用PCR技术进行病原鉴定,并通过光学显微镜和透射电镜进行病理组织显微和超微结构观察。结果显示,人工感染 3 h 后即可通过PCR技术检测出DPV核酸;透射电镜观察表明感染后10 h可在脾脏中首先观察到少量的病毒,30 h 后胸腺开始发现病毒,病毒的数量随感染时间增加逐渐增加;感染18 h后,中枢免疫器官胸腺表现为淋巴细胞数量降低,组织间隙增大;脾脏组织病变严重,其余器官组织结构均出现程度较轻的组织损伤;感染后30 h,中枢免疫器官的淋巴细胞极度减少,器官组织结构模糊不清,出血较为严重;一些器官则出现细胞肿胀,肠道等器官组织也有细胞变性、出血等病理变化;在死亡鸭的肝脏、脾脏、十二指肠、胸腺发现数量极多的病毒。对照组鸭组织中未发现病理变化。这些研究结果可以为鸭瘟病毒的致病机制研究和鸭瘟的病理学诊断提供试验依据。
关键词:鸭瘟病毒;雏鸭;组织病理变化;超微结构变化
中图分类号: S8583253文献标志码:
文章编号:1002-1302(2017)16-0140-08
收稿日期:2016-07-02
基金项目:国家自然科学基金(编号:31260607、31560703);贵州省科学技术基金(编号:黔科合 J 字号[2009]2137 号)。
作者简介:刘忠伟(1980—),男,内蒙古锡林郭勒人,高级实验师,主要从事动物学研究。E-mail:zwliu @gzueducn。
通信作者:文明,博士,教授,主要从事兽医免疫学研究。E-mail:asmwen@gzueducn。
鸭瘟又称鸭病毒性肠炎,是由鸭瘟病毒(duck plague virus,DPV)引起的,多发于鸭、鹅和其他雁形目禽类的一种急性热性败血性传染病,其特征是血管损伤、体腔溢血、消化道出血坏死、淋巴器官受损和实质器官退行性变化等,是危害养鸭业最为严重的疾病之一。鸭瘟的流行没有明显的季节性,一年四季皆有发生,当鸭瘟传入易感鸭群后,一般3~7 d开始出现零星病鸭,再经3~5 d陆续出现大批病鸭,进入流行发展期和流行盛期。鸭群整个流行过程一般为2~6周。如果鸭群中有免疫鸭或耐过鸭时,可延至2~3个月或更长。在试验条件下,DPV可通过口腔、鼻内、静脉、腹腔、肌肉和泄殖腔等途径传染;在形成病毒血症期间,吸血节肢动物也可传播本病。近年来研究发现,鸭瘟病毒与其他疱疹病毒相似,也可形成潜伏感染,在鸭等水禽的三叉神经节和淋巴组织包括外周血液中的淋巴细胞中可长期潜伏存在[1-5]。
本试验通过鸭瘟病毒强毒人工感染雏鸭,以PCR技术检测确认为鸭瘟感染后,利用光学显微镜和透射电镜进行病理组织显微和超微结构观察,以了解鸭瘟病毒人工感染后的组织器官病变规律、感染后病毒分布情况及细胞超微结构变化,为鸭瘟病毒的致病机制研究和鸭瘟的病理学诊断提供试验依据。
1材料与方法
11试验毒株
DEV GZ株,本实验室分离、鉴定和保存。
12试验动物
90羽15日龄雏鸭,购自贵阳市花溪区未接种鸭瘟病毒疫苗的养殖户。90羽雏鸭随机分成2组,第一组为人工感染组,72羽,腿部肌肉接种鸭瘟病毒GZ株病毒液01mL/羽;第二组为空白对照组,18羽,不进行任何处理,2组隔离饲养。分别在3、6、10、18、30、48、72、96、108 h剖杀雏鸭,观察临床症状,记录各器官病理变化及雏鸭的死亡情况。无菌采集脑、肝、脾、肾、十二指肠、胸腺、心、肺等组织样本(其中每个时段人工感染组剖杀8羽,空白对照剖杀2羽),编号并分别装于灭菌平板内和浸泡于固定液中。
13试验仪器
试验仪器包括超低温冰箱、常规解剖器械、PCR仪、凝胶成像仪、电泳仪、切片机、普通光学显微镜、透射电子显微镜等。
14试验方法
141利用PCR法检测病毒根据 GenBank 中登录的鸭瘟病毒基因序列,用Prime 50软件设计了1对特异性引物,上游引物为5′-ATGGCTATGGACCAACCG-3′,下游引物为5′-CATTCTCGCTCCGACACG-3′,扩增产物约923 bp,由上海生工生物工程有限公司合成。采用动物组织基因组DNA提取试剂盒(上海生工)提取DNA作为 PCR模板,按常规PCR方法进行鉴定。
142光学显微镜观察浸泡于固定液的组织水洗过夜,乙醇梯度脱水,透明、浸蜡、包埋、切片、HE染色,光学显微镜下观察并拍摄和记录下各组织的病理变化。
143透射电子显微镜观察标本用25%戊二醛固定 4 h,1% 锇酸后固定1 h,丙酮梯度脱水,环氧树脂618 包埋,超薄切片机切片,柠檬酸铅-醋酸铀双染,透射电镜观察。
2结果与分析
21临床症状及大体病理变化
211临床症状
人工感染后30 h内未出现明显临床症状,48 h后开始出现临床症状:精神沉郁,不喜動,喜卧,脖子紧缩,不饮水,吃食较少;72 h开始出现死亡,病鸭呼吸出现湿罗音,鼻腔分泌少量清亮黏液,精神沉郁不喜动,头搭向身体一侧,部分表现出神经症状呈单脚支撑站立姿势;96 h头搭向身体一侧,不食不饮,眼内膜灰白浑浊,瞳孔内有白色针尖状颗粒,鼻腔分泌物黏稠呈脓性,呼吸急促,拉稀粪污染肛门周边羽毛;108 h全部死亡。
212大体病理变化
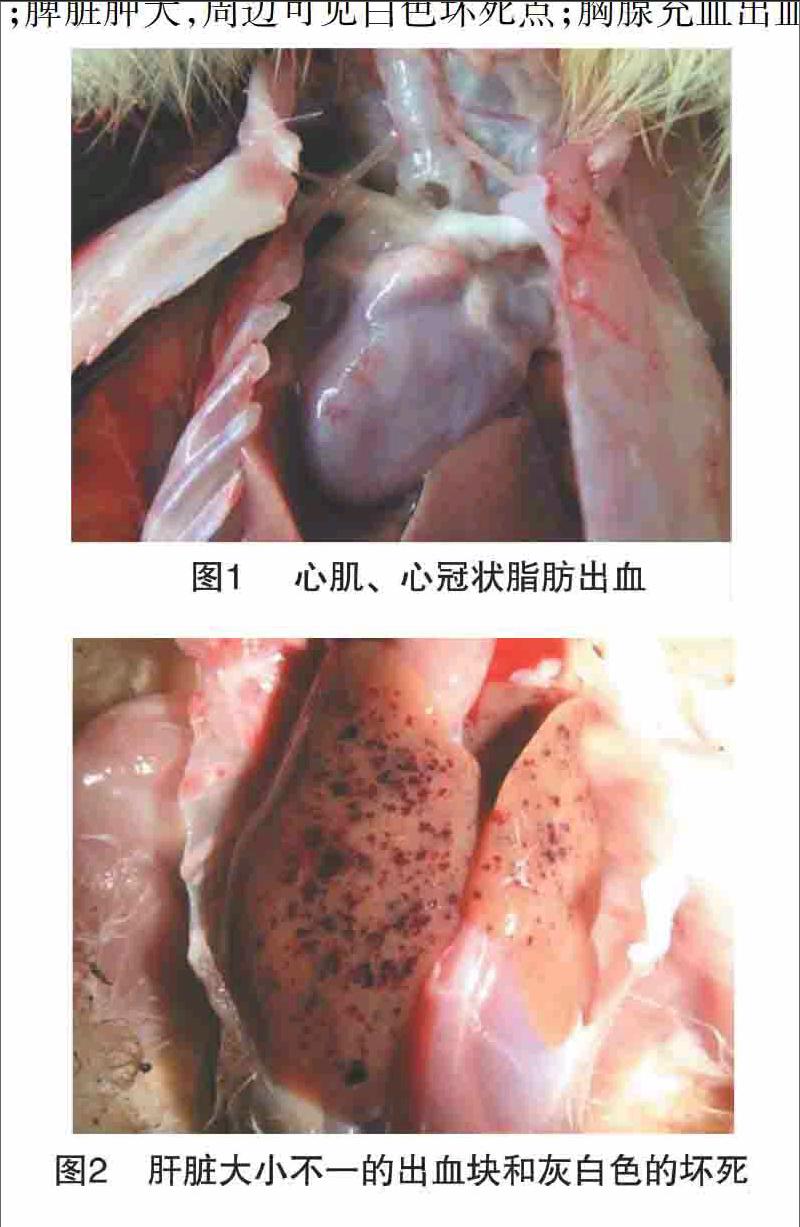
感染后18 h内解剖病变不明显,剖检仅见胸腔肋骨下有黄色少量渗出物,部分胸腺有散在的小出血点。感染后30 h胸腺皆有出血点变化,肝脏和脾脏出现少量大小不一的白色坏死灶,脑部轻度充血。感染后48 h肝脏坏死灶周边伴随有环状出血带,脾脏出现大量坏死点,脑部充血程度加重。感染后72 h腹膜水肿,有大量浓性黄色渗出物与脏器相粘连,体内各器官出现肿大充血出血。感染后 96~108 h雏鸭死亡,立即解剖的雏鸭亦呈现以上大体病理变化,且程度有所加重:心冠状脂肪、心内膜有出血点(图1);肝脏遍布大小不一的出血块和白色坏死灶,胆囊肿大(图2);肺脏出血,气管充血出血(图3);肾脏肿大,有大量出血斑(图4);脑部肿大充血出血(图5);回肠、结肠有环状出血带,肠黏膜脱落,有溃疡突出于肠上皮表面,直肠、盲肠皆有出血点(图6);脾脏肿大,周边可见白色坏死点;胸腺充血出血。
22利用PCR法检测病毒
采集感染后雏鸭的不同组织提取DNA样本,应用PCR技术进行检测。结果显示感染3 h后即可在肝、脾、脑、胸腺、肾和肺几种器官中检出DPV核酸;感染10 h后还可在十二指[CM(25]肠、盲肠、心肌和胸肌等器官中检测出病毒核酸;而空白对[CM)]
照组鸭各个受检样品在不同时段上均呈阴性反应(图7)。
23组织学病理变化
231心脏接种后18 h,部分心肌纤维出现轻度肿胀,少量炎性细胞浸润。接种后48 h,心肌纤维出现胞核、肌浆深染,有部分心肌纤维溶解断裂(图8)。接种后72 h,肌纤维出现脂肪变性和空泡变性,间质明显充血、出血,血管内皮受损。接种后108 h,炎性细胞浸润,肌纤维间隙增宽、结构紊乱、变性、断裂、着色不均 (图9)。
232肝脏接种后6 h,肝细胞核肿胀变大变圆,少数核淡染或消失而留下核影,肝细胞之间的界限模糊,胞浆嗜伊红性增[CM(25]强,内含有微细颗粒状物。之后时间段肝组织呈现不同程[CM)]
度的脂肪变性、水泡变性,局部出现炎性细胞成团聚集。接种后48 h,中央静脉血管壁内皮细胞肿胀,管壁结缔组织增生、排列疏松;肝细胞索变窄、结构紊乱,部分肝窦内含有大量红细胞 (图10)。接种后72 h,肝细胞胞浆、胞质深染,窦状隙间红细胞数量亦增多,并且有炎性细胞浸润(图11)。接种后 108 h,中央静脉及血窦扩张瘀血,静脉周围的肝细胞发生严重的空泡变性、溶解和坏死,形成大小不等的坏死灶,坏死灶呈现网状、红色淡染,内有红细胞、细胞碎片以及炎性细胞(图12)。
233脾脏接种后18 h,网状细胞增多,脾窦中的红细胞增多,白髓部分淋巴细胞数量减少,细胞间距增宽。接种后 48 h,网状细胞增生,淋巴细胞间距增宽,呈网状,脾小体结构变的模糊不清,脾窦大量充血,淋巴细胞数量极度减少(图13)。接种后108 h,实质内有大小不等的凝固性坏死灶,其内含有大量细胞碎片、 中性粒细胞、少量红细胞,淋巴细胞大
量减少甚至部分区域无淋巴细胞,坏死灶周围有出血 (图14)。
234肺脏接种后18 h,肺的毛细血管扩张充满红细胞,肺泡内有少量红细胞、纤维蛋白,间质血管充血(图15)。接种后48 h,肺泡壁毛细血管严重扩张,充血、出血,局部出现坏死灶,其内红染,含有大量细胞碎片和炎性细胞,肺泡腔变窄。接种后108 h,整个肺实质充血、出血,少数3级支气管充满红
细胞,肺局部出现坏死,肺泡结构破坏,坏死灶数量增多,大量炎性细胞浸润(图16)。
235肾脏接种10 h后,毛细血管充血,部分肾小球出现萎缩,有的肾小球变大而充满肾小囊或是肾小囊腔变窄,有的肾小囊壁层细胞缺失,其完整结构被破坏,肾小管的上皮细胞核肿大变圆,间质有少量炎性细胞浸润。接种48 h后,肾小管上皮细胞结构疏松,胞质淡染,有的肾小管上皮细胞溶解消失,管腔内有数量不等红染的片状蛋白和红色颗粒,间质血管充血、出血,大量炎性细胞浸润(图17)。接种72 h后,肾组织病理变化进一步加重,肾小球和肾小球的损害程度加剧,间质出现大量细胞碎片、中性粒细胞、巨噬细胞。接种96 h后,肾组织结构严重破坏,肾小管上皮细胞胞浆溶解消失,有的肾小管结构破坏,上皮细胞独立散在,部分胞核消失留下核影;有些区域未见正常的肾小体结构,肾脏广泛性出血,间质伴有炎性细胞浸润(图18)。
236大脑接种后18 h,脑组织出现轻度水肿,血管扩张轻度充血,有的血管内皮细胞受损。接种后48 h,脑组织结构
疏松,胶质细胞增生,血管扩张,充血、血管周间隙增大(图19)。接种后72 h,脑组织结构呈网状变化,有的神经细胞核只留下核影,小胶质细胞成团聚集。接种后96 h,病理变化进一步加重,脑组织出现许多空泡,血管周隙增宽,血管充血,管壁水肿,大脑皮层出血(图20)。
237十二指肠接种18 h后,浆膜层下有充血出血,肌层平滑肌轻度水肿,固有层结缔组织结构疏松,绒毛顶部上皮细胞缺损。接种48 h后,病理变化进一步加重,有的肌层平滑肌发生崩解。接种72 h后,肠绒毛出现断裂、脱落,正常结构被破坏、黏膜上皮细胞及浅层固有膜坏死、脱落,部分肠腺出现凝固性坏死(图21)。接种96 h后,十二指肠黏膜上皮变性、坏死、崩解,固有层内有红细胞、坏死脱落的细胞碎片、淋巴细胞及炎性细胞浸润,多数肠腺结构被破坏 (图22)。
238胸腺接种10 h后,细胞间隙增宽,细胞与细胞之间多见红染;到30 h后多见细胞碎片,坏死区内无细胞成分。接种48 h后,上述病理变化加重。接种72 h后,淋巴细胞数量极度减少,细胞间隙明显增宽,网状细胞增生,胸腺皮质、髓质界限消失, 并见有固缩、碎裂、溶解的淋巴细胞核及坏死灶
(图23)。接种96 h后,淋巴细胞进一步减少,胸腺出现血管充血、组织出血,部分雏鸭出现胸腺萎缩(图24)。
24细胞超微结构变化
鸭感染 10 h 后在脾脏中首先观察到少量的病毒,30 h 后胸腺开始发现病毒,病毒的数量随感染时间延长逐渐增加,在死亡鸭的肝、脾、十二指肠和胸腺发现数量较多的病毒。在网状内皮细胞、巨噬细胞、肠上皮细胞、纤维细胞、肝细胞、血管内皮细胞可见大量成熟病毒。对照鸭组织中未发现病毒。
241肝脏的透射电镜观察
感染后18 h可以觀察到有的细胞膜结构不完整,核发生固缩。感染后48 h有的细胞内质网的电子密度增大,有的细胞出现板层小体。感染后72 h有的细胞出现退行性变化,有的细胞核周隙增宽,线粒体肿胀,电子密度深浅不一, 同时在胞质内发现病毒颗粒 (图25、 图
26)。感染后96 h可以观察到多个坏死的细胞,有的细胞发生碎裂,同时伴有细胞质溶解,有的细胞膜结构已经不完整,染色质边移,在有的细胞内发现了成熟度不同的病毒颗粒(图27)。
242脾脏的透射电镜观察
感染后10 h可以观察到有的淋巴细胞核膜破裂,核电子密度增大,有的淋巴细胞核固缩,同时在细胞质内发现少量病毒颗粒(图28)。感染后48 h有的细胞内质网的电子密度增大,有的细胞的内质网出现板层小体,细胞出现退行性变化,且电子密度深浅不一,脾髓质皮质边界模糊(图29)。感染后72 h有的细胞出现退行性变化,细胞核发生固缩、溶解,有的细胞核周边间隙增宽(图30),可以观察到多个坏死的细胞。
243肺脏的透射电镜观察
感染18 h后观察到肺毛细血管扩张,部分肺泡细胞膜结构发生改变。感染48 h后肺泡腔变窄,部分细胞细胞核固缩、溶解,细胞膜破裂,细胞胞质溶解释放。感染后108 h,肺泡细胞出现大量坏死,肺泡结构破坏,细胞内外发现大量病毒颗粒(图31、图32)。
244肾脏的透射电镜观察
感染18 h后可以观察到部分肾小球出现萎缩,有的细胞完整结构被破坏。感染48 h后上皮细胞结构疏松,细胞的电子密度增大,有的细胞出现细胞核固缩现象。感染72 h后有细胞出现退行性变化,细胞核周边间隙增宽,细胞器肿胀扩张,基质电子密度降低(图33)。感染108 h 后可以观察到多个坏死的细胞, 细胞膜碎裂,细胞胞
浆胞质溶解消失,在细胞内外发现大量成熟度不同的病毒颗粒(图34)。
245胸腺的透射电镜观察
感染后30 h可以观察到有的细胞膜结构完整性被破坏,同时在细胞质内发现病毒颗粒(图35),可以观察到多个细胞核发生固缩或者碎裂。感染后48 h 可以观察到有的细胞核发生固缩,细胞质电子密度降低,有的细胞发生细胞器崩解(图36)。感染后 72 h 观察到细胞存在坏死,核发生固缩、碎裂,在细胞质内发现了病毒颗粒。感染后96 h在细胞核内外均观察到了病毒颗粒(图37)。感染后108 h坏死细胞数量增多,有的细胞膜结构不完
整,有的细胞核发生固缩、崩解,在坏死细胞中有病毒颗粒存在(图38)。
3结论与讨论
本试验以DEV GZ株腿部肌肉注射15日龄健康雏鸭,使其成功感染,表现出鸭瘟的相关临床症状和大体的病理变化特点,并用PCR技术进行了病原鉴定。本试验注射感染的雏鸭在108 h内全部死亡,潜伏期为1~2 d。在感染后不同时间剖杀雏鸭观察其大体病理变化,发现DPV对易感动物体内各组织器官均具有侵袭力;各组织器官主要以出血病变和坏死为特征,其中胸腺最早表现出出血变化,此后,肝脏、肺脏、脾脏、肾脏、心冠状脂肪、食道与腺胃交界处、肠道、胰腺等部位亦表现出血病变,部分组织也有大小不等的坏死点或坏死灶,特别是在死亡高峰期出现时,维持机体生命活动的实质器
官都出现大面积的变性坏死,使得机体正常的生命活动难以维持。这些大体病理变化特点与有关学者的研究报道相一致[7-10]。病原PCR检测结果显示感染3 h后即可在肝、脾、脑、胸腺、肾和肺几种器官中检出DPV核酸;感染10 h后还可在十二指肠、盲肠、心肌和胸肌等广泛的器官组织中检测出病毒核酸,这在分子水平上印证了DPV感染雏鸭后出现全身败血症和广泛的组织器官损害的症状[11]。
通過对感染后3、6、10、18、30、48、72、96、108 h的雏鸭各组织病理切片的观察,感染后18 h在某些器官如肺脏、肾脏、大脑等出现毛细血管扩增充血现象,其后时间段所检组织血管内皮细胞皆发生不同程度的损伤;肝脏、肾脏和胸腺较早观察到其特有的组织学病变。消化系统中肝脏的实质细胞在感染后 6 h 就出现颗粒变性,伴随着病程发展,DPV对肝脏的损伤越发加重,严重地影响了肝脏作为机体最大消化腺的功能;十二指肠由感染初期出现的肌层水肿发展为后期平滑肌断裂、肠上皮细胞坏死、绒毛脱落、肠腺坏死和萎缩,这两个机体内最重要的消化腺和消化道的病变表明鸭肠炎病毒会对机体消化系统产生严重损害。免疫系统中胸腺和脾脏分别在感染后10 h和感染后18 h观察到细胞间隙增大,其后淋巴细胞逐渐减少,部分区域甚至消失呈红染,多细胞碎片和炎性细胞,这两个机体主要的免疫器官中淋巴细胞大量受到损害,预示着机体体液免疫和细胞免疫功能下降。呼吸系统中大量肺脏肺泡结构受到破坏,其中含有炎性细胞和坏死灶,肺部有效通气量减少,导致机体呼吸困难。机体中各器官与病毒、各器官之间相互作用,体现出相似或特有的组织学变化,共同影响着机体内环境的变动方向,通过对病理切片的观察,可以诊断和预示病程的发展状况[12]。
对感染雏鸭的超微组织结构观察的结果显示,鸭感染后10 h在脾脏中首先观察到少量的病毒,感染后30 h胸腺开始发现病毒,病毒的数量随感染时间延长逐渐增加,在死亡鸭的肝、脾、十二指肠和胸腺发现数量较多的病毒。对照鸭组织中未发现病毒。电镜观察发现,病毒具有典型的疱疹病毒特征,核衣壳以及成熟病毒的形态和在细胞内的分布与李成等、翟中和等[14]、袁桂萍等[15-16]对DPV的研究相一致。根据相关文献报道,疱疹病毒核衣壳装配方式主要存在细胞核内与细胞质内2种不同的方式[16-19]。疱疹病毒的核衣壳的装配方式是通过内外核膜进入细胞质,在细胞质中获得皮层后病毒出芽到高尔基体或内质网获得囊膜,再以出芽、胞吐、细胞破裂等方式释放到细胞外[14-15,18-19]。本研究中也观察到细胞核内与细胞质内2种不同的核衣壳装配方式,但细胞质中的装配更为常见,这与已有研究结果[15-16]相一致。
通过大体病理解剖、组织病理学、细胞超微结构病理变化观察研究发现,当病毒进入机体后,在组织细胞中大量繁殖,对免疫器官脾脏、胸腺和法氏囊造成直接的损伤,导致淋巴细胞大量凋亡和坏死,机体的细胞免疫和体液免疫受到严重破坏,从而加速了病毒繁殖,进一步使宿主的免疫系统、消化系统、神经系统受到严重破坏。这也是感染 DPV 后,病鸭容易引起免疫抑制和继发感染而加快死亡的原因。
参考文献:[HJ169mm]
殷震,刘景华 动物病毒学[M] 2版北京:科学出版社,1997:1073-1077
卡尔尼克B W 禽病学[M] 高福,苏敬良,译 10版北京:中国农业出版社,1999:857-867
[3]陈溥言 兽医传染病学[M] 5版北京:中国农业出版社,2006:383-385
[4]程安春,汪铭书 最新鸭病诊断和防治[M] 成都:四川大学出版社,1995:120-129
[5]Shawky S,Sandhu T,Shivaprasad H L Pathogenicity of a low-virulence duck virus enteritis isolate with apparent immunosuppressive ability[J] Avian Diseases,2001,44(3):590-599
[6]程安春,汪銘书,刘菲,等 PCR在鸭瘟临床诊断和免疫及致病机理研究中的初步应用[J] 病毒学报,2004,20(4):364-370
[7]韩晓英 人工感染鸭瘟病毒急性病理模型的病理学发展规律及免疫荧光检测石蜡切片中鸭瘟病毒分布规律的研究[D] 雅安:四川农业大学,2004
[8]许媛媛 鸭瘟的动态病理学研究和鸭CD4的克隆[D] 武汉:华中农业大学,2010
[9]江楠,杨颖,李基棕,等 鸭肠炎病毒人工感染雏鸭的病理学动态变化[J] 广东农业科学,2011,38(17):87-88
[10]张坤,刁有祥,程彦丽,等 鸭瘟病毒强毒株感染SPF鸭后动态病理组织学变化[J] 中国兽医学报,2013,33(1):9-15,48
[11]杨颖,夏梦,殷俊磊,等 人工感染雏鸭体内DEV强毒的荧光定量PCR检测[J] 动物医学进展,2010,31(6):43-46
[12]杨颖 DEV人工感染雏鸭组织学变化及其NP基因表达规律[D] 贵阳:贵州大学,2011
[13]李成,谷守林,姜绍德,等 鸭瘟鸡胚化疫苗毒的电镜观察[J] 中国预防兽医学报,1996(1):50-51
[14]翟中和,丁明孝,刘鹗书,等 鸭瘟病毒的形态及其繁殖(复制)的电子显微镜研究[J] 病毒学集刊,1982(1):63-69
[15]袁桂萍,程安春,汪铭书,等 鸭病毒性肠炎病毒强毒在人工感染鸭体内形态结构和发生学的电镜观察[J] 畜牧兽医学报,2005,36(5):486-491
[16]Yuan G P,Cheng A C,Wang M S,et al Electron microscopic studies of the morphogenesis of duck enteritis virus[J] Avian Diseases,2005,49(1):50-55
[17]彭光勇,乐美兆人类疱疹病毒7型体外生长特点的研究[J] 中国病毒学,2000,15(4):323-329
[18]黄文林 分子病毒学[J] 北京:人民卫生出版社,2002
[19]Mettenleiter T C Herpesvirus assembly and egress[J] Journal of Virology,2002,76(4):1537-1547
