虫草素治疗抑郁症的生物学机制及效果研究*
2017-10-26罗劭蕾侯杨杨高堂鑫
李 白,罗劭蕾,侯杨杨,高堂鑫,杜 静
(云南大学医学院 昆明 650091)
虫草素治疗抑郁症的生物学机制及效果研究*
李 白**,罗劭蕾,侯杨杨,高堂鑫,杜 静**
(云南大学医学院 昆明 650091)
抑郁症是一种高患病、高复发的精神类疾病。目前临床常用的抗抑郁药物,主要是基于上世纪50年代开发的三环类和单胺氧化酶抑制剂,其通过调节脑中5-羟色胺或去甲肾上腺素的水平,缓解患者的抑郁症状。新研发的抗抑郁药虽然特异性较以往有所提升,但仍然存在起效慢、患者应答率低和副作用严重等弊端。虫草素是我国传统中医药材冬虫夏草的主要活性成分。本文通过综述现有文献,讨论虫草素的抗抑郁效果及其涉及的生物学机制,为传统中医药材的研发应用和中医现代化进程提供新的思路和参考。
中医药 虫草素 抗抑郁效果 突触可塑性
抑郁症(major depressive disorder,MDD)是一种常见的、易于复发的严重情感障碍性精神疾病[1],其高致残和致死率严重影响着患者的健康及其家庭的生活质量。目前临床常用的抗抑郁药物多为作用于单胺类(5-羟色胺、多巴胺、去甲肾上腺素)神经递质的选择性再摄取抑制剂,其抗抑郁作用机制较为相同。由于治疗药物的作用机制并未发生变化,现有抗抑郁药物存在的给药周期长、起效慢、患者应答率低、不同程度躯体及精神方面副作用、停药期间症状易复发等弊端,未从本质上得到改善。所以,研发在生物学机制和作用机理上有所突破的新型抗抑郁药物显得尤为重要。
虫草素是传统中医药材冬虫夏草中主要的生物活性物质,在抗癌、抗菌、抗病毒、免疫调节、神经保护性和抗氧化等方面的功效均得到了大量研究的证实。目前已有大量文献研究显示,虫草素在治疗抑郁症方面也具有一定的积极疗效。本文基于国内外相关文献的分析整理,简要综述了虫草素在治疗抑郁症方面的相关研究。通过对其研究内容及结论的综述,分析整理中药有效成分虫草素的量效关系,尝试探索中药现代化的研究新思路,为中药现代化提供参考。
1 抗抑郁药的研究现状
抗抑郁药(antidepressant)疗法是临床治疗抑郁症较为有效的方法。早期临床研究发现三环类(TCA)和单胺氧化酶抑制剂(MAOI)可显著提升抑郁症患者脑中5-羟色胺(5-HT)和去甲肾上腺素(NE)的表达水平[2],目前临床使用特异性更好的新型抗抑郁药物均基于此二类药物,但其核心作用机制均为促进单胺类神经递质的表达。选择性5-羟色胺再摄取抑制剂(SSRIs)是现有较为主要的临床抗抑郁药物,如氟西汀(fluoxetine)、帕 罗 西 汀(paroxetine)、西 酞 普 兰(citalopram)等。此类药物能抑制突触前膜5-羟色胺转运体对5-羟色胺的摄取,进而增加突触间隙5-羟色胺的浓度。除此之外,去甲肾上腺素再摄取抑制剂(NRIs)、5-羟色胺和去甲肾上腺素再摄取抑制剂、去甲肾上腺素和多巴胺再摄取抑制剂(NDRIs)等都能增加突触间隙单胺类神经递质浓度,这些抗抑郁药物是临床治疗抑郁症的组合用药物。遗憾的是,仅有约50%的抑郁症患者在接受了药物治疗后病情得到了缓解,且多数患者伴有失眠、激越、肠胃和性功能障碍等躯体或神经系统的不良反应,在停药后会出现头痛、情绪波动、肌肉紧张等不适应症状[3]。

图1 腺苷和虫草素的分子结构
沃替西汀(vortioxetine)是2013年美国食品药品监督管理局批准使用于治疗抑郁症的最新临床药物,该药物与5-羟色胺转运体有很高的亲和力,与去甲肾上腺素及多巴胺转运体亲和力较低,是具有较强的5-羟色胺再摄取抑制效果的抗抑郁药物。在6项针对成人抑郁症患者的临床试验中,沃替西汀较安慰剂有显著的抗抑郁效果,并能有效降低治疗后复发的可能性,其药物不良反应也较常规SSRIs有所减轻。然而,临床研究发现沃替西汀通常在患者服用2周后才逐渐起效,4周或更长时间才能达到稳定疗效[4,5],这与传统抗抑郁药物相似。
氯胺酮(Ketamine)是临床使用的麻醉剂,是目前报道较多、研究较深入的抗抑郁药物。现有研究证据认为氯胺酮具有快速强烈的抗抑郁效果。动物实验结果显示,腹腔注射雄性小鼠亚麻醉剂量(2.5 mg/kg)氯胺酮30 min后,显著降低了小鼠在强迫游泳实验中的不动时间[6]。临床研究发现,0.5 mg/kg剂量氯胺酮注射24 h或72 h后,患者的抑郁症状较安慰剂对照组明显改善,且每周三次药物注射可较好地维持氯胺酮的抗抑郁效果[7,8]。Zarate等涉及氯胺酮不同起效时间的临床研究显示,静脉注射0.5 mg/kg剂量氯胺酮2 h后,有效改善了患者抑郁症状,且这一抗抑郁效果可持续约一周时间[9]。另一项涉及有自杀背景的重度抑郁症患者的抗抑郁药物研究显示,静脉注射0.5 mg/kg氯胺酮40 min后有效遏制了患者的自杀倾向,并改善了部分患者的抑郁、焦虑、绝望等症状[10]。此外,氯胺酮对改善具有自杀倾向的双相抑郁障碍患者同样有效,其起效时间也与之前研究结果相似(40 min)[11]。遗憾的是,近年来的研究证实氯胺酮存在严重的药物副作用,一份早期针对健康志愿者的研究显示,氯胺酮存在与N,N-二甲基色胺(强烈致幻剂,第一类精神药品)相似的致幻效果,且该效果与氯胺酮使用剂量相关[12]。Roback等的研究显示,抑郁症患者注射氯胺酮后,出现呼吸抑制、肠胃不良反应等不适症状[13],并伴有不同程度的拟精神病、心律失常和高血压症状[14]。虽然研究证实了氯胺酮的快速且持续的抗抑郁效果[15],但考虑到其潜在的拟精神病效果和强烈的药物依赖性等副作用[16],目前我国食品药品监督管理局还未将其列为临床治疗抑郁症的药物。
现有数据均显示,目前临床常用抗抑郁药物均存在起效慢且副作用严重等缺陷,究其原因这很大程度上是因为现有药物和上世纪50年代研发的三环类药物作用机制相似,致使“新”的抗抑郁药物的抗抑郁效果和适用人群在过去近60年间并未发生本质上的变化。氯胺酮虽然具有快速且持续的抗抑郁效果,但是其显著的副作用影响了氯胺酮的临床使用。因此,起效快且副作用小的抗抑郁药物的研发显得尤为重要。尝试从中药成分中发现具有抗抑郁活性的新药物,将是抗抑郁药物研发的一条新思路。。
2 虫草素作为抗抑郁药的研究进展
2.1 虫草素基本信息简介
冬虫夏草(cordyceps militaris)是我国民间常用的一种名贵药材,传统中医认为其具有很高的药用价值。研究证实冬虫夏草在抗炎、抗氧化/衰老、抗肿瘤/癌症、抗病毒、免疫调节等方面均具有显著效果[17]。早期的研究还发现,冬虫夏草可以通过调节神经递质的释放,实现神经保护性作用[18]。
早在1950年,德国科学家坎宁汉(Cunningham)等人就从蛹虫草菌人工培养的滤液中分离得到了虫草素。研究发现,蛹虫草中虫草素含量相对较高,而在野生的冬虫夏草中虫草素的含量也较高。虫草素是腺苷(adenosine)的类似物,是由腺苷和具有碳支链的脱氧戊糖组成的一种核苷酸,因此它也被称为3′-脱氧腺苷(3′-deoxyadenosine),是从真菌中分离出来的第一个脱氧核苷类抗生素。
研究显示虫草素参与一系列的生物过程,并具有抗癌、抗菌、抗病毒、调节免疫、辅助睡眠、降血脂和抗氧化等功效[19,20]。这可能是因为:①虫草素的化学结构类似于腺苷,化学结构式如图1所示。所以,虫草素可以和腺苷类受体(可以和腺苷结合并被激活的蛋白)结合行使其药理功能;②虫草素,也就是3′-脱氧腺苷,可被还原成腺苷。所以,又是强抗氧化剂;③3′-脱氧腺苷(虫草素)和腺苷一样可以进一步合成腺嘌呤类似物,从而抑制一些病毒mRNA的多聚腺嘌呤合成,起到抑制病毒复制和抑制肿瘤生长的作用。
2.2 虫草素抗抑郁症的可行性分析
2.2.1 虫草素可激活腺苷受体
腺苷(adenosine)是一种能调节能量代谢,并参与多种个体行为和病理生理学过程的神经递质,是能量物质三磷酸腺苷(ATP)消耗后的主要产物,在全身各组织中均有表达[21]。中枢神经中腺苷可调节神经递质释放、神经突触可塑性、缺血性神经保护和氧化应激状态下神经保护作用等[22-25]。一般情况下,腺苷通过其四个亚型受体(A1、A2A、A2B和A3受体)发挥生物学效应,其中A1和A2A受体与腺苷的亲和度较A2B和A3高[26]。通常认为腺苷A1受体与调节突触传导和神经元超极化(Hyperpolarizes)有关;A2A受体较多参与调节神经递质的释放;A2B受体参与大脑中cAMP水平和Ca2+离子通道的调节[27]。此外,腺苷A3受体可能在调节神经突触可塑性方面发挥着重要作用,Costenla等研究显示使用腺苷A3受体的激动剂Cl-IBMECA(100 nM)处理大鼠海马体切片,升高了由LTP引起的θ波脉冲,并且减弱了LTD,研究者使用腺苷A3受体的拮抗剂MRS1191处理海马体切片后,有效抑制了由Cl-IBMECA引起的LTP变化[23],随后的细胞实验印证了该实验结果[28]。从分子结构上看虫草素(3’-脱氧腺苷)是腺苷的类似物研究发现虫草素是腺苷受体(A1、A2A、A2B和A3)的非特异性激动剂。Kitamura等研究显示用1µM或5µM剂量虫草素处理小鼠睾丸间质细胞后,升高了腺苷A1、A2A和A3受体mRNA的表达水平,并以腺苷受体亲和力依赖的方式(A3>A1>A2A)激活下游内固醇的生物合成[29];另一项涉及虫草素抗癌、抗转移的研究显示,虫草素可激活糖原合成酶激酶GSK-3b并抑制细胞周期蛋白D1的表达,起到抗癌效果,同时虫草素还可通过抑制基质金属蛋白酶MMPs 2和MMPs 9,促进组织金属蛋白酶抑制剂TIMP 1和TIMP 2的分泌,降低癌细胞的侵袭性进而抑制癌细胞的转移,这一系列的生理过程均依赖于虫草素对于腺苷A3受体的激活[30]。涉及腺苷药代动力学的文献认为,腺苷衍生物可通过腺苷转运体经血脑屏障(blood-brain barrier,BBB)从血液进入大脑[31,32],这意味着虫草素可经由腺苷转运体从外周循环通过血脑屏障直接作用于中枢神经系统。
2.2.2 虫草素具有保护和调节神经的作用
近年来的文献显示,虫草素具有神经调节和神经保护的作用。大脑组织的缺血再灌注会导致大脑功能的严重损伤,而这种损伤大多是不可逆转的。脑组织的缺血再灌注与多个病理生理变化密切相关,其中涉及自由基的产生、细胞内Ca2+离子的失衡、细胞凋亡相关基因的表达失调和炎症的发生[33]。小鼠细胞培养和动物实验发现,虫草素可以显著降低细胞外谷氨酸盐和天冬氨酸盐的表达水平、降低丙二醛的含量、增加超氧化物歧化酶的活性,并抑制基质金属蛋白酶3的过度表达,降低由缺血再灌注造成的小鼠大脑组织的损伤,起到神经保护性作用[34]。
另一项涉及小鼠学习记忆的研究显示,口服虫草素可以有效改善正常和脑缺血小鼠在Y迷宫实验中的表现,实验正确率均显著高于对照组小鼠。此外虫草素有效降低了脑缺血对小鼠海马体CA1和CA3区的神经损伤[35]。在脂多糖诱导神经小胶质细胞过表达的实验中,虫草素可以显著降低编码一氧化氮合成酶和环氧化酶2基因mRNA的表达水平,抑制促炎症细胞因子TNF-α和IL-1β的蛋白表达量,同时虫草素逆转了由脂多糖诱导的NF-κB的过表达,起到抑制炎症的作用。此外研究还发现,虫草素可以缓解由脂多糖引起的海马体神经在生长和发育过程中的损伤,增加神经元活性、促进生长锥的生长和树突棘的形成[36]。
Jin等研究发现,虫草素可以通过激活腺苷A1受体,调节活性氧和Ca2+离子含量,降低由内质网应激引起的半胱天冬氨酸蛋白酶12的高表达,调节海马体细胞的凋亡[37]。研究认为睡眠分为非眼球快速运动睡眠状态和眼球快速运动睡眠状态。非眼球快速运动睡眠阶段,全身肌肉松弛,没有眼球运动,心率、呼吸均减慢,基础代谢率低。而在眼球快速运动睡眠阶段,出现混合频率脑电波,睡眠较浅容易惊醒。Hu等针对大鼠睡眠的研究显示,虫草素有效降低了大鼠的惊醒周期并延长了大鼠非眼球快速运动睡眠阶段,脑电图结果显示虫草素增加了非眼球快速运动睡眠阶段θ波功率密度,此外虫草素还调节了与睡眠调节相关的腺苷A1、A2b和A3受体的表达水平[38]。
2.3 虫草素抗抑郁效果研究
2.3.1 虫草素具有快速且稳定的抗抑郁效果
近年来的研究显示,在慢性未知温和压力引起的雄性CD-1小鼠抑郁样模型研究中,腹腔注射20 mg/kg和40 mg/kg剂量虫草素3至6周,长期虫草素腹腔注射显著降低了抑郁样小鼠在悬尾和强迫游泳实验中的不动时间,显示出较好的抗抑郁效果[39]。我们之前的研究结果发现,虫草素具有快速且稳定的抗抑郁效果[40]:使用12.5 mg/kg和5 mg/kg高低两个剂量虫草素腹腔注射CD-1雄性小鼠45 min后进行悬尾或强迫游泳实验,结果显示虫草素显著减少了行为学实验中小鼠不动时间,且与药物剂量相关。值得注意的是,12.5 mg/kg剂量虫草素处理小鼠不动时间相比传统三环类抗抑郁药物丙咪嗪(10 mg/kg)显著降低(图2A和2B)。此外,我们还发现使用虫草素(5 mg/kg和12.5 mg/kg)或传统抗抑郁药物丙咪嗪(10 mg/kg)连续腹腔注射小鼠5天后,丙咪嗪组小鼠和虫草素高低剂量组小鼠在行为学实验中的不动时间较生理盐水组均显著减少(图2C和2D)。
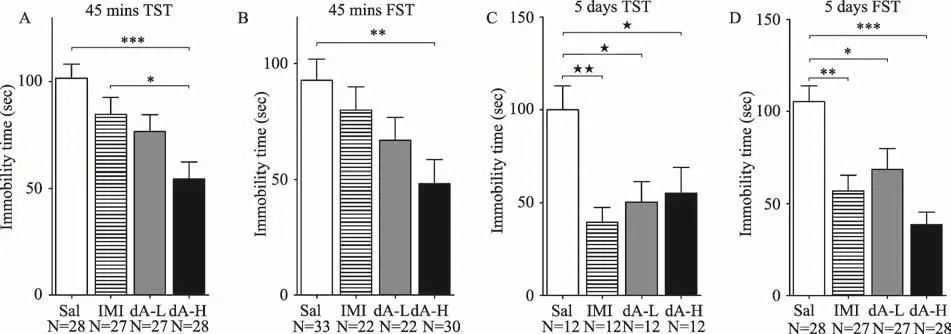
图2 虫草素低剂量(5 mg/kg,dA-L)、高剂量(12.5 mg/kg,dA-H)、丙咪嗪(15 mg/kg,IMI)和生理盐水(Sal)腹腔注射CD-1小鼠,45 min后进行悬尾(TST)或强迫游泳(FST)实验。单因素方差分析(Bonferroni检验,*p<0.05,**p<0.01,***p<0.001)。(A)药物注射45 min后,虫草素显著降低了小鼠在悬尾实验中的不动时间;(B)药物注射45 min后,虫草素显著降低了小鼠在强迫游泳实验中的不动时间;(C)药物连续注射5天后,虫草素显著降低了小鼠在悬尾实验中的不动时间;(D)药物连续注射5天后,丙虫草素显著降低了小鼠在强迫游泳实验中的不动时间。
我们的研究还发现[40],高剂量(12.5 mg/kg)虫草素处理小鼠45 min后,快速且显著增加了小鼠大脑前额叶皮层和海马体组织中GluR1 Ser845位点磷酸化水平,丙咪嗪处理组相应脑区的GluR1 Ser845磷酸化水平较对照组没有升高(图3A和3B)。连续5天虫草素和丙咪嗪腹腔注射后的小鼠脑组织免疫印迹结果显示,各药物处理组小鼠大脑前额叶皮层和海马体中GluR1 Ser845位点磷酸化水平均较生理盐水对照组显著增加(图3C和3D)。丙咪嗪处理组小鼠前额叶皮层和海马体GluR1 Ser845位点磷酸化水平较对照组有显著性升高,这与相关研究结果一致[41]。此外,虫草素处理小鼠45 min或5天后相应脑区的GluR1蛋白表达水平较生理盐水对照组均无变化(图3)。这些研究结果均显示,虫草素较传统的抗抑郁药具有快速且稳定的抗抑郁效果。
2.3.2 虫草素的抗抑郁效果与AMPA受体介导的突触可塑性有关
近年来,越来越多的数据显示AMPA受体在调节神经形成、突触强度和突触可塑性过程中具有重要作用[42-44]。此外,有研究认为AMPA受体GluR1 Ser845位点的磷酸化是抗抑郁药物治疗抑郁症的共通机制[41]。AMPA受体GluR1 Ser845是一个蛋白激酶A(PKA)位点,该PKA位点的磷酸化可以促使神经元中AMPA受体激活,增加受体在神经元膜嵌入,促进LTP的发生,进而调节神经突触可塑性[45-48]。临床研究中抑郁症患者前额叶皮层中GluR1表达水平较正常人群降低[49],相关动物实验结果与临床研究一致[50-52]。相关抗抑郁药物的动物研究发现,拉莫三嗪和利鲁唑能增加大鼠海马体AMPA受体GluR1 Ser845位点的磷酸化水平[41],锂盐抗抑郁效果研究也发现雄性C57BL小鼠大脑海马体GluR1磷酸化水平,以及GluR1蛋白表达量升高[53]。
一般认为AMPA受体GluR1的磷酸化水平与其在突触迁移和膜定位相关,而AMPA受体GluR1在突触表达水平的变化与LTP和LTD相关[42-44,54,55]。研究显示,抗抑郁剂量(10 mg/kg)的氯胺酮可快速升高大鼠前额叶皮层突触GluR1的表达水平,促进了新棘突(spine synapses)的形成[56]。使用地昔帕明(desipramine)和帕罗西汀连续腹腔注射大鼠1、2或3周后,显著升高了大鼠海马体突触AMPA受体GluR1表达水平,且与药物注射时间相关[57,58]。而我们的研究结果发现[40],12.5 mg/kg剂量虫草素注射45 min后,小鼠前额叶皮层突触组分中GluR1 Ser845位点磷酸化水平和GluR1的表达量较对照组显著升高,这与虫草素高剂量能快速调节前额叶皮层总蛋白GluR1 Ser845位点磷酸化水平结果一致;与前额叶皮层突触组分结果不同的是,不同剂量虫草素并未显著增加小鼠海马体突触组分中GluR1 Ser845位点的磷酸化水平和GluR1的表达量(图4A和4B)。使用虫草素连续注射5天后,虫草素高、低两个剂量组和丙咪嗪组小鼠皮层前额叶和海马体突触组分中GluR1 Ser845位点的磷酸化水平和GluR1表达量显著升高(图4C和4D)。提示虫草素的抗抑郁效果可能是通过调节AMPA受体GluR1 S845位点磷酸化水平,并调节GluR1受体在前额叶皮层突触的表达量实现的。
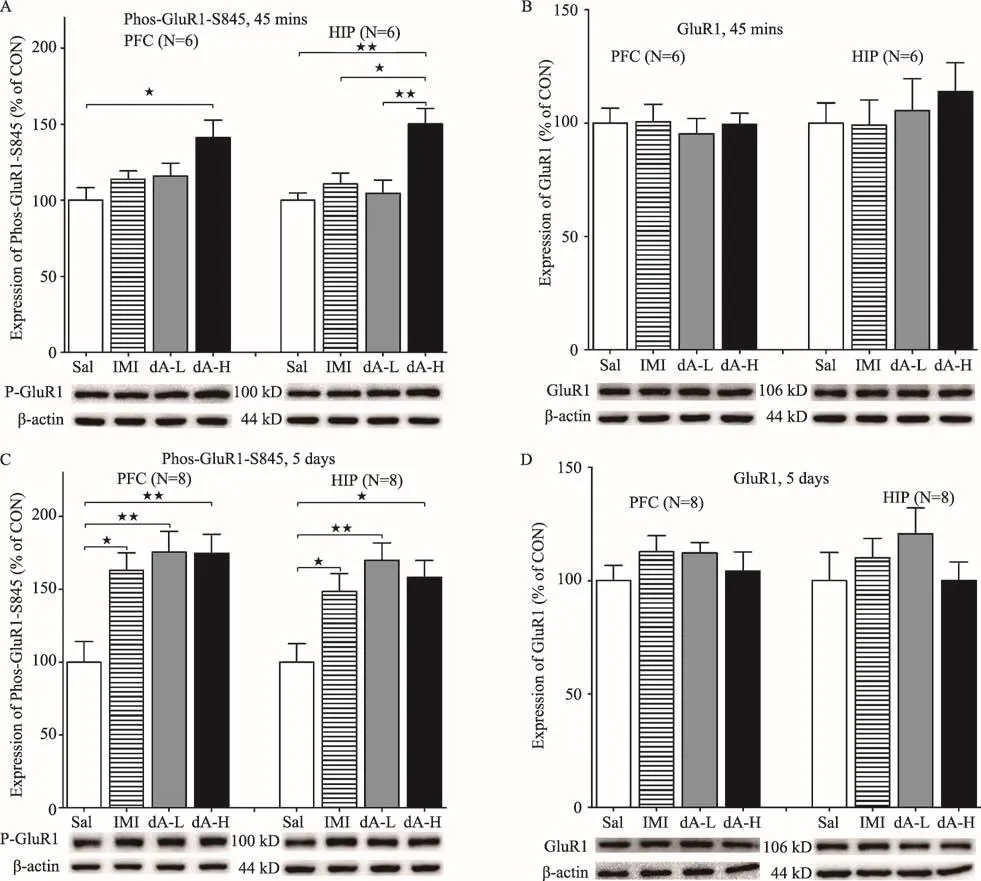
图3 虫草素低剂量(5 mg/kg,dA-L)、高剂量(12.5 mg/kg,dA-H)、丙咪嗪(15 mg/kg,IMI)和生理盐水(Sal)腹腔注射CD-1小鼠,单因素方差分析(Tukey检验,★:p<0.05,★★:p<0.01)。45 min后进行悬尾或强迫游泳实验(A)虫草素高剂量组小鼠前额叶皮层(PFC)和海马体(HIP)中GluR1 S845位点磷酸化水平显著升高;(B)前额叶皮层和海马体中GluR1表达无显著差异。连续腹腔注射CD-1小鼠5天后,(C)虫草素和丙咪嗪处理组小鼠前额叶皮层和海马体中GluR1 S845位点磷酸化水平显著升高;(D)前额叶皮层和海马体中GluR1表达无显著差异。
2.3.3 虫草素的抗抑郁作用与AMPA受体功能增强有关
有文献认为AMPA受体GluR1 Ser845位点的磷酸化是治疗抑郁症的共通机制[49],GYKI 52466和NBQX是AMPA受体的特异非竞争性抑制剂,Farley等研究发现小鼠CUMS模型实验中GYKI 52466有效抑制了氟西汀的抗抑郁效果(悬尾实验)[59];在类似的研究中,使用锂盐快速(1.5天)和长期处理后,显著降低了小鼠在悬尾和强迫游泳实验中的不动时间,上调了AMPA受体GluR1和GluR2的表达水平,研究者发现GYKI 52466可以完全抑制由锂盐在行为学实验中产生的抗抑郁效果[53],说明该抗抑郁效果是通过调节AMPA受体介导的信号通路实现的。而单独使用GYKI 52466处理动物,并没有导致动物在悬尾和强迫游泳实验中不动时间较对照组发生变化[53,59];而使用NBQX腹腔注射能有效地抑制氯胺酮(2.5 mg/kg)在雄性小鼠中的快速抗抑郁效果[6]。与这些研究结果相似,使用GYKI 52466腹腔注射小鼠后,有效地抑制了由虫草素引起的快速抗抑郁效果[40],说明虫草素的抗抑郁效果是通过调节AMPA受体介导信号通路实现的(图5)。
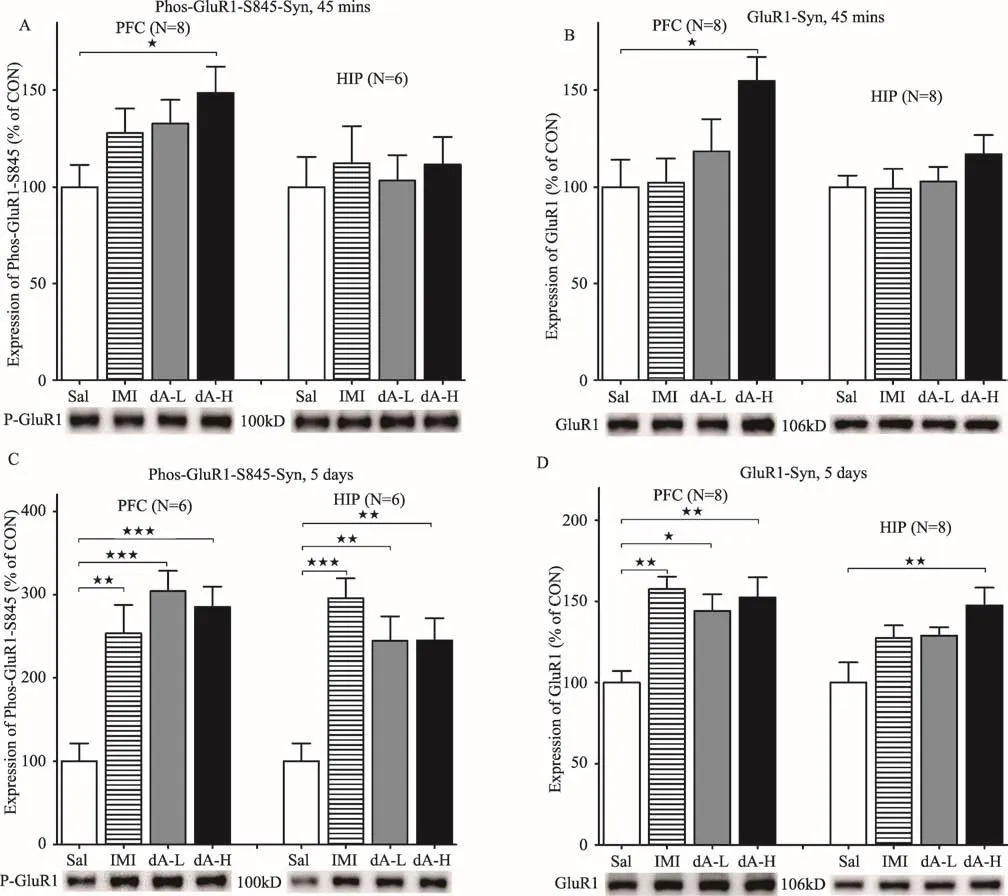
图4 虫草素低剂量(5 mg/kg,dA-L)、高剂量(12.5 mg/kg,dA-H)、丙咪嗪(15 mg/kg,IMI)和生理盐水(Sal)腹腔注射CD-1小鼠,单因素方差分析(Tukey检验,★:p<0.05,★★:p<0.01)。腹腔注射CD-1小鼠45 min后,(A)虫草素高剂量组小鼠前额叶皮层突触(Syn)中GluR1 S845位点磷酸化水平显著升高;(B)虫草素高剂量组小鼠前额叶皮层突触中GluR1表达水平显著升高。连续腹腔注射CD-1小鼠5天后,(C)虫草素和丙咪嗪处理组小鼠前额叶皮层和海马体突触中GluR1 S845位点磷酸化水平显著升高;(D)虫草素和丙咪嗪处理组小鼠前额叶皮层和海马体突触中GluR1 S845位点磷酸化水平显著升高。
2.3.4 虫草素的快速抗抑郁效果与神经兴奋药物不同
一些神经兴奋性药物,如可卡因(cocaine)或安非他命(amphetamine)也具有快速抗抑郁效果,但相关研究均显示这类药物存在严重的兴奋性神经毒性,能造成受试者强烈的药物成瘾性[60,61],并伴有不同程度的运动亢进(locomotor hyperactivity)状态[62],且在停药期间会导致个体出现抑郁症状[63,64]。Labonte等使用安非他命腹腔注射(1.5 mg/kg)青春期雄性SD大鼠,开野实验发现安非他命处理组大鼠总体移动距离较生理盐水对照组升高了约25%,成显著性差异[62],说明安非他命的快速抗抑郁效果可能与其引起的个体运动亢进状态有关。我们的研究发现[40],12.5 mg/kg和5 mg/kg两个剂量虫草素连续腹腔注射小鼠3天后,开野实验结果显示,虫草素处理组小鼠在总移动距离和中间区域移动距离与生理盐水对照组相比无统计学差异(图6A和6B),提示虫草素和安非他命等神经兴奋性药物不同,并不会导致小鼠出现运动功能亢进的现象。此外,连续使用虫草素腹腔注射并未导致小鼠体重出现显著变化(图6C)。
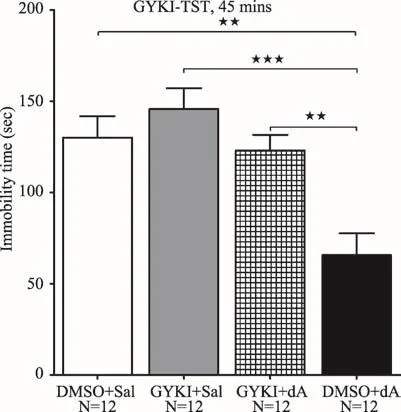
图5 AMPA特异性拮抗剂GYKI 52466有效地抑制虫草素在小鼠中的快速抗抑郁效果。单因素方差分析(Tukey检验,★:p<0.05,★★:p<0.01,★★★:p<0.001)。

图6 虫草素连续腹腔注射CD-1小鼠3天后进行开野实验(OFT)。ANY-maze动物行为分析系统记录并分析实验过程中小鼠的总移动距离和在中心区域的移动距离。单因素方差分析各处理组间统计学差异性。(A)开野实验中小鼠总体移动距离;(B)开野实验中小鼠在中心区域移动距离;(C)各组小鼠连续注射药物5天体重变化情况。
3 结论与展望
中医药现代化建设,科学地使用中医药产品已经上升为中国的大健康国家战略。精准保健、精准医疗,对于慢性病的预防和诊疗有十分重要的意义。日本和韩国在现有的国际中医药产业中占据主要地位,而中国仅仅作为主要的原料药出口国。为了将中国的中医药发扬光大,更好的推进中医药现代化进程,以适应当代社会和国际化的发展需求,研究出符合国际主流标准的优质高效、安全稳定、质量可控的新型现代化中药,我们应该做好两件事情,一是中药有效成分的分析研究,二是中药有效成分的量效关系研究。
目前临床使用的抗抑郁药物多为作用于单胺类(5-羟色胺、多巴胺、去甲肾上腺)神经递质的选择性再摄取抑制剂,其抗抑郁作用机制较为相同。而这些常用抗抑郁药物均存在起效慢且副作用严重等缺陷。所以,研发在生物学机制和作用机理上有所突破的新型抗抑郁药物显得尤为重要。虫草素是传统中医药材冬虫夏草中最为主要的生物活性物质。研究发现虫草素在小鼠行为学实验中具有快速且稳定的抗抑郁效果,并通过大量分子实验进一步证实其抗抑郁效果与调节AMPA受体介导的神经突触可塑性相关。这一发现将对研发起效快、效果好且更为安全的新型抗抑郁药物提供参考依据。这些中药有效成分的量效关系研究,将对科学、有效地使用中医药产生深远地影响,为推动中医药现代化进程和人类的健康事业发展做出应有的贡献。
1 Belmaker R H,Gam G.Major depressive disorder.N Engl J Med,2008,358(1):55-68.
2 Slattery D A,Hudson A L,Nutt D J.Invited review:the evolution of antidepressant echanisms.Fundam Clin Pharmacol.2004,18(1):1-21.
3 Berton O,Nestler E J.New approaches to antidepressant drug discovery:beyond monoamines.Nat Rev Neurosci,2006,7(2):137-151.
4 Citrome L.Vortioxetine for major depressive disorder:a systematic review of the efficacy and safety profile for this newly approved antidepressant-what is the number needed to treat,number needed to harm and likelihood to be helped or harmed?Int J Clin Pract,2014,68(1):60-82.
5 Schatzberg A F,Blier P,Culpepper L,et al.An overview of vortioxetine.J Clin Psychiatry,2014,75(12):1411-1418.
6 Maeng S,Carlos A,Zarate Jr,et al.Cellular mechanisms underlying the antidepressant effects of ketamine:role of alpha-amino-3-hydroxy-5-methylisoxazole-4-propionic acid receptors.Biol Psychiatry,2008,63(4):349-352.
7 Berman R M,Cappiello A,Anand A,et al.Antidepressant effects of ketamine in depressed patients.Biol Psychiatry,2000,47(4):351-354.
8 Price R B,Nock M K,Charney D S,et al.Effects of intravenous ketamine on explicit and implicit measures of suicidality in treatmentresistant depression.Biol Psychiatry,2009,66(5):522-526.
9 Zarate C A Jr,Singh J B,Carison P J,et al.A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression.Arch Gen Psychiatry,2006,63(8):856-864.
10 Diaz Granados N,Lbrahim L A,Brutache N E,et al.Rapid resolution of suicidal ideation after a single infusion of an N-methyl-D-aspartate antagonist in patients with treatment-resistant major depressive disorder.J Clin Psychiatry,2010,71(12):1605-1611.
11 Zarate C A Jr,Brutsche N E,Lbrahim L,et al.Replication of ketamine's antidepressant efficacy in bipolar depression:a randomized controlled add-on trial.Biol Psychiatry,2012,71(11):939-946.
12 Bowdle T A,Radant A D,Cowley D S,et al.Psychedelic effects of ketamine in healthy volunteers:relationship to steady-state plasma concentrations.Anesthesiology,1998,88(1):82-88.
13 Roback M G,Wathen J E,Machenzie T,et al.A randomized,controlled trial of i.v.versus i.m.ketamine for sedation of pediatric patients receiving emergency department orthopedic procedures.Ann Emerg Med,2006,48(5):605-12.
14 Aan R M,Collins K A,Murough J W,et al.Safety and efficacy of repeated-dose intravenous ketamine for treatment-resistant depression.Biol Psychiatry,2010,67(2):139-145.
15 Murrough J W.Ketamine as a novel antidepressant:from synapse to behavior.Clin Pharmacol Ther,2012,91(2):303-309.
16 Caddy C,Giaroli G,White T P,et al.Ketamine as the prototype glutamatergic antidepressant:pharmacodynamic actions,and a systematic review and meta-analysis of efficacy.Ther Adv Psychopharmacol,2014,4(2):75-99.
17 Das S K,Masuda M,Sakuai A,et al.Medicinal uses of the mushroom Cordyceps militaris:current state and prospects.Fitoterapia,2010,81(8):961-968.
18 Ribeiro J A.Purinergic inhibition of neurotransmitter release in the central nervous system.Pharmacol Toxicol,1995,77(5):299-305.
19 Sun Y,Wang Y H,Qu K,et al.Beneficial effects of cordycepin on metabolic profiles of liver and plasma from hyperlipidemic hamsters.J Asian Nat Prod Res,2011,13(6):534-546.
20 Wang F,Yin P,Lu Y,et al.Cordycepin prevents oxidative stressinduced inhibition of osteogenesis.Oncotarget,2015,6(34):35496-35508.
21 Haas H L,Selbach O.Functions of neuronal adenosine receptors.N-S Arch Pharmacol,2000,362(4-5):375-381.
22 Sebastiao A M,Ribeiro J A.Fine-tuning neuromodulation by adenosine.Trends Pharmacol Sci,2000,21(9):341-346.
23 Costenla A R,Lopes L V,Mendonca A D,et al.A functional role for adenosine A3 receptors:modulation of synaptic plasticity in the rat hippocampus.Neurosci Lett,2001,302(1):53-57.
24 Cunha R A.Adenosine as a neuromodulator and as a homeostatic regulator in the nervous system:different roles,different sources and different receptors.Neurochem Int,2001,38(2):107-125.
25 Ferreira J M,Paes-de-Carvalho R.Long-term activation of adenosineA(2a)receptors blocks glutamate excitotoxicity in cultures of avian retinal neurons.Brain Res,2001,900(2):169-176.
26 Fredholm B B,Ljzerman A P,Jacobson K A,et al.International Union of Basic and Clinical Pharmacology.LXXXI.Nomenclature and classification of adenosine receptors--an update.Pharmacol Rev,2011,63(1):1-34.
27 Dunwiddie T V,Masino S A.The role and regulation of adenosine in the central nervous system.Annu Rev Neurosci,2001,24(24):31-55.
28 Maggi L,Trettel F,Scianni M,et al.LTP impairment by fractalkine/CX3CL1 in mouse hippocampus is mediated through the activity of adenosine receptor type 3(A3R).J Neuroimmunol,2009,215(1-2):36-42.
29 Kitamura M,Kato H,Saito Y,et al.Aberrant,differential and bidirectional regulation of the unfolded protein response towards cell survival by 3'-deoxyadenosine.Cell Death Differ,2011,18(12):1876-1888.
30 Nakamura K,Shinozuka K,Yoshikawa N.Anticancer and antimetastatic effects of cordycepin,an active component of Cordyceps sinensis.J Pharmacol Sci,2015,127(1):53-56.
31 Li J Y,Boado R J,Pardridge W M.Cloned blood-brain barrier adenosine transporter is identical to the rat concentrative Na + nucleoside cotransporter CNT2.J Cereb Blood Flow Metab,2001,21(8):929-936.
32 Pardridge W M.Drug transport across the blood-brain barrier.J Cereb Blood Flow Metab,2012,32(11):1959-1972.
33 Plum F.Neuroprotection in acute ischemic stroke.J Am Med Assoc,2001,285(13):1760-1.
34 Cheng Z,He W,Zhou X,et al.Cordycepin protects against cerebral ischemia/reperfusion injury in vivo and in vitro.Eur J Pharmacol,2011,664(1-3):20-28.
35 Cai Z L,Yang C Y,Jang Z J,et al.Effects of cordycepin on Y-maze learning task in mice.Eur J Pharmacol,2013,714(1-3):249-253.
36 Peng J,Wang P,Ge H,et al.Effects of cordycepin on the microgliaoveractivation-induced impairments of growth and development of hippocampal cultured neurons.PLoS One,2015,10(5):e0125902.
37 Mei L J,Sun Y P,Kim Y H,et al.The neuroprotective effects of cordycepin inhibit glutamate-induced oxidative and ER stress-associated apoptosis in hippocampal HT22 cells.Neurotoxicology,2014,41(3):102-111.
38 Hu Z,Lee C L,Shah V K,et al.Cordycepin Increases Nonrapid Eye Movement Sleep via Adenosine Receptors in Rats.Evid Based Complement Alternat Med,2013,2013(4):840134.
39 Tianzhu Z,Shihai Y,Juan D.Antidepressant-like effects of cordycepin in a mice model of chronic unpredictable mild stress.Evid Based Complement Alternat Med,2014,2014:438506.
40 Li B,Hou Y,Zhu M,et al.3'-Deoxyadenosine(Cordycepin)Produces a Rapid and Robust Antidepressant Effect via Enhancing Prefrontal AMPA Receptor Signaling Pathway.Int J Neuropsychopharmacol,2016,19(4):pyv112.
41 Du J,Suzuki K,Wei Y,et al.The anticonvulsants lamotrigine,riluzole,and valproate differentially regulate AMPA receptor membrane localization:relationship to clinical effects in mood disorders.Neuropsychopharmacology,2007,32(4):793-802.
42 Carlezon W A Jr,Nestler E J.Elevated levels of GluR1 in the midbrain:a trigger for sensitization to drugs of abuse?Trends Neurosci,2002,25(12):610-615.
43 Malenka R C.Synaptic plasticity and AMPA receptor trafficking.Ann N Y Acad Sci,2003,1003(1):1-11.
44 Du J,Creson T K,Wu L J,et al.The role of hippocampal GluR1 and GluR2 receptors in manic-like behavior.J Neurosci,2008,28(1):68-79.
45 Roche K W,O'Brien R J,Mammen A L,et al.Characterization of multiple phosphorylation sites on the AMPA receptor GluR1 subunit.Neuron,1996,16(6):1179-1188.
46 Banke T G,Bowie D,Lee H,et al.Control of GluR1 AMPA receptor function by cAMP-dependent protein kinase.J Neurosci,2000,20(1):89-102.
47 Lee H K,Barbarosie M,Kameyama K,et al.Regulation of distinct AMPA receptor phosphorylation sites during bidirectional synaptic plasticity.Nature,2000,405(6789):955-959.
48 Esteban J A,Shi S H,Wilson C,et al.PKA phosphorylation of AMPA receptor subunits controls synaptic trafficking underlying plasticity.Nat Neurosci,2003,6(2):136-143.
49 Beneyto M,Kristiansen L V,Oniorisan A,et al.Abnormal glutamate receptor expression in the medial temporal lobe in schizophrenia and mood disorders.Neuropsychopharmacology,2007,32(9):1888-1902.
50 Toth E,Gersner R,Wilfyarkoni A,et al.Age-dependent effects of chronic stress on brain plasticity and depressive behavior.J Neurochem,2008,107(2):522-532.
51 Yuen E Y,Wei J,Liu W,et al.Repeated stress causes cognitive impairment by suppressing glutamate receptor expression and function in prefrontal cortex.Neuron,2012,73(5):962-977.
52 Kallarackal A J,Kvarta M D,Cammarata E,et al.Chronic stress induces a selective decrease in AMPA receptor-mediated synaptic excitation at hippocampal temporoammonic-CA1 synapses.J Neurosci,2013,33(40):15669-15674.
53 Gould T D,O'Donnell K C,Dow E R,et al.Involvement of AMPA receptors in the antidepressant-like effects of lithium in the mouse tail suspension test and forced swim test.Neuropharmacology,2008,54(3):577-587.
54 Du J,Gray N A,Falke C A,et al.Modulation of synaptic plasticity by antimanic agents:the role of AMPA glutamate receptor subunit 1 synaptic expression.J Neurosci,2004,24(29):6578-6589.
55 Du J,Quiroz J,Yuan P,et al.Bipolar disorder:involvement of signaling cascades and AMPA receptor trafficking at synapses.Neuron Glia Biol,2004,1(3):231-243.
56 Li N,Lee B,Liu R J,et al.mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists.Science,2010,329(5994):959-964.
57 Martinez-Turrillas R,Del Rio J,Frechilla D.Sequential changes in BDNF mRNA expression and synaptic levels of AMPA receptor subunits in rat hippocampus after chronic antidepressant treatment.Neuropharmacology,2005,49(8):1178-1188.
58 Martinez-Turrillas R,Frechilla D,Del Rio J.Chronic antidepressant treatment increases the membrane expression of AMPA receptors in rat hippocampus.Neuropharmacology,2002,43(8):1230-1237.
59 Farley S,Apazoglou K,Witkin J M,et al.Antidepressant-like effects of an AMPA receptor potentiator under a chronic mild stress paradigm.Int J Neuropsycho pharmacol,2010,13(9):1207-1218.
60 McCance-Katz E F,Kosten T R,Jatlow P.Concurrent use of cocaine and alcohol is more potent and potentially more toxic than use of either alone--a multiple-dose study.Biol Psychiatry,1998,44(4):250-259.
61 Pierce R C,Kalivas P W.A circuitry model of the expression of behavioral sensitization to amphetamine-like psychostimulants.Brain Res Brain Res Rev,1997,25(2):192-216.
62 Labonte B,Mclaughlin R J,Dominguezlopez S,et al.Adolescent amphetamine exposure elicits dose-specific effects on monoaminergic neurotransmission and behaviour in adulthood.IntJ Neuropsychopharmacol,2012,15(9):1319-1330.
63 Che Y,Cui Y H,Tan H,et al.Abstinence from repeated amphetamine treatment induces depressive-like behaviors and oxidative damage in rat brain.Psychopharmacology(Berl),2013,227(4):605-614.
64 Krzascik P,Zajda M E,Majewska M D.The neurosteroid dehydroepiandrosterone sulfate,but not androsterone,enhances the antidepressant effect of cocaine examined in the forced swim test--Possible role of serotonergic neurotransmission.Horm Behav,2015,70:64-72.
Cordycepin Produces An Antidepressant Effect Via Activating Synaptic Plasticity
Bai Li,Shaolei Luo,Yangyang Hou,Tangxin Gao,Jing Du
(Medical college,Yunnan University,Kunming 650091,China)
Available antidepressants are based on the tricyclic and monoamine oxidase inhibitor which were discovered more than sixteen years ago.These antidepressants were found to promote serotonin or noradrenaline function in the brain to produce a antidepressant effect.Although newer agents are more specific,but unfortunately,the issues of slower effect,low-response rate and side-effect are still unsolved.Cordycepin is the main effective component of Cordyceps Militaris which has been used as a Chinese herb and food for hundreds of years.This review summarizes the antidepressant effect and the involved mechanisms of Cordycepin,and provides a novel concept on the research and development of antidepressants by using Chinese herb.
Traditional Chinese medicine,Cordycepin,Antidepressant effect,Synaptic plasticity.
10.11842/wst.2017.07.008
R74
A
2017-07-22
修回日期:2017-07-22
* 云南省科技厅云南省高端科技人才引进项目(2012HA004):云南省科技厅云南省高端科技人才引进项目,负责人:杜静;国家自然科学基金委(31560274):FKBP51在糖皮质激素调节线粒体功能和线粒体蛋白转录因子表达中的作用,负责人:杜静;国家自然科学基金委(31650005):腺苷受体介导的神经免疫M1(炎症)向M2(抗炎)状态的转变对抑郁和自杀相关行为的影响,负责人:杜静。
** 通讯作者:杜静,博士,教授,主要研究方向:神经精神药理学;李白,博士,助理研究员,主要研究方向:神经精神药理学。
(责任编辑:张 静,责任译审:王 晶)
