中药药代动力学研究的思与行*
2017-10-26刘瑞娟
丁 黎,刘瑞娟
(1.中国药科大学药物分析教研室 南京 210009;2.郑州大学第一附属医院药学部 郑州 450003)
中药药代动力学研究的思与行*
丁 黎1**,刘瑞娟2
(1.中国药科大学药物分析教研室 南京 210009;2.郑州大学第一附属医院药学部 郑州 450003)
随着当今中药现代化的发展需求,中药研究不仅在体外寻找其化学物质基础,而且应深入探讨其在体内的处置过程,定量评价中药各化学成分间的相互作用。因此,中药药代动力学研究显得尤为迫切。中药及其复方的药代动力学研究,对系统地阐明和揭示中药作用的物质基础及作用机制,阐明其配伍或组方的原理,科学地指导临床合理用药,促进中医药的现代化具有重要的意义。本文结合研究实例,对中药药代动力学研究的目的和意义,特殊性和难点及常用研究方法等科学问题进行分析与总结,希望对学者们有所帮助,共同推动中药药代动力学研究的发展。
中药 药代动力学 物质基础 相互作用 中药现代化
中药(Traditional Chinese Medicine,TCM)及其复方是我国历代医家经过长期实践积累的宝贵财富,其作为一种重要的药用资源用于疾病的预防和治疗已有几千年的历史。近来也吸引西方国家对其进行越来越多的研究和应用[1,2]。但是,中药中效应成分从体外如何吸收进入体内,效应成分如何在体内分布、代谢和排泄,对于这些动力学过程人们却知之甚少,中药药代动力学研究正是阐明这些问题的根本途径[3]。近年来,中药效应成分药代动力学得到极大关注。通过对中药药代动力学的研究,可以更科学更系统地阐明中药作用的物质基础及作用机制,为探索中药组方原理提供科学依据;为设计及优选中药给药方案提供基础和依据;为研究古方、筛选新方、开发新药提供科学依据和方法;推动中药的现代化和国际化[4]。
1 中药药代动力学的定义
中药药代动力学是借助于动力学原理,研究中药单方制剂、复方制剂、中药制品、中药提取物中的效应成分、毒性成分、及代表性成分等在体内吸收、分布、代谢和排泄(Absorption,Distribution,Metabolism and Excretion,ADME)的动态变化规律及其体内时-量或时-效关系,并用数学模型提供药代动力学参数的一门学科[4]。它是在西药药代动力学研究基础上发展起来的一个研究领域,是中药药理学、体内药物分析与药物代谢动力学相互结合、相互渗透而形成的。中药成分复杂,成分微量,未知和干扰因素较多,其药代动力学的研究较通常的化学药物的药代动力学研究更为复杂,面临诸多困难、问题和挑战[5-7]。
2 中药药代动力学研究的目的和意义
中药用于疾病的预防和治疗已有几千年的历史,有效性已得到验证。那么,中药是哪些效应成分进入体内发挥作用?这些成分如何从体外吸收进入体内?如何在体内分布、代谢和排泄?这些都是目前亟待阐明的关键科学问题。为阐明这些科学问题,中药的药代动力学研究应运而生。中药药代动力学研究的目的和意义主要表现在以下几个方面。
2.1 阐明和揭示中药作用的物质基础及作用机制
中药能够产生药理作用,产生疗效,其作用无论来自本身存在的化学物质,组方配伍后产生出新的物质,通过机体作用产生出代谢产物,还是调动在体的化学物质或机体的反应系统产生药理作用,必定存在一定的物质基础及作用机制。通过研究中药体内过程的动态变化规律,可以阐明中药药效物质基础及作用机制,为中药传统理论提供科学的阐释。此处以药动-药效相结合的方法研究双黄连口服液抗菌作用药效物质基础为例,来介绍这一问题的研究思路,如图1。

图1 双黄连口服液抗菌作用药效物质基础研究思路
将双黄连口服液浓缩后灌胃给予大鼠,在无菌条件下采集不同时间点的血清。一部分血清用来做抑菌活性试验,评价其体内药效动力学过程,抗菌效应成分在体内的浓度随时间变化,其浓度高,在培养皿上的抑菌斑就大,抑菌斑直径的对数值与药物浓度呈线性关系,抑菌斑直径对数值随时间变化曲线就相当于药效-时间曲线。另一部分血清用来研究双黄连口服液指纹图谱中的指纹特征成分的体内动态变化规律,即检测入血成分,各成分指纹峰的峰面积大小代表其血药浓度高低,峰面积随时间的变化作为成分的血药浓度-时间曲线。将各成分的血药浓度-时间曲线和药效-时间曲线作对比,选择达峰时间和半衰期比较接近药效-时间曲线的成分,比如图2中E成分的血药浓度-时间曲线和药效-时间曲线很接近,就可将E分离出来,验证是否有药效,这样可以提高筛选有效成分的速度。实验结果示意图见图2。
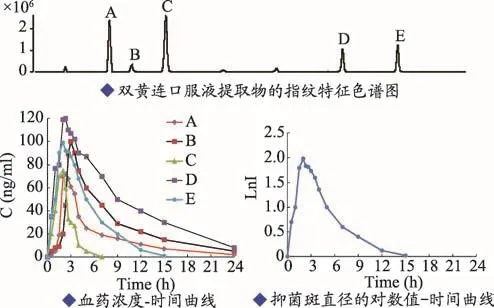
图2 双黄连口服液指纹特征成分的药动-药效研究结果示意图
2.2 为中药复方组方原理提供科学依据
中药复方较为复杂,有关中医药的理论较多,如:整体观、辨证论治、脏腑学说、君臣佐使等等,这些属于中医药独特的理论体系和精髓。近年来,有研究者提出“药对”学说,药对是中医临床常用的相对固定的两药味的配伍组合,是中药配伍应用中的最小单元,“药对”的配伍机制,多从药物相互作用的角度来解释。药物相互作用的发生机制有多种[8],比如代谢类型、竞争靶点类型、竞争蛋白结合类型等,其中代谢类型的药物相互作用最为常见,人体主要的I相和II相代谢酶[9]如图3所示。T.Osana等[10]研究了10名健康志愿者分别在连续服用200 mg伊曲康唑或安慰剂,4天后口服0.5 mg溴替唑仑药物,伊曲康唑对单剂量口服溴替唑仑药效学药动学的影响,结果见图4,伊曲康唑是CYP3A4的抑制剂,溴替唑仑的主要代谢酶是CYP3A4,因此当伊曲康唑和溴替唑仑合用时,伊曲康唑使得溴替唑仑的代谢酶被抑制,溴替唑仑的血药浓度下降缓慢,半衰期延长,暴露量大大增加。
药物间相互作用原理也可阐释中药复方配伍机制。以甘草配伍为例,甘草是最常用的中药材之一,是很多中药复方中具有代表性的“使药”,发挥药物-药物相互作用。甘草在治疗疾病中与其它中药配伍主要发挥以下三种作用:(1)增强其他中药的药效;(2)降低其他中药的毒性;(3)对中药复方进行调味矫味。它的作用原理见图5[11,12],甘草的药效成分包括甘草酸、甘草次酸、光甘草定、甘草素等,它们是CYP450酶的诱导剂或抑制剂,假设某一中药的毒性成分是被CYP2C19代谢的,这一毒性成分若和甘草合用,甘草中的甘草酸等多个成分可以诱导它的代谢酶CYP2C19,使其在体内快速消除,从而起到减毒的作用。假设某一药效成分是被CYP3A4代谢的,这一成分和甘草合用,甘草中的甘草酸等多个成分可以抑制它的代谢酶CYP3A4,使其体内代谢消除减慢,体内的药物浓度增高,发挥药效药效时间延长。因此,中药的“君臣佐使”正是利用了中药中各成分间相互作用的原理而发挥作用的。古人云:“药有个性之特长,方有合群之妙用”,所谓合群之妙用,正是合理利用药物的相互作用原理来增效减毒,使药物更好地发挥药效,降低毒性。
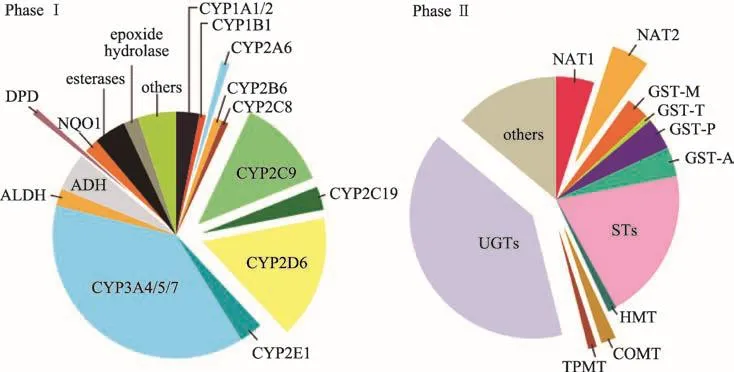
图3 人体内主要的代谢酶类型及其含量比例示意图[9]

图4 10名健康志愿者分别在连续服用200 mg伊曲康唑(●)或安慰剂(○)4天后口服0.5 mg溴替唑仑,其血浆中溴替唑仑药物浓度-时间曲线图[10]
从整体观点出发研究中药的药代动力学特征,可以为组方配伍原理提供科学依据。本课题组利用大鼠研究了双花百合片(Shuanghua Baihe Tablets,SBT)中小檗碱及其它成分与苦地丁中紫堇灵之间的药物-药物相互作用[13],本实验将大鼠随机分成四组,每组6只,分别灌胃给药双花百合片(SBT,含有紫堇灵、小檗碱和其它成分)、紫堇灵和小檗碱纯品的混合物(与SBT中含有同等剂量的紫堇灵和小檗碱)、紫堇灵纯品(与SBT中含有同等剂量的紫堇灵),静脉注射紫堇灵纯品。实验结果见图6,紫堇灵纯品在大鼠体内生物利用度较低,消除速度快;与灌胃给予紫堇灵纯品相比,灌胃给予含有同等剂量紫堇灵的SBT时,紫堇灵的末端消除半衰期t1/2约延长3倍,达峰浓度Cmax和血药浓度-时间曲线下面积AUC0-12分别增加了46.5%和34.2%。结果表明大鼠灌胃给予SBT时,紫堇灵的生物利用度增加和消除半衰期延长。与紫堇灵组相比,紫堇灵和小檗碱组中,紫堇灵的Cmax和AUC0-12分别增加了11.1倍和5.0倍。结果表明小檗碱可显著增加紫堇灵在大鼠体内血浆暴露量(Cmax和AUC0-12),小檗碱与紫堇灵之间存在药物-药物相互作用,这也警示紫堇灵与小檗碱合用时存在潜在毒性的风险。有趣的是,SBT组中紫堇灵暴露量的增加程度要小于紫堇灵合用小檗碱组中紫堇灵暴露量的增加程度。这表明小檗碱可以显著改变紫堇灵在大鼠体内的药动学特征,同时SBT中其他成分对紫堇灵药动学行为的影响也是不可忽略的,这也体现了中药复方中各组分之间增效减毒配伍机制的妙处。
2.3 为设计及优选中药给药方案提供基础和依据
长期以来,中药多以经验给药或辨证用药为主,多数情况缺乏药代动力学研究资料的支持。通过中药药代动力学研究可明确中药中有效成分在体内吸收、分布、代谢、排泄等过程的动态变化规律,获得其药动学参数,从而可以科学地拟定给药方式、给药剂量、给药间隔及确定疗程,从而可提高其临床整体治疗水平。

图5 甘草活性成分调节的主要CYP450酶亚型示意图

图6 血浆中紫堇灵的平均血药浓度-时间曲线图[13]
以黄杨宁(Cyclovirobuxine D)片为例,它是黄杨科植物小叶黄杨所含的一种生物碱制剂,已上市多年。q其说明书中的用药方式为口服,1次2 mg,1日3次。该药物治疗心绞痛临床效果好,但是按照说明书连续使用1周左右后会出现四肢麻木,头晕等副作用。部分医生将黄杨宁片的服药方式改成:连续用药5天,停药2天,然后再连续用药5天。这种服药方式不但保证了黄杨宁片的疗效,而且基本避免了其副作用。根据此种现象,研究人员进行了如下研究,给6例健康志愿者单次口服2 mg黄杨宁片,绘制血浆平均药-时曲线,半衰期为33.8 h;再按照黄杨宁片的说明书连续给药5天,第6天采血,绘制平均药-时曲线,结果[14]显示(图7),连续给药5天后,黄杨宁在人体内蓄积,其暴露量与服药的第1天相比增加了5-7倍。结合黄杨宁的这一药动学特征,再考虑到按照黄杨宁片说明书连续用药1周左右后会出现较多副作用,故将服药方式改为“连续用药5天,停药2天,然后再连续用药5天”就可以避免副作用发生。按照药品说明书的服药方法服药5天后病人体内的药物浓度蓄积达到较高的稳态血药浓度,易产生毒副作用。药动学试验结果说明需降低黄杨宁片的每日服药剂量,降低其连续服药后的稳态血药浓度,以减小其毒副作用。通过黄杨宁的药动学试验,得到其在人体内的药动学特征,选择合理的临床给药方式与给药剂量,可以避免其稳态血药浓度蓄积过高而产生毒副作用。

图7 6例健康志愿者按照说明书单次、多次口服黄杨宁片后的平均黄杨宁血药浓度-时间曲线[14]
2.4 为选择合理给药途径及合适剂型提供依据
中药及其提取物的制剂研发需要制定合理的给药途径和药物剂型,其需要结合体内药效和体内药代研究来确定。甘利欣,是甘草酸二铵的注射剂,临床用于慢性病毒性肝炎的治疗效果非常明显,市场销量很好。甘利欣做成注射剂非常合适,若做成口服制剂,则吸收较差,该药物的药代动力学实验研究显示其绝对生物利用率仅有3%左右,因此口服给药不是甘利欣(甘草酸二铵)合适的给药途径。因此,只有通过体内药代研究,才能提供最直接的给药途径或剂型选择的依据,才能真正达到中药制剂的质量可控、高效、低毒的目的。
2.5 推动中药的现代化和国际化
中药药代动力学研究不仅可以揭示药效物质基础、方剂组方原理和配伍规律;还为初步化学成分筛选、剂型设计、质量评估和给药方案制订提供依据,故能够提高药物的临床控制程度,更好地指导临床用药,推动中药的现代化和国际化[15]。
3 中药药代动力学研究的特殊性和难点
由于中药化学成分的复杂性、中药药效的多效性和中医临床应用的辨证施治及复方配伍的中医特色等特点,使得中药药动学研究有别于化学药药动学研究,有其特殊性和复杂性[16]。
3.1 中药成分及其体内过程的复杂性
中药成分的复杂性,表现在单味中药含有多种成分,复方成分更为复杂,且配伍后的各成分可能发生变化。中药是一个复杂的体系,不论是单味中药还是中药复方,均为含有大量化学成分,而且有些成分含量极微。这些客观存在的问题均构成其药效学和药代动力学研究的难点,其原因可能是发挥药效是多种成分相互作用产生的综合结果,难以系统、全面地分析中药药效作用的物质基础。
3.2 研究方法的难度
多数中药发挥药效作用的物质基础尚不确定,使药代动力学研究的目标化学成分选择困难;目标化学成分在复方中的含量低,其血、尿和组织中的浓度无法检测;多种成分同时吸收入血,其体内代谢物均可能干扰测定,这增加了生物样品测定的难度;因中药材的特殊性,中药制剂中所含成分的含量往往不确定,只规定含量不低于某个值,而药动学研究是需要确定剂量的,剂量不同药动学特征有可能不同,这也给药代动力学研究增加了难度。中药药代动力学与化学药药代动力学的研究方法比较见表1。
3.3 中药的整体观难以认识
中药的药效往往是多种化学成分相互作用所产生的综合效果,其复杂性导致药动学测定指标选择困难,到底选择哪些指标能代表该中药的药效往往是一个难以定论的问题。中药药动学研究必须考虑中药配伍的真正内涵,辨证论治,君臣佐使等原则是中医用药的精髓,因而整体观思想应该在中药药动学研究中体现。因此,如何从体整体观研究中药药代动力学是一挑战。

表1 中药药代动力学与化药药代动力学的研究方法比较
4 中药人体药代动力学研究方法
中药药代动力学的研究方法包括药物浓度法、生物效应法以及中药药代动力学研究的新理论、新方法,如整体药动学。最常用的是药物浓度法。
4.1 药物浓度法
该法通过测定给药后不同时间的血药浓度,得到血药浓度-时间数据,然后通过房室分析或非房室分析方法学或生理药动学模型,计算药动学参数,从而阐明效应成分在体内的动态变化规律。此法适用于效应成分明确的中药或中药制剂的药动学研究,也是评价药代动力学特征最常用最准确的一种方法。该法对于新药开发、中药作用机制的阐明及临床合理用药具有重要的意义。有学者[15]认为被选用于药动学研究的指标性成分应该具备以下特征:能代表复方的主要药效成分;是药物的质控指标;在靶器官内有较高的分布;其体内浓度与复方药效在时间上具有密切联系;能被吸收入血;具有可检测性等。
4.2 相关分析技术
主要包括高灵敏度、高通量的生物样品分析技术和中药多组份同时定量分析技术。中药制剂中成分多种多样,且结构较为复杂,含量一般都很低。进人体内后,原药及代谢物在血浆、胆汁、尿液等体液中的含量往往只有ng或pg级水平。一般的方法如高效液相色谱法(HPLC)、气相色谱法(GC)等难以检测,且前处理操作繁琐,从基质中分离的难度也很大。液相色谱与质谱串联的技术(LC-MS)将色谱技术的高分离能力与质谱技术的高灵敏,及结构解析能力成功结合,成为应用广泛、潜能巨大的分析技术,为中药药动学的快速测定分析提供了一个重要技术手段。中药人体药代动力学的试验流程一般为:文献调研、预试验→选择具有代表性的有效成分→临床试验方案设计→预试验确定分析成分、采血点和线性范围→临床试验方案修订→分析方法方案设计→方法学确证→正式临床试验→分析测定生物样品→数据统计分析及药动学评价→试验报告。
4.3 临床药动学试验需考虑的问题
采样点的确定对药代动力学研究结果具有重大的影响,在进行中药复方制剂的药动学临床试验时,因中药成分复杂,采样点的设计要兼顾多个有效成分,必要时需进行多个临床试验。具体参照临床药代动力学研究技术指导原则中的规定开展试验。

图8 双花百合片的药味组成及君臣佐使关系
5 典型实例介绍:双花百合片中多组分的人体药代动力学研究[17]
5.1 药物及研究背景
双花百合片是扬子江药业的上市品种,由黄连、苦地丁、板蓝根、紫草、金银花、淡竹叶、蛇胆、地黄、百合、细辛10味中药组成,其君臣佐使关系见图8。双花百合片于2012年获得国家食品药品监督管理局的生产批件(国药准字Z20123033)。本品为薄膜衣异型片,除去薄膜衣后显棕黑色;气清香,味苦。主要功能为清热泻火,解毒凉血。用于轻型复发性口腔溃疡心脾积热证,症见口腔粘膜反复溃疡,灼热疼痛,口渴,口臭,舌红苔黄等。含量测定规定小檗碱的含量不得少于18 mg/片。
5.2 复方中成药药动学研究检测成分的确定
根据君臣佐使的关系,查找文献进行调研。首选中药质量标准中检测和鉴别的化学成分,当质量标准中没有明确定量成分和鉴别成分时,则按照以下顺序确定药动学检测成分:第一步,按中药配伍的君、臣、佐、使的先后顺序,从文献中分别检索与中药说明书中药效一致的单味药材中的效应成分;第二步,对复方中成药进行含量测定,确定“第一步”中检索到的各化学成分是否在制剂中可以检测到,含量如何;第三步,用大鼠或人进行预实验,确定制剂中可以检测到的成分哪些是可以吸收入血的;最后将吸收入血成分确定为药动学研究对象。

图9 双花百合片提取流程
按照上述方法检索双花百合片的化学成分,主要为生物碱类、醌类、有机酸和其他类成分。其中君药黄连主要是小檗碱成分,臣药苦地丁主要成分为紫堇灵和乙酰紫堇灵,臣药紫草主要成分为紫草素和乙酰紫草素,佐药金银花主要成分是绿原酸和木犀草素,佐药蛇胆主要成分为牛黄酸。
5.2.1 双花百合片中主要化学成分的定性鉴别与结构解析
对双花百合片进行提取,流程见图9,利用LCTOF/MS分析技术在双花百合片中寻找鉴定上述化学成分,并进行定性分析和结构解析。
ESI正离子模式下,鉴别出17个化合物,两个未知化合物,这些化合物多为生物碱类成分,源于君药黄连和臣药苦地丁两味药材;ESI负离子模式下,鉴别出16个化合物,分别来自于佐药金银花和蛇胆。将双花百合片灌胃给予大鼠后,观察大鼠血浆和尿液样品中是否能找到上述鉴定的33个化合物,再结合文献调研和LC-MS/MS分析结果,选择了11个与复方药理作用相关的入血活性成分作为双花百合片复方的指标成分,这11个指标成分分别为:小檗碱、表小檗碱、小檗红碱、木兰花碱、黄连碱、巴马汀、药根碱、紫堇灵、乙酰紫堇灵、绿原酸和牛磺胆酸,各指标性成分的结构式见图10和图11。

图10 双花百合片中生物碱类指标性成分结构式
5.2.2 双花百合片中主要生物碱类化学成分的含量测定
测定双花百合片中入血成分的含量,测得双花百合片(批号:14032311,规格:0.6 g/片)每片中11个指标性成分的各成分含量如下:小檗碱18.01碱量(合片(批号:、黄连碱5.11碱量(合片(批号、表小檗碱5.38碱量(合片(批号、药根碱2.42±0.07 mg、木兰花碱1.90±0.07 mg、小檗红碱1.04±0.07 mg、巴马汀4.92±0.07 mg、紫堇灵0.465±0.07 mg:学、乙酰紫堇灵0.061±0.07 mg:学、绿原酸0.91±0.07 mg和牛磺胆酸4.62±0.07 mg,其中小檗碱的含量为18.01 mg/片,符合规定。根据含量测定的结果换算给药剂量。
5.3 生物样本中双花百合片主要药效成分的分析方法的建立
药动学主要研究体内血浆中药物浓度变化规律和尿液中的排泄特征,因此分别建立双花百合片主要活性成分血药浓度测定方法和尿药浓度测定方法,具体内容详见文献报道[18-20]。
5.4 双花百合片中多组分的人体药代动力学研究
5.4.1 遵守试验伦理
试验要严格遵守赫尔辛基宣言,临床试验方案由中国医学科学院皮肤病研究所伦理委员会审核批准;研究者在受试者开始试验前将试验的相关信息充分告知受试者,受试者于试验前均自愿签署知情同意书。
5.4.2 设计临床试验方案
按照图12方案给药,试验药物:双花百合片(国药准字Z20123033),规格:0.6 g/片,服药方式:空腹口服,单次给药一次4片,多次给药一天3次每次4片,健康受试者:12名,男女各半。
5.4.3 采样时间点
单次给药时分别在给药前(0 h)及给药后0.25,0.5,0.75,1,1.33,1.67,2,2.5,3,4,5,6,8,12,24,48,72和96 h采集血液;多次给药时,连续给药5天,于第12,13,14天早晨给药前采集静脉血以测定谷浓度,第14天采血时间同单次给药。
尿液收集时间分别在单次给药前(0 h)及给药0-2,2-4,4-8,8-12,12-24,24-36,36-48,48-60,60-72 h后分段采集。
5.4.4 试验结果
12名健康受试者单、多次给药后9种生物碱的平均血药浓度-时间曲线见图13和图14;12名受试者单次(多次)口服双花百合片后9种生物碱类成分的主要药代动力学参数见表2,表3;男、女受试者分别单次口服双花百合片后9种生物碱的主要药动学参数比较见表4;12名健康受试者单、多次给药后绿原酸(A)和牛磺胆酸(B)的平均血药浓度-时间曲线比较图见图15;双花百合片给药后绿原酸在人体内的药代动力学参数见表5;男、女受试者分别单次口服双花百合片后绿原酸的主要药动学参数比较见表6;受试者单次口服双花百合片后尿液中九种生物碱和绿原酸的累积排泄量和累积排泄率见表7。
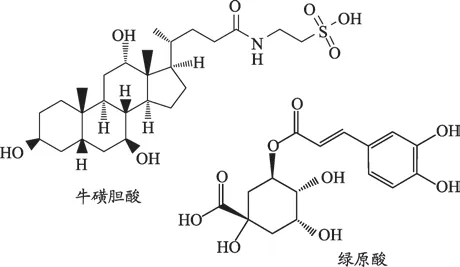
图11 双花百合片中有机酸类指标性成分结构式

图12 双花百合片临床试验给药方案
5.4.5 试验小结与讨论
受试者单次给药后,大多成分在体内吸收快,血药浓度达峰时间为1.0-2.7 h,t1/2相差较大,如绿原酸(1.3 h),小檗碱(48.5 h)。性别差异不会影响木兰花碱、小檗红碱、紫堇灵、乙酰紫堇灵和绿原酸在人体内的药动学过程;女性受试者中小檗碱的lnAUC0-96、MRT0-96和CL/F、黄连碱的MRT0-96、表小檗碱的lnAUC0-96和MRT0-96、药根碱的 lnAUC0-96和 lnCmax、巴马汀的lnAUC0-96和MRT0-96,比男性受试者的相应参数要高1-4倍。单次、多次两种给药方式下,双花百合片中主要成分的Tmax无显著性变化。多次给药后表小檗碱、药根碱、巴马汀、紫堇灵和乙酰紫堇灵的暴露量增加到单次给药的2倍以上,紫堇灵增加到了单次给药的5-6倍;但这些成分在最后一次给药的96 h后基本可从体内消除。连续口服双花百合片5天(每次4片,每天3次)后,小檗碱、黄连碱、木兰花碱、小檗红碱、紫堇灵、乙酰紫堇灵和绿原酸的血药浓度均可达到稳态,且稳态血药浓度波动较小。

图13 12名健康受试者单、多次给药双花百合片后小檗碱、黄连碱、表小檗碱、药根碱、木兰花碱和小檗红碱的平均血药浓度-时间曲线图
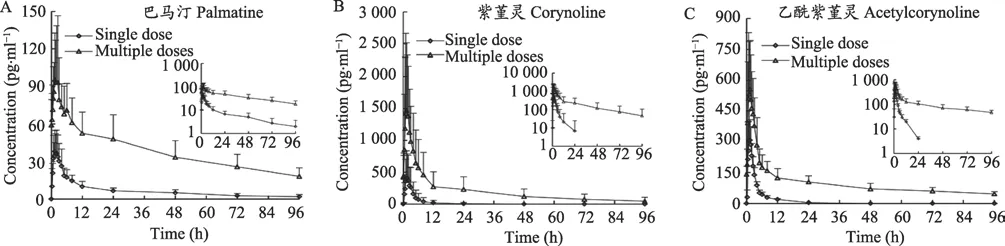
图14 12名健康受试者单、多次给药双花百合片后巴马汀、紫堇灵和乙酰紫堇灵的平均血药浓度-时间曲线图
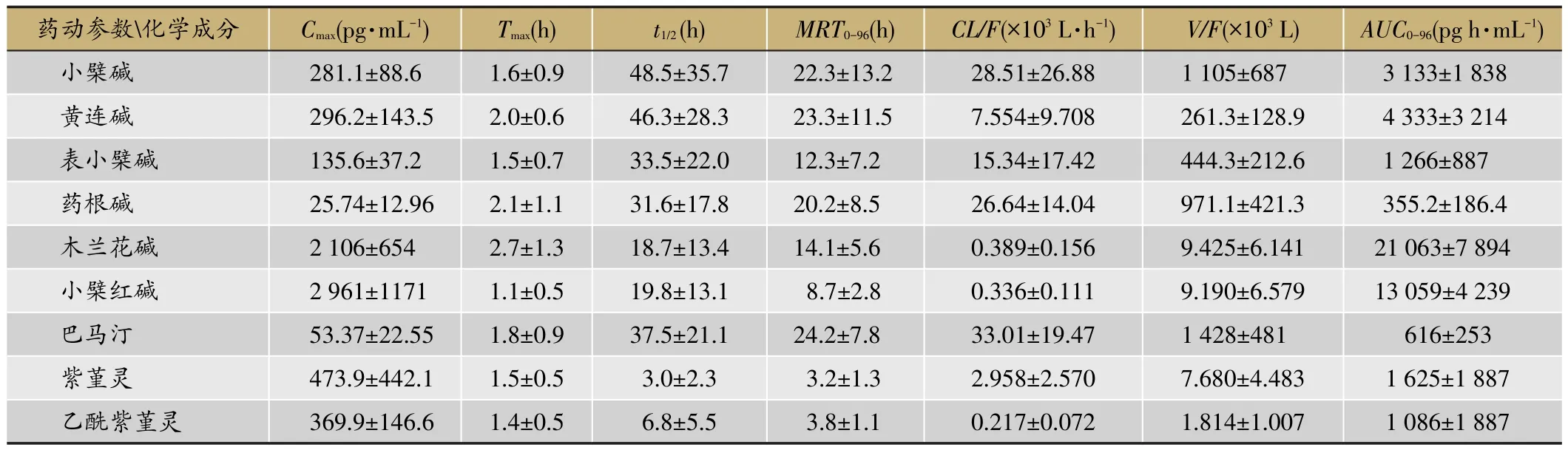
表2 受试者单次口服双花百合片后9种生物碱类成分的主要药代动力学参数(n=12)

表3 受试者多次口服双花百合片后9种生物碱类成分的主要药代动力学参数(n=12)
为提高药物的安全性和有效性,药动学特征是新药设计需考虑的关键特性之一。药动学研究可以为阐明和解释临床用药之间发生的复杂的相互作用提供帮助。本研究中发现,紫堇灵的主要药动学参数(Cmax,AUC和t1/2)在单次和多次两种给药方式下有显著性的差异。与单次给药相比,多次给药后紫堇灵的血浆暴露量显著增加,t1/2明显延长,Tmax则无明显变化。导致这些结果的原因可能与双花百合片中十味中药的配伍及相互作用有关。与化学药物不同,中草药成分复杂,其治疗疾病产生临床疗效通常是多成分整体作用的结果[11],这些共存的多个化合物可能导致药代动力学的相互作用[21],这就是当今研究较为热门的中药-药物和中药-中药相互作用。细胞色素P450的诱导和抑制是产生草药-药物相互作用的最常见的机制。同样,草药中的化学成分可能是CYP450酶的底物、抑制剂或诱导剂,从而对合用药物的药代动力学产生影响[22]。有研究证明紫堇灵主要由CYP2C9和CYP3A4代谢,但同时又是这两种酶的抑制剂[23]。黄连(Rhizoma Coptidis)是双花百合片复方中的君药,小檗碱是黄连中含量最高的效应成分。另有研究显示,连续多次服用小檗碱可以抑制CYP2D6、CYP2C9和CYP3A4的活性,故与小檗碱合并用药时,应注意中药-西药发生相互作用[24]。因此,我们推测本试验多次给药后紫堇灵的Cmax和AUC的增加,是由它本身被CYP2D6、CYP2C9和CYP3A4代谢的量较少导致的;同时这也导致了紫堇灵在体内的半衰期的延长和清除速率的减慢;这些结果刚好和我们对紫堇灵及其在双花百合片中的潜在相互作用研究的结果[13]相一致。
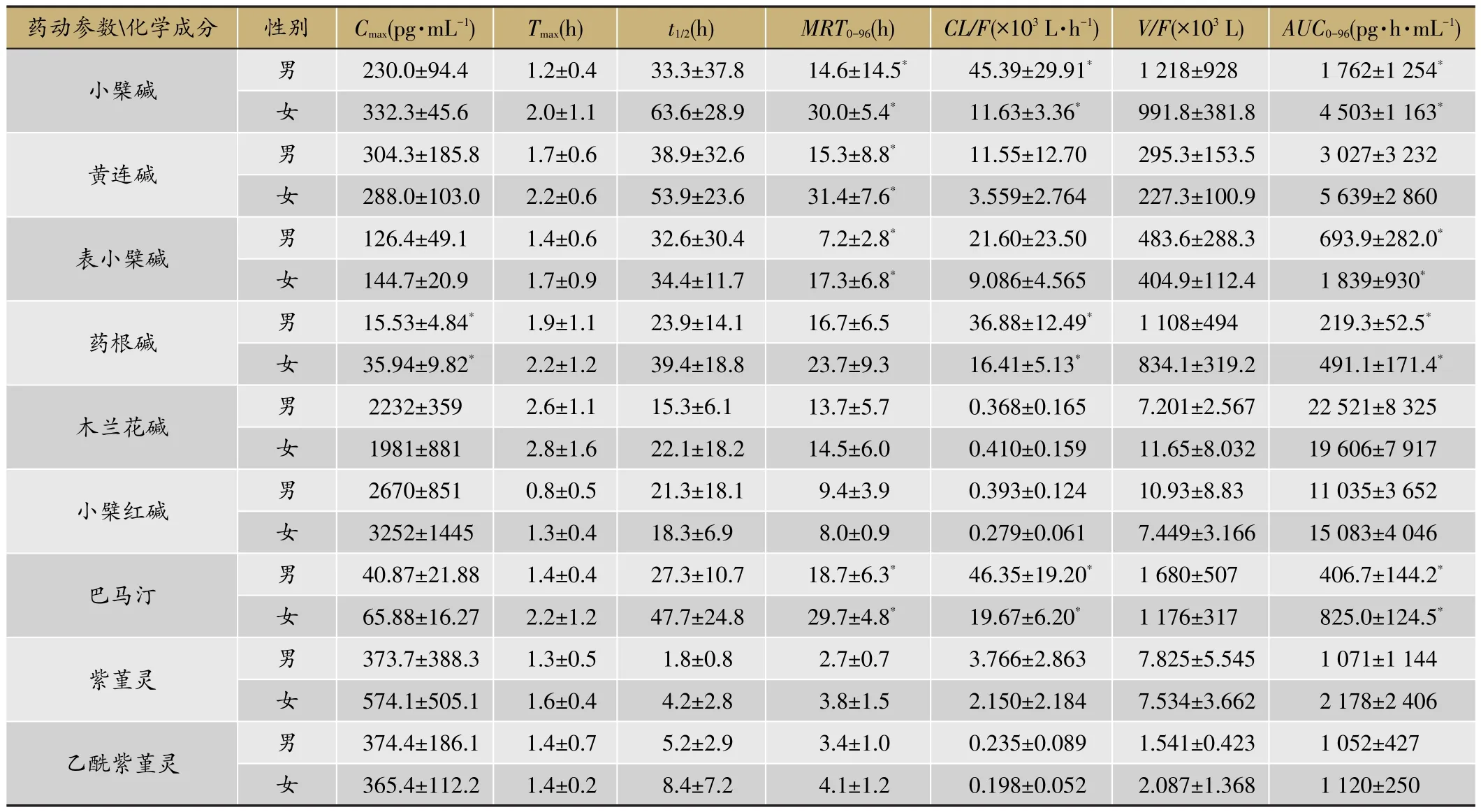
表4 男、女受试者分别单次口服双花百合片后9种生物碱的主要药动学参数比较(n=6)
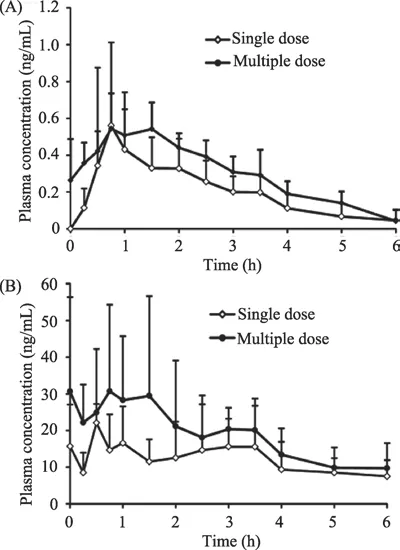
图15 健康受试者单、多次给药双花百合片后绿原酸(A)和牛磺胆酸(B)的平均血药浓度-时间曲线图
此外,与文献[25]报道的中国健康受试者单次口服单一成分小檗碱片剂后的药动学参数相比较,服用双花百合片后小檗碱血药浓度达峰时间Tmax(1.6 h)明显短于单一成分片剂(小檗碱片)中小檗碱的血药浓度达峰时间(9.8 h);双花百合片中小檗碱的暴露量(Cmax与AUC)与剂量之比是文献中单一成分片剂(小檗碱片)的2-3倍,消除半衰期t1/2显著延长,从28.6 h(小檗碱片)到48.5 h(双花百合片)。这表明双花百合片中的其他成分可以增强小檗碱的吸收速度和生物利用度。小檗碱主要由CYP1A2、CYP3A4和CYP2D6代谢[26],这就暗示双花百合片中紫堇灵和其他成分可能会抑制小檗碱的代谢,在后续研究中将对此进行探讨。有关双花百合片中中药-西药或中药-中药相互作用以及配伍机制仍需进一步研究。
牛磺胆酸是由肝细胞分泌的胆汁酸与牛磺酸结合形成的内源性物质,因此人体血浆中含有一定浓度的牛磺胆酸。本试验中受试者服用双花百合片后血浆中牛磺胆酸浓度-时间曲线并没有显著的特征性,这是人体胆囊每天有生理节律性的分泌牛磺胆酸与双花百合片释放的牛磺胆酸的总体表现。同时牛磺胆酸在体内的合成、转运和代谢会受到机体的多方面调控以维持其在体内的平衡[27],这又进一步增加了牛磺胆酸在体内处置过程的复杂性,因此试验未能得到牛磺胆酸具体的药动学特征。
健康受试者单次口服双花百合片后,在72 h内尿液中小檗碱、黄连碱、表小檗碱、药根碱、木兰花碱、小檗红碱、巴马汀、紫堇灵、乙酰紫堇灵和绿原酸的累积排泄率为0.01%-6.5%。结果显示双花百合片中的这些主要成分以原型的形式从肾脏排泄的量较少。可能这些成分在体内被广泛代谢,可能与葡萄糖醛酸或磺酸结合形成II相代谢物,或者生物转化后形成相应的I相代谢物,最终以代谢物的形式排泄。因此为了考察这些成分的主要代谢途径和物料平衡,有关它们在体内的代谢和处置过程还仍需进一步研究。
总之,本试验的研究结果为后期考察双花百合片用于治疗口腔黏膜炎患者的安全性和有效性的研究奠定基础。目前,双花百合片在国内正在进行用于口腔黏膜炎治疗药物的IV期临床试验的一系列评估,本研究为指导双花百合片的临床合理用药及其作用机制的研究提供参考,为推动双花百合片的国际化和现代化提供了一定的科学依据。
6 展望
中药药代动力学经历了几十年的研究历程,现代药理学研究也已证明中药复方药效的发挥并不是简单的单味药药理作用的简单相加或毒性作用的抵消或相减,而是多成分、多靶点的综合,是方中药物各成分之间发生的协同、制约或改性等作用的综合效果[4]。近年来,中药药代动力学的研究广泛借鉴数学、化学、生物学等学科的研究方法,已经从针对于单一成分发展为同时监测众多成分和众多生物效应。随着研究方法和技术的发展,中药药代动力学得到了较快的发展,基于药物浓度法、生物效应法以及PK/PD结合模型等各种中药药代动力学研究新方法新思路已经在不同中药中得到了应用和验证。现代数学模型和动力学原理成功地被应用于中药多组分药代动力学研究,客观科学地研究了中药复方在人体内吸收、分布、代谢和消除过程的规律,为中药多组分药代动力学的研究,为中药现代化开创了新研究思路。中药或其复方的药效物质基础、药理作用机制和安全性评价是中药现代化的关键环节。中药的安全性问题是中药现代化进程中的瓶颈,正确评价中药的毒副作用,明确中药毒性机制及其物质基础,科学合理使用中药,对减少或杜绝中药毒性具有重要意义。中医药是中华民族的宝贵财富,2015年屠呦呦因发现青蒿素而获得诺贝尔奖,再度引发了人们对中药的关注与激情;2016年3月全国政协十二届四次会议上,有关促进和规范中医药发展的话题再次成为了关注热点,相信随着科学技术的发展及科研工作者的不懈努力,中医药定会迈进国际的医药舞台,彰显和发挥独特的优势和魅力。

表5 受试者单次、多次口服双花百合片后绿原酸的主要药代动力学参数(Mean±SD)
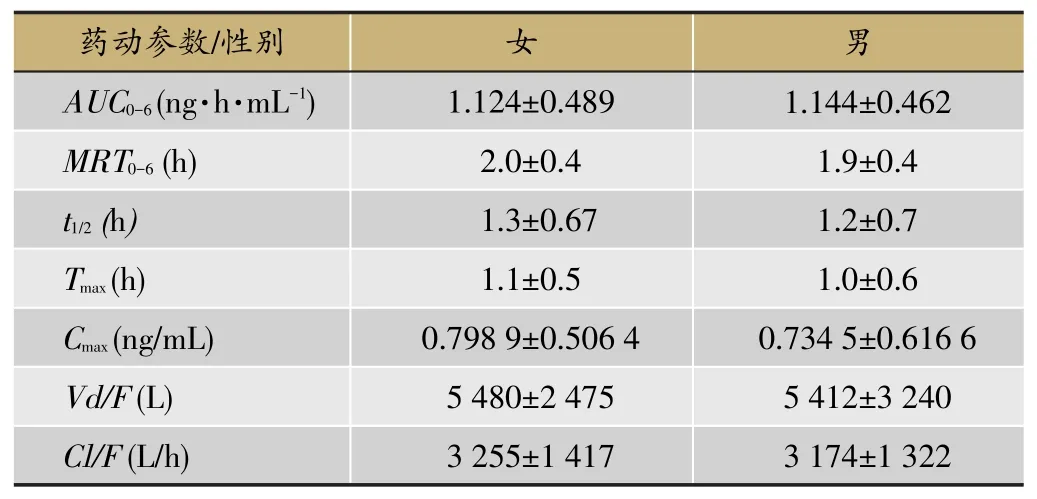
表6 男、女受试者分别单次口服双花百合片后绿原酸的主要药动学参数(n=6)

表7 受试者单次口服双花百合片后尿液中九种生物碱成分和绿原酸的累积排泄量和累积排泄率(n=12)
1 Song Q,Song Y,Zhang N,et al.Potential of hyphenated ultra-high performance liquid chromatography-scheduled multiple reaction monitoring algorithm for large-scale quantitative analysis of traditional chinese medicines.Rsc Adv,2015,5(71):57372-57382.
2 Zhang A,Sun H,Qiu S,et al.Advancing drug discovery and development from active constituents of yinchenhao tang,a famous traditional chinese medicine formula.Evid Based Complement Alternat Med,2013,2013:257909.
3 王蒙蒙,李晓玉,白燕,等.中药药代动力学研究进展.2013年中国药学大会暨第十三届中国药师周论文集.2013,4.
4 韩玲.多成分中药药代动力学研究的现状及思考.中国中药杂志,2008,33(21):2442-2448.
5 刘昌孝.中药药代动力学研究的难点和热点.药学学报,2005,40(5):395-401.
6 刘昌孝.中药药物代谢动力学研究思路与实践.科学出版社,2013.
7 彭珑,高晓燕,郭明星,等.中药整体药代动力学研究思路探讨.中华中医药学会中药分析分会第五届学术交流会论文集.2012:4..
8 Zhou S F,Zhou Z W,Li C G,et al.Identification of drugs that interact with herbs in drug development.Drug Discov Today,2007,12(15-16):664-673.
9 Evans W E,Relling M V.Pharmacogenomics:Translating functional genomics into rational therapeutics.Science,1999,286(5439):487-491.
10 Osanai T,Ohkubo T,Yasui N,et al.Effect of itraconazole on the pharmacokinetics and pharmacodynamics of a single oral dose of brotizolam.Br J Clin Pharmacol,2004,58(5):476-481.
11 Wang X,Zhang H,Chen L,et al.Liquorice,a unique"guide drug"of traditional chinese medicine:A review of its role in drug interactions.J Ethnopharmacol,2013,150(3):781-790.
12 Thaxton C S,Hill H D,Georganopoulou DG,et al.A bio-bar-code assay based upon dithiothreitol-induced oligonucleotide release.Anal Chem,2005,77(24):8174-8178.
13 Liu R,Gu P,Wang L,et al.Study on the pharmacokinetic profiles of corynoline and its potential interaction in traditional chinese medicine formula shuanghua baihe tablets in rats by lc-ms/ms.J Pharm Biomed Anal,2015,117:247-254.
14 Ding L,Hu J,Jiang M,et al.Sensitive hplc-apci-ms method for the determination of cyclovirobuxined in human plasma.J Chromatogr B Analyt Technol Biomed Life Sci,2006,843(1):78-83.
15厉将斌,李海松,张壮.中药药代动力学研究方法述评.北京中医药大学学报,2002,25(6):51-54.
16高姗,徐康康.中药药代动力学研究进展.中国实用医药,2010,5(21):249-251.
17 Liu R J,Wu Y,Cheng M L,et al.Pharmacokinetics and safety of the multiple constituents of Shuanghua Baihe tablets in healthy subjects.RSC Adv,2015,5:101989-101998.
18 Cheng M L,Liu R J,Wu Y,et al.LC-MS/MS determination and urinary excretion study of seven alkaloids in healthy Chinese volunteers after oral administration of Shuanghua Baihe tablets.J Pharm Biomed Anal,2016,118:89-95.
19 Wu Y,Liu R J,Gu P,et al.Highly sensitive method for simultaneous determination of nine alkaloids of Shuanghua Baihe tablets in human plasma by LC-MS/MS and its application.J Chromatogr B,2015,1007:81-92.
20 Liu R J,Zheng L,Cheng M L,et al.Simultaneous determination of corynoline and acetylcorynoline in human urine by LC-MS/MS and its application to a urinary excretion study.J Chromatogr B,2016,1014:83-89.
21 Qiao X,Ye M,Xiang C,et al.Analytical strategy to reveal the in vivo process of multi-component herbal medicine:A pharmacokinetic study of licorice using liquid chromatography coupled with triple quadrupole mass spectrometry.J Chromatogr A,2012,1258:84-93.
22 Mukherjee P K,Ponnusankar S,Pandit S,et al.Botanicals as medicinal food and their effects on drug metabolizing enzymes.Food Chem Toxicol,2011,49(12):3142-3153.
23 Fang Z Z,Zhang Y Y,Ge G B,et al.Identification of cytochrome P450(CYP)isoforms involved in the metabolism of corynoline,and assessment of its herb-drug interactions.Phytother Res,2011,25(2):256-263.
24 Guo Y,Chen Y,Tan Z R,et al.Repeated administration of berberine inhibits cytochromes P450 in humans.Eur J Clin Pharmacol,2012,68(2):213-217.
25 Hua W,Ding L,Chen Y,et al.Determination of berberine in human plasma by liquid chromatography-electrospray ionization-mass spectrometry.J Pharm Biomed Anal,2007,44(4):931-937.
26 Li Y,Ren G,Wang Y X,et al.Bioactivities of berberine metabolites after transformation through CYP450 isoenzymes.J Transl Med,2011,9:62.
27 Lefebvre P,Cariou B,Lien F,et al.Role of bile acids and bile acid receptors in metabolic regulation.Physiol Rev,2009,89(1):147-191.
Consideration and Exploration on Pharmacokinetic Study of Traditional Chinese Medicine
Ding Li1,Liu Ruijuan2
(1.Department of Pharmaceutical Analysis,China Pharmaceutical University,Nanjing 210009,China;2.Department of Pharmacy,The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450003,China)
With the development of traditional Chinese medicine(TCM)modernization,the study of TCM is not only limited to clarify the chemical material basis in vitro,but also to further study the fate of active components contained in TCM in vivo as well as the interaction and effect among them.It is to say that the pharmacokinetic(PK)study of TCM is needed.The results of PK study of TCM are useful for investigating its mechanism of action,reasonable use of TCM in clinic and modernization of TCM.In this paper,some scientific issues,including the purpose and significance of PK study of TCM,its particularity,difficulty and commonly used research methods,were analyzed and summarized combining with research examples.The authors hoped that it would be helpful for the scholars and promote the development of PK study of TCM.
Traditional Chinese medicine,pharmacokinetics,material basis,interaction,modernization of traditional Chinese medicine
10.11842/wst.2017.07.005
R36
A
2017-05-16
修回日期:2017-07-15
* 国家自然科学基金委员会面上项目(81573387):基于生物条码专属分离和放大-质谱检测标签增敏的体内蛋白多肽类药物定量分析新方法研究,负责人:丁黎;国家自然科学基金委员会面上项目(81273482):以代谢激活理论为导向的中药潜在肝损成分质谱快速识别及其致毒关联度研究,负责人:丁黎;;郑州大学第一附属医院青年基金(YNQN2017134):以反应性代谢物为导向的质谱快速识别中药潜在肝损伤成分的研究,负责人:刘瑞娟。
** 通讯作者:丁黎,博士,教授,博士生导师,主要研究方向:药物分析与药代动力学研究。
(责任编辑:陈 宁,责任译审:王 晶)
