CT灌注成像预测宫颈鳞癌新辅助化疗后预后高危因素的初步研究
2017-10-25雷军强郭吉刚翟亚楠
殷 亮,雷军强,郭吉刚,翟亚楠,窦 郁
(兰州大学第一医院放射科,甘肃 兰州 730000)
◁妇产影像学▷
CT灌注成像预测宫颈鳞癌新辅助化疗后预后高危因素的初步研究
殷 亮,雷军强,郭吉刚,翟亚楠,窦 郁
(兰州大学第一医院放射科,甘肃 兰州 730000)
目的:探讨CT灌注成像对宫颈鳞癌新辅助化疗后预后高危因素的预测价值。方法:选取2011年5月—2015年8月在兰州大学第一医院接受新辅助化疗并手术的51例宫颈鳞癌患者,根据术后病理是否存在预后高危因素及短期预后将其分为无高危因素组(n=36,70.59%)和高危因素组(n=15,29.41%),对两组的CT灌注参数及临床资料作回顾性分析,探讨其对宫颈鳞癌新辅助化疗后预后高危因素的影响。结果:高危因素组中BF、化疗后肿瘤最大直径大于无高危因素组,差异有统计学意义(P<0.05),且与预后高危因素呈正相关(r=0.420,P=0.002;r=0.296,P=0.035)。 FIGO 分期、病理分级和化疗前肿瘤最大直径、BV、permeability、TTP与宫颈鳞癌新辅助化疗预后高危因素无相关性(P>0.05)。多因素Logistic回归分析及ROC显示BF为宫颈鳞癌新辅助化疗预后高危因素的独立影响因素并能够对其做出较为准确的预测AUC=0.810,P=0.001,95%CI(0.682~0.918)。结论:BF对宫颈鳞癌新辅助化疗后是否存在预后高危因素具有较高的预测价值。当BF≥46.64 mL/(100 mL·min)时,预测预后高危因素的敏感度、特异度和准确度分别为 86.67%(13/15)、94.44%(34/36)和 92.16%(47/51)。
宫颈肿瘤;癌,鳞状细胞;抗肿瘤联合化疗方案;体层摄影术,螺旋计算机
宫颈癌新辅助化疗虽已广泛用于临床治疗,但与手术及同步放化疗比较是否能确切改善患者预后尚存在争议[1-3]。准确评估宫颈癌新辅助化疗后是否存在预后高危因素对进一步的治疗选择具有重大意义,也是目前学界亟待解决的问题,但传统影像及临床检查尚无公认有效的方法。近年来诸多研究显示CT灌注成像对于评估肿瘤的治疗效果及预测预后具有良好的效果[4-6]。因此,本研究尝试利用CT灌注成像对宫颈鳞癌新辅助化疗后可能存在的预后高危因素进行预测,以期为患者个体化治疗选择提供参考依据。
1 资料与方法
1.1 临床资料
选取2011年5月—2015年8月兰州大学第一医院51例经病理证实并接受新辅助化疗及手术的宫颈鳞癌患者资料行回顾性分析。根据国际妇产科联盟(FIGO)的分期标准,Ⅰb期 22例,Ⅱa期 18例,Ⅱb 期 11 例。年龄 38~62 岁,平均(49.8±6.4)岁。所有患者均为鳞癌,肿瘤最大直径3.5~5.4 cm,平均直径(4.25±0.82)cm。本研究获得兰州大学第一医院伦理委员会批准,所有病人均签署知情同意书。
1.2 研究方法
1.2.1 样本选取
本研究样本纳入标准:①患者化疗方案相同且完成2个疗程化疗。②所有患者化疗后根据临床触诊、影像检查及实体肿瘤疗效的判断标准(RECIST)均为部分缓解(PR)。③无其他部位恶性肿瘤病史,于新辅助化疗前未曾进行放化疗及手术干预 (不包括活检)。④无造影剂过敏及妊娠试验阳性。化疗结束3周后择期行经腹或腹腔镜下子宫广泛切除术+盆腔淋巴结清扫及腹主动脉旁淋巴结活检,于术前1周内行CT灌注扫描。
1.2.2 样本分组
宫颈癌预后高危因素包括:标本切缘阳性、宫旁浸润,盆腔淋巴结和/或腹主动脉旁淋巴结阳性[7]。根据手术病理结果,51例患者中9例存在高危因素(每例中包括1~3个高危因素不等),其中切缘阳性2例,宫旁浸润3例,盆腔淋巴结阳性6例,主动脉旁淋巴结阳性3例。术后病理未检出高危因素的42例患者于术后接受6~12月随访,复查间隔时间为3或6月,随访过程中患者接受胸部X线或CT扫描、腹部MR或CT扫描,以病理结果(活检)为主要判断标准,综合影像及临床、实验室检查以确认病情。随访结果显示,2例患者术区复发(检出时间分别为术后第3、6月),3例患者盆腔淋巴结转移 (检出时间为术后第6、6、9月),1例患者腹主动脉旁淋巴结转移(检出时间为术后第6月)。将具有预后高危因素及术后复发、淋巴转移的患者归入高危因素组(n=15,29.4%),余患者归入无高危因素组 (n=36,70.6%)。
1.2.3 CT灌注成像
采用西门子64层螺旋CT行宫颈癌灌注成像,扫描前行呼吸训练并用腹带固定盆腔。病人使用高压注射器经肘静脉注射非离子型对比剂碘普胺(300 mgI/mL)50 mL,注射流率 6 mL/s,随后以相同流率注射等量生理盐水,延迟10 s后扫描。扫描参数:管电压100 kV,管电流100 mA,扫描时间40 s,平均 DLP 为(268.54±6.75)mGy·cm,时间分辨率为165 ms。患者采用仰卧位,扫描方向为头先进,选择肿瘤最大直径层面为灌注中心层面,灌注扫描范围28.8 mm,单层扫描层厚7.2 mm,重建层厚2.4 mm。
1.2.4 影像分析
采用西门子64层螺旋CT体部灌注扫描软件包,由2名高级职称影像医师共同测量肿瘤最大直径并选择兴趣区(ROI),以肿瘤最大直径层面为中心层面,根据肿瘤形态及体积选取3或4个连续层面为靶层面,每层选取3~5个ROI,选择时避开肿瘤边缘、大血管及坏死区域(增强后为低密度且血流量(BF)值小于 5mL/(100mL·min),每个 ROI直径 5mm,间距≥5 mm。测量ROI的BF、血容量(BV)、渗透性(permeability)、达峰时间(TTP)。 将同一患者所有层面ROI测得各参数的算术平均值作为统计学数据。
1.2.5 新辅助化疗
采用顺铂+紫杉醇(TP)联合化疗方案治疗2个疗程,全身静脉滴注给药,每个疗程21天,第1与第2疗程间隔2周。两次疗程结束后3周结合妇科触诊及盆腔CT或MR检查结果确定评估肿瘤体积变化及与周围组织的关系。
1.3 统计学方法
采用SPSS 18.0软件进行统计学分析。计数资料以率或构成比表示,两组间比较采用连续性校正卡方检验。正态分布的计量资料以均数±标准差表示(±s),组间比较采用t检验。两组资料行Spearman相关分析,利用多因素Logistic回归分析不同资料对新辅助化疗预后高危因素的影响,以P<0.05为差异有统计学意义。对新辅助化疗预后高危因素有显著影响的资料建立受试者操作特征(ROC)曲线。
2 结果
两组间FIGO分期、病理分级、年龄构成及化疗前肿瘤最大直径比较(表1,2)差异均无统计学意义(P>0.05)。新辅助化疗后,高危因素组 BF、平均肿瘤最大直径大于无高危因素组(表 2,3,图 1,2),差异有统计学意义 (P=0.001,0.041)。 两组间 BV、permeability、TTP 差异均无统计学意义(P>0.05)。 相关性分析显示,BF、化疗后肿瘤最大直径与预后高危因素呈正相关(r=0.420,P=0.002;r=0.296,P=0.035);FIGO分期、病理分级、年龄、化疗前肿瘤最大直径、BV、permeability、TTP均与预后高危因素无相关性(r=0.064,P=0.677;r=0.140,P=0.370;r=0.104,P=0.468;r=0.182,P=0.202;r=0.177,P=0.214;r=0.133,P=0.432;r=0.251,P=0.075)。 将所有资料作为自变量进行多因素Logistic回归分析,结果显示BF是新辅助化疗后预后高危因素的独立影响因素(表4)。ROC曲线显示BF对宫颈鳞癌新辅助化疗后是否存在预后高危因素有较高的预测价值 AUC=0.810,P=0.001,95%CI(0.682~0.918)(图 3)。BF 以 46.64 mL/(100 mL·min)为阈值,对预后高危因素预测的敏感度、特异度和准确度分别为86.67%(13/15)、94.44%(34/36)和 92.16%(47/51)。
表3 两组间灌注参数比较(±s)
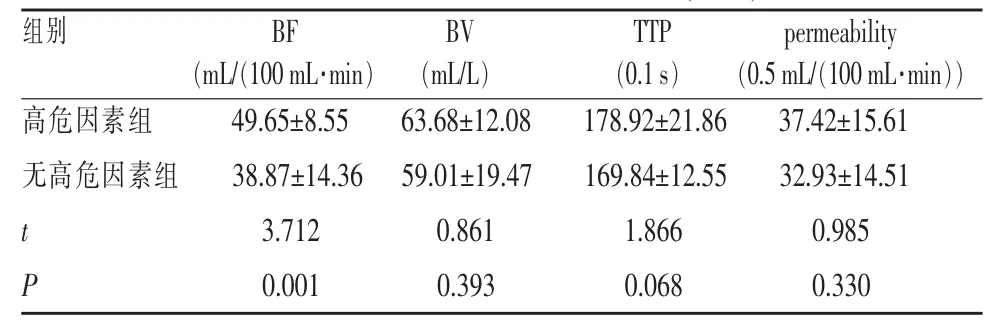
表3 两组间灌注参数比较(±s)
?
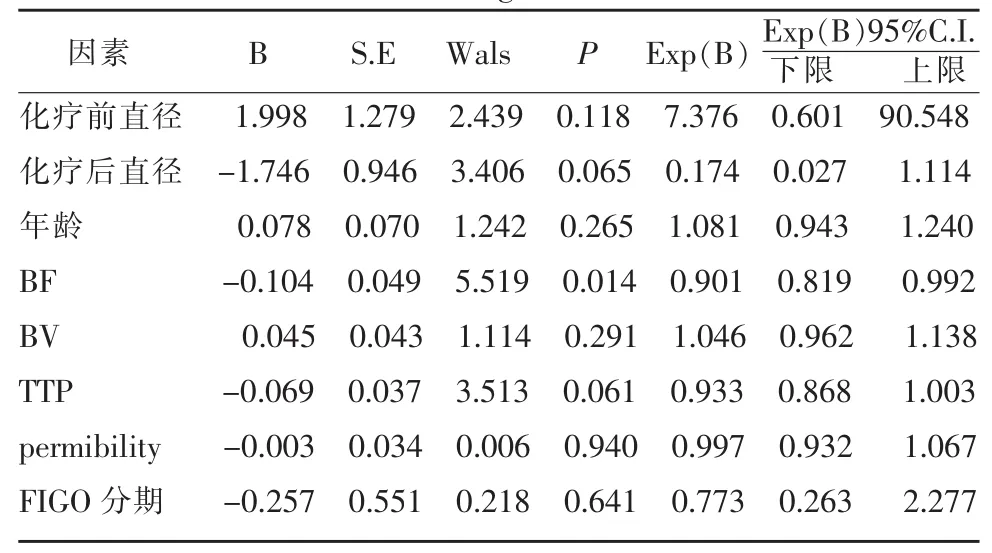
表4 影响宫颈鳞癌新辅助化疗预后高危因素的相关因素的Logistic回归分析

图1a,1b,2a,2b 分别为高危因素组和无高危因素组样本的CT扫描及同层面BF伪彩图。红色、黄绿色代表高灌注区,蓝色和紫色代表低灌注区。对比两组图像,高危因素组肿瘤(图1a,1b,黑色箭头)较无高危因素组肿瘤(图2a,2b,黑色箭头)血流量更为丰富。Figure 1a,1b,2a,2b.Represents respectively CT image and color-coded BF perfusion map of different samples selected from the group of cases with prognostic high-risk factors and the group of cases without prognostic high-risk factors.The area in red,green and yellow represent high perfusion area;area in blue and purple represent low perfusion area.Comparing images of two groups,the tumor with high-risk factors(Figure 1a and 1b,black arrow)has higher blood flow than the tumor without high-risk factors(Figure 2a and 2b,black arrow).
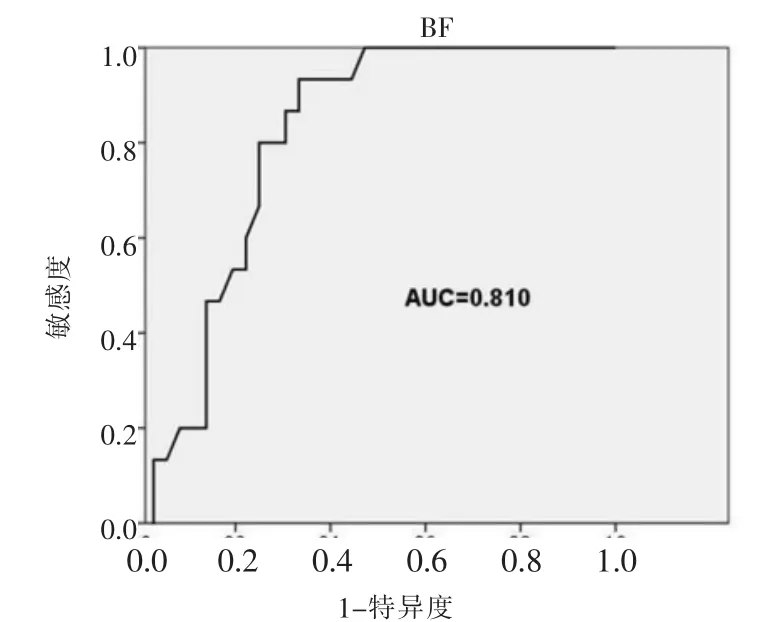
图3 BF预测宫颈鳞癌新辅助化疗预后高危因素的ROC曲线Figure 3. ROC curve of BF to predict the presence of highrisk prognostic factors in cervical squamous carcinoma after neoadjuvant chemotherapy.
3 讨论
肿瘤血管对肿瘤的生长至关重要,在很大程度上决定肿瘤的侵袭性和转移潜力并影响着化疗的敏感性及效果[8]。减少或控制预后高危因素是新辅助化疗的目的之一[1,9]。目前诸多研究表明,CT灌注作为一种功能成像方法,能够为肿瘤血管生成提供定性和定量信息[4-5]。因此,通过CT灌注成像提供的血流动力学信息能够在一定程度上反映出肿瘤目前的生物学行为,利用其对宫颈癌新辅助化疗后是否存在预后高危因素进行预测具有理论依据和现实意义。
切缘阳性、宫旁浸润、盆腔淋巴结和/或腹主动脉旁淋巴结阳性等高危因素的检出受手术医师个人能力和病理取材的影响,且存在部分病变术前难以准确评价的情况。近期国内学者研究认为新辅助化疗能够有效的控制和减少预后高危因素[10-11],但也有研究认为接受新辅助化疗患者的生存率、复发率并无改善[3],Kim 等[12]和 Taucher等[13]针对这一现象提出“掩盖作用假设”。该假设认为:新辅助化疗会缩小转移瘤的体积,可能会使一些微小病灶难以被常规手术、病理检查发现,导致部分本来具有高危因素的患者免于术后放化疗从而降低了整体预后。同时,淋巴结微转移(LNM)也是影响预后的重要因素[14]。综上所述,本研究将术后病理未发现高危因素,但短期内出现复发及(或)转移的样本视为可能存在微小病灶或LNM,亦纳入预后高危组。
本研究结果显示,化疗后肿瘤最大直径与预后高危呈正相关,即肿瘤最大直径缩小越显著,其出现预后高危因素的可能性越低,短期预后也越好。宫颈癌的主要转移途径为直接蔓延和淋巴转移,随着肿瘤体积越大,与邻近脏器和淋巴结的空间距离缩小,淋巴管接触面积增大,更多的血管生成加剧了脉管内癌栓形成的几率,增加了其转移的可能性[15]。有研究表明宫颈癌最大直径越小其淋巴结转移和复发的几率越低,5年生存率更高[16-17]。本研究结果说明化疗后宫颈癌最大直径同样是评价其预后的重要参考依据,但多因素回归分析显示,化疗后肿瘤最大直径并不是预后高危因素的独立影响因素。本研究中FIGO分期、病理分级、年龄均与新辅助化疗后预后高危因素无相关性,这可能与所选取样本均为化疗有效(PR)且两组样本化疗前肿瘤最大直径差异无统计学意义有关。
BF指血管内血流速度,其取决于肿瘤内血管密度、管径和开放程度,越快的血流速度意味着更快的氧气和营养成分交换[5,18]。BV指血管内血容量,包括成熟与新生血管,permeability为血管管壁的通透性与外渗程度,主要反映不成熟新生血管,TTP与血管开放程度与动静脉瘘相关[18-19]。但在本研究中BV、permeability、TTP并没有显示与预后高危因素有相关性。因此,结合本研究结果,笔者认为化疗后肿瘤血管的血流速度较血管密度、新生血管数量更能反映肿瘤的代谢和生长状况,处于“高流速、低容量、低渗透性”灌注模式的肿瘤目前依然处于代谢相对活跃状态,出现转移和侵犯的可能性随之增高。本研究显示BF是宫颈鳞癌新辅助化疗预后高危因素的独立影响因素,当BF值大于46.64 mL/(100 mL·min)时,肿瘤存在预后高危因素的可能性很大,此时是否是手术最佳时机尚待商榷。目前学界对于宫颈癌新辅助化疗的疗程选择尚无明确的指导意见,临床中使用2~4个疗程不等[1],有学者认为化疗的疗程对预后并无明显影响[20],但也有学者认为是否增加化疗疗程应行评估后再做决定[21]。因此对于这部分患者,鉴于其2个疗程的化疗有效,是否可尝试增加一个化疗疗程后再行评估,这仍需要进一步的临床研究。对于接受手术的患者,笔者给与以下建议:①术中应仔细观察是否有微小病灶的存在并行系统、广泛的淋巴结清扫。②对于术后病理未发现预后高危因素的患者,应缩短复查间隔(建议以3月为宜)以及早发现可能的转移或复发。
CT灌注成像能够良好的反应宫颈鳞癌新辅助化疗后的病理状况,对预测预后高危因素展现出了良好的应用前景,但本研究为小样本试验,结果的准确性仍需大样本证实。相信随着灌注软件的普及、灌注扫描标准化的建立,CT灌注成像将在宫颈癌的治疗监测和预后评估中发挥更大的作用。
[1]Osman M.The role of neoadjuvant chemotherapy in the management of locally advanced cervix cancer:a systematic review[J].Oncol Rev,2014,8(2):60-66.
[2]Giuseppa S,Giuseppe S,Giuseppe LB,et al.Efficacy and tolerability of paclitaxel,ifosfamide and cisplatin as a neoadjuvant chemotherapy in locally advanced cervical carcinoma[J].J Gynecol Oncol,2015,26(2):118-124.
[3]Lee J,Kim TH,Kim GE,et al.Neoadjuvant chemotherapy followed by surgery has no therapeutic advantages over concurrent chemoradiotherapy in International Federation of Gynecology and Obstetrics stageⅠB-ⅡB cervical cancer[J].J Gynecol Oncol,2016,27(5):e52.
[4]Kim SH,Kamaya A,Willmann JK.CT Perfusion of the liver:principles and applications in oncology[J].Radiology,2014,272(2):322-344.
[5]García-Figueiras R,Goh VJ,Padhani AR,et al.CT perfusion in oncologic imaging:a useful tool[J].AJR,2013,200(1):8-19.
[6]Eilaghi A,Yeung T,d'Esterre C,et al.Quantitative Perfusion and Permeability Biomarkers in Brain Cancer from Tomographic CT and MR Images[J].Biomark Cancer,2016,8(Supply 2):47-59.
[7]Kim HS,Kim JY,Park NH,et al.Matched-case comparison for the efficacy of neoadjuvant chemotherapy before surgery in FIGO stageⅠB1-ⅡA cervical cancer[J].Gynecol Oncol,2010,119(2):217-224.
[8]Jayson GC,Kerbel R,Ellis LM,et al.Antiangiogenic therapy in oncology:current status and future directions[J].Lancet,2016,30,388(10043):518-529.
[9]董霞,王刚.局部晚期宫颈癌新辅助化疗影响因素研究进展[J].中华临床医师杂志:电子版,2012,6(15):4412-4415.
[10]Peng YH,Wang XX,Zhu JS,et al.Neo-adjuvant chemotherapy plus surgery versus surgery alone for cervical cancer:Metaanalysis of randomized controlled trials[J].J Obstet Gynaecol Res,2016,42(2):128-135.
[11]Guo L,Liu X,Wang L,et al.Outcome of international Federation of gynecology and obstetrics stageⅡb cervical cancer from 2003 to 2012:an evaluation of treatments and prognosis:a retrospective study[J].Int J Gynecol Cancer,2015,25(5):910-918.
[12]Kim K,Kim MJ,Chung HH,et al.Inadvertent potential risk of neoadjuvant chemotherapy in cervical cancer[J].Med Hypotheses,2009,73(6):1005-1007.
[13]Taucher S,Steger GG,Jakesz R,et al.The potential risk of neoadjuvant chemotherapy in breast cancer patients-results from a prospective randomized trial of the Austrian Breast and Colorectal Cancer Study Group(ABCSG-07)[J].Breast Cancer Res Trea,2008,112(2):309-316.
[14]Cibula D,Zikan M,Slama J,et al.Risk of micrometastases in non-sentinel pelvic lymph nodes in cervical cancer[J].Gynecol Oncol,2016,143(1):83-86.
[15]Sakuragi N,Satoh C,Takeda N,et al.Incidence and distribution pattern of pelvic and paraaortic lymph node metastasis in patients with StagesⅠB,ⅡA,andⅡB cervical carcinoma treated with radical hysterectomy[J].Cancer,1999,85(7):1547-1554.
[16]Horn LC,Bilek K,Fischer U,et al.A cut-off value of 2 cm in tumor size is of prognostic value in surgically treated FIGO stageⅠB cervical cancer[J].Gynecol Oncol,2014,134(1):42-46.
[17]Horn LC,Fischer U,Raptis G,et al.Tumor size is of prognostic value in surgically treated FIGO stageⅡcervical cancer[J].Gynecol Oncol,2007,107(2):310-315.
[18]Goh V,Glynne-Jones R.Perfusion CT imaging of colorectal cancer[J].Br J Radiol,2014,87(1034):20130811.
[19]Razek AA,Tawfik AM,Elsorogy LG,et al.Perfusion CT of head and neck cancer[J].Eur J Radiol,2014,83(3):537-544.
[20]Rydzewska L, Tierney J, Vale CL, et al. Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer[J].Cochrane Database Syst Rev,2012,12:CD007406.
[21]Lapresa M,Parma G,Portuesi R.Neoadjuvant chemotherapy in cervical cancer:an update[J].Expert Rev Anticancer Ther,2015,15(10):1171-1181.
A preliminary study on predicting the prognostic high-risk factors of cervical squamous cell carcinoma after neoadjuvant chemotherapy by CT perfusion imaging
YIN Liang,LEI Jun-qiang,GUO Ji-gang,ZHAI Ya-nan,DOU Yu
(Department of Radiology,The First Hospital,Lanzhou University,Lanzhou 730000,China)
Objective:To explore the predictive value of CT perfusion imaging for predicting the prognostic high-risk factors of cervical squamous carcinoma after neoadjuvant chemotherapy.Methods:The 51 patients who had cervical squamous carcinoma and underwent neoadjuvant chemotherapy before surgery between 2011 May and 2015 August in the First Hospital of Lanzhou University were selected.Based on the prognostic high-risk factors of pathology test and short-term prognosis,the cases were divided into two groups:non-high-risk factors(n=36,70.59%)and high-risk group(n=15,29.41%).CT perfusion parameters and clinical data were retrospectively analyzed to investigate the high-risk prognostic factors.Results:Two indexes of the high-risk group cases,the BF(blood flow)and the maximum diameter of the tumor post chemotherapy,were statistically significant higher than another group(P<0.05).The high-risk prognostic factors were positively correlated with BF and the maximum diameter of tumor after neoadjuvant chemotherapy(r=0.420,P=0.002;r=0.296,P=0.035).FIGO staging,pathological grade,the initial diameter of the tumor,BV,permeability and TTP were not correlated with the high-risk prognostic factors(P>0.05).Multivariate logistic regressionn analysis showed BF was an independent predictor to predict the existence of high-risk prognostic factors in cervical squamous carcinoma after neoadjuvant chemotherapy.BF can predict the?prognostic results accurately AUC=0.810,P=0.001,95%CI(0.682~0.918).Conclusion:BF had significant predictive value as a prognostic high-risk factor of cervical squamous carcinoma after neoadjuvant chemotherapy.Using BF equal to or greater than 46.64 mL/(100mL·min)to predict the existence of high-risk prognostic factors got 86.67%(13/15),94.44%(34/36)and 92.16%(47/51)in sensitivity,specificity and accuracy,respectively.
Vervix neoplasms;Carcinoma,squamous cell;Antineoplastic combined chemotherapy protocols;Tomography,spiral computed
R737.33;R730.261;R814.42
A
1008-1062(2017)05-0350-04
2016-08-23;
2016-12-03
殷亮(1980-),男,甘肃酒泉人,主治医师。 E-mail:sese1980128@163.com
雷军强,兰州大学第一医院放射科,730000。E-mail:leijq1990@163.com
2013年甘肃卫生行业科研管理项目(GWGL2013-27)。
