外源激素对桃儿七愈伤组织诱导的影响
2017-10-24李金娟陶自为陶海霞
李金娟,陶自为,陶海霞,李 婷
(1.甘肃省农业科学院质量标准与检测技术研究所,甘肃 兰州 730070;2.兰州大学通信网络中心,甘肃 兰州 730050)
外源激素对桃儿七愈伤组织诱导的影响
李金娟1,陶自为2,陶海霞1,李 婷1
(1.甘肃省农业科学院质量标准与检测技术研究所,甘肃 兰州 730070;2.兰州大学通信网络中心,甘肃 兰州 730050)
为了探讨外源激素对桃儿七愈伤组织诱导的影响,以桃儿七的胚及无菌苗的子叶和胚轴为材料,以MS为基本培养基,研究了3种不同激素配比对不同外植体愈伤组织诱导的影响。结果表明,以胚为外植体,在3.0 mg/L 2,4-D、0.5 mg/L KT和0.5 mg/L IAA组合处理的培养基中,诱导率达到39.5%;诱导子叶和胚轴形成愈伤组织的最佳激素配比为4.0 mg/L 2,4-D+0.5 mg/L KT+0.2 mg/L IAA;成熟胚比子叶和胚轴更易诱导愈伤组织的形成,诱导率分别提高了43.64%和315.79%,诱导效果最显著(P<0.001);在接种前,用5mg/L 2,4-D溶液浸蘸子叶和胚轴可有效提高其出愈率。
外源激素;桃儿七;愈伤组织
桃儿七(sinopodophy)为小檗科桃儿七属,是一种多年生草本植物,主要分布于中国的甘肃、陕西、青海、四川、云南以及西藏等地的山区林地[1-3],是我国著名的珍稀濒危药用植物,其根和根茎中含有大量具有抗癌、抗病毒等多种药用价值的木脂素类活性物质,其中鬼臼毒素(podophyllo toxin)是合成V P216(etopo side)、VM 226(tenipo side)和 GP7 等抗癌药物的原始物质,其所具有的抗癌活性最为显著[4-8]。此外,它还具有对一些重要病毒的抗病毒活性[9-10]。然而,由于近年来人们的过度采挖,使原本稀少的野生桃儿七植物资源遭到了严重的破坏,再加上人工合成、分离并纯化鬼臼毒素在技术上较难实现,因而,国内外利用细胞悬浮培养方法获得鬼臼毒素已成为获得鬼臼毒素最有效的途径之一[11-14]。Kadkade等研究证明,从美属足叶草(podophyllumpoltatum)、印足叶草(podophyllumhexandrumRoyle)的愈伤组织和悬浮培养体系中可以获得鬼臼毒素,但含量很低,并且含鬼臼毒素的愈伤组织培养非常困难[15-17];近年来,Uden和Chattopadhyay报道了他们在桃儿七的组织培养,愈伤诱导及其鬼臼毒素的生产等方面的研究进展,但均未获得长势与稳定性均好的细胞系[18-21];国内则仅有漆燕玲、景宁、杨晖等发表过有关利用桃儿七成熟胚诱导愈伤组织的报道[22-24]。
试验以桃儿七种子成熟胚及其无菌苗的不同部位为外植体,通过2,4-D、KT和IAA的不同组合处理,进行桃儿七愈伤组织诱导,探索桃儿七愈伤组织形成的有效诱导条件,为高产细胞系的筛选、大规模细胞培养生产鬼臼毒素的研究奠定良好的基础,并为解决桃儿七资源保护和开发利用之间的矛盾提供新的途径。
1 材料与方法
1.1 试验材料
以桃儿七当年种子的成熟胚为试验材料,种子采自于甘肃渭原县会川镇海拔2 100 m的山区林地自然生长的桃儿七植株,千粒重34.45±0.10 g。
1.2 试验方法
1.2.1 材料的消毒与处理将桃儿七种子用温水浸泡冲洗干净,无菌条件下,用无菌水冲洗3次,用70%酒精消毒20 s,无菌水冲洗3次,再用0.1%升汞灭菌20 min,无菌水冲洗4次,最后用已作灭菌处理的500 mg/L GA3浸泡36 h。在无菌条件下,用无菌水漂洗3~4次,再用70%酒精消毒20 s,0.1%升汞灭菌20 min,无菌水冲洗4~5次。
1.2.2 外植体的选择与处理无菌条件下将消毒、浸泡处理过的种子剥取种胚,直接接种于愈伤组织诱导培养基中,培养30 d后,再截取0.4 cm2或0.4 cm的小块或小段无菌苗子叶和胚轴分别在5 mg/L或10 mg/L两种处理的2,4-D中浸蘸1~2 min后接种于愈伤组织诱导培养基中培养。
1.2.3 愈伤组织的诱导将培养30 d的无菌苗子叶和胚轴分别接种于不同激素(2,4-D、KT和IAA)组合处理的MS培养基中,置于pH值为5.0~6.0、温度25±1℃、光照强度 38~40 μmol/m2·s的培养条件下诱导愈伤组织。
1.3 数据观察、记录与处理
不同外植体在不同激素组合处理的诱导愈伤组织培养基上20 d后,通过目测法观测愈伤组织的生长状况和生长势,记录结果,并按公式(1)计算愈伤组织的诱导率。
愈伤组织诱导率(%)=(诱导获得的愈伤组织外植体数/接种的外植体总数)×100 (1)
数据通过Excel和SPSS 13.0软件进行统计分析。
2 结果与分析
2.1 不同激素配比对愈伤组织诱导的影响
2.1.1 不同激素配比对成熟胚愈伤组织诱导的影响从表1中可以看出,不同浓度的2,4-D与KT组合,2,4-D、KT与IAA三者的组合能不同程度的诱导成熟胚的愈伤组织的发生。在M6培养基(3.0 mg/L 2,4-D+0.5 mg/L KT)上,成熟胚的愈伤组织诱导率达到了24.5%,愈伤组织呈淡黄绿色,形态呈颗粒或絮状,其结构较疏松,生长较好。2,4-D与KT组合的培养基中添加一定浓度的IAA,可在其基础上显著提高诱导率:M7、M8均显著高于其他未添加的试验组,其中M8(图1)诱导率达到39.5%,显著优于其他激素组合培养基(P <0.05)。
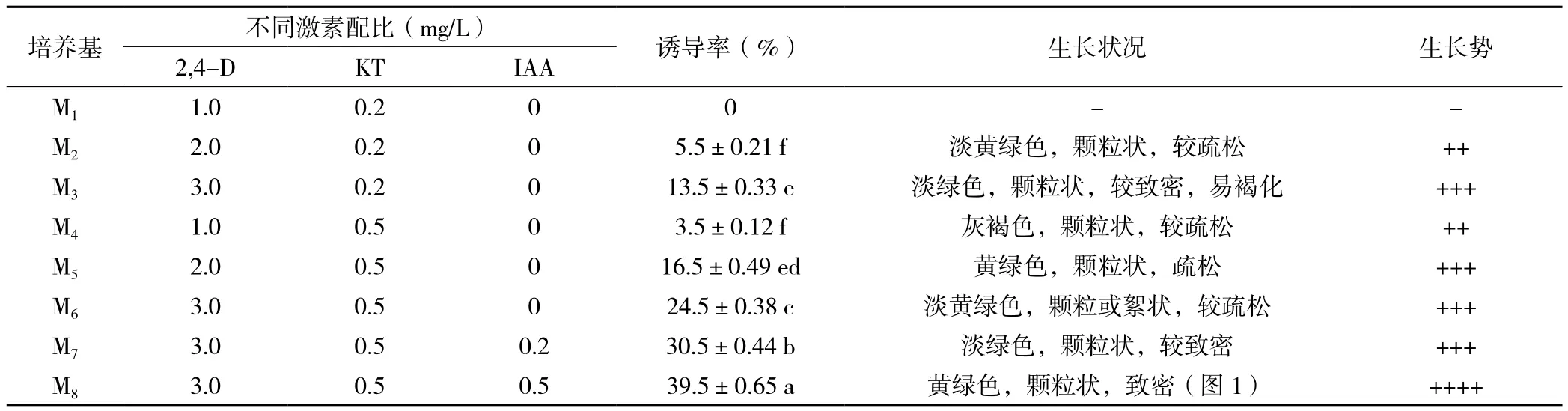
表1 不同激素配比对桃儿七成熟胚愈伤组织诱导的影响

图1 种子胚诱导的愈伤组织
2.1.2 不同激素配比对桃儿七无菌苗子叶和胚轴愈伤组织诱导的影响适宜浓度的激素组合对桃儿七无菌苗子叶和胚轴愈伤组织的发生能产生一定的诱导效应。由表2可知,在培养基L2和L5中,子叶的诱导率分别达到了12%和16%,对愈伤组织的产生有较好的诱导效应;添加了IAA的L7和L8中,其出愈率均有较大提高,分别比L5提高了71.88%和28.13%,诱导效应显著高于其他激素组合处理(P<0.05);并且L7中,愈伤组织呈淡黄绿色,颗粒状,生长势好(图2A)。由表3可知,不同激素组合处理下,胚轴的诱导率均较低,但与子叶诱导愈伤组织的效应相同的是,L7的诱导效应较其他组合处理显著增强(P< 0.05),且愈伤组织生长势相对较好(图2B)。
2.2 不同外植体对愈伤组织诱导的影响
如表4可知,桃儿七的种子成熟胚及无菌苗的胚轴、子叶均可诱导形成愈伤组织,但其诱导率有一定差异。其中,成熟胚、胚轴和子叶的诱导率分别为39.5%、9.5%和27.5%,与胚轴和子叶相比,成熟胚可显著提高愈伤组织的诱导率,极显著优于胚轴和子叶(P<0.01)。接种20 d后,观察愈伤组织的生理形态发现:成熟胚诱导的愈伤组织呈黄绿色的颗粒状;胚轴诱导的愈伤组织呈翠绿或黄绿色,形态为絮状或颗粒状;子叶诱导的愈伤组织为绿色或黄绿色的致密颗粒。与子叶和胚轴诱导的愈伤组织相比,由成熟胚诱导的愈伤组织的质量和生长势均较好。
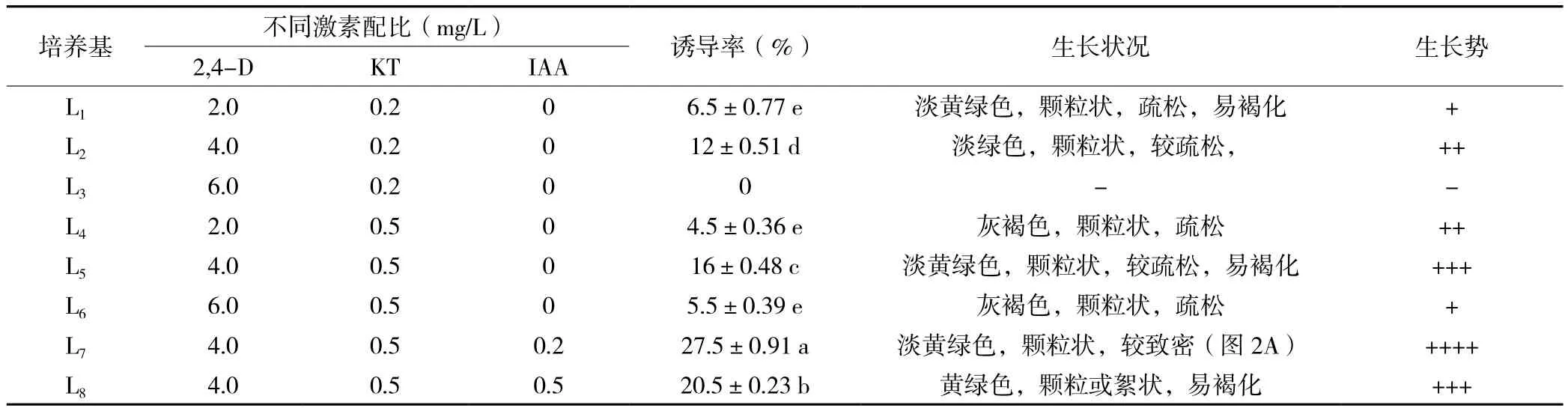
表2 不同激素配比对桃儿七无菌苗子叶愈伤组织诱导的影响

图2 子叶和胚轴诱导的愈伤组织

表3 不同激素配比对桃儿七无菌苗胚轴愈伤组织诱导的影响
2.3 不同浓度2,4-D处理对胚轴和子叶愈伤组织诱导的影响
由表5可知,在接种前,胚轴和子叶不进行2,4-D溶液浸蘸处理,则二者均不产生愈伤组织,用5 mg/L和10 mg/L 2,4-D浸蘸外植体,均可诱导愈伤组织的发生,其中以前者的诱导效应最显著。
3 结论与讨论

表4 不同外植体对愈伤组织诱导的影响
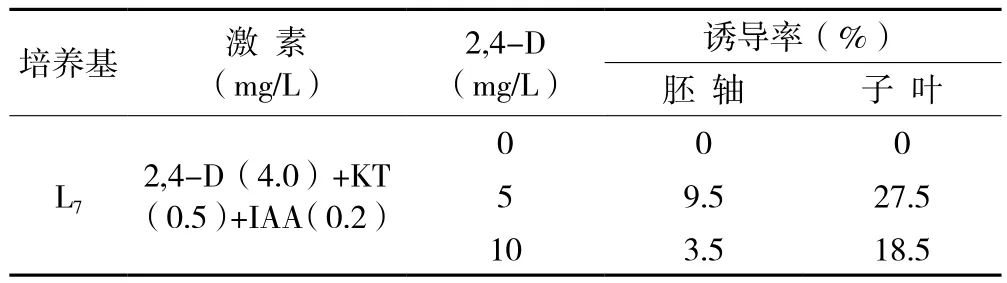
表5 不同浓度2,4-D处理对胚轴和子叶愈伤组织诱导的影响
在植物的组织培养过程中,影响其愈伤组织形成的因素主要有两个方面,一是所用的外植体类型,另一个是培养基中所使用的激素种类和浓度配比[25]。Gautheret[26]认为,一个分化了的植物细胞向分生状态恢复的程度,取决于它在自然部位上所具有的生理状态和其所处的位置。分化程度越高、离其生长中心越远的细胞,向分生状态恢复的可能性就越小。徐刚标[27]的研究也同样表明,银杏分化程度高的茎段和叶片比分化程度低的银杏子叶和胚轴诱导生成愈伤组织的难度更高。
试验结果显示:与子叶和胚轴相比,成熟胚更易诱导愈伤组织的形成,其诱导率分别比二者提高了43.64%和315.79%,并且愈伤组织生理形态和生长势较好,胚的愈伤组织诱导效果显著优于子叶和胚轴(P<0.01),这与Gautheret等的研究结果相一致;以胚为外植体,在2,4-D(3.0 mg/L)+KT(0.5 mg/L)+IAA(0.5 mg/L)组合处理的培养基中,其愈伤组织诱导率达到39.5%,愈伤组织呈黄绿色,形态为颗粒状,结构致密,生长势较好,而诱导子叶和胚轴形成愈伤组织的最佳激素配比为2,4-D(4.0 mg/L)+KT(0.5 mg/L)+IAA(0.2 mg/L)。来源不同的桃儿七外植体脱分化和愈伤组织的继代培养所需要的激素种类和浓度配比具有明显的差异,这表明所处不同生理阶段、不同部位的外植体在激素刺激后的反应类型和灵敏度是不同的,可以推断这可能主要取决于其外植体自身的内源激素水平,这是因为外源激素最终仍然需要通过内源激素水平的调整和变化而起作用[28-29]。Yamaday等[30]的研究表明,2,4-D能够使花粉原本正常的发育途径发生改变,它通过与染色质的组蛋白结合,使其DNA链脱离,从而使DNA链活化,导致DNA的大量复制,细胞分裂连续进行,最终形成愈伤组织。试验结果发现,接种前,用不同浓度的2,4-D溶液浸蘸子叶和胚轴可显著提高愈伤组织诱导率,甚至起到决定性作用,其中以5 mg/L 2,4-D的诱导效果最好。
研究中虽然获得了一定数量的愈伤组织,但其生长缓慢,分化能力较弱,继代培养很不稳定,褐化现象严重。减轻或控制褐变发生是桃儿七组织培养研究的重要内容,需进一步探索建立稳定高效的胚性愈伤组织细胞系,实现利用细胞培养的方法来获得鬼臼毒素的目的,进而为从根本上解决药用成分鬼臼毒素的社会供给问题,为濒危野生药用植物桃儿七自然资源的保护工作奠定坚实的基础。
[1] 虞 泓. 珍稀植物桃儿七[J]. 植物杂志,1999,(3):6.
[2] Xiao P G. Newly Compiled Record of Chinese Materia Medica[M].Beijing:Chemical Industry Press,2002.
[3] 吕丽芬,袁理春,杨丽云,等. 重要濒危保护植物桃儿七[J]. 云南农业科技,2006,(3):29.
[4] 孙彦君,李占林,陈 虹,等. 桃儿七化学成分研究[J].中药材,2012,35(10):1607.
[5] 刘 翔,赵纪峰,王昌华,等. 四川康定折多山濒危药用植物桃儿七群落主要种间联结性研究[J]. 中国中药杂志,2014,39(13):2473.
[6] 陈大霞,赵纪峰,刘 翔,等. 濒危药用植物桃儿七野生居群遗传多样性与遗传结构的Sco T分析[J]. 中国中药杂志,2013,38(2):278.
[7] 何晋武,祁永安,石利兵,等. 甘肃省中药材产业发展现状及对策研究[J]. 中国农业资源与区划,2011,32(5):60.
[8] 张杰雄,何 祥,杨 梅,等. 楚雄州中药材种植区划研究[J]. 楚雄师范学院学报,2013,28(6):84.
[9] 赵纪峰,刘 翔,王昌华,等. 珍稀濒危药用植物桃儿七的资源调查[J]. 中国中药杂志,2011,36(10):1255.
[10] Giri A,Narasu M L. Production of podophyllotoxin from Podophyllum hexanddrum:a potential natural product for clinically useful anticancer drugs[J]. Cytotechnology,2000,(34):17-26.
[11] 黄 坤,蒋 伟,赵纪峰,等. 濒危药用植物桃儿七中鬼臼毒素和总木脂素含量测定[J].中国中药杂志,2012,37(10):1360.
[12] 熊文勇,魏朔南,岳 明,等. HPLC分析桃儿七中鬼臼毒素的含量 [J]. 中成药,2010,32(5):875.
[13] Ian W Renner,David I Warton. Equivalence of MAXENT and poisson point process models for species distribution modeling incology[J].Biometrics,2013,69(1):274.
[14] 伍奥林,李 敏,张寿文,等. 地形因子对桃儿七鬼臼毒素含量的影响与生态适宜度研究[J].中国中药杂志,2015,40(12):2299-2303.
[15] Kadkade P G.Growth and podophyllotoxin production in callus tissues of Podophyllum hexanddrum[J]. Plant Sci Lett,1982,25 :107-115.
[16] Chattopadhyay S,Mehra R S,Srivastava A K,et al. Effect of major nutrients on podophyllotoxin production in Podophyllum hexanddrum suspension cultures[J]. Appl Microbiol Biotechnol,2003,(60):541-546.
[17] Saurabh C,Srivastava A K,Bhojwani S S,et al. Production of podophyllotoxin by plantcell cultures of Podophyllum hexandrumin in bioreactor[J].Biosc Bioeng,2002,93(2):215-220.
[18] Uden W van,Pras N,Visser J F,et al. Detection and identification of podophyllotoxin produced by cell cultures derived from Podoyhyllum hexandrum Royle[J].Plant Cell Reports,1989,8(3):165-168.
[19] Uden W van,Plas N,Malingre T M,et al. On the improvement of the podophyllotoxin production by phenylpropanoid precursor feeding to cell cultures of Podoyhyllum hexandrum Royles[J]. Plant Cell,Tissue and Organ Culture,1990,23(3):217-224.
[20] Uden W van,Bouma A S,Bracht W J F,et al. The production of podophyllotoxin and its 5-methoxy derivative through bioconversion of cyclodextrin-complexed desoxypodophyllotoxin by plant cell cultures[J].Plant Cell,Tissue and Organ Culture,1995,42(1):73-79.
[21] Chattopadhyay S,Srivastava A K,Bhojwani S S,et al. Development of suspension culture of Podoyhyllum hexandrum for production of podophyllotoxin[J]. Biotechnology Letters,2001,(23):2063-2066.
[22] 漆燕玲,栗孟飞,孙 萍,等. 桃儿七成熟胚的离体培养研究[J].生物学杂志,2008,25(4),39-41.
[23] 景 宁,康 晋,张耀宏,等. 桃儿七愈合组织的诱导及植株再生[J].浙江农林大学学报,2015,32(1):162-166.
[24] 杨 晖,王治业,陆 栋,等. 濒危药用植物桃儿七的愈伤组织诱导和悬浮培养及其鬼臼毒素含量分析[C]. 第八届全国药用植物及植物药学术研讨会,2009,07-25.
[25] 朱红威,邵菊芳,陶秀祥,等. 天然产物研究与开发[J]. 激素对银杏愈伤组织诱导及继代培养的影响,2008,(20):482-487.
[26] Gautheret R J. Cell Differentiation and Morphogenesis[J]. Amsterdam:North-Holland Publish Co,1966:55-95.
[27] 徐刚标,何 方,陈良昌. 银杏愈伤组织诱导与继代培养研究[J].中南林学院学报,1999,19(3):32-36.
[28] Dominigue L. Direct embryogenesis from microspores of Ginkgo biloba L. medicinal woody species[J]. Plant Cell Report,1993,(12):501-505.
[29] Webb D T,Arias W,Hostos E D. Callusformation by Ginkgo biloba embryoson hormone-freemedia controlled by closures andmedia components[J]. Phytomorph,1986,36(1):121-12.
[30] 许智宏. 植物生物技术[M]. 上海:上海科学技术出版社,1998,123-124.
Effects of Hormone on Callus Induction for Podophyllum hexandrum royle
LI Jin-juan1,TAO Zi-wei2,TAO Hai-xia1,LI Ting1
(1. Institute of Quality Standards and Testing Technology, GanSu Academy of Agricultural Sciences, Lanzhou 730070, PRC; 2. Information Technology Services of LanZhou University, Lanzhou 730050, PRC)
Embryos and cotyledon and hypocotyl of plantlets from Podophyllum hexandrum royle were used to establish callus cultures with MS medium with various hormones in order to study the effects of hormone on callus induction. The results indicated that the embryos callus induction rate could reach 39.5% under the interactions treatments of 3.0 mg/L 2,4-D+0.5 mg/L KT +0.5 mg/L IAA.4.0 mg/L 2,4-D+0.5 mg/L KT+0.2 mg/L IAA was the optimal hormone ratio selected for the cotyledon and hypocotyl callus induction. Mature embryos were more likely to induce callus formation than cotyledons and hypocotyls, which were 43.64% and 315.79% higher than those of the two. The induction effect was the most significant (P <0.001).The dipping of 5 mg/L 2,4-D for cotyledon and hypocotyl before the vaccination was increased the callus induction rate effectively.
Hormone; Podophyllum hexandrum royle; callus
Q943
A
1006-060X(2017)09-0006-04
10.16498/j.cnki.hnnykx.2017.009.002
2017-06-29
李金娟(1985-),女,甘肃兰州市人,研究实习员,主要从事植物发育生物学相关研究。
(责任编辑:夏亚男)
