酒驾血液乙醇含量测试最佳血储容器的选择探究
2017-10-24涂国章张显强
涂国章, 张显强
(贵州警官职业学院, 贵州贵阳 550005; 贵州省道路交通事故鉴定工程技术研究中心, 贵州贵阳 550005)
酒驾血液乙醇含量测试最佳血储容器的选择探究
涂国章, 张显强
(贵州警官职业学院, 贵州贵阳 550005; 贵州省道路交通事故鉴定工程技术研究中心, 贵州贵阳 550005)
目的 血储容器的选择对血液乙醇含量准确测试有重要影响,为真实测定酒驾人员血液乙醇含量,减少因存储容器不佳而造成测试结果的偏离,筛选最佳的血储容器供基层交管部门推广使用。方法 选取5种真空采血抗凝管,饮酒100 mL后30 min抽取人体静脉鲜血,于4~8 ℃冰箱冷藏保存,按0、3 d、7 d、14 d、21 d、28 d后用GC法测试血液乙醇含量,并对结果进行初筛。之后,选取其中含量检测结果准确性较好的抗凝管,采取酒后人体静脉鲜血后,于-20 ℃下冰柜保存,按0、3 d、7 d、14 d、21 d、28 d、35 d、42 d及49 d后GC法测试,并对测试结果进行统计分析及比较。结果 初筛EDTA-K2采血管、枸橼酸钠(1∶9)采血管、肝素钠采血管等3种采血管的血液乙醇含量检测结果的准确性比氟化钠- 草酸钾采血管和枸橼酸钠(1∶4)采血管要好。-20 ℃下冰柜保存结果显示EDTA-K2采血管的血液乙醇含量检测结果的准确性比枸橼酸钠(1∶9)采血管、肝素钠采血管均要好。其中,枸橼酸钠(1∶9)采血管、肝素钠采血管在35 d后结果有明显变化(P<0.05),而EDTA-K2采血管在49 d后结果与初测含量几乎不变(P>0.05)。结论 本研究认为EDTA-K2采血管为酒驾最佳血储容器,氟化钠- 草酸钾采血管和枸橼酸钠(1∶4)采血管不宜作为血储容器。
血储容器; 真空采血抗凝管; 气相色谱; 探究
0 引言
酒后驾车极易导致交通事故[1-2]。新《道路交通安全法》对饮酒后驾车有着不同的处罚标准,血液乙醇含量的高低直接影响交管部门对酒驾人员的判罚。而血储容器合理的选择对检测结果准确性有直接的影响, 筛选最佳的血储容器具有重要的应用价值。现行的血储容器即真空采血管有9种,基层交管部门用于采取疑似酒驾人员血样送检至鉴定机构的9种采血管都较常见,缺乏统一规范且相关行业标准中也没有明确规定[3]。
众所周知,不同采血管因是否具有真空条件及储存不同血样时,对血液乙醇稳定性有影响[4-5],这样势必会影响血液乙醇含量测试结果,对疑似酒驾人员的认定会造成偏差。因此,血储容器的选择统一规范迫在眉睫。据实践和资料显示,真空采血普通管、促凝管、惰性分离胶促凝管及含肝素锂的惰性分离胶管等作为血储容器,短时间内很容易使血液凝固,同时分离胶管在制作过程中本身残留有乙醇成分,从而影响血液乙醇含量测试结果,故实践中在血储容器的选择上倾向于选择真空采血抗凝管[6]。然而真空采血抗凝管有多种,分别有EDTA采血管、枸橼酸钠1∶9采血管(柠檬酸钠1∶9)、肝素采血管、枸橼酸钠1∶4采血管(柠檬酸钠1∶4)、氟化钠- 草酸钾采血管等,究竟哪种是最佳的血储容器目前没有资料记载,相关行业标准也没有规定。因而本实验对多种真空采血抗凝管储血乙醇含量变化进行选择性研究,筛选最佳的血储容器,尽可能减小血储容器对血液乙醇含量测试的影响,对获取真实的酒驾血液乙醇检测结果具有重要的意义。
1 材料与方法
1.1 样本来源
选择健康成年男性30人,在酒后30 min后至实验室抽取静脉鲜血[7],血样分别储存于5种真空采血抗凝管中,即枸橼酸钠1∶9采血管(柠檬酸钠1∶9)、EDTA-K2采血管、肝素钠采血管、枸橼酸钠1∶4采血管(柠檬酸钠1∶4)、氟化钠- 草酸钾采血管,立即测量各管的初始乙醇含量,选取其中乙醇浓度≥20 mg/100 mL且数值接近的血样为研究样本,每种管选取10份,共50份,然后在冰箱(4~8 ℃)中冷藏保存。5种抗凝管分别依次编为A、B、C、D、E,每种抗凝管各取10只,分别标记为1~10号。在此基础上,选择血液乙醇含量检测结果准确性较好的3种采血管:枸橼酸钠1∶9采血管(柠檬酸钠1∶9)、EDTA-K2采血管、肝素钠采血管,编号依次为S、Z、R,并各选取10份乙醇浓度≥20 mg/100 mL且数值接近的血样在-20 ℃下冰柜保存,每种管的10只管同样分别标记为1~10号。
1.2 仪器和色谱条件[8]
岛津GC-2010 plus型气相色谱仪、顶空自动进样器(岛津HS-20)。色谱条件:色谱柱1和2:均为Rtx-BAC1,30 m×0.32 mm毛细柱;柱温为40 ℃,进样口温度150 ℃;柱流量5 mL/min,吹扫流量3 mL/min;分流比6.4。检测器FID1和FID2:温度为250 ℃。顶空进样:恒温炉温度为65 ℃;样品流路温度为105 ℃;传输线温度为110 ℃;样品瓶恒温时间为10 min;样品瓶加压时间为0.3 min;加压平衡时间0.3 min;导入时间0.8 min;导入平衡时间0.4 min;进样时间为0.5 min;进样针冲洗时间0.4 min。
1.3 样本的测定
1.4 统计学分析
应用SPSS 20.0 进行统计分析,采用重复测量数据的方差分析。检测水准α≈0.05[9]。
2 结果
2.1 4~8 ℃冰箱冷藏下5种采血管中血液乙醇含量在各测试时间段的比较
2.1.1 5种采血管间血液乙醇含量比较
5种采血管的血液乙醇含量检测结果有统计学意义(F=392.811,P<0.01)。5种采血管中,A、B、C 3种采血管之间无显著性差异(p>0.05),D、E采血管与A、B、C 3种采血管之间有显著性差异(p<0.05)。具体见表1,表2。

表1 5种采血管中血液乙醇浓度 mg/100 mL
2.1.2 5种采血管血液乙醇含量随时间的动态趋势
从趋势图1、图2显示;A、B、C即枸橼酸钠1∶9管(柠檬酸钠1∶9)、EDTA-K2管、肝素钠管这3种采血管的血液乙醇含量在0~14 d内检测结果的准确性比D、E即枸橼酸钠1∶4管(柠檬酸钠1∶4)和氟化钠- 草酸钾管这2种采血管要好。但14 d后含量都显著下降(P<0.05),其中D管即枸橼酸钠1∶4采血管(柠檬酸钠1∶4)7 d后显著下降(P<0.05),E试管即氟化钠- 草酸钾采血管3 d后显著下降(P<0.05),因此,D、E 2种管不宜作为血储容器。
2.2 -20 ℃冰柜保存下3种采血管中血液乙醇含量在各测试时间段的比较
2.2.1 3种采血管间血液乙醇含量比较
3种采血管的血液乙醇含量检测结果有统计学意义(F=221.051,P<0.01)。S、R、Z这3种采血管之间有显著的统计学差异(P<0.05)(见表3,表4)。
2.2.2 3种采血管血液乙醇含量随时间的动态趋势
从趋势图3可知,EDTA-K2采血管(Z)的血液乙醇含量检测结果准确性比枸橼酸钠(1∶9)采血管(S)和肝素钠采血管(R)均要好。
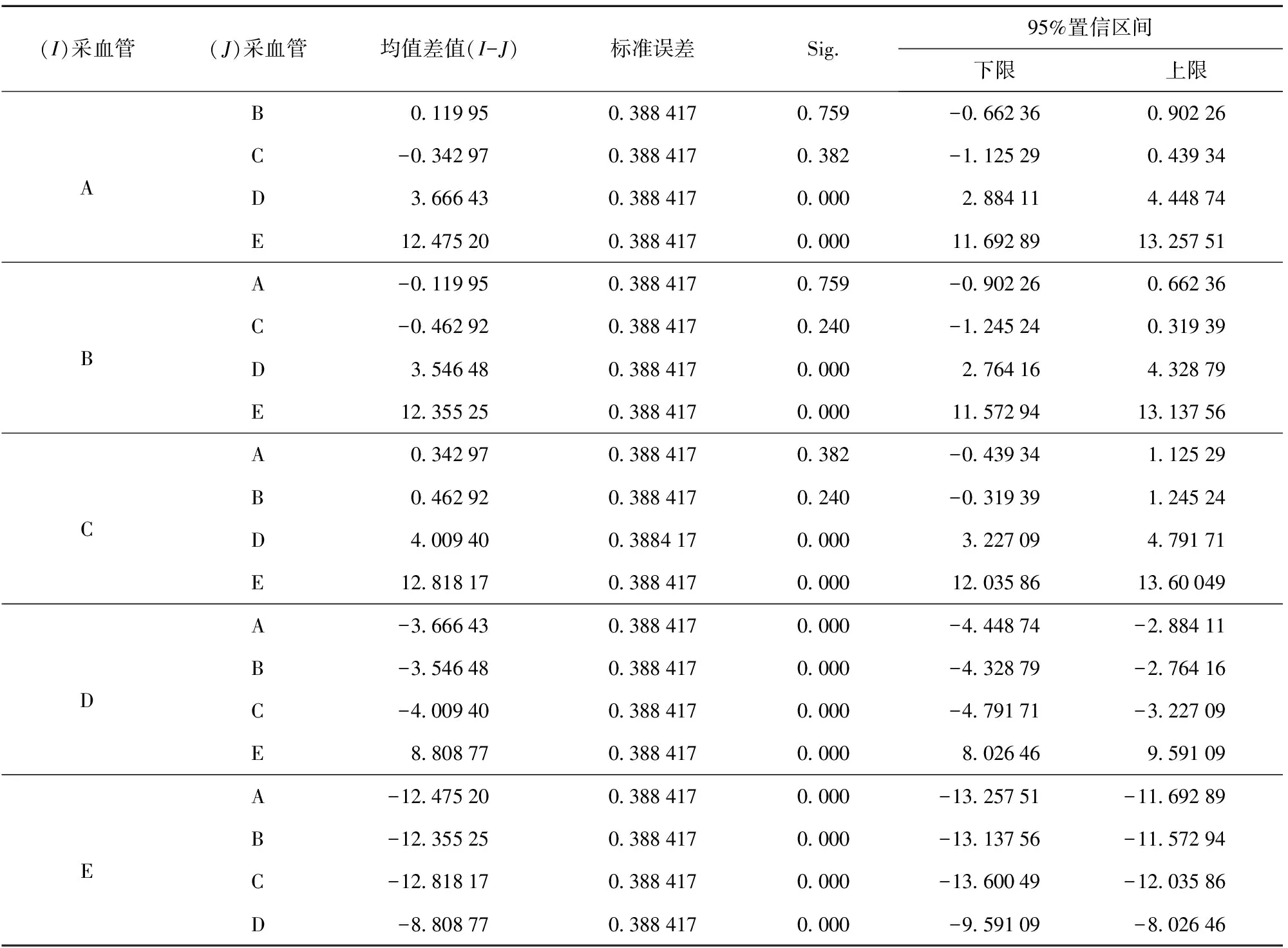
表2 5种采血管间血液乙醇含量比较
(注;4~8 ℃温度冰箱冷藏保存下各管的标记,A:柠檬酸钠(1∶9)采血管、B:EDTA-K2采血管、C:肝素钠采血管、D:柠檬酸钠(1∶4)采血管、E:氟化钠- 草酸钾采血管)
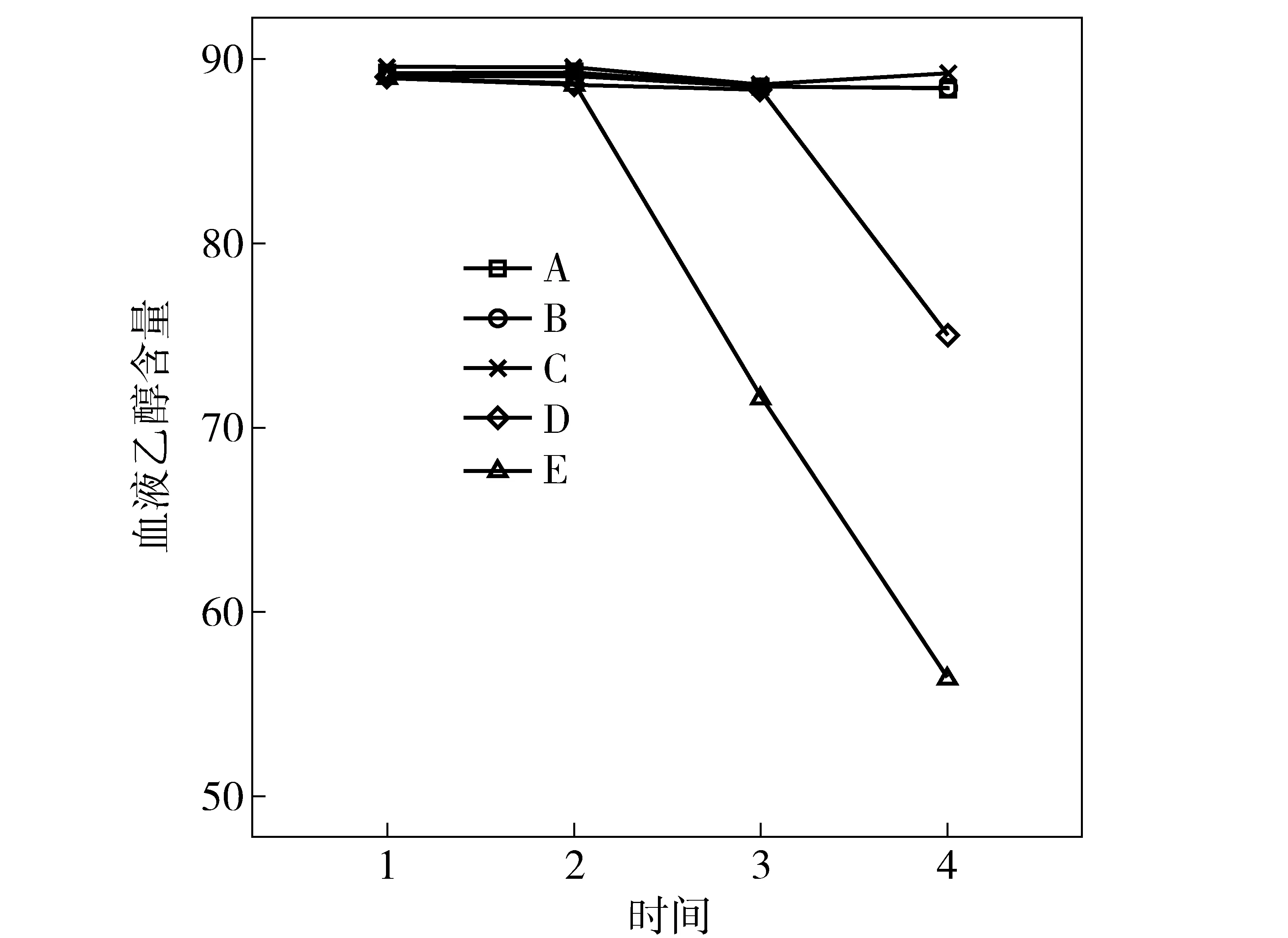
图1 5种采血管血液乙醇含量随时间变化趋势图
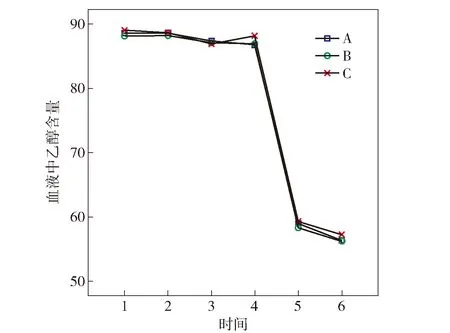
图2 3种采血管血液乙醇含量随时间的变化趋势图
因此,综合2.1和2.2结果显示:虽然4~8 ℃冰箱冷藏下5种血储容器中EDTA-K2采血管、枸橼酸钠1∶9采血管(柠檬酸钠1∶9)、肝素钠采血管在14 d内血液乙醇含量检测结果的准确性较好。可因冰箱容积本身的限制以及4~8 ℃冰箱冷藏下,随时间的延长各采血管中血液乙醇含量都会变化。实践中血样宜长时间保存在-20 ℃冰柜中。再从-20 ℃温度冰柜保存下EDTA-K2管、枸橼酸钠1∶9管(柠檬酸钠1∶9)、肝素管3种采血管血液乙醇含量随时间的变化来看,EDTA-K2采血管血液乙醇含量检测结果的准确性最好。因此本研究认为EDTA-K2采血管为酒驾血液乙醇含量测试最佳的血储容器。
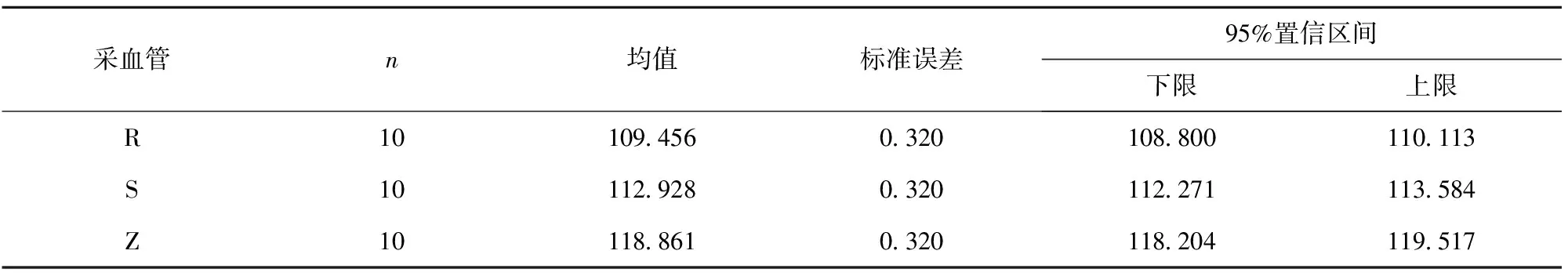
表3 3种采血管中血液乙醇浓度 mg/100 mL
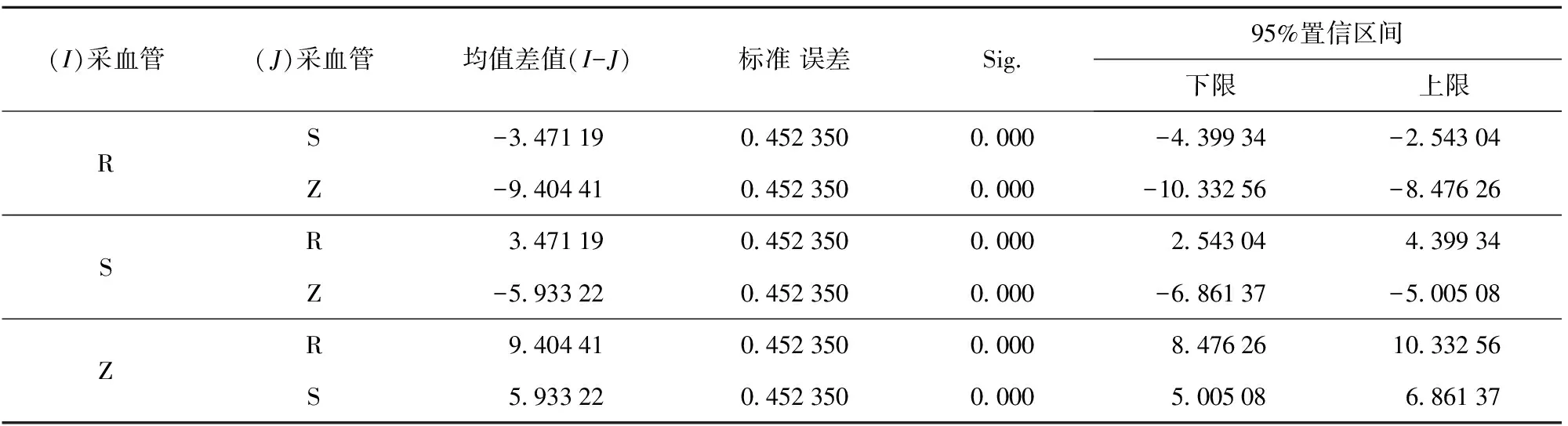
表4 3种采血管间血液乙醇含量比较
注:-20 ℃冰柜保存下各管的标记;S:枸橼酸钠(1∶9)采血管、R:肝素采血管、Z:EDTA-K2采血管)
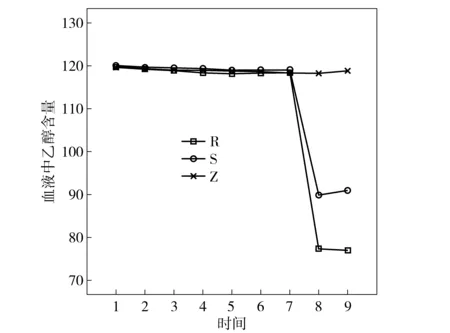
图3 3种采血管血液乙醇含量随时间变化趋势图(注t1-0d,t2-3d,t3-7d,t4-14d,t5-21d,t6-28d,t7-35d,t8-42d,t9-49d)
3 讨论
酒后驾车可增加发生交通事故的比例[10]。血液乙醇含量的检测结果是各国以法律判定酒后或醉酒驾驶行为的重要依据[11]。以往研究发现,检测方法、血储容器等因素均有可能对血液乙醇检测结果造成影响[12-15]。就检测方法而言,随着仪器分析的发展,气相色谱法中顶空气相色谱法因操作简单,稳定性好,定量结果更为准确,被普遍使用。然而,血储容器在相关行业标准中没有严格规定,国内外资料中也少有涉及[3],因而基层交管部门在使用采集容器时五花八门,势必会影响血液乙醇含量的准确测定,进而影响司法公正评判。为避免血储容器对结果准确性的影响,虽然以往研究中倾向于推荐使用真空采血抗凝管为血储容器,但抗凝管中哪种为最佳并未涉及[6]。本研究通过对常见的5种真空采血抗凝管进行筛选, 4~8 ℃温度冰箱冷藏保存下EDTA-K2管、枸橼酸钠1∶9管(柠檬酸钠1∶9)、肝素钠管这3种采血管的血液乙醇含量检测结果的准确性比枸橼酸钠1∶4 管(柠檬酸钠1∶4)和氟化钠(草酸钾)管均要好。但14 d后血液乙醇含量都明显下降,其中枸橼酸钠1∶4 管(柠檬酸钠1∶4)7 d后显著下降,氟化钠(草酸钾)管3 d后显著下降,这两种采血管因短时间内会导致血液乙醇含量发生较大变化,血液乙醇含量检测结果的准确性较差,均不宜作为血储容器。可由于4~8 ℃冰箱冷藏只能短时间保存血样,一方面是冰箱冷藏容积有限不能储存更多血样,另一方面该温度下保存血样,随着时间的延长所有管中的血液乙醇浓度均会呈现明显变化,因而在4~8 ℃冰箱冷藏室内不宜长时间保存血样。据资料显示,针对含有乙醇的血液样品,保存以冰冻最好,冷藏次之[5],鉴于此,本研究将4~8 ℃在冰箱冷藏室内保存的血液乙醇含量检测结果准确性较好的EDTA-K2管、枸橼酸钠1∶9管(柠檬酸钠1∶9)、肝素钠管这3种采血管于-20 ℃冰柜保存并测试,结果显示:在-20 ℃冰柜保存条件下,这3种采血管都能较长时间保持血液乙醇含量检测结果的准确性,其中枸橼酸钠(1∶9)采血管和肝素钠采血管在42 d后结果有明显变化,而EDTA-K2采血管在49 d后结果与初测含量几乎不变。不过相比较而言,枸橼酸钠(1∶9)采血管和肝素钠采血管的血液乙醇含量检测结果的准确性均不如EDTA-K2采血管。由此可见,血样宜在-20 ℃冰柜中长时间保存,同时可知不同抗凝剂对血液乙醇含量检测结果有影响,以上5种真空采血抗凝管以EDTA-K2采血管做血储容器最优,其次为枸橼酸钠(1∶9)采血管和肝素钠采血管,而枸橼酸钠1∶4采血管(柠檬酸钠1∶4)和氟化钠(草酸钾)采血管不宜作为血储容器。另外,有关检测中血液乙醇含量变化,可能因保存过程中微生物分解、自身挥发等而减少,或因血液腐败导致自身产生乙醇成分而升高[16]。由于本研究采集的是鲜血,加之血储容器处于真空密闭和低温状态,能有效防止外部微生物的进入,从而被微生物污染造成乙醇含量增加的可能性小,同时有效防止乙醇因挥发造成乙醇含量降低的可能性。因此可不考虑血液腐败、微生物分解和挥发产生的影响,至于检测中血液乙醇浓度下降的原因虽有报道与稀释比例等因素有关[17],但下降机理还需进一步研究。
综上所述,血储容器对于血液样本乙醇浓度检测结果有影响,所研究的5种真空采血抗凝管中EDTA-K2采血管作为血储容器时其血液乙醇含量检测结果的准确性最好,因而本研究认为EDTA-K2采血管为酒驾血液乙醇测试最佳的血储容器。建议交警部门在按照规定抽取涉嫌酒驾人员血样后保存于EDTA-K2采血管中送检,确保血液乙醇测试结果的准确性。
[1] IMPINEN A, MAKELA P, KARJALAINEN K, et al. High mortality among People suspected of drunk-driving. An 18-year register-based follw-up[J]. Drug Alcohol Depend, 2010, 110(1-2): 80-84.
[2] ZIAVROU K, BOUMBA V A, VOUGIOUKLAKIS T G. Insights into the origin of postmortem ethanol[J]. International Journal of Toxicology, 2005, 24(2): 69-77.
[2] Ziavrou K,Boumba V A,Vougiouklakis T G. Insights into the origin of postmortem ethanol[J]. Int J Toxicol,2005,24 (2):69-77.
[3] 中华人民共和国公安部. 公安部关于公安机关办理醉酒驾驶机动车犯罪案件的指导意见[EB/OL](2011-08-11)[2015-01-16]. http:∥wenku.baidu.com/view/916a960202020740be1e9b49.html.
[4] 马栋,卓先义,卜俊,等.血液中乙醇保存稳定性研究[J].法医学杂志,2007,23(2):117-119.
[5] 陈渝,廖林川,颜有仪,等.血液样品中乙醇稳定性的实验研究[J].刑事技术,2007(2):12-14.
[6] 谢春,钟方前,吴敬杰,等.储存容器对血液乙醇浓度的影响[J].环境与职业医学,2012,29(7):443-445.
[7] 贾常明.驾驶员酒后血液酒精含量与时间关系研究[J].刑事技术,2009(2):21-23.
[8] 中华人民共和国国家标准委员会. 车辆驾驶人员血液、呼气酒精含量阈值与检验:GB19522—2010[S].北京:中国标准出版社,2011.
[9] 李灿.重复测量数据方差分析在SPSS16.0软件中的实现[J].统计与决策,2011(1):34-36.
[10] TAYLOR B, IRVING H M, KANTERES F, et al. The more you drink, the harder you fall: a systematic review and meta-analysis of how acute alcohol consumption and injury or collision risk increase together[J]. Drug Alcohol Depend, 2010, 110(1-2): 108-116.
[11] WINEK C L, BAUER J, WAHBA W W, et al. Blood versus synovial fluid ethanol concentration in humans[J]. Journal of Analytical Toxicology, 1993, 17(4): 233-235.
[12] 李明,曹峻华,黄伟,等.交通事故酒精检测结果及其影响因素[J].中国法医学杂志,2014(5):507-508.
[13] 甄广怀.不同浓度、不同放置保存方式对测定血液乙醇浓度的影响[J].重庆医学,2010(12):1596-1597.
[14] 李萱,汪炜,孟祥志.人体血液酒精浓度检测的影响因素[J].基层医学论坛,2014(22):2993-2995.
[15] 张权,陈文生,洪亮.人体内乙醇含量检测的影响因素分析[J].中国法医学杂志,2014(2):128-130.
[16] 刘兆,杨瑞琴,温永启,等. 腐败血液中乙醇的顶空气相色谱分析[J]. 中国司法鉴定,2010(4):26-28.
[17] 刘冬娴,贺江南.采血管中添加剂对血样中乙醇含量的影响[J].法医学杂志,2014(6):452-455.
(责任编辑于瑞华)
D918.93
贵州省道路交通事故鉴定工程技术研究中心研究项目([2015]10022)。
涂国章(1970—),男,贵州德江人,副教授。研究方向为微量物证、毒物毒品的分析与研究。
