富氢水后处理对大鼠肾脏缺血再灌注后抗氧化损伤作用及机制研究*
2017-10-23彭本君李艳玲
彭本君 李艳玲
(解放军第八十八医院肾内科,山东 泰安 271000)
富氢水后处理对大鼠肾脏缺血再灌注后抗氧化损伤作用及机制研究*
彭本君 李艳玲
(解放军第八十八医院肾内科,山东 泰安 271000)
目的 探讨富氢水后处理对抗大鼠肾脏缺血再灌注(IR)后氧化应激损伤的作用及其机制。方法 选择健康雄性SD大鼠30只,质量230~250 g,釆用随机数字表法分为3组(n=10),假手术组(Sham组)、缺血再灌注组(IR组)和富氢水组(HS组)。Sham组:腹正中切口开腹,游离两侧肾脏,分离并结扎右侧肾蒂,分离左侧肾蒂不予结扎,暴露手术野30 min后缝合;IR组:分离左侧肾蒂并用动脉夹阻断血流,30 min后恢复血液灌注,制备大鼠肾脏缺血再灌注模型;HS组:前期处理同IR组,再灌前即刻给与2%富氢水(10 ml·kg-1·d-1)灌肠。其余两组同法给与同等剂量生理盐水。造模成功后,各组分别于再灌后3 h、6 h、12 h、24 h采取血清标本,测定各组大鼠血尿素氮(BUN)、血清肌酐(SCr)、血清超氧化物歧化酶(SOD)、血清丙二醛(MDA)。结果 各组大鼠BUN和SCr水平与Sham组比较均明显升高(P<0.05)。IR组BUN和SCr水平随时间延长而逐渐升高,组间差异有统计学意义(P<0.05)。与IR组比较,HS组BUN和SCr各时间段水平均降低(P<0.05)。SOD和MDA结果显示:各组与Sham组比较,IR组大鼠SOD水平均明显降低,MDA水平均明显升高,差别有统计学意义(P<0.05)。与IR组比较,HS组SOD水平升高,MDA水平降低,差别有统计学意义(P<0.05)。结论 富氢水后处理对大鼠肾脏IRI可产生保护作用,作用机制可能是通过选择性抗氧化、抑制炎症因子释放来实现。
富氢水;肾脏;缺血再灌注损伤;后处理
缺血再灌注损伤(ischemia-reperfusion injury,IRI)由Jennings于1960年首先提出,是指在某些条件下,造成器官和/或组织缺血,当血液供应恢复后,器官组织损伤反而加重,甚至发生组织功能代谢及结构不可逆性损伤的现象[1]。肾脏 IRI 主要发生在创伤、休克、肾移植、泌尿外科手术等情况,如何有效地防治肾脏 IRI 成为学者们研究的热点。有报道,在器官缺血后,再灌前几分钟给予药物干预可以起到减轻器官IRI的作用,这种干预方法被称为药物后处理(pharmacological postconditioning,PPoC)[2]。现有的资料表明:氢气具有选择性抗氧化作用:即氢只与氧化作用很强的、造成细胞损害的自由基、如OH-和ONOO-直接相结合[3],从而对抗缺血性再灌注产生的氧自由基(ROS)。另外,氢气具有抑制器官炎症反应[4]、减低药物毒性的[5]作用。本研究通过建立大鼠肾脏IR模型并给与富氢水后处理,通过观察大鼠肾功能和血清学变化,探讨富氢水后处理对肾脏IRI的保护作用,为富氢水后处理在肾脏科的临床实践提供依据。
1 资料和方法
1.1实验动物
实验动物为Sprague-Dawley(SD)雄性大鼠30只,周龄6~8周,体重230~250 g,由泰山医学院实验动物中心提供。均饲养于恒温(18~22 ℃)、恒湿(40%~70%)环境,保持空气流通,分笼饲养一周,每笼各5只,使大鼠适应环境。自由饮水及进食,使用超滤去菌饮水和钴60灭菌饲料。术前12 h禁食,自由饮水。
1.2动物模型的建立
所有动物用10%水合氯醛腹腔注射麻醉(0.35 ml/100 g),固定手术台,手术区去毛,常规碘伏消毒铺巾,腹部正中切口,逐层切开皮肤、腹直肌联合腱及腹膜,打开腹腔后暴露左、右肾脏。分离肾蒂周围组织游离右侧肾蒂并进行结扎,消除其缺血代偿作用。而后暴露左侧肾脏,分离肾蒂周围组织,暴露肾蒂结构,分离并提起肾动脉。经手术处理后,各组手术方法如下:Sham组(n=10):不做处理,暴露30 min后逐层缝合腹壁;IR组(n=10):用动脉夹将左侧肾动脉夹闭,肾脏由鲜红色变为暗紫色,夹闭30 min后再开放动脉,肾脏由暗紫色逐渐变为紫红色,造模成功;HS组(n=10):在IR组模型的基础上,于开放动脉再灌后即刻给予2%富氢水灌肠(10 ml·kg-1·d-1),恢复正常血液供应。缺血期间大鼠模型用无菌生理盐水纱布覆盖创面,以减少内脏暴露及体液流失。各组模型制作完毕后,逐层缝合、关闭腹腔,置于手术前笼中饲养。
1.3标本留取及处理
上述3组大鼠在造模成功后,每组分别随机选取5只大鼠,于持续再灌注3 h、6 h、12 h、24 h留取血液标本,留取血液标本采用尾尖采血法:10%水合氯醛麻醉后固定,用45 ℃温水浸泡大鼠尾部,见血管充盈后,酒精棉球消毒,灭菌手术剪剪去尾尖10 mm,血液从尾尖排出,用负压肝素锂抗凝采血管收集血液标本约2 ml,室温静置后放入4 ℃冰箱过夜,用离心机以3000 rpm离心 10 min,吸取全部上清液、标记、-80 ℃冰箱冷冻备检。血尿素氮(BUN)检测采用脲酶法,血清肌酐(SCr)检测采用苦味酸法,超氧化物歧化酶(SOD)活性检测采用羟胺法,丙二醛(MDA)检测采用硫代巴比妥酸法。
1.4统计学处理
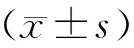
2 结 果
2.1各组大鼠BUN监测结果
与Sham组比较,IR各组BUN水平均明显升高,差异显著(P<0.05)。IR各组组内BUN水平随时间延长而升高(P<0.05)。与IR组相比较,HS组BUN水平均降低(P<0.05),差异具有统计学意义。见表 1。
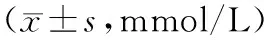
表1 各组大鼠BUN检测结果
注:△:与Sham组比较P<0.05;▲与IR组比较P<0.05。
2.2各组大鼠SCr检测结果
参照Sham组,IR组SCr水平均明显升高(P<0.05)。IR各组组内SCr随缺血时间延长而升高(P<0.05)。与IR组相比较,HS组SCr各组水平均降低(P<0.05),差异有统计学意义。见表2。
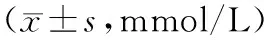
表2 各组大鼠SCr检测结果
注:△:与Sham组比较P<0.05;▲:与IR组比较P<0.05。
2.3各组大鼠SOD结果
参照Sham组,IR各组SOD活性水平明显降低(P<0.05)。IR各组组内SOD水平随时间延长而减低(P<0.05),差异有统计学意义。见表3。

表3 各组大鼠SOD检测结果
注:△:与Sham组比较P<0.05;▲与IR组比较P<0.05。
2.4各组大鼠MDA监测结果 与Sham组比较,IR各组MDA均明显升高(P<0.05)。IR组内MDA水平随时间延长而升高(P<0.05)。与IR组相比较,HS组MDA总体水平均减低(P<0.05),差异有统计学意义。(见表4)
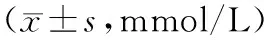
表4 各组大鼠MDA检测结果
注:△:与Sham组比较P<0.05;▲与IR组比较P<0.05。
3 讨 论
1960年缺血再灌注损伤(ischemia-repeifusion injury,IRI)的概念提出之后,直到20世纪80年代,IRI才逐渐在文献中见到。缺血性再灌注造成氧化和抗氧化水平失衡,可以产生大量的氧自由基(oxygen free radical,OFR),OFR可以攻击脂质、蛋白质及核酸等多种组织结构[6],引起生物膜中不饱和脂肪酸的过氧化,引起细胞代谢及功能障碍、甚至死亡:(1)对蛋白质、酶的损伤,导致蛋白质变性、功能丧失和酶失活;(2)对核酸和染色体的破坏,导致DNA链的断裂、染色体的畸变;(3)破坏细胞外基质,使其变得疏松、弹性下降,导致组织器官功能损伤[7]。在正常情况下,细胞中存在正常量的OFR,不会造成细胞损伤,并能被细胞内的抗氧化物质(如SOD)及时清除,从而达到氧化——抗氧化的动态平衡。而自由基的代谢产物丙二醛(MDA)含量可反应机体内脂质过氧化的程度,间接地反映机体细胞受自由基攻击的严重程度和损伤程度。氢是自然界存在最多、最简单的元素,占宇宙物质组成的90%左右,具有无色、无味、具有一定还原性的双原子气体,是宇宙最基本的化学元素。氢气是一种优质的抗氧化物质,具有无毒、无残留、制备容易,且为非兴奋剂、非药物等特点。日本学者采用化学反应、细胞学等手段证明氢气具有选择性抗氧化作用[8]。国内学者孙学军等通过实验及临床研究证实,人体只需要呼吸氢气或饮用富氢水,就可以对诸如心、脑、肝、肾、肺、小肠等缺血再灌注损伤(I/R)与心脏器官移植后的炎症损伤等具有显著的抑制作用,对糖尿病、中风、慢性氧化应激性疾病具有明显的治疗作用[9-11]。纵览以往研究发现,有关氢的抗氧化作用的医学实验集中于诸如器官缺血再灌注损伤(I/R)[8]、减轻神经损伤[12]、抑制器官炎症反应[13]、减低药物毒性[14],治疗小鼠基因缺陷[15]、帕金森病[16]以及人类II型糖尿病[17]等慢性氧化应激损伤与疾病。
本研究采用SD大鼠制作动物模型,手术切口选择腹白线切口的方式,手术野暴露充分,易于操作,手术遵守无菌操作可降低围手术期感染率。预实验时发现预实验中发现,左侧肾蒂更易于暴露和游离,故最终实验选择了结扎右侧肾蒂防止代偿性作用影响血清学结果、夹闭左侧肾动脉的方法造模,有异于传统的肾蒂阻断。从肾脏缺血再灌注损伤后机体抗氧化方面探讨富氢水的作用。通过研究再灌注后肾脏细胞血清学(BUN、SCr、SOD、MDA)变化,探寻富氢水选择性抗氧化的客观依据,从而为进一步深入研究氢对抗再灌注损伤的内在机制以及富氢水的临床应用奠定理论基础。
[1] Jennings RB,Sommers HM,Smyth GA,et al.Myocardial necrosis induced by temporary occlusion of a coronaryartery in the dog[J].Arch.Pathol,1960,70:68-78.
[2] Obal D,Dettwiler S,Favoccia C,et al. The influence of mitochondrial KATP-channels in the cardioprotection of preconditioning and postconditioning by sevoflurane in the rat in vivo[J].Anesth Analg,2005,101(5):1252-1260.
[3] 林辉,张祥贵.三七总皂苷预处理对急性期缺血再灌注肾脏的保护作用[J].贵州医药,2017, 41(2):124-126.
[4] 孙丰伟,韩玉刚,等.富氢水预处理对大鼠肝缺血再灌注损伤的保护研究[J].泰山医学院学报,2014,35(10):984-987.
[5] Nagata K,Nakashima-Kamimura N,Mikami T,et al.Consumption of Molecular Hydrogen Prevents the Stress-Induced Impairments in Hippocampus-Dependent Learning Tasks during Chronic Physical Restraint in Mice[J].Neuro psychopharma- cology,2009,34(2):501-508.
[6] 王聪,王程.白藜芦醇对大鼠肾脏缺血再灌注损伤的保护作用[J].天然产物研究与开发,2017,29:831-835.
[7] Ji LL,Gomez-Cabrera MC,Vina J.Exercise and hormesis:activation of cellular antioxidant signaling pathway[J]. Ann.N.Y.Acad.Sci,2006,1067:425-435.
[8] Ohsawa I,Ishikawa M,Takahashi K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med,2007,13:688-694.
[9] Chen Y,Jiang J,Miao H,et al.Hydrogen-rich saline attenuates vascular smooth muscle cell proliferation and neointimal hyperplasia by inhibiting reactive oxygen species production and inactivating the Ras-ERK1/2-MEK1/2 and Akt pathways[J].Int J Mol Med, 2013,31:597-606.
[10] Manaenko A,Sun XJ,Kim CH,et al. PAR-1 antagonist ameliorates apoptosis following surgical brain injury through inhibition of ASK1-JNK in rats[J]. Neurobiol Dis,2013,50:13-20.
[11] Tan M, Sun X, Guo L,et al. Hydrogen as additive of HTK solution fortifies myocardial preservation in grafts with prolonged cold ischemia[J]. Int J Cardiol, Jan 19, 2012.
[12] Cai JM,Kang ZM,Liu K,et al.Neuroprotective effects of hydrogen saline in neonatal hypoxia- ischemia rat model[J].Brain Res,2009,1256(23):129-137.
[13] Buchh-lz BM,Kaczorowski DJ,Sugimoto L,et al.Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury[J].Am d Transplant,2008,8:2015-2024.
[14] Nagata K,Nakashima-Kamimura N,Mikami T,et al.Consumption of Molecular Hydrogen Prevents the Stress-Induced Impairments in Hippocampus-Dependent Learning Tasks during Chronic Physical Restraint in Mice[J].Neuro psychopharma- cology,2009,34(2):501-508.
[15] Sato K,Kajiyama S,Amano A,et al.Hydrogen-rich pure water prevents superoxide formation in brain slices of vitamin C-depleted SMP30/GNL knockout mice[J].Biochem Biophys Res Commun,2008,375(3):346-350.
[16] Fu Y,Ito M,Fujita Y,et al.Molecular hydrogen is protective against 6-hydroxydopamine- induced nigrostriatal degeneration in a rat model of Parkinson’s disease[J].Neurosci Lett, 2009, 453(2):81-85.
[17] Kajiyama S,Hasegawa G,Asano M,et al.Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance[J].Nutr Res,2008,28(1):137-143.
The effects and mechanism research of post-conditioning with rich hydrogen water against oxidation of renal ischemia-reperfusion injury in rats
PENG Ben-jun LI Yan-ling
(Dept. of Nephrology, No. 88 Hospital of PLA,Taian 271000,China)
Objective:To investigate the effects of hydrogen-rich water treatment on post-oxidative stress injury in rats with renal ischemia reperfusion (IR) and its mechanism.Methods:30 healthy male SD rats, the quality of 230~250 g.With random number table method was divided into 3 groups(n=10), control group(Sham), ischemia reperfusion group(IR group) and hydrogen rich water group(HS).The ventral median incision in Sham group was opened, and the kidneys were dissociated, separated and ligated with the right kidney. The left kidney was not ligated, and the surgical field was closed after 30min.The renal ischemia-reperfusion model of rat kidney was prepared after 30 min of blood perfusion.The HS group was treated with the IR group and immediately gave 2% hydrogen rich water(10 ml·kg-1·d-1) enema before irrigation. The other two groups were given the same dose of saline.After the success of the building, each group respectively in reperfusion after 3 h, 6 h, 12 h, 24 h to serum specimens, the determination of each group rats blood urea nitrogen (BUN), serum creatinine(SCr),serum superoxide dismutase(SOD),serum malondialdehyde (MDA).Results:Both the BUN and SCr levels of rats in each group were significantly higher than those in Sham group(P<0.05).The level of BUN and SCr of IR group increased gradually with time, and the difference between groups was statistically significant(P< 0.05). Compared with IR group, the levels of the HS group BUN and SCr were reduced at each time period(P<0.05).The results of SOD and MDA showed that the SOD levels of the rats in IR group were significantly lower than those in the Sham group, and the MDA level was significantly higher, and the difference was statistically significant(P<0.05).Compared with IR group, SOD level of HS group increased, MDA level decreased, and the difference was statistically significant(P<0.05).Conclusion:the treatment of IRI in rats can be protected by hydrogen-rich water treatment, which may be achieved by selective antioxidation and inhibition of inflammatory cytokines.
hydrogen-rich suline;kidneys;ischemia reperfusion injury;post-processing
彭本君(1982—),男,山东泰安人,主治医师,硕士,主要从事临床肾内科工作。
李艳玲(1982—),女,主治医师,主要从事主要从事核素诊断工作。
R692
A
1004-7115(2017)10-1101-04
10.3969/j.issn.1004-7115.2017.10.007
2017-07-20)
