糖尿病患者进行洗涤式自体血回输过程中红细胞渗透脆性的研究*
2017-10-23孙丰伟
孙丰伟 李 铁 李 逵
(1.泰山医学院附属医院,山东 泰安 271000; 2. 新泰市天宝中心卫生院,山东 泰安 271200)
糖尿病患者进行洗涤式自体血回输过程中红细胞渗透脆性的研究*
孙丰伟1李 铁1李 逵2
(1.泰山医学院附属医院,山东 泰安 271000; 2. 新泰市天宝中心卫生院,山东 泰安 271200)
目的 观察洗涤式自体血回输过程中糖尿病患者回收红细胞的渗透脆性的变化,以及由此带来的机械性损伤。方法 择期术中采用血液回输机进行自体血回输的患者60例。根据有无合并糖尿病分为糖尿病组(D组,n=30),和对照组(C组,n=30),监测手术前、洗涤前、洗涤后红细胞的渗透脆性,测量回收血静置2 h、4 h、6 h、12 h、24 h后游离血红蛋白浓度和血钾水平。结果 同一处理条件下,手术前、洗涤D组患者的红细胞在0.36%~0.68%低渗液中的溶血率均高于C组(P<0.05),洗涤后差异无统计学意义(P>0.05),洗涤后回收血液静置时间越长游离血红蛋白和血钾浓度越高,与洗涤后即刻比较有明显差异(P<0.05),但在回收后同一时间点上,两组间指标无统计学差异(P>0.05)。结论 洗涤式自体回输过程中没有加重糖尿病患者红细胞的损伤程度,糖尿病患者使用自体血回输是安全的,但是回收血液应尽早回输,以减少红细胞溶血的发生。
糖尿病;自体血液回输;红细胞;渗透脆性
红细胞是血液中最主要的有形成分,约占血液体积的一半,红细胞的变化对血液循环,特别是微循环有重要的影响。1886年自体输血的概念被首次提出,直至1921年为临床接受。术中洗涤式自体血回输是通过回收手术野失血、洗涤、回输的一种适于急救、快捷的输血技术,该技术能明显减少异体血输入,降低感染、免疫抑制及输血反应等不良反应,在心血管手术、整形外科、神经外科、器官移植及急救创伤等领域已得到广泛应用[1]。糖尿病能引起红细胞变形指数降低,聚集指数增加,从而使红细胞渗透脆性增加,粘滞度增加,严重影响患者微循环,带来末梢循环、末梢神经损伤性疾病[2]。有研究表明,红细胞的存活率与渗透脆性改变相关[3],那么在糖尿病病人病理改变的基础上进行洗涤式自体血回输对红细胞渗透脆性是否影响有待观察。本研究对糖尿病患者在洗涤过程中的红细胞渗透脆性进行了评估,以期为糖尿病患者应用自体血回输技术提供科学依据。
1 资料与方法
1.1一般资料
择期手术治疗且需要洗涤式自体血液回输技术的患者60例,年龄18~65岁,平均(33±5.5)岁,排除心、肝、肾功能障碍病例;糖尿病诊断标准参照年美国《糖尿病学会指南》[4],确诊Ⅱ型糖尿病3~10年,无糖尿病并发症。根据有无合并糖尿病分为糖尿病组(n=30)合对照组(n=30)。经本院伦理委员会批准,征得家属同意并签署知情同意书。
1.2自体血回收方法
回输方法[5]:本组采用北京京精公司生产的ZT-2000型血液回收机。自体血液回收方法:(1)手术全过程将体腔积血及手术野出血收集到储血器中,输入抗凝剂(500 ml生理盐水加入低分子肝素100 mg)与回收血液混合,防止凝固。然后进行分离、生理盐水或林格氏液洗涤处理。细胞碎片、游离血红蛋白及抗凝剂等被分流到废液袋中,而后将纯净、浓缩的血细胞保留在血液袋内,在术中直接回输。
1.3血清学监测:
1.3.1手术前(T0)红细胞的渗透脆性、游离血红蛋白浓度和血钾水平监测 所有患者入手术室前抽取静脉血6 ml备检。
1.3.2洗涤前(T1)红细胞的渗透脆性、游离血红蛋白浓度和血钾水平监测 回收血袋内的血在采血前轻摇动使血液混匀后留取血液6ml备检。
1.3.3洗涤后(T2)红细胞的渗透脆性、游离血红蛋白浓度和血钾水平监测 洗涤后的红细胞悬液即刻取6 ml备检。
1.3.4静置2 h、4 h、6 h、12 h、24 h后游离血红蛋白浓度和血钾水平监测 分别取洗涤后的红细胞悬液6 ml置于5个试管中静置2 h、4 h、6 h、12 h、24 h后,利用K5600微量分光光度计测量红细胞渗透脆性,血气分析仪测定游离血红蛋白和血钾[6,7]。
1.4红细胞渗透脆性监测[8]
用天平称取医用盐,按浓度梯度配制0.36%~0.68%低渗盐溶液各2.5 ml加入试管中,另取2.5 ml生理盐水和2.5 ml蒸馏水于试管中。分别取各组血液样本各100 μl加入各低渗溶液试管中,反复混匀后离心,观察各管上清液的颜色,取上清液2 μl,依据手术前静脉血加入生理盐水试管的上清液为空白对照,采用K5600微量分光光度计测定540 nm波长处溶血后的吸光度值。计算溶血率:溶血率=样本吸光度值÷最大溶血吸光度值×100%。
1.5游离血红蛋白和血鉀监测
每个时间点血液6 ml放入的试管中,立即以3500转/分离心10 min,取上清液做游离血红蛋白和血钾检测。采用瑞尔达血浆游离血红蛋白试剂盒(北京),按照说明书进行检测。游离血红蛋白=测定管吸光度OD值/标准管吸光度OD值×100%。
1.6统计学处理
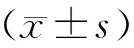
2 结 果
2.1两组红细胞术前、洗涤前和洗涤后在不同NaCl浓度时的渗透脆性比较 两组患者红细胞在术前、洗涤前溶血率组间比较差异均有统计学意义,而洗涤后差异无统计学意义;对照组组内比较差异无统计学意义,糖尿病组洗涤后溶血率较洗涤前有所降低。 说明糖尿病患者术前红细胞渗透脆性较正常人高,而洗涤式自体血回输并不增加糖尿病患者红细胞的溶血率(表1)。

表1 两组红细胞不同时间点在低渗浓度NaCl的渗透脆性比较
注:☆:与对照组比较P<0.05。
2.2回收血静置时间与游离血红蛋白和血钾的变化 两组患者回收血液随着留置时间延长血清游离血红蛋白浓度和血钾值逐渐增高,组内比较0 h、2 h、4 h、6 h、12 h、24 h差异均有统计学意义(P<0.05),同一时间点两组之间数据比较差异无统计学意义(P>0.05)。 说明糖尿病患者洗涤后血液红细胞脆性与正常人无明显差异,但洗涤后红细胞随留置时间越长红细胞破碎越多,提示回收血应尽早回输(表2,3)。
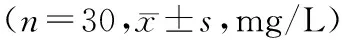
表2 两组洗涤后血液静置时间与游离血红蛋白的变化
注:a:与0h比较,P<0.05;b:与2h比较,P<0.05。
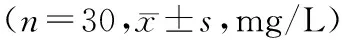
表3 两组洗涤后血液静置时间与血清钾的变化
注:a:与0h比较,P<0.05;b:与2h比较,P<0.05。
3 讨 论
1900年Lnadsteiner首先发现了人类存在不同血型,为异体输血奠定了理论基础。近年来,随着治疗用血量逐渐增多、血源日益紧张,临床输血供需矛盾日渐突出。所以,如何避免大量输入异体血、减少库血输血量及输血反应成为手术科室关注的焦点。自体血回输自然成为热门话题,在急诊患者救治过程中,血源紧张、配血困难时,自体血回输成为抢救患者生命的必然措施,而且,回输自体血避免了过敏、溶血等不良反应,不失为抢救患者的有效方法[9]。但是,多数医师认为自体血回输方法对非糖尿病患者红细胞影响较小[10],而糖尿病患者长期(3~10年)高血糖可以导致红细胞膜蛋白变性,使红细胞膜结构发生改变,导致红细胞变形能力降低,膜的渗透脆性增加,洗涤过程中可能引起红细胞碎裂。
红细胞的渗透脆性实验是根据细胞在低渗液中,由于水分子内渗导致细胞膨胀破裂的原理来确定的,当红细胞置于不同浓度低渗液中,其溶血率大小不同,红细胞渗透脆性由细胞膜结构及其形状的变化来决定,糖尿病引起的红细胞膜的过氧化及红细胞表面积增加均可以引起渗透脆性增加,导致红细胞变形能力的下降难以通过微循环管道,并且在洗涤过程容易受到破坏。本实验通过两组患者术前、洗涤前、洗涤后红细胞渗透脆性的变化的研究,提示洗涤式自体血洗涤、回输过程对合并糖尿病的红细胞渗透脆性影响较小,原因是自体血洗涤过程中,渗透脆性高的衰老红细胞在高速离心作用下发生破裂而被清除,获得的浓缩红细胞多数结构正常[11],说明洗涤式自体血回输方法可安全用于糖尿病患者的围手术期供血。
游离血红蛋白是红细胞裂解产生的蛋白,检查数值代表血浆中血红蛋白的含量,是当红细胞因为渗透脆性增加而破坏时,游离血红蛋白和钾水平自然升高,是检测红细胞破损程度的一个重要指标,可以间接反映经洗涤后的红细胞渗透脆性。所以本研究选择洗涤回输的红细胞静置不同时间后监测游离血红蛋白浓度和血钾值作为评估指标,结果显示洗涤后糖尿病患者红细胞的溶血程度较非糖尿病患者红细胞无明显差异,说明经过回输机洗涤后糖尿病患者红细胞的抗机械损伤能力接近正常,可较安全地应用于临床输血。
总之,洗涤式自体血回输可以安全应用于合并糖尿病出血的患者,尤其是Rh阴性患者能及时提供专门血型的自体新鲜红细胞,为患者的抢救赢取时间,节约库血血源。尤其适合偏远地区取血困难的基层医院,特别是艾滋病、传染病高发区更具有不可替代的社会价值。
[1] 林慧丹,张冯江,潘志浩,等.洗涤式自体血回输对糖尿病患者回收血红细胞渗透脆性的影响[J].中华医学杂志,2014,25(7):491-493.
[2] 付汉菁,潘素芳.糖尿病患者红细胞形态和渗透脆性的初步研究[J].中国微循环杂志,1998, 8(3):13-15.
[3] 关波,潘微.Trinder法检测血浆游离血红蛋白的应用探讨[J].中国输血杂志,2010,S1-9.
[4] American DA.Standards of medical care in diabetes-2013[J]. diabetes care,2013,36Suppl 11:11-66.
[5] 王自华,陈祥青.洗涤式自体血回输在外科急性失血手术中的应用价值[J].泰山医学院学报, 2016,37(10):1126-1128.
[6] Leary MF,Szklarski P,Klein TM,et al.Hemolysis of red blood cells after cell washing with different automated technologies:clinical implications in a neonatal cardic surgery population [J].Transfusion Practics,2011,51:955-960.
[7] Michael G,Anita B,Melanie F,et al.Washing of banked blood by three different blood salvage devices[J].Transfusion,2013,53:1001-1009.
[8] 周金锋,王朋,类维富.顺铂联合加热对体外血液中肝肿瘤细胞的杀灭作用及对红细胞的影响[J].中华麻醉学杂志,2011,31:193-196.
[9] 杨德勇,王俊勤.自体血回输在骨科手术中的应用价值[J].泰山医学院学报,2010,31(3): 205-206.
[10] 关波,潘微. Trinder法检测血浆游离血红蛋白的应用探讨[J]. 中国输血杂志,2010,23(S1):9.
[11] 李西慧,张明礼,崔虎军.冠状动脉旁路移植术中自体血液回收对红细胞的影响[J]中国胸心血管外科临床杂志,2004,11:171-174.
Research of red blood cell permeates brittleness in washed autologous blood transfusion from diabetics
SUN Feng-wei1LI Tie1LI Kui2
(Affiliated Hospital of Taishan Medical University,Taian 271000,China)
Objective:To observe the changes of the infiltration of red blood cells in patients with diabetes in the process of washing and blood transfusion,and the mechanical damage.Methods:60 cases of autologous blood transfusion were carried out by blood transfusion. According to the presence of diabetes mellitus divided into diabetic group (group D,n=30), and the control group (group C,n=30), to monitoring before the operation, after washing, washing before erythrocyte osmotic fragility, measuring blood recycling let stand for 2 h, 4 h, 6 h, 12 h, 24 h after free hemoglobin concentration and potassium levels.Results:Under the same processing conditions, before the operation, washing group D red blood cells of patients with hemolysis in 0.36%~0.68% low drainage rate were higher than group C (P<0.05), after washing there was no statistically significant difference (P>0.05), after washing recycling the longer incubation time free hemoglobin and blood potassium concentration is higher, compared with immediately after washing with obvious difference (P<0.05), but at the same time point after recycling, index no statistical difference between the two groups (P>0.05).Conclusion:In the process of washing type of autologous doping did not increase the damage degree of red blood cells in diabetic patients, diabetic patients using autologous blood doping is safe, but the recovery of blood should be back as soon as possible, to reduce the hemolysis of red blood cells.
diabetes;autologous blood transfusion;red blood cells;osmotic fragility
孙丰伟(1974—),男,山东泰安人,讲师,本科,主要从事临床检验工作。
R446.1
A
1004-7115(2017)10-1098-03
10.3969/j.issn.1004-7115.2017.10.006
2017-06-18)
