人参核盘菌侵染对参根不同部位细胞壁降解酶及防御酶活性的影响
2017-10-23车喜庆傅俊范李自博周如军桑海旭邢亚楠
车喜庆,傅俊范,李自博,周如军,桑海旭,邢亚楠
(1.辽宁省盐碱地利用研究所,辽宁 盘锦 124010; 2.沈阳农业大学 植物保护学院,辽宁 沈阳 110866)
人参核盘菌侵染对参根不同部位细胞壁降解酶及防御酶活性的影响
车喜庆1,2,傅俊范2*,李自博2,周如军2,桑海旭1,邢亚楠1
(1.辽宁省盐碱地利用研究所,辽宁 盘锦 124010; 2.沈阳农业大学 植物保护学院,辽宁 沈阳 110866)
为了明确人参不同部位对人参核盘菌的敏感性,在温室分别对人参芦头部和须根部接种病菌,观察不同部位发病情况,并对人参不同部位细胞壁降解酶活性及寄主防御酶活性进行测定。结果表明,人参菌核病芦头部发病时间早于根须部。人参芦头部多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)、果胶甲基反式消除酶(PMTE)活性在侵染过程中大于根须部,而多聚半乳糖醛酸反式消除酶(PGTE)活性在侵染中期及羧甲基纤维素酶(Cx)、β-葡萄糖苷酶活性在侵染后期出现芦头部小于根须部的现象。人参根须部过氧化氢酶(CAT)、过氧化物酶(POD)活性在侵染前期,超氧化物歧化酶(SOD)活性在侵染中期大于芦头部。可见,人参芦头部对菌核病较根须部敏感,可能主要是芦头部在病菌侵染前期细胞壁降解酶(PG、PMG、PMTE)活性较高,而防御酶(POD、CAT)活性较低造成。
人参菌核病; 细胞壁降解酶; 植物防御酶; 侵染过程
人参(PanaxginsengC.A.Mey.)属五加科多年生药用植物,具有极高的药用和经济价值。人参菌核病是由土壤传播的最严重的人参病害之一,病原为人参核盘菌(SclerotiniaginsengWang et Chen),最早于1912年从人参根腐病株上分离得到。以往该病发生较轻,对人参产量及质量影响小,然而近年来由于非林地栽参面积的日益扩大,人参菌核病发生普遍,危害严重。田间调查发现,病田率在90%以上,发病率达到5.7%,菌核病已经成为长白山区人参主要病害之一[1]。该病害前期发生在人参芦头部,在芦头部坏死之后逐渐扩张到根须部,但根须部病害发生相对较轻,发病时间也延后,最后整株腐烂死亡。由于芦头部坏死后植株的根部与地上的颈部分离,严重影响人参的产量。迄今,国内外仅对人参菌核病病原学、病菌生态型和致病性分化以及药剂防治等方面进行研究[2],未见关于不同部位发病时间不一致现象的研究报道。
细胞壁是植物重要的物理性防御屏障,在抵御真菌侵染过程中起着重要作用[3]。核盘菌在侵入植物过程中,主要通过分泌果胶酶、纤维素酶等水解酶瓦解寄主细胞壁等防卫体系,抑制寄主相关抗性反应,最终达到侵染目的[4]。活性氧在病原菌与植物互作过程中能够起到激发寄主抗性反应的作用,但活性氧过量时也会使寄主细胞受到伤害,寄主细胞可以通过产生一系列抗氧化酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等清除活性氧,降低危害[5]。为明确人参菌核病在不同部位发病时间不一致这一现象产生的原因,对人参核盘菌在侵染人参根不同部位过程中细胞壁降解酶及防御酶的活性进行分析,以此来探讨酶活性变化对产生这一现象的作用,为了解该病菌在田间的侵染过程及生产上安全防控人参菌核病提供科学依据。
1 材料和方法
1.1供试菌株与人参
人参核盘菌采自吉林省集安市榆林镇人参病株,采用常规分离法分离鉴定后,保存于沈阳农业大学药用植物病害研究室。供试2年生人参来源于辽宁省抚顺市新宾县,在沈阳农业大学温室盆栽种植。
1.2材料处理及取样
选择外观整齐、健康并无损伤的人参栽于营养土与杨树林下土1∶1均匀混合的盆中,每盆2株,置于温室内。缓苗后对根部进行针刺接种:分别在芦头部和根须部使用大头针刺扎10下,然后在PDA培养基上20 ℃培养5 d的人参核盘菌菌落边缘打取直径为4 mm的菌饼,每个部位接种1个菌饼,将长满菌丝的一面接种到根上,喷洒无菌水并覆盖保鲜膜保湿,分别在接种后0、1、2、3、5、7、9、15 d取样,其中接种后0、1、2 d直接去除菌饼取样,接种3 d后用镊子除去接种的菌饼并用无菌水轻度清洗。根据预试验,POD活性测定的取样时间选择0.5 d替代1 d。经液氮冷冻后于-80 ℃下保存待用。并以每个处理随机抽取10株进行病害调查,计算发病率。
1.3细胞壁降解酶及防御酶提取
细胞壁降解酶的提取参照高增贵等[6]方法:将取样的每株人参分别在病健交界处的芦头部和主根根须部称质量1 g,加入5 mL 0.25 mol/L NaCl提取液及适量石英砂,冰浴中研磨成匀浆,经纱布过滤后,4 ℃、10 000 r/min离心20 min。取上清液(粗酶液)用于酶活性测定。每个处理重复4次。
防御酶提取参照倪郁等[7]方法并改进:将每株取样的植株分别称取芦头部和根须部各0.5 g,加入0.05 mol/L pH值7.8的磷酸缓冲液5.0 mL、PVP 0.05 g,于冰浴中研磨成匀浆, 4 ℃、10 000 r/min下离心20 min,上清液即为待测粗酶液。每个处理重复4次。
1.4细胞壁降解酶及防御酶活性测定
细胞壁降解酶活性测定参照苏丹[8]的方法进行。多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)、羧甲基纤维素酶(Cx)与β-葡萄糖苷酶于520 nm处测定反应混合液释放的还原糖含量,以30 ℃下每小时每克酶液催化底物释放1.0 μg还原糖为1个酶活性单位;多聚半乳糖醛酸反式消除酶(PGTE)、果胶甲基反式消除酶(PMTE)于232 nm处测定反应混合液释放的还原糖含量,以30 ℃下每分钟每克酶液催化底物释放1.0 μmol还原糖为1个酶活性单位。
CAT活性测定参照Dhindsa等[9]的方法进行,以每分钟OD240值变化0.01的酶量定义为1个酶活性单位;POD活性测定参照张志良等[10]的方法进行,以OD470值变化0.1为1个酶活性单位;SOD活性测定参照孙群等[11]的方法进行,以反应抑制氮蓝四唑(NBT)光氧化还原50%的酶量作为1个酶活性单位。
2 结果与分析
2.1人参核盘菌接种人参根后发病情况
通过图1及表1可知,人参菌核病在不同部位发病时间有所不同,芦头部早于根须部3 d,随着接种后时间变化,根须部病害发生也加重。从图1可以看出,在接种后2 d芦头部位出现轻微侵入,3 d出现明显菌丝生长,5 d开始产生菌核。而根须部位在接种前3 d并未出现明显菌丝生长,接种后5 d出现少量菌核。在侵染9 d后,整个根部均发生严重病害。

图1 接种人参核盘菌后人参根部发病症状
由表1可知,芦头部在接种后2 d开始发病,发病率为10%,接种后5 d发病率达100%;根须部在接种后5 d才开始发病,发病率为50%,接种后9 d发病率达100%。
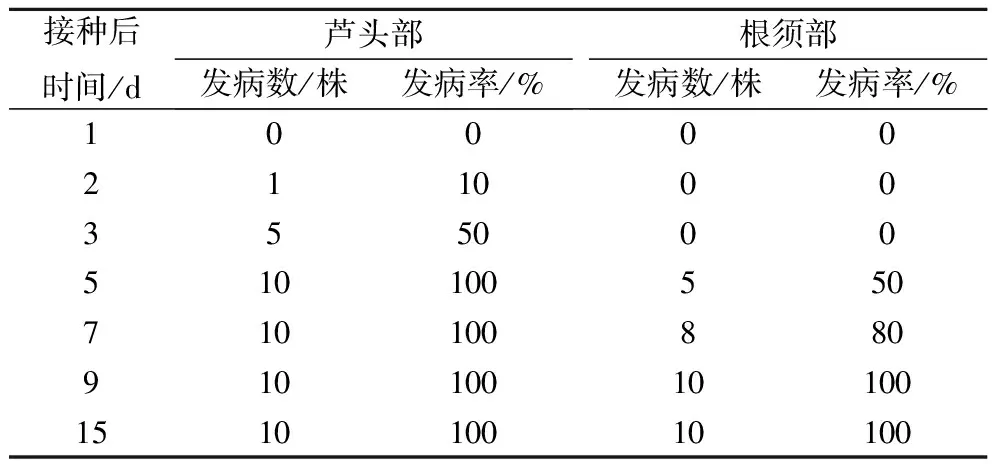
表1 接种人参核盘菌后人参根部发病调查结果
2.2人参核盘菌接种人参根后细胞壁降解酶活性变化
2.2.1 PG与PMG活性 由图2可知,人参核盘菌在侵染植株过程中芦头部PG、PMG活性一直高于根须部。前期PG活性在人参芦头部与根须部都处于上升阶段,芦头部PG活性在接种后5 d达到峰值,之后有所下降,而根须部在5 d达到峰值后急速下降,但在7 d后开始再次上升。在芦头部,PMG活性前期升高较快,在接种后2 d达到峰值后开始缓慢降低;在根须部,PMG活性在接种后1 d降到最低值后迅速升高,并在接种后5 d达到最大值,之后下降,而9 d后开始再次上升。

不同小写字母表示同一部位不同时间之间差异显著(P<0.05),下同图2 接种人参核盘菌后PG与PMG活性变化
2.2.2 PGTE与PMTE活性 由图3可知,在侵染过程中除接种后7 d外,PGTE活性在芦头部一直大于根须部,芦头部PGTE活性在接种后1 d达到最大值,随后持续下降在接种后7 d降到最小值,并且小于根须部,之后再次上升并在接种后9 d开始平稳。PMTE活性在芦头部变化较大,先后在接种后1、3、9 d出现峰值,并在9 d达到最大值,而在根须部PMTE活性几乎无变化。

图3 接种人参核盘菌后PGTE与PMTE活性变化
2.2.3 Cx与β-葡萄糖苷酶活性 由图4可知,芦头部Cx与β-葡萄糖苷酶活性在侵染前7 d一直高于根须部,之后开始改变。芦头部Cx活性在病菌侵染植株前期一直增强,在接种后7 d达到最大值后下降。前期根须部Cx活性除在接种后3~5 d有所下降外均增强,并在9 d达到峰值。芦头部β-葡萄糖苷酶活性前期一直上升,在接种后7 d达到峰值后开始下降,根须部β-葡萄糖苷酶活性在接种前5 d一直上升,在5 d达到第1个峰值后下降,7 d后其活性再次上升。

图4 接种人参核盘菌后Cx与β-葡萄糖苷酶活性变化
2.3人参核盘菌接种人参根后防御酶活性变化
2.3.1 SOD活性 由图5可知,在侵染过程中,只有在接种后7 d根须部SOD活性大于芦头部。侵染前期,芦头部SOD活性显著升高,在接种后1 d达到最大值,之后开始下降,在接种后7 d降到最低后再次上升;根须部SOD活性分别在接种后1 d和7 d达到峰值。
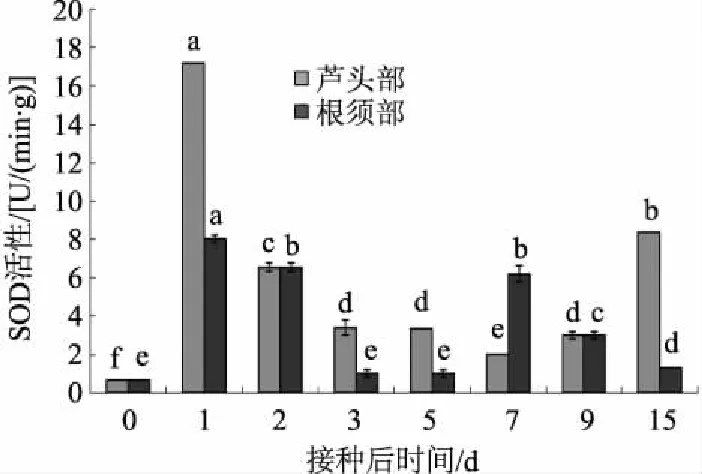
图5 接种人参核盘菌后SOD活性变化
2.3.2 POD活性 由图6可知,侵染过程中,根须部POD活性仅在接种后0.5 d大于芦头部。芦头部POD活性分别在接种后3、9 d达到峰值,并在 9 d达到最大值后显著下降;根须部分别在接种后0.5 d和3 d达到峰值,其中接种后3 d为最大值。
2.3.3 CAT活性 由图7可知,在病菌侵染前期,根须部CAT活性明显大于芦头部,5 d之后发生改变,芦头部酶活性升高并大于根须部。芦头部CAT活性前期显著降低,2 d后快速升高并于接种后7 d达到最大值,之后下降。根须部酶活性前期呈下降趋势,3 d后开始出现多次连续变化。

图6 接种人参核盘菌后POD活性变化

图7 接种人参核盘菌后CAT活性变化
3 结论与讨论
人参菌核病在芦头部发病时间比根须部早,这与田间调查结果相一致。本次试验采用的是针刺接种,而在田间,芦头部位在上,越冬过程中可能更容易受到冻害的影响出现自然伤口,同时田间管理中芦头部位也会受到人为影响,因此,田间环境及越冬条件对伤口的影响有待进一步研究。田间芦头部早于根须部的发病时间更长(1周),这可能是由于田间相对于温室环境更加复杂,多种因素共同作用所导致的。
细胞壁降解酶是植物的主要致病因子之一。本试验对主要的细胞壁降解酶活性测定分析发现,PG、PMG活性最高,Cx与β-葡萄糖苷酶活性其次,这与杨志敏等[12]报道的马铃薯干腐病、陈捷等[13]报道的玉米纹枯病致病过程相似。PG、PMG作用强于其他酶,这与吴洁云等[14]报道的灰葡萄孢侵染番茄的结果一致,可能是果胶酶在侵染过程中起着更加重要的作用,但与刘志恒等[15]报道的棒孢叶斑病菌侵染中纤维素酶活性高于果胶酶不同,可能是细胞壁降解酶在不同病原菌与寄主互作过程中存在差异。在病原菌侵染人参植株根部过程中,芦头部的细胞壁降解酶活性明显高于根须部,芦头部PG、PMG和PMTE活性在整个过程中一直大于根须部,PGTE活性在侵染中期及Cx与β-葡萄糖苷酶活性在侵染后期出现小于根须部的情况,这可能是植株在侵染5 d后,芦头部组织已坏死,其相关酶活性下降,而根须部受到病原菌的持续侵染,相关酶活性已经上升所导致的。PG、PMG、Cx及β-葡萄糖苷酶活性在侵染根须部和芦头部过程中显著升高,PGTE与PMTE活性在侵染芦头部过程中也发生较大变化,但PGTE活性在侵染根须部的过程中波动相对较小且PMTE无变化,其中芦头部在前期细胞壁主要降解酶PG、PMG、PMTE活性高于根须部,对细胞壁的降解程度大,这可能是芦头部病害发生较早的主要原因。病原侵染寄主是一个复杂的过程。张敬泽等[16]报道,柿树炭疽病菌侵染不同部位发病情况不同,可能菌丝的形成和扩展是寄主上致病性差异的重要机制之一。人参芦头比根须部的体积大,菌丝生长量在芦头部大于根须部也可能影响细胞壁降解酶的产生。
对植物抗病机制研究表明,H2O2参与抗病反应信息传递,激发植物的防卫反应并产生系统获得性抗性。植物体内POD、SOD均与抗性反应有关,是植物体内的主要保护酶系,参与木质素合成、自由基消除等,其活性的增加有利于木质素合成,是与植物抗病相关的重要酶;CAT是植物降解H2O2的主要酶,在植物防卫反应过程中能保持活性氧的体内平衡[16]。本研究发现,根须部POD、CAT活性在侵染前期高于芦头部,与芦头部发病时间早于根须部相一致,因此,可能是由于抗性相关酶的产生导致根须部的抗病性增强,但SOD活性只有在侵染中期根须部大于芦头部,这可能是由于3种酶活性变化不是同步的,在侵染的不同阶段发挥作用,这与王勇等[17]报道的辣椒青枯病相关研究结果相似。
[1] 杨昭霞,刘长宝,刘美良.东部山区人参常见病害的症状及防治[J].农业与技术,2005,25(2):62-63.
[2] 黄存达,周剑峰,王教利,等.菌核净防治人参菌核病试验[J].农药,1997,36(12):43.
[3] 冯韬.油菜菌核病病理与防治研究进展[J].作物研究,2014,28(3):316-320.
[4] Lagaert S,Belien T,Volckaert G.Plant cell walls:Protecting the barrier from degradation by microbial enzymes[J].Seminars in Cell & Developmental Biology,2009,20:1064-1073.
[5] 赵丽坤,廖祥儒,蒋继志.活性氧与植物系统获得抗病性研究进展[J].河北农业大学学报,2002,25(S1):173-176.
[6] 高增贵,陈捷,高洪敏.玉米茎腐病菌产生的细胞壁降解酶种类及其活性分析[J].植物病理学报,2000,30(2):148-152.
[7] 倪郁,尹亚丽,郭彦军,等.紫花苜蓿对三叶草核盘菌敏感性差异的生理生化特性研究[J].西南大学学报(自然科学版),2010,32(12):19-24.
[8] 苏丹.新归圃药用植物白头翁叶斑病病原学及其致病机理研究[D].沈阳:沈阳农业大学,2013.
[9] Dhindsa R,Plumb-Dhindsa P,Thorpe T A.Leaf senescence:Correlated with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase[J].J Exp Bot,1981,32:93-101.
[10] 张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2005.
[11] 孙群,胡景江.植物生理学研究技术[M].杨凌:西北农林科技大学出版社,2006.
[12] 杨志敏,毕阳,李永才,等.马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J].中国农业科学,2012,45(1):127-134.
[13] 陈捷,唐朝荣,邹庆道,等.玉米纹枯病菌致病因子的研究[J].沈阳农业大学学报,1999,30(3):189-194.
[14] 吴洁云,纪兆林,徐敬友,等.灰葡萄孢胞壁降解酶对番茄植株致病作用的分析[J].扬州大学学报(农业与生命科学版),2010,31(3):70-74.
[15] 刘志恒,亓烨,黄欣阳,等.黄瓜棒孢叶斑病(褐斑病)病菌细胞壁降解酶产生条件及活性分析[J].中国蔬菜,2011(8):76-80.
[16] 张敬泽,徐同.柿树炭疽病菌侵染不同柿树种、品种和部位的细胞学特征[J].菌物学报,2005,24(1):116-122.
[17] 王勇,周冬梅,郭坚华.蜡质芽孢杆菌AR156对辣椒的防病促生机理研究[J].植物病理学报,2014,44(2):195-203.
Effects ofSclerotiniaginsengon Cell Wall Degrading Enzymes and Defense Enzymes in Different Position of Ginseng
CHE Xiqing1,2,FU Junfan2*,LI Zibo2,ZHOU Rujun2,SANG Haixu1,XING Yanan1
(1.Liaoning Provincial Saline-Alkali Land Utilization and Research Institute,Panjin 124010,China; 2.College of Plant Protection,Shenyang Agricultural University,Shenyang 110866,China)
In order to clarify the sensitivity of different parts of ginseng toSclerotiniaginseng,heads and roots were separately inoculated with the pathogen in greenhouse,the disease development was observed,and the activities of cell wall degrading enzymes and defense enzymes in different parts were measured.The results showed that the disease onset time on the heads was earlier than the roots.The activities of polygalacturonase(PG),polymethylgalacturonase(PMG),pectin methyltranseliminase(PMTE) in heads were higher than the roots in the whole process of infection,but polygalacturonic acid transeliminase(PGTE) activity in the middle of infection and carboxymethylcellulose(Cx),β-glucosidase activities in the late stage of infection showed lower in the heads than in the roots.The catalase(CAT) and peroxidase(POD) activities in the early stage of infection,superoxide dismutase(SOD) activity in the middle of infection were higher in the roots than in the heads.Therefore,the main reasons for the higher sensitivity of heads than roots to sclerotinia rot were that in the early stage of infection the activities of cell wall degrading enzymes(PG,PMG,PMTE) were higher and the activities of defense enzymes(POD,CAT) were lower in heads.
sclerotinia rot of ginseng; cell wall degrading enzymes; plant defense enzymes; infection process
S435.675
A
1004-3268(2017)10-0066-05
2017-03-13
公益性行业(农业)科技专项(201303111)
车喜庆(1988-),男,辽宁营口人,研究实习员,硕士,主要从事植物病理学研究。E-mail:chexiqing@126.com
*通讯作者:傅俊范(1958-),男,辽宁朝阳人,教授,主要从事药用植物病理学研究。E-mail:fujunfan@163.com
