麻疯树JcWRI1基因启动子克隆及功能分析
2017-10-23唐跃辉赵君苇徐克东包欣欣李晓丽于德水李成伟
唐跃辉,刘 坤,赵君苇,徐克东,张 菊,包欣欣,张 怡,李晓丽,齐 静,于德水,王 健,李成伟*
(1.周口师范学院 植物遗传与分子育种重点实验室,河南 周口 466000;2.河南省作物分子育种与生物反应器重点实验室,河南 周口 466000)
麻疯树JcWRI1基因启动子克隆及功能分析
唐跃辉1,2,刘 坤1,2,赵君苇1,2,徐克东1,2,张 菊1,2,包欣欣1,2,张 怡1,2,李晓丽1,2,齐 静1,2,于德水1,2,王 健1,2,李成伟1,2*
(1.周口师范学院 植物遗传与分子育种重点实验室,河南 周口 466000;2.河南省作物分子育种与生物反应器重点实验室,河南 周口 466000)
WRI1基因在控制从碳水化合物到脂类的转化过程中起着重要的作用。通过qRT-PCR方法分析了JcWRI1在麻疯树不同组织中的表达特性,结果表明:JcWRI1主要在种子中表达。同时克隆了麻疯树JcWRI1基因起始密码子上游2 000 bp序列。序列分析表明,该序列不仅包含有TATA-box和CAAT-box基本元件,而且含有胚乳表达所需的顺式调控元件、脱落酸应答相关顺式作用元件、光响应元件及各种胁迫响应元件。将该启动子与GUS报告基因连接构建表达载体,并转化水稻。GUS组织化学染色分析结果表明,JcWRI1启动子驱动GUS基因在根、茎、叶中有很低的表达,然而在种子中具有较高的表达活性。表明该启动子主要在种子中表达,并受多种因子的调控。
麻疯树; 启动子; 转录因子;JcWRI1基因
脂类既是植物细胞重要的贮藏物质,也是人类的重要能源物质,阐明植物脂类的生物合成和分子调控机制是培育高含油量作物的重要基础。近年来,影响脂类合成的转录因子已引起广泛的关注[1-4]。1998年,Focks等[5]发现一个影响拟南芥种子储藏物质积累的突变体,因其种皮表面皱褶而命名为wrinkled1(wri1),该突变体在种子发育的过程中不能正常地将葡萄糖和蔗糖转化为脂肪酸合成的前体物质并且降低了糖酵解途径一些酶的活性,如质体丙酮酸激酶、己糖激酶等的活性,种子的含油量较野生型减少了80%。2004年,Cernac等[6]克隆了AtWRI1基因,该基因编码1个AP2/ERF家族的转录因子,包含2个保守的AP2/ERF结构域,其中一个AP2/ERF结构域相当保守,另一个保守性稍差,在角果中表达水平最高,在其他组织如叶、茎、根和花中也均有表达,过表达该基因不仅能增加种子的含油量,还能引起幼苗积累三酰甘油。2007年,Baud等[7]研究发现,WRI1基因受上游因子LEC2的直接调控。2009年,Maeo等[8]研究表明,过表达WRI1使脂肪酸代谢途径的一些基因如编码乙酰辅酶A羧化酶、酰基载体蛋白、酮脂酰基ACP合酶的基因表达上调,然而在wri1突变体中,这些基因下调。目前,在玉米、油菜、蓖麻中也发现了WRI1基因,并且超表达该基因增加了种子含油量[9-11]。最近,Li 等[12]研究发现,油菜BnWRI1在维持三酰甘油、膜脂和糖在植物体内平衡中起重要的作用,并且在油菜中过表达BnWRI1基因还可以促进油菜提前开花、提高种子油的积累。
麻疯树(JatrophacurcasL.)又名小桐子,是大戟科多年生落叶灌木/小乔木。麻疯树种子含油量高,种仁含油率在40%~60%,富含18碳脂肪酸,尤其是油酸和亚油酸[13]。前期研究发现,麻疯树JcWRI1基因在种子发育后期表达[14],说明该基因在种子贮藏物质的合成中可能起着重要的作用。本研究从麻疯树基因组中分离到了长度为2 000 bp的JcWRI1基因启动子,详细分析了该启动子的序列特征,并在水稻中研究该基因的表达模式,对进一步研究该基因在将糖转化为脂类过程中的作用具有重要的意义。
1 材料和方法
1.1试验材料
麻疯树引种于贵州黔西,种植在周口师范学院试验田。分别选取麻疯树的根、茎、叶、花及授粉后35 d的种子用于组织特异性表达分析,锡箔纸包裹并立即放液氮速冻,然后放于-80 ℃保存待用。
供试水稻材料为粳稻中花11(ZH11),种植于周口师范学院试验田。取14 d水稻幼苗根、叶片,抽穗后5 d的茎及蜡熟期的水稻种子(全部为上位强势粒)进行GUS染色。用于GUS检测的样品取样处理后直接放37 ℃反应。
供试试剂pMD18-T载体、限制性内切酶、Taq酶及相关试剂盒和试剂购自大连宝生物工程有限公司,T4连接酶购自北京百泰克生物技术有限公司,其他试剂均为国产分析纯。供试大肠杆菌DH5α、pCAMBIA1391Z表达载体由河南省作物分子育种与生物反应器重点实验室保存。
1.2试验方法
1.2.1 麻疯树DNA的提取 待麻疯树生长3周后,取地上部分叶片用液氮速冻,采用CTAB法[15]提取麻疯树DNA。
1.2.2 麻疯树RNA的提取 麻疯树根、茎、叶、花、授粉后35 d的种子RNA提取使用Magen公司的植物RNA提取试剂盒,参考方法为较难提取植物组织RNA小量提取法。取2 μg 提取RNA作为模板,参照Magen公司逆转录试剂盒说明书进行第一链cDNA合成。
1.2.3 引物设计与合成 根据已经建立的麻疯树基因组数据库的JcWRI1基因相关信息设计引物,引物合成委托北京奥克鼎盛生物科技有限公司进行。
1.2.4 基因表达分析 以引物JcActionF:5′-TAATGGTCCCTCTGGATGTG-3′;R:5′-AGAAAAGAAAAGAAAAAAGCAGC-3′为内参引物,JcWRI1 F:5′-GGAAGAACCAACCGCAGATAG-3′; R: 5′-ACACTTTGCTGTACCATGAAAACAC-3′为定量PCR引物,通过qRT-PCR方法检测JcWRI1基因在麻疯树不同组织中表达情况,每个试验设3个生物学重复,每个重复设2个技术性重复。
1.2.5JcWRI1启动子的克隆、检测及测序 以麻疯树叶DNA为模板,以F:5′-TCCCAAAGGCTAAACATAATCTCT-3′; R:5′-TTGTGCCTCGCCTTCTGTTATG-3′为引物,通过PCR扩增JcWRI1启动子序列。PCR的反应条件如下:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,33个循环;72 ℃总延伸7 min,16 ℃保温。取10 μL反应液,加入1 μL DNA上样缓冲液,进行1%琼脂糖凝胶电泳检测。将PCR产物分别连接到pMD18-T载体上,通过PCR检测获得阳性克隆。阳性克隆送到北京奥克鼎盛生物科技有限公司测序。
1.2.6 序列的生物信息学分析 经Softberry(http://www.Softberry.com)的tssp分析,寻找序列中可能的转录起始位点和TATA-box。利用在线植物转录元件工具plantCARE[16]对克隆到的启动子序列进行分析,寻找可能的植物顺式作用元件。
1.2.7 表达载体的构建 根据JcWRI1基因启动子序列设计引物F:5′-GCTGCTGTCTCATAAACAACAAACT-3′,R:5′-TTTCTGTCTTTCTTTCTTTCTGTGG-3′。以麻疯树叶DNA为模板扩增JcWRI1启动子序列。随后将该片段连接到pCAMBIA1391Z上的PstⅠ和EcoR Ⅰ位点间,阳性克隆酶切检测后,将构建好的载体送北京奥克鼎盛生物科技有限公司测序。
1.2.8 水稻转基因 水稻愈伤组织的诱导及转基因采用Tang等[17]的方法。
1.2.9GUS基因表达检测 取野生型和转基因阳性水稻根、茎、叶和种子进行GUS检测,组织化学染色按Jefferson等[18]的方法。
2 结果与分析
2.1麻疯树JcWRI1基因表达模式分析
以JcWRI1基因(NCBI登录号:JCGZ_09727)cDNA序列设计引物,通过qRT-PCR (实时荧光定量PCR) 技术检测了JcWRI1基因在水稻不同发育时期的表达模式。结果表明,JcWRI1主要在授粉后35 d种子中表达,在花中有微弱的表达,然而在根、茎和叶中表达更弱或者几乎检测不到表达(图 1)。

图1 JcWRI1基因在麻疯树根、茎、叶、花和授粉后35 d种子中的定量PCR分析
研究发现,授粉后29~41 d(种仁灌浆后期)是麻疯树种子中贮藏物质积累转化的关键时期[14]。以上结果表明,JcWRI1可能在麻疯树贮藏物质积累转化的过程中起关键的调控作用。
2.2JcWRI1基因启动子的克隆
根据麻疯树全基因组测序结果[19]设计引物,通过PCR扩增获得了目的条带(图2),回收并连接到pMD18-T载体后送公司测序。测序结果表明:PCR扩增得到的序列长度为2 042 bp,其3′有部分序列与JcWRI1基因CDS 5′相同,证明该序列是JcWRI1基因起始密码子ATG的上游区域。去掉与JcWRI1基因CDS 5′相同的序列,该启动子DNA片段长2 000 bp。

M:DNA Marker DL2000; 1—2:JcWRI1启动子目的片段图2 PCR扩增JcWRI1启动子电泳图谱
2.3JcWRI1基因启动子序列分析
生物信息学分析显示(图3),该片段包含了翻译起始密码子ATG(将翻译起始密码子ATG的A定义为+1位)上游2 000 bp序列,获得的启动子片段经在线软件tssp分析,结果发现,-61处的A可能为转录起始的核心位置。该启动子除含有TATA-box和CAAT-box基本元件外,还含有脱落酸应答相关顺式作用元件(TACGGTC)、胚乳表达所需的顺式调控元件(GTCAT)、光响应元件(TTTCAAA)、与光胁迫相关的MBS(CGGTCA)和MYB结合位点(AACCTAA),说明JcWRI1基因可能在胚乳中表达并受光和各种胁迫等因素的调控(表 1)。
2.4JcWRI1基因启动子植物表达载体的构建
JcWRI1基因启动子驱动GUS的植物表达载体(JcWRI1 pro::GUS)见图 4。设计带PstⅠ和EcoR Ⅰ酶切位点的特异引物,以麻疯树叶DNA为模板,通过PCR扩增获得长2 000 bp的启动子序列,然后将该序列连接到pCAMBIA1391Z植物表达载体上,并通过PstⅠ和EcoR Ⅰ对构建好的载体进行酶切检测(图5),表明该载体是含有JcWRI1基因启动子的植物表达载体,测序结果也表明连接完全正确。

JcWRI1基因翻译起始位点ATG和预测的转录起始位点A使用双下划线表示,JcWRI1基因保守的顺式调控元件使用单下划线表示图3 麻疯树JcWRI1基因启动子序列分析结果
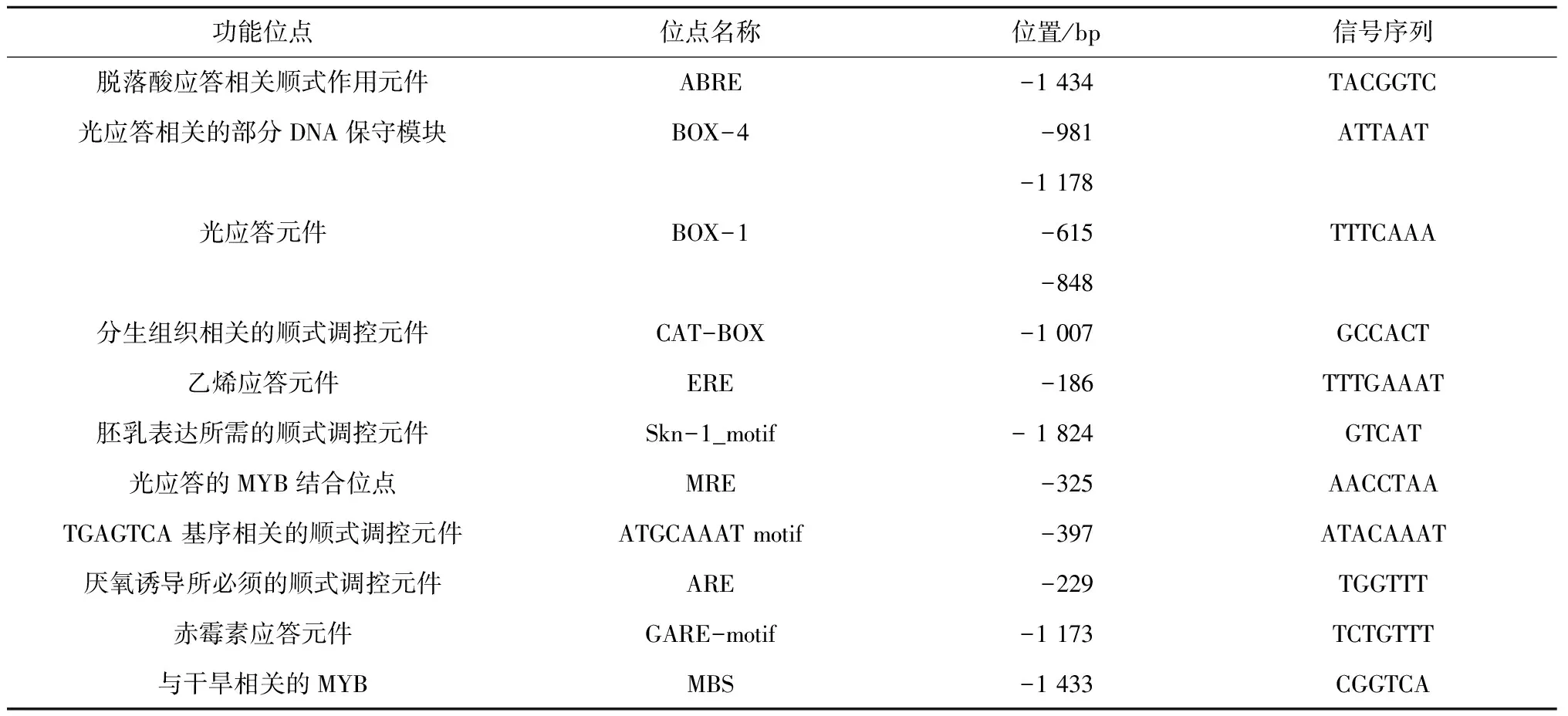
表1 JcWRI1基因启动子主要顺式作用元件

JcWRI1 pro:JcWRI1启动子;GUS:β-葡萄糖醛酸报告基因;35S polyA:花椰菜花叶病毒基因终止转录区; Nos polyA:胭脂氨酸合成酶基因终止转录区;Hph:潮霉素磷酸转移酶基因;35S:花椰菜花叶病毒启动子图4 JcWRI1 pro::GUS植物表达载体

M:DNA Marker DL2000; 1—2:酶切 pCAMBIA1391Z-JcWRI1-GUS结果图5 JcWRI1基因启动子植物表达载体酶切鉴定
2.5JcWRI1基因启动子在水稻中的表达特性
以水稻愈伤组织为受体,通过农杆菌介导法将构建好的JcWRI1启动子驱动GUS植物表达载体转入水稻愈伤组织中,通过潮霉素抗性筛选和PCR技术鉴定阳性转基因株系,通过T2代分离比,挑选单拷贝插入转基因株系(分离比为3︰1)进行进一步的分析。取野生型和转基因阳性植株的不同组织部位进行GUS染色,结果表明:野生型的所有组织中都不能检测到GUS活性(图6),转JcWRI1 pro::GUS植株中的根、茎和叶在反应体系中反应2 h很难检测到GUS活性,反应8 h后才有蓝色产物,而授粉后15 d种子反应15 min就可以检测到GUS活性,然而在胚中没有检测到GUS活性(图 6中箭头指示方向)。说明JcWRI1基因启动子的活性表现为水稻种子中明显高于根、茎和叶中。这种表达模式与JcWRI1在麻疯树不同组织的表达模式分析结果相一致。

图6 JcWRI1转基因水稻和野生型水稻植株的GUS基因表达检测
3 结论与讨论
Cernac等[6]的研究表明,AtWRI1基因在豆荚中高表达,在叶、茎、根和花中也有表达,功能缺失或过表达该基因分别致使拟南芥种子含油量降低80%或提高20%。试验还证明,该基因在35S启动子操纵下的异位表达可同时增加种子和幼苗中的含油量[7]。WRI1是AP2/ERF家族中的一员,有关其他植物WRI1的研究发现,它对种子油脂积累及相关代谢活动具有调控作用[9-11],所以WRI1基因有可能成为一种新的改良种子含油量的目标基因。
本研究对JcWRI1启动子序列的分析发现,其包含转录起始位点上游2 000 bp,除了含有基本的顺式作用元件TATA-box、CAAT-box外,还包含多个光响应元件、胚乳表达必需的顺式调控元件、胁迫相关的元件,这表明JcWRI1基因可能在种子中表达,并且该基因的表达也可能受光照、激素以及各种胁迫的调控。本研究结果表明,JcWRI1主要在授粉后35 d麻疯树的种子中表达,推测该基因可能与麻疯树种子贮藏物质的合成积累有关。通过GUS活性进一步对该基因在水稻中的表达特性进行分析,也发现该基因在水稻种子中具有较高的GUS活性,而在其他组织中有微弱的GUS活性。组织特异性表达启动子是研究基因功能和改变植物特异性状的重要工具,通过分子生物学手段改变稻米品质或者改变麻疯树种子含油量(因为麻疯树含油量主要在种仁或者种子中[13]),需要导入的基因只有在种子专一表达而在其他组织微弱或者不表达,才会对植物的生长发育没有明显的影响。因此,本研究将为该启动子应用于麻疯树、水稻或其他植物的种质改良提供新的资源和依据。
[1] Lotan T,Ohto M,Yee K M,etal.ArabidopsisLEAFY COTYLEDON1 is sufficient to induce embryo development in vegetative cells[J].Cell,1998,93(17):1195-1205.
[2] To A,Valon C,Savino G,etal.A network of local and redundant gene regulation governsArabidopsisseed maturation[J].The Plant Cell,2006,18(7):1642-1651.
[3] Santos M M,Dubreucq B,Miquel M,etal.LEAFY COTYLEDON 2 activation is sufficient to trigger the accumulation of oil and seed specific mRNAs inArabidopsisleaves[J].Febs Letters,2005,579(2):4666-4670.
[4] Cernac A,Andre C,Hoffmann-Benning S,etal.WRI1 is required for seed germination and seedling establishment[J].Plant Physiology,2006,141(2):745-757.
[5] Focks N,Benning C.Wrinkled1:A novel,low-seed-oil mutant ofArabidopsiswith a deficiency in the seed-specific regulation of carbohydrate metabolism[J].Plant Physiology,1998,118(1):91-101.
[6] Cernac A,Benning C.WRINKLED1 encodes an AP2/EREB domain protein involved in the control of storage compound biosynthesis inArabidopsis[J].Plant Journal,2004,40(4):575-585.
[7] Baud S,Mendoza M S,To A,etal.WRINKLED1 specifies the regulatory action of LEAFY COTYLEDON2 towards fatty acid metabolism during seed maturation inArabidopsis[J].Plant Journal,2007,50(5):825-838.
[8] Maeo K,Tokuda T,Ayame A,etal.An AP2-type transcription factor,WRINKLED1,ofArabidopsisthalianabinds to the AW-box sequence conserved among proximal upstream regions of genes involved in fatty acid synthesis[J].Plant Journal,2009,60(3):476-487.
[9] Shen B,Allen W B,Zheng P,etal.Expression ofZmLEC1 andZmWRI1 increases seed oil production in maize[J].Plant Physiology,2010,153(3):980-987.
[10] Liu J,Hua W,Zhan G M,etal.Increasing seed mass and oil content in transgenicArabidopsisby the overexpression of wri1-like gene fromBrassicanapus[J].Plant Physiology and Biochemistry,2010,48(1):9-15.
[11] Tajima D,Kaneko A,Sakamoto M,etal.Wrinkled 1 (WRI1) Homologs,AP2-type transcription factors involving master regulation of seed storage oil synthesis in castor bean[J].American Journal of Plant Sciences,2013,4:333-339.
[12] Li Q,Shao J,Tang S,etal.Wrinkled1 accelerates flowering and regulates lipid homeostasis between oil accumulation and membrane lipid anabolism inBrassicanapus[J].Frontiers in Plant Science,2015,6(192):1-15.
[13] Divakara B N,Upadhyaya H D,Wani S P,etal.Biology and genetic improvement ofJatrophacurcasL.:A review[J].Applied Energy,2010,87(3):732-742.
[14] Jiang H,Wu P,Zhang S,etal.Global analysis of gene expression profiles in developing physic nut(JatrophacurcasL.) seeds[J].PLoS One,2012,7(5):e36522.
[15] Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[16] Lescot M,Déhais P,Thijs G,etal.Plantcare,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J].Nucleic Acids Research,2002,30(1):325-327.
[17] Tang Y,Li M,Chen Y,etal.Knockdown ofOsPAOandOsRCCR1 cause different plant death phenotypes in rice[J].Journal of Plant Physiol,2011,168(16):1952-1959.
[18] Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:Beta glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].EMBO Journal,1987,6(13):3901-3908.
[19] Wu P,Zhou C,Cheng S,etal.Integrated genome sequence and linkage map of physic nut (JatrophacurcasL.),a biodiesel plant[J].Plant Journal,2015,81(5):810-821.
Cloning and Functional Analysis ofJcWRI1 Promoter ofJatrophacurcasL.
TANG Yuehui1,2,LIU Kun1,2,ZHAO Junwei1,2,XU Kedong1,2,ZHANG Ju1,2,BAO Xinxin1,2, ZHANG Yi1,2,LI Xiaoli1,2,QI Jing1,2,YU Deshui1,2,WANG Jian1,2,LI Chengwei1,2*
(1.Key Laboratory of Plant Genetics and Molecular Breeding,Zhoukou Normal University,Zhoukou 466000,China; 2.Henan Key Laboratory of Crop Molecular Breeding and Bioreactor,Zhoukou 466000,China)
WRI1 plays an important role in controlling the conversion course from carbohydrates to lipids.We analyzed the expression pattern of theJcWRI1 in different tissues inJatrophacurcasL.by qRT-PCR.The result showed thatJcWRI1 transcripts were predominantly expressed in seeds.On the other hand,the promoter ofJcWRI1 was obtained fromJatrophacurcasL.in this paper.Sequence analysis indicated that the promoter included TATA-box,CAAT-box,and a number of cis-acting elements involved in abscisic acid response,light response,stress response,endosperm-specific expression,respectively.TheJcWRI1 promoter was fused withGUSreporter gene and transferred intoOryzasativaL..Histochemical staining of different organs of the transgenic plants showed that a very lowlyGUSreporter gene expression in root,stem,leaf and higher expression in seed.The results indicated that the promoter functioned in the seed and regulated by multiple factors.
JatrophacurcasL.; promoter; transcription factor;JcWRI1 gene
Q78
A
1004-3268(2017)10-0110-06
2017-05-10
河南省科技开放合作项目(132106000077);河南省科学技术厅科技攻关项目(152102410074);2018年度河南省高等学校重点科研项目(18A180035);周口师范学院高层次引进人才科研基金启动项目(ZKNUC2016030);周口师范学院2017年大学生科研创新基金项目(ZKNUD201701)
唐跃辉(1985-),男,河南许昌人,讲师,博士,主要从事水稻基因克隆与功能研究。E-mail:yhtang2005@163.com
*通讯作者:李成伟(1972-),男,河南商丘人,教授,博士,主要从事植物与病原菌互作研究。E-mail:lichengweiwau@hotmail.com
