液相色谱-串联质谱法检测食用动物血液中伊维菌素残留
2017-10-23李光满夏明星陈宗祥李应国
李光满, 夏明星, 唐 璜,陈宗祥, 李应国
(1.万州出入境检验检疫局,重庆404020;2.涪陵出入境检验检疫局,重庆408008;3.重庆出入境检验检疫局,重庆 400020)
液相色谱-串联质谱法检测食用动物血液中伊维菌素残留
李光满1, 夏明星1, 唐 璜2,陈宗祥1, 李应国3*
(1.万州出入境检验检疫局,重庆404020;2.涪陵出入境检验检疫局,重庆408008;3.重庆出入境检验检疫局,重庆 400020)
本试验旨在建立一种检验食用动物血液中伊维菌素兽药残留的液相色谱-串联质谱(HPLC-MS/MS)检测方法。样品经乙腈提取,采用液质联用仪电喷雾离子源(ESI+),多反应监测(MRM)检测,内标峰面积法定量。进行回收率、精密度和检出限等技术要素评价。本方法在15 min内完成目标化合物分析;伊维菌素在10.0~50.0 μg/L浓度范围内均呈良好线性关系,相关系数r=0.9999,添加3个浓度水平(10、20、40 μg/kg)伊维菌素标准溶液,猪血、羊血、牛血、兔血、鸡血、鸭血的平均回收率为75.6%~95.5%,RSD为1.44%~8.57%,本方法检出限(LOQ)为10 μg/kg。该方法灵敏度高,稳定性好,可适用于食用动物血液样品中伊维菌素含量检测。
伊维菌素;液相色谱-串联质谱法;食用动物血液;兽药残留
伊维菌素是新型的广谱、高效、低毒抗生素类抗寄生虫药,对体内外寄生虫特别是线虫和节肢动物均有良好的驱杀作用。在农业生产中用于猪、马、牛、羊、家畜等多种动物,具有广谱、高效、安全等优点。超剂量使用可引起中毒,无特效解毒药。肌内注射会产生严重的局部反应。
目前,国内外关于伊维菌素检测的相关文献报道方法比较多,常见方法有液相色谱法、液质联用法、酶联免疫吸附法等[1-5],检测对象主要为牛奶、奶粉、河豚鱼、鳗鱼和烤鳗、水产品、饲料、牛肉、牛肝等[6-14]。现行有效的国家、行业标准伊维菌素药物残留的液相色谱-串联质谱法仅适用于河豚鱼、鳗鱼和烤鳗、牛奶、奶粉、牛肉、牛肝、动物源性食品[11-14],还没有针对食用动物血液的液相色谱-串联质谱法。当有机溶剂乙腈与食用动物血液接触时,产生团状不溶解沉淀,现有的文献报道[2-5]均采用高速离心方法将血清与血桨分离,其伊维菌素的分析结果准确性会受影响。本试验采用食用动物全血检测;提取采用内标法定量,不再需要通过固相萃取柱净化,方法操作简单,定性定量准确,灵敏度等各项技术指标满足残留检测要求,以期为伊维菌素的检测研究提供一定的参考依据。
1 材料与方法
1.1 材料与试剂 标准物质:伊维菌素(Ivermetine,CAS号:70288-86-7),纯度均大于96%、伊维菌素同位素内标(Ivermetin-d2),纯度大于98%。试验所用试剂包括乙腈、甲酸、乙酸铵、氯化钠、吸附剂PSA、微孔滤膜。试验用水均为超纯水,猪血、羊血、牛血、兔血、鸡血、鸭血均为外购,用抗凝采血管收集,采集数量不得少于20 mL,密封,并标准标记。待检血液试样于4℃保存,留存血液试样于-18℃冷冻保存。
1.2 仪器与设备 液相色谱-串联质谱仪(美国AB公司 4000Qtrap):配电喷雾离子源(ESI);天平(瑞士梅特勒-托利多公司XS204);离心机(Sigma公司);旋涡混匀器;超声清洗器;氮吹仪。1.3 方法
1.3.1 溶液配制 标准溶液配制:准确称取伊维菌素标准品0.1 g(精确到0.0001g),用乙腈充分溶解,稀释定容于100 mL容量瓶中,配制成浓度为1 mg/mL的标准储备溶液,将伊维菌素同位素内标标准品10 mg,用乙腈充分溶解,稀释定容于10 mL容量瓶中,配制成浓度为1 mg/mL的标准储备溶液,最后分别将定容后的标准储备液倒入棕色试剂瓶中,-18℃以下避光保存。根据需要用乙腈将标准储备液稀释成合适的浓度的混合标准工作曲线溶液,参考线性浓度范围为10~50 ng/mL,伊维菌素同位素内标浓度为20 ng/mL,临用时现配。
5 mmol/L乙酸铵+0.1%甲酸水溶液:称取0.385 g乙酸铵于烧杯中,用水溶解,转移至1 000 mL容量瓶中,用水洗涤烧杯至少3次,直至洗净,并将洗液全部转移至1 000 mL容量瓶中,再加入1 mL甲酸于1 000 mL容量瓶中,用水定容。
1.3.2 样品前处理 ①采样和试样制备:动物血液用抗凝采血管收集,采集数量不得少于20 mL,密封,并标记,备用。②提取:称取2.0 g(精确到0.01 g)试样和0.5 g氯化钠于50 mL离心管中,加入40 μL的1 mg/mL伊维菌素同位素内标储备溶液、3 mL水和 10 mL乙腈,旋涡混匀2 min,振荡提取30 min,以8 000 r/min冷冻离心5 min,取上清液5 mL氮气吹干,加入1.0 mL乙腈,加入30 mg吸附剂PSA,超声溶解残渣,过0.22 mm滤膜后,供液相色谱-串联质谱仪测定和确证。
1.3.3 液相色谱-串联质谱条件 ①液相色谱条件。色谱柱:Kinetex 2.6μ C18100A,New Column 100 mm×4.6mm;流动相:5 mmol/L乙酸铵+0.1%甲酸水溶液(A)-乙腈(B);流速: 0.4 mL/min;进样体积:20 μL;柱温:30℃;液相色谱梯度洗 脱 程 序:0~1.0 min,50%A~50% B;1.0~12.0 min,5%A~95% B;12.0~12.1 min,50%A~50%B;12.0~13.0 min,5%A~95% B;12.1~15.0 min,50%A~50% B。伊维菌素标准溶液的多反应监测(MRM)色谱图见图1。在上述色谱条件下,伊维菌素的参考保留时间分别约为7.60 min。②质谱条件。离子源:电喷雾电离ESI(+),电喷雾电压:5.5 kV,雾化气压力:50 Psi及干燥气:20 L/min;碰撞气压力:Medium。离子源温度:600℃;扫描模式:多反应监测模式。
2 结果与分析
2.1 质谱条件优化 分别将伊维菌素及内标的标准溶液配制成20 μg/L浓度的标准溶液,不接色谱柱,使用两通连接液相色谱与质谱,首先在正离子模式下进行全扫描,确定化合物的分子离子,将分子离子作为母离子,给予一定的碰撞能量和碰撞气体,全扫描二级离子,选取丰度较强、干扰较小的2个子离子分别作为定性及定量离子,并优化母离子电压和碰撞电压,伊维菌素及内标质谱参数优化结果见表1。

图 1 伊维菌素(10 μg/L)标准溶液和伊维菌素同位素内标(20 μg/L)标准溶液的多反应监测(MRM)色谱图
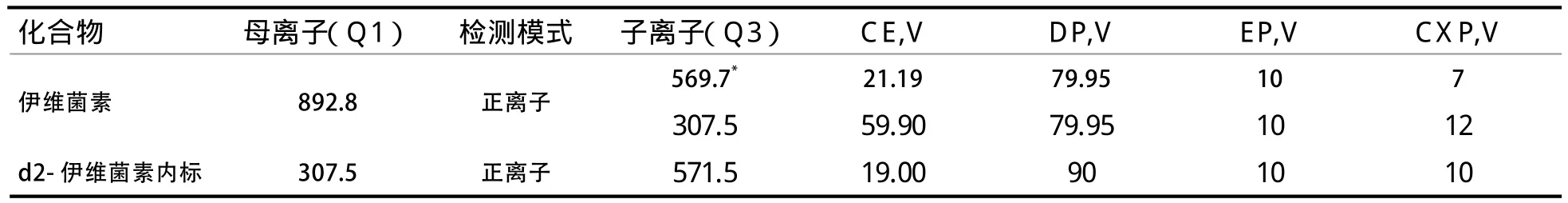
表1 伊维菌素及内标药物质谱参数
2.2 前处理条件优化
2.2.1 提取条件优化 血液中蛋白质与乙腈混合产生团状不可逆溶沉淀,对伊维菌素不能进行有效提取,为了改善沉淀程度,采取血液中先加入水,后加入乙腈的方式;同时,为了让乙腈有机相与水相有效分离,再加入适量氯化钠。经过多次试验验证,0.5 g氯化钠,3 mL水和10 mL乙腈的比例最佳。
2.2.2 提取方式的选择 QuEChERS方法净化样品时,常用PSA去除糖、有机酸和脂肪酸等干扰物,GCB去除叶绿素、类胡萝卜素等色素化合物,C18去除脂肪和脂类等非极性有机化合物。以猪血为样品,比较了 PSA、C18、PCX、GCB、NH2吸附剂用量均为10 mg时对样品的净化效果。结果表明,PSA净化时,样品的回收率较其他吸附剂高。故本研究最终选择PSA吸附剂净化样品。试验比较了PSA吸附剂用量为10、20、30、50 mg时回收率和基质效应。结果表明,PSA吸附剂用量为10 mg净化时,用量过少,回收率较低,基质干扰较大;PSA吸附剂用量为30、50 mg净化时,回收率和基质效应无太大差别,考虑经济成本,最终选择30 mg PSA吸附剂净化样品。
2.3 方法的线性范围及检出限 伊维菌素在10.0~50.0 μg/L浓度范围均呈良好的线性关系,线性方程为y=0.0443x+0.225及相关系数为r=0.9999,伊维菌素标准曲线如图2。

图2 采用LC-MS/MS法测定时伊维菌素的标准曲线图
食用动物如猪、牛、羊、兔、鸡、鸭血液中添加浓度为10 μg/kg时,其信噪比(S/N)满足信噪比≥3和信噪比≥10的定性定量要求,同时根据资料,中国没有伊维菌素的限量,欧盟对所有哺乳动物食品生产品种中肌肉、肾脏的伊维菌素残留量限值为30 μg/kg,供港猪的伊维菌素残留量限值为15 μg/kg,因此选择10 μg/kg浓度作为方法的检出限可以满足要求。因此,选择10 μg/kg浓度作为方法的检出限可以满足要求。
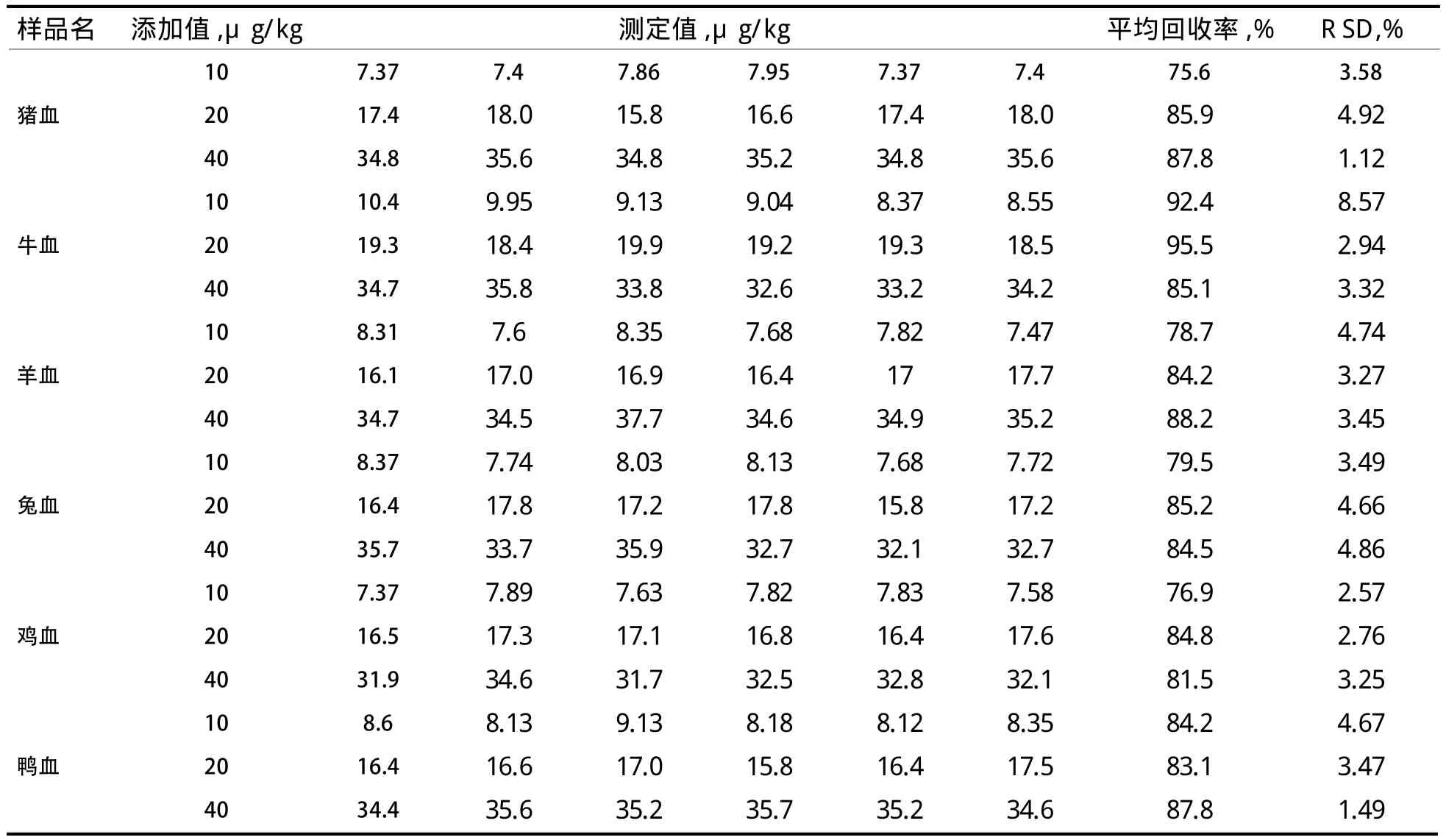
表2 采用LC-MS/MS法测定动物血液样品中的加标回收率结果 (n=6)
2.4 回收率及精密度实验 通过LC-MS/MS方法检测添加伊维菌素的血液样品的含量,通过计算回收率验证方法的技术要素,伊维菌素在猪血、牛血、羊血、鸡血、鸭血中的平均回收率为75.6%~95.5%,处于60%~120%,满足方法技术要素对回收率的要求,精密度值为1.44%~8.57%,具体结果见表2。
2.5 实际样品测定 用本方法对猪血、牛血、羊血、兔血、鸡血、鸭血样品进行检测,结果都低于检出限。
3 结 论
本方法选择水:乙腈(3:10)作为提取溶剂提取伊维菌素,PSA吸附剂较大程度去除了基质所带来的干扰。此方法在10.0~50.0 μg/L浓度范围均呈良好的线性关系,而且灵敏度高,最低检出限为10 μg/kg,伊维菌素回收率在75.6%~95.5%,RSD为1.44%~8.57%。此方法稳定性高,重现性好。因此,本方法适用于动物食品中伊维菌素残留量的常规检测。
[1] 褚明英, 赵兴东. 抗寄生虫新药-伊维菌素[J]. 兽药与饲料添加剂, 2000, (6): 19.
[2] 周红蕾, 刘仁杰, 汤仁想, 等. 高效液相色谱荧光检测法检测Beagle犬血浆中伊维菌素的试验[J]. 中国兽药杂志,2014, 50 (3): 78-8l.
[3] 曹红, 陈坚, 刘红. 绵羊血浆中阿维菌素的高效液相色谱法测定[J]. 伊犁教育学院学报, 2003, 16(3): 120-122.
[4] 赵剑虹, 孙成均, 毛丽莎, 等. 高效液相色谱法测定猪血清中的依维菌素[J]. 四川大学学报(医学版), 2005,36(1): 130-131.
[5] 张晓东. 伊维菌素-二氧化硅纳米缓释颗粒的制备及羊血浆中伊维菌素测定方法的建立[D]. 郑州: 河南农业大学, 2013.
[6] 刘迎贵, 苏亚, 韩琪, 等. 牛羊猪肉组织中伊维菌素残留量检测HPLC法的改进[J]. 中国兽药杂志, 2007, 41 (7):28-3l.
[7] 郑卫东, 胡江涛, 阴文娅, 等. 高效液相色谱-串联质谱测定猪肝中阿维菌素、伊维菌素残留[J]. 食品科学,2011, 32 (4): 185-188.
[8] 张云, 江昌木, 陈虹, 等. 液相色谱串联质谱法同时测定鳗鱼中阿维菌素和伊维菌素残留量[J]. 分析试验室,2008, 27 (5): 104-107.
[9] 周俊, 乔坤云, 冯婷, 等. 牛、猪肉中伊维菌素残留量的HPLC检测与分析[J]. 现代科学仪器, 2006, (1): 82-83.
[10] 江敏, 彭章晓, 吴昊. 反相高效液相色谱法检测鲫鱼肌肉中伊维菌素[J]. 分析化学, 2009, 37 (8): 1223-1226.
[11] 中华人民共和国农业部, 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准: 水产品中阿维菌素和伊维菌素多残留的测定 高效液相色谱法: GB 29695-2013 [S]. 北京: 中国标准出版社, 2014.
[12] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 河豚鱼、鳗鱼和烤鳗中伊维菌素、阿维菌素、多拉菌素和乙酰氨基阿维菌素残留量的测定液相色谱-串联质谱法: GB/T 22953-2008 [S]. 北京: 中国标准出版社, 2009.
[13] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 牛奶和奶粉中伊维菌素、阿维菌素、多拉菌素和乙酰氨基阿维菌素残留量的测定 液相色谱-串联质谱法: GB/T 22968-2008 [S]. 北京: 中国标准出版社, 2009.
[14] 河北省质量技术监督局. 饲料中伊维菌素的测定: DB13/T 1384.9-2011 [S]. 2011.
Determination of Ivermectin Residue in the blood of the Food-animals by Liquid Chromatography-Mass spectrometry
LI Guang-Man1, XIA Ming-Xing1, TANG Huang2, CHEN Zong-Xiang1, LI Ying-Guo3*
(1. Wanzhou Entry-Exit Inspection and Quarantine Bureau, Chongqing 404020, China;2. Fuling Entry-Exit Inspection and Quarantine Bureau, Chongqing 408008, China;3. Chongqing Entry-Exit Inspection and Quarantine Bureau, Chongqing 400020, China)
To determination of the blood samples of the food-animals by liquid chromatography - mass spectrometric (LCMS/MS). the blood samples of the food-animals were extracted with acetonitrile. Using LC-MS/MS (ESI+) with multiple reactions monitoring (MRM), the internal standard peak area method. Evaluation of recovery, precision and detection limit,etc. The method completes the analysis of the target compounds within 15 min. The concentration range of 10.0~50.0 µg/L Ivermectin are in a good linear relationship, the correlation coefficient for R2= 0.9999, The recoveries were ranged from 75.6% to 95.5% for the pigs blood, sheep blood, cattle blood, rabbit blood, chicken blood, duck blood with 3 spiked levels of 10, 20 and 40 μg/kg. The relative standard deviations (RSDs) were 1.44%~8.57% (n=6), and the limits of quantitation(LOQ) for pigs blood, sheep blood, cattle blood, rabbit blood, chicken blood, duck blood were 10 μg/kg. The proposed method is fast, accurate and sensitive, which is suitable for detecting Ivermectin residues in the blood samples of the foodanimals.
Ivermectin; Liquid chromatography-mass spectrometry; The blood of the food-animals; Residues of veterinary drug
S859.84
A
10.19556/j.0258-7033.2017-10-106
2017-05-22;
2017-06-15
重庆市应用开发计划项目(cstc2014yykfB80016);国家认证认可监督管理委员会2014年第三批出入境检验检疫行业标准制修订计划项目(2014B371)
李光满(1986-),女,重庆人,硕士,主要从事食品理化检测,E-mail: 348144432@qq.com
* 通讯作者:李应国,E-mail: 389586108@qq.com
