运动对成长期骨骼肌神经源性诱导因子Agrin及其受体MuSK表达的影响
2017-10-22安楠
安楠
国家体育总局运动医学研究所(北京 100061)
神经肌肉连接(neuromuscular junction,NMJ)是完成神经肌肉间信号传递、实现运动功能的关键结构。研究发现,NMJ的发育从胚胎期开始,在出生后的一段时间内完成结构和功能的成熟。迄今为止,Agrin-MuSK信号通路是已知最清晰的诱导NMJ发育的信号途径。Agrin即集聚蛋白,1990年McMahan提出位于NMJ间隙的神经源性因子Agrin对诱导NMJ分化、促进n型乙酰胆碱受体(n-AchR)聚集和稳定起重要作用。Agrin在脑组织、运动神经元、肌纤维和Schwann细胞中都有表达,但仅神经元表达的异构体具有高度特异的nAchR聚集活性[1]。Agrin经运动神经元轴突释放后结合于肌细胞膜,在此与其受体结合,可以使n-AchR亚基酪氨酸发生磷酸化,这可能是诱导n-AchR聚集的关键[2]。肌特异性受体酪氨酸激酶(muscle sPecific ki⁃nase,MuSK)则是一种跨膜n-AchR耦联酪氨酸激酶,选择性地由发育中的骨骼肌细胞表达并聚集在突触后膜上,1995年由Valenzuela等分离。MuSK能被Agrin快速磷酸化,研究已证实它是Agrin受体复合物的重要组成成分[3]。只有当MuSK被Agrin激活后,才启动细胞内信号级联反应,导致一系列蛋白磷酸化,促使 n-AchR发生聚集,这一过程受正反馈调节[4]。
Agrin和MuSK对NMJ的发育和运动功能成熟起重要作用。研究表明,上述过程是在运动因素的诱导下,由神经元和肌细胞同时释放因子,交互信号,共同诱导完成的[5]。已知运动可以促使NMJ形态增大、结构成分增多、突触传递功能增强,以适应运动负荷增加的需要[6];另一方面,肌肉废用后 NMJ也出现形态、结构和功能上的退化,机制尚不清楚[7]。关于NMJ发育和成熟的机制一直是国内外神经科学研究的热点,研究大部分集中在有关信号转导的分子机制方面[8],而对NMJ在出生后早期的发育规律以及运动因素的调控作用关注不多。本研究从体育科学的角度出发,研究Agrin及MuSK在成长期的表达规律及其在运动干预下的变化,可以有助于解释NMJ的发育过程及运动促进NMJ发育的机制,对于早期发展运动能力有一定的理论和实践指导意义。
1 对象和方法
1.1 研究对象
出生18天的Sprague-Dawley(SD)雄性大鼠130只,体重50.1±6.9 g,购自中国人民解放军军事医学科学院实验动物中心,动物生产许可证号:SCXK(军)2009-018,大鼠饲养和取材均在国家体育总局体育科学研究所SPF级动物实验中心进行,动物使用许可证号:SYXK(京)2011-030。
实验大鼠随机分为对照组、运动组和悬吊组,其中对照组50只,运动组和悬吊组各40只。对照组常规饲养,3周龄时取材10只。运动组进行跑台运动,运动负荷从8 m/min、20 min/d开始,运动强度和运动时间交替增加,至8周龄时达42 m/min、60 min/d,每天运动1次,每周运动6天。悬吊组采用尾部悬吊造成后肢悬空去负荷,设置悬吊组的目的是为了减少大鼠日常活动对神经肌肉系统的运动刺激。各组在饲养至4周龄、5周龄、6周龄、8周龄时分别取材10只,按0.3 ml/100 g体重剂量腹腔注射10%水合三氯乙醛溶液麻醉,迅速分离出腓肠肌于预冷的生理盐水中漂洗,滤纸吸干,置液氮速冻待测。
1.2 研究方法
应用荧光定量PCR法(RT-PCR)测定Agrin及其受体MuSK转录水平;酶联免疫吸附法(ELISA)测定MuSK蛋白水平。
1.2.1 RT-PCRT
所有引物均先由GNEBANK查询mRNA序列,用Primer软件进行引物设计,上海生工生物工程有限公司合成(见表1)。
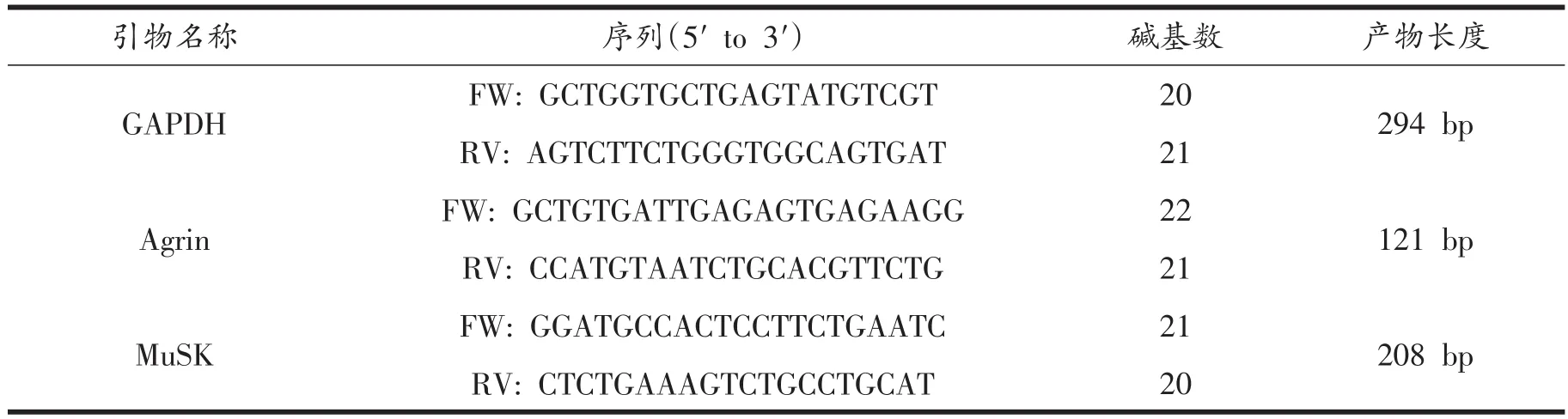
表1 Agrin和MuSK引物序列
提取组织RNA:取腓肠肌组织0.1g,迅速加入液氮研磨至粉末状;加入1 mlMylab通用型RNA快速提取试剂充分混合,室温放置成溶液,加入50 μl无RNase水,溶解RNA。加氯仿0.25 ml,13000 rpm离心5 min,取上清750 μl,加等体积异丙醇-20℃沉淀核酸,离心取沉淀,75%乙醇洗涤,加DEPC水溶解。用DN⁃ase I消化样品RNA中的DNA(见表2),电泳可见5S、18S、28S的清晰条带。
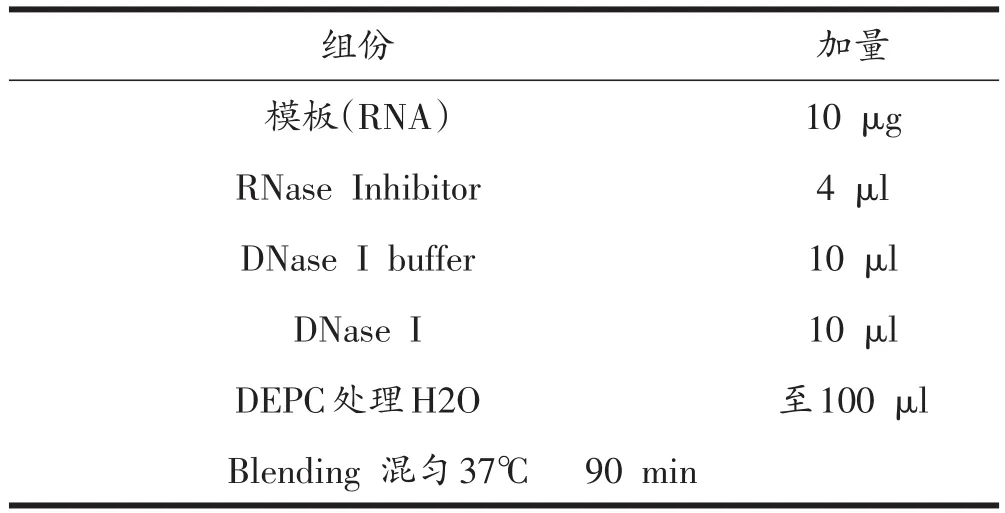
表2 DNA消化步骤
反转录(25 μl反应体系):取RNA样品3 μg,加Oligo Dt T18(50M)2.5 μl,加 DEPC 水至 25 μl,混匀。70℃ 5 min,立即冰浴,然后在反应体系中依次加入 5×buffer 8 μl,dNTP(10 mM)4 μl,RNase Inhibitor(MBI)1 μl,混匀,37℃ 5 min;再加入M-MuLV(MBI)2 μl,于42℃ 60 min,70℃ 10 min。
PCR检测:向PCR管中分别加入不含染料2´qP⁃CR TaqMix 12.5 μl,10 μM 各基因正反向引物混合物0.5 μl,对应的cDNA各1 μl,其中一管不加模板用作阴性对照,各管补加水至25 μl。混匀,置于SLAN荧光定量PCR仪中。95℃ 5 min,55℃ 15 s,65℃ 35 s(荧光检测),40循环,获得扩增曲线。将实验数据代入公式计算2-△△Ct值进行相对定量计算。
1.2.2 酶联免疫吸附法(ELISA)
称取一定重量的腓肠肌组织,加入液氮研磨成粉末,加入对应体积的0.1 MPBS制成10%组织匀浆,二次冻融破膜,混匀,5000 rpm离心5 min,取上清液。按产品说明6次倍比稀释标准品,取标准品及待测样品各100 μl,加入酶标孔底部,混匀,覆膜,37℃ 120 min;弃去液体,每孔加检测溶液 A100 μl,37℃ 60 min;弃去液体,洗板2 min×3次,每孔加检测溶液B100 μl,37℃ 60 min;弃去液体,洗板2 min×5次;每孔加底物溶液90 μl,37℃避光30 min,每孔加入终止液50 μl,终止反应;立即在酶标仪上450 nm波长读取各孔OD值。
1.3 主要仪器和试剂
Takara TP600型梯度PCR仪(日本);SLAN双通道荧光定量PCR仪(上海);JY-SP-B型电泳槽(北京);JY02S型凝胶紫外分析仪(北京);Mylab通用型RNA快速提取试剂盒(美莱博医学科技有限公司,中国);MMuLV反转录酶:200μ/μl,Fermentas(MBI公司,美国);RNase Inhibitor:40μ/μl,Fermentas(MBI公司,美国)。大鼠组织MuSK试剂盒(UCL.co美国);酶标仪(北京)。
1.4 数据处理
所得实验数据以均数±标准差(±s)表示;用SPSS16.0统计软件进行Multivariate Analysis检验周龄和运动因素对指标影响的显著性,0ne-way ANOVA比较均值差异显著性,显著性水平取P<0.05,非常显著性水平取P<0.01。
2 结果
2.1 成长期及运动干预下大鼠腓肠肌Agrin及MuSK mRNA相对表达量
表3显示,周龄因素和运动干预对Agrin mRNA表达水平均有显著影响(P<0.01)。正常发育下,Agrin mRNA在4周龄组较3周龄组表达减少(P<0.01),5周龄再次出现表达高峰(P<0.01),之后降低(P<0.01),至8周龄时未检测到表达;运动干预下,运动组和悬吊组5~8周龄的Agrin mRNA表达水平呈现均高于对照组的趋势(P<0.01)。

表3 成长期及运动干预下大鼠腓肠肌Agrin mRNA相对表达量(n=8)
表4显示,周龄因素和运动干预对MuSK mRNA表达水平均有显著影响(P<0.01)。正常发育下,MuSK mRNA在4周龄时表达水平显著低于3周龄组(P<0.01),5周龄时未检测到表达,6周龄以后再次出现表达增多(P<0.01),且持续到8周龄(P<0.05);运动干预下,运动组MuSK mRNA表达水平在5周龄时显著高于对照组(P<0.01),其他周龄组与对照组无显著差异;悬吊组MuSK mRNA表达水平在各周龄组均显著低于同龄对照组(6周龄P<0.05;4周龄、8周龄均P<0.01)。
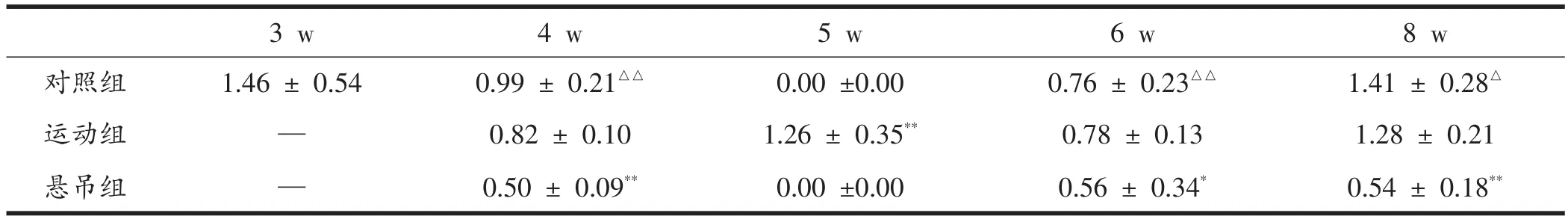
表4 成长期及运动干预下大鼠腓肠肌MuSK mRNA相对表达量(n=8)
2.2 成长期及运动干预下大鼠腓肠肌MuSK蛋白水平
表5 显示,MuSK蛋白水平与其mRNA水平变化规律基本一致;在运动干预下,各周龄运动组MuSK蛋白水平均显著高于对照组(5周龄、6周龄、8周龄均P<0.05);悬吊组MuSK蛋白水平则在各周龄组均呈现出低于同龄对照组的趋势(4周龄P<0.05)。

表5 成长期及运动干预下大鼠腓肠肌MuSK蛋白水平(n=8,U/L)
3 讨论
本研究发现神经源性诱导因子Agrin及其受体MuSK在成长期骨骼肌的表达具有一定的时间规律:Agrin mRNA在出生4周龄较3周龄表达水平显著下降(P<0.01),MuSK作为其受体,在出生4周后mRNA表达水平下降(P<0.01),根据以往文献,推测Agrin在大鼠出生后3周龄(离乳)以前具有一次表达高峰。Agrin广泛存在于中枢和外周神经系统,对各类神经组织的分化成熟均具有重要作用,已证明Agrin在其他神经组织中的表达具有一定的时间规律性,并且这种规律与该神经组织的功能发育进程密切相关。有研究观察Agrin在成长期大鼠大脑皮层中的表达,发现Agrin在发育的不同时期表达程度不同,总体表现为,Agrin在出生时表达很低,随后迅速上升,出生第1周时达高峰,以后随着发育的成熟Agrin表达逐渐降低,4周龄时大脑皮层中Agrin的表达接近于成年水平[4]。从NMJ发育的时间进程分析,运动神经源性Agrin的最早表达时间应该与胚胎期n-AchR(N型乙酰胆碱受体)的表达时间平行,即当神经末梢生长接触到肌纤维表面时,Agrin与MuSK结合,开始诱导肌纤维膜上广泛表达的n-AchR聚集,功能性突触连接在数分钟或数小时中建立,Agrin在这一时期的表达水平最高,随着n-AchR的聚集完成,Agrin表达水平开始下降,这一过程一直延续到出生以后[4]。由于NMJ主要在大鼠出生后3~4周内完成nAchR亚基向成熟型和多神经支配向单神经支配转换的重要过程,因此可以推论出生后至3周龄(离乳)是NMJ成熟的第一个重要阶段,Agrin及其受体MuSK在这个阶段出现表达高峰以配合这个过程。
本研究还发现,Agrin及其受体MuSK在大鼠5周龄后再次出现显著的表达高峰,分析显示这个峰值与周龄因素非常显著相关(P<0.01)。大鼠5周龄相当于青春期阶段,已知n-AchR胚胎型γ-亚基在5周龄后的表达也有显著增加[9],Agrin在同一时期的表达增高可能与诱导γ-n-AchR表达增多有关,这个过程是与运动功能的增强相适应的。Agrin作为诱导n-AchR排列和聚集的重要因子,可能诱导NMJ在青春期进一步发育成熟。NMJ在青春期出现的发育高峰以神经肌肉功能完善为主要过程,而结构成分增长并不显著,提示Agrin及其受体MuSK在此阶段的表达增加可能更多地引起辅助蛋白合成的增加,通过提高NMJ结构成分的排列密度,使运动终板上n-AchR的分布更加集中,从而适应青春期逐渐过渡到成年期的运动需要。关于这一点还需要更多实验证据的支持。
关于运动干预对Agrin和MuSK表达的影响,本研究发现运动的增多和减少都可以促进Agrin更多地表达(P<0.01);但对于MuSK,只有运动训练可以促使其表达增加,抑制运动则会减少其表达。运动和悬吊作为运动刺激增强和减弱的两个相反的方面,对NMJ神经肌肉信号传递具有一定的调节作用。在NMJ功能发育的敏感期,运动需求的改变能够迅速通过某种途径将功能调整的信号传递到NMJ,进而通过神经肌肉之间的信号交换,引起突触前、后成分的改变。一些由神经和肌肉释放的营养因子参与了这个过程,结果使NMJ结构排列更加密集,从而提高神经肌肉信号传递的效率。由于NMJ在发育成熟后其结构成分的代谢率并不很高,提示成年后NMJ对运动负荷的适应主要是通过电生理特性的改变实现的[10]。悬吊是神经肌肉活动减弱的过程,本研究中在运动减弱的情况下Agrin的表达也升高,这可能是机体为保持NMJ的结构完整通过维持或提高自发性神经肌肉冲动而出现的一种代偿反应。结合MuSK的蛋白水平变化表明,减少运动时虽然机体试图代偿,但仍然会引起Agrin受体蛋白水平的降低,从而降低NMJ功能;同时也从相反的角度说明,日常活动作为一种运动刺激,同样可以起到维持神经肌肉功能的作用,但显然运动训练的效果更为显著。
MuSK作为肌细胞膜上NMJ发育调节因子复合物的重要成分,其蛋白水平可以在一定程度上反映NMJ发育调控的程度。已知MuSK具有常规的受体络氨酸激酶(RTK)特征,即含有1个信号肽,一个大的胞外域,1个跨膜域和1个胞浆域,其胞外域常常含有9个或10个氨基酸的插入,可能是由于MuSK mRNA被选择剪辑而形成,这一胞外域结构将与Agrin反应,使MuSK被快速磷酸化,从而介导nAchR的聚集[2]。近年来的研究不断提出,MuSK对于肌纤维运动终板的发育影响更大,MuSK基因缺失鼠的肌细胞几乎丧失所有突触后分化的特征,n-AchR等蛋白成分不再聚集在NMJ处,而是均匀地分布在肌细胞表面,几乎完全看不到n-AchR的聚集现象,提示肌细胞膜上的MuSK是比Agrin更关键的因子。从本研究测定的MuSK蛋白水平看,其随周龄的变化基本与mRNA水平的变化趋势一致,且运动组MuSK蛋白水平在各周龄组均显著高于对照组(P<0.01),说明运动刺激能够通过某种途径影响MuSK的蛋白水平。在MuSK转录以后,运动刺激可能作为外因引起MuSK发生重要的蛋白结构转换过程,将Agrin对NMJ发育的诱导信号向下传递。也就是说,MuSK的最终作用不仅受其转录水平影响,更与功能调节及修饰后的蛋白水平有关,运动则可能是这个过程的主要决定因素,Ca2+和钙调蛋白(Calmodulin,CaM)也可能参与了这个过程[11,12]。有研究显示,低密度脂蛋白受体相关蛋白(Low Density Lipoprotein Receptor-related Pro⁃tein,LRP)可能表达在运动神经元上,作为Agrin的直接受体参与调控[13],有学者提出Agrin-LRP4-MuSK是以两分子四聚体的“8字环”形式存在,起到信息交互作用[14]。LRP4可能通过结合Agrin并激活MuSK,既促进Agrin的簇集作用,又与MuSK结合成复合物做为突触前分化的退行性信号,发挥双向作用调节NMJ形成[15];后续在肌无力患者体内陆续检出抗LRP4抗体也进一步证明了这一论点[16,17];LRP4在Agrin及MuSK受体复合物中可能起核心作用[18];载脂蛋白E(ApoE)作为大多数LRP4的配体,也可能在LRP4调控神经组织发育中发挥作用[19,20]。关于运动干预下Agrin及其受体MuSK究竟如何受LRP4的调节,以及是否通过Ca2+CaM及ApoE作用,尚需更深入的实验证据支持。
4 结论
综上所述,成长期骨骼肌Agrin及其受体MuSK的表达具有一定的时间规律,在大鼠出生3~4周(离乳)呈现减少趋势,至5~6周(青春期)前后再次出现表达高峰,MuSK蛋白水平表现相应的变化;在此期间进行适当负荷的运动训练可以促使Agrin及其受体MuSK更多地表达,特别能使肌纤维膜上MuSK蛋白水平升高,这可能作为一种机制,促进NMJ在成长期的发育,具体调控过程有待进一步研究。
