外周血来源的间充质干细胞在脱矿松质骨支架中的增殖和成软骨能力的实验研究
2017-10-22王少杰李鹏强张继英王薇余家阔
王少杰 李鹏强 张继英 王薇 余家阔
1北京大学第三医院运动医学研究所(北京 100191)
2长春理工大学化学与环境工程学院
3厦门大学附属中山医院关节外科和运动医学科
关节软骨一旦损伤,其自身修复能力十分有限,基于细胞的组织工程手段是一种具有良好前景的软骨修复策略。自1987年以来,自体软骨移植(autologous chondrocyte implantation,ACI)就被用于治疗软骨缺损的治疗[1].然而,该技术存在诸多弊病,例如供区损伤,可得到的细胞数量有限,体外扩增软骨细胞发生快速去分化等[2,3]。因此,研究者们积极寻找软骨细胞的替代来源作为种子细胞。因间充质干细胞(mesenchy⁃mal stem cells,MSCs)的快速增殖以及多向分化能力,来源于不同组织的MSCs得到广泛重视[4,5]。骨髓间充质干细胞(bonemarrow mesenchymalstem cells,BMMSCs)是目前最常用的MSCs,但可获得的骨髓样本量少,创伤相对较大。在前期研究中,我们成功从新西兰大白兔和大鼠的外周血中分离并扩增出外周血来源的间充质干细胞(peripheral bloodmesenchymal stem cells,PBMSCs)[6,7]。PBMSCs具有和BMMSCs相似的增殖能力以及多向分化潜能,并且其可以大量微创获取的特点非常适合临床应用,具有良好的应用前景。不仅如此,相比BMMSCs,PBMSCs具有相似的生物学特性,甚至更强大的成软骨分化能力[8]。
然而,此前多数关于PBMSCs的研究都是基于2D平面培养的结果,这显然与细胞在体内所处的3D环境是不同的。研究者们对PBMSCs在3D多孔支架中的生物学行为知之甚少。对此方面进行深入研究,为后续研究工作提供更加可靠和具有指导作用的3D微环境中的生物学行为,对于组织工程软骨的设计和构建大有裨益。本研究的主要目的是对PBMSCs在脱矿松质骨(demineralizedcancellous bone,DCB)支架中的生物学行为进行深入研究。DCB是组织工程软骨构建中的一种极为常见的生物活性支架。通过将同种异体兔来源的PBMSCs接种到猪DCB支架后,对PBMSCs的形态、粘附、增殖、成软骨分化的能力进行评估和分析,并与兔来源的BMMSCs以及关节软骨细胞(articular car⁃tilage chondrocytes,ACCs)进行对照分析,以验证PBM⁃SCs替代BMMSCs和ACCs作为种子细胞用于软骨缺损修复的可行性。
1 材料和方法
1.1 实验动物、主要材料、试剂与仪器
实验所用动物和实验设计均通过北京大学第三医院动物伦理委员会论证和批准,新西兰大白兔(4周龄,1 kg左右)购自北京大学医学部动物实验中心。AMD3100(Sigma,美国)淋巴细胞分离液(Ficoll-pa⁃queTM,1.077 g/mL,美国),兔成软骨诱导培养基(RBX⁃MX-90041,赛业);Live/Dead 染色试剂盒(Invitrogen,美国),Hoechst 33258木瓜蛋白酶(Sigma,美国),CCK-8(Cell Counting Kit-8,CCK-8)试剂盒(Dojin⁃do,日本),COL 2酶联免疫吸附试验(enzyme-linked immunosorbent assay ,ELISA)试剂盒(Cloud-clone,美国),激光共聚焦显微镜(Leica,德国),多功能酶标仪(Thermoscientific,美国)。
1.2 细胞培养
1.2.1外周血MSC的动员,分离和培养
连续5天按50 μg/kg的剂量在兔皮下注射粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF),末次注射24 h后按5 mg/kg的剂量静脉注射趋化因子受体-4(chemokine receptor-4,CXCR4)拮抗剂AMD3100。在注射AMD3100一小时后,耳缘静脉取血10 mL加入到含Ficoll淋巴细胞分离液的离心管中离心后吸取富含单个核细胞的白膜层细胞,磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤后重悬于α-MEM完全培养基(含有10%FBS,100 U/mL青霉素,100 μg/mL链霉素,25 ng/mL两性霉素B,2 mM L-谷氨酰胺),置于37°C含5%CO2和一定湿度的培养箱中孵育。经过3~4天后弃去非贴壁细胞和碎片,此后每3~4天更换完全培养基一次。大约10~15天细胞达到80%~90%融合。收集第4代PBMSCs细胞用于后续实验。
1.2.2 BMMSCs的分离和原代培养
在麻醉和无菌条件下,从兔髂骨抽吸3 mL骨髓。每份骨髓样本用1:1 PBS稀释,同样以密度梯度离心法分离单核细胞,PBS洗涤后,重悬于α-MEM完全培养基(含有10%FBS,100 U/mL青霉素,100 μg/mL链霉素,25 ng/mL两性霉素B,2 mM L-谷氨酰胺),置于37°C含5%CO2和一定湿度的培养箱中孵育。传代和扩增见PBMSCs分离和培养,收集第4代BMMSCs细胞用于后续实验。
1.2.3 新西兰大白兔关节软骨细胞的提取与培养
取3周龄新西兰大白兔膝关节软骨,含1%双抗的PBS溶液反复冲洗后,使用眼科剪剪成1mm3大小的碎片;用0.2%2型胶原酶消化法将软骨碎片在37°C培养箱内消化4~6 h;离心弃上清液,加入DMEM完全培养基(含有10%FBS,100 U/mL青霉素,100 μg/mL链霉素,25 ng/mL两性霉素B),置于37℃ CO2培养箱中培养(饱和湿度,5%CO2)。5~7天后,待原代ACCs融合90%以上,使用0.25%胰酶/0.1%EDTA消化,直至细胞以及软骨碎片从皿底脱落,使用含 10%FBS的DMEM培养基终止消化。使用P2代ACCs用于后续实验。
1.3 支架制备,表征以及与细胞复合培养
1.3.1 猪脱矿松质骨支架的制备
取家猪膝关节股骨远端以及胫骨近端,剔除周围软组织,自来水冲洗干净,蒸馏水浸泡;使用电动摆锯制成厚度1~2 mm的薄片,去除骨碎屑,血块,以及脂肪组织;5%盐酸脱钙7天,蒸馏水洗;浓度为1∶1的甲醇/氯仿液中脱脂48 h,蒸馏水洗;3%双氧水H2O2中浸泡4 h,蒸馏水洗;采用冷冻干燥机将DCB冻干48 h;最后用角膜环钻裁剪成直径6 mm,高度2 mm圆柱形支架,60Co消毒备用。
1.3.2 支架表征测定
将支架切成薄片,喷金60 s,然后用扫描电镜(scanning electronic microscopy,SEM)观察微观结构,并随机选取DCB电镜图片3张,每张图测定20个孔的最大直径,采用Image-pro Plus 6.0软件计算60个孔的平均孔径。
1.3.3 PBMSCsBMSCs、BMMSCsMMSCs、ACCsACCs和支架材料的复合和培养
3种细胞均以相同方法接种,将40 μL(5.0×105cells)细胞悬液接种到DCB支架上(直径5 mm,厚度2 mm)。待细胞充分粘附后,加入含2 mL10%FBS的α-MEM(用于MSCs-DCB复合培养)或10%FBS的DMEM(用于ACCs-DCB复合培养)。最后放置在37°C,5%CO2孵育箱中培养,培养第3天改用兔成软骨诱导培养基(RBXMX-90041;赛业)成软骨诱导培养,每3天换液。
1.4 细胞形态学、活性和增殖检测
1.4.1 细胞在支架上的分布以及形态观察
细胞DCB支架复合物在生长培养基中培养24小时后取出;PBS洗5分钟后,入2.5%的戊二醛固定过夜;梯度酒精脱水后临界点干燥;高度真空中喷金60 s,形成5 nm金涂层;用SEM观察。
1.4.2 细胞活性检测
细胞DCB支架复合物在生长培养基中培养72小时后取出;PBS溶液浸洗,Live/Dead工作液中,置于37°C孵育箱中染色60 min;PBS浸洗2遍;在激光共聚焦显微镜下观察。
1.4.3 CCK- 8测定细胞增殖
在体外培养的不同时间点,如1、5、7天时,吸净培养基,PBS浸洗2 min;每个支架加入20 μL的CCK-8以及180 μL培养基,37°C孵育2 h;酶标仪测定450 nm波长处的孵育液吸光度。
1.5 DNA以及细胞外基质分泌含量检测
1.5.1 DNA以及GAG含量测定
DNA含量测定:体外成软骨诱导培养14、21天后,取出支架,滤纸吸干,微量天平称量湿重;将支架加木瓜蛋白酶裂解液(木瓜蛋白酶125 μg/mL,0.1 M乙酸钠,5 mM L-半胱氨酸盐酸,0.05 M EDTA;pH=6.0),眼科剪将支架剪碎,60°C水浴裂解48小时;取支架裂解液,通过Hoechst-33258(2 μg/mL)37°C避光孵育1 h标记DNA,酶标仪设定波长360 nm,发射光波长460 nm测定裂解液荧光强度;根据标准曲线计算裂解液的DNA含量。取上述支架裂解液以1,9-二甲基亚甲蓝(dimethylmethyleneblue,DMMB)法测定波长525 nm的孵育液吸光度;用硫酸软骨素标准品(Sigma)作出浓度与吸光度的标准曲线;根据标准曲线算出待测支架裂解液的GAG含量;GAG含量与同一样本支架的DNA含量的比值作为该支架上细胞分泌GAG含量。
1.5.2 共聚焦显微镜检测COL 2分泌
体外培养3周后,取出支架PBS冲洗,4%多聚甲醛固定60 min;PBS冲洗15 min;10%FBS封闭1 h;小鼠抗兔Ⅱ型胶原抗体4°C过夜孵育,PBS冲洗;Alexa 594标记的羊抗小鼠二抗室温孵育2 h,PBS冲洗,Hoechst-33258工作液500 μL,室温5 min;激光共聚焦显微镜观测骨特异性基因2型胶原(collagen type 2,COL 2)。
1.5.3 ELISA测定COL 2含量
在体外成软骨诱导培养后14和21天时使用Cloud-clone Collagen Type 2 ELISA检测试剂盒对支架裂解液所含COL 2进行定量检测,操作按说明书进行。
1.6 RT-PCRT检测软骨分化相关基因表达
通过RT-PCR检测透明软骨特异性基因聚集蛋白聚糖(aggrecan,AGC),COL 2,纤维软骨基因1型胶原(collagen type 1,COL 1),成骨基因碱性磷酸酶(alka⁃line phosphatase,ALP)。利用Trizol提取RNA,按Pro⁃mega逆转录试剂盒说明书进行mRNA逆转录扩增操作,以磷酸甘油醛脱氢酶(GAPDH)为内参照,引物序列见表1。PCR反应条件:95°C变性10 min,95°C15s,60°C 1min,40个循环,mRNA相对表达量用2-△△Ct表示。
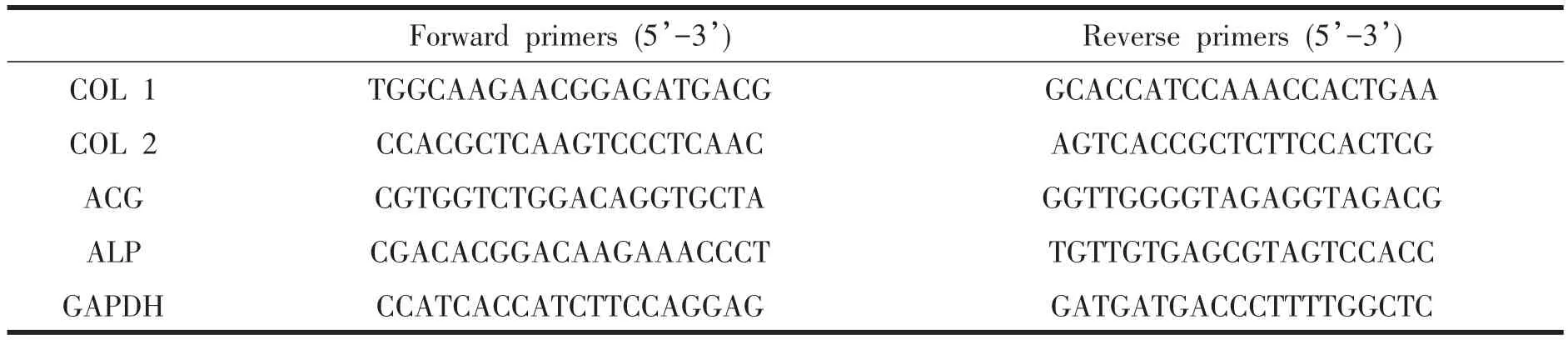
表1 RT-PCR引物序列
1.7 统计学分析
采用GraphPad Prism 6.0软件进行标准误、方差分析(三组数据比较)、Student-t检验(两组数据比较)等统计学分析,当P值小于0.05时,差异具有显著性。
2 实验结果
2.1 DCB支架制作及表征测定
电镜观察可见DCB具有大量天然的高度联通的多孔结构,孔径范围137.9~558.1 μm(图1A),平均孔径332.3±136.7 μm,平均孔隙率 77.9% ±0.03%(图1B)。

图1 支架大体形态观察以及扫描电镜下微观形貌
2.2 细胞在DCB支架上的存活,增殖分析
体外培养 24 h后,SEM观察发现3种细胞均在DCB支架的表面以及孔隙的侧壁上紧密贴附,部分区域可见细胞成簇分布。PBMSCs与BMMSCs为长梭形或多角形。而ACCs类似鹅卵石样或多角形(图2 AC)。体外培养 72 h后,大量细胞活性良好(图3AC)。如图4所示,CCK-8法检测发现第1天MSCs数量多于ACCs,但第5天时3组细胞的数量无显著区别(P>0.05),第7天PBMSCs细胞数较BMMSCs略增加,但3组细胞数较第5天无显著增加(P>0.05)。
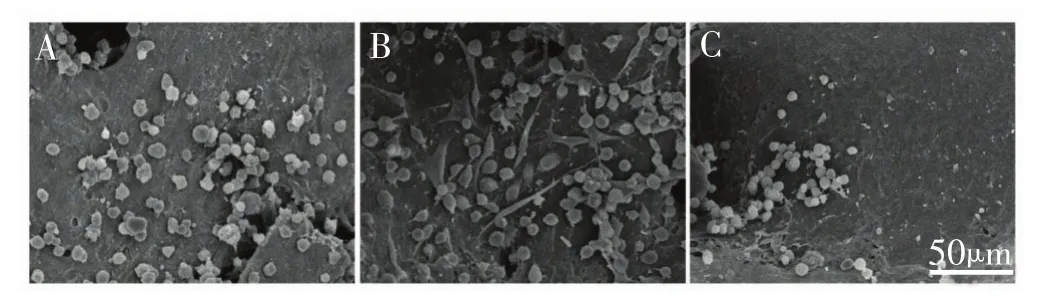
图2 扫描电镜显示不同细胞在DCB支架上体外培养24小时后在DCB支架表面形态
图3 激光共聚焦显微镜显示细胞在DCB支架上体外培养72小时后的细胞活性
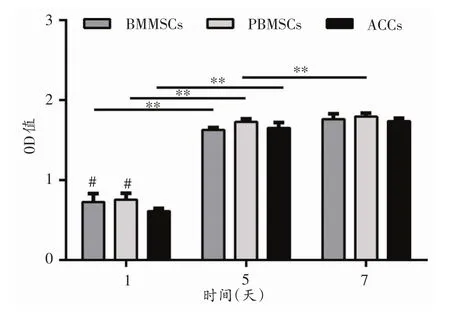
图4 CCK-8检测细胞增殖(n=3)
2.3 细胞在DCB支架上的软骨细胞外基质分泌
在体外培养3天后DCB支架上的细胞DNA含量也逐渐增加。第14天PBMSCs的DNA含量与BMMSCs和ACCs相似(图5A)。体外培养21天后,两种MSCs的DNA含量相似,但PBMSCs略高于ACCs组(P<0.01)。ACCs的GAG早期大量表达,但体外培养14天后逐渐下降。PBMSCs和BMMSCs的GAG表达持续增加(图5B)。在体外培养14天MSCs的GAG分泌量与ACCs相似,在21天时,MSCs的GAG含量多于ACCs组。在各时间点,PBMSCs和BMMSCs组的GAG含量均无显著差异。如图6所示,体外成软骨诱导培养3周后MSCs周围均出现细胞外高强度COL 2表达,且与软骨细胞相似。如图7所示,ELISA法检测细胞外基质COL 2分泌情况发现3种细胞支架在共培养3周过程中COL 2分泌均逐渐增加。接种ACCs的DCB支架分泌COL 2逐渐减少,但COL 2在第21天时仍然高于接种MSCs的DCB支架。

图5 DNA含量测定(A)和DMMB法检测GAG含量(B)(n=3)
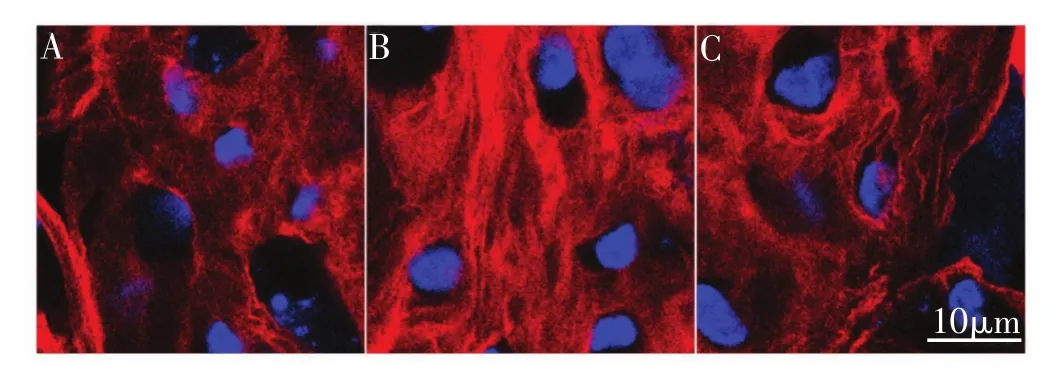
图6 支架内细胞体外成软骨诱导3周后3组细胞均显示高强度COL 2表达

图7 ELISA法检测COL 2的分泌含量(n=3)
2.4 基因表达分析
3组细胞间的基因表达在体外诱导培养14天和21天时均有显著区别(图8)。与14天比较,MSCs组在21天时的透明软骨特异性基因(AGC,COL 2)表达明显上调(P<0.01),成骨基因 ALP相比升高(P<0.01)。ACCs组在21天时的透明软骨基因和成骨基因ALP相比14天显著下调(P<0.01)。MSCs组的纤维软骨基因COL 1表达趋势逐渐增加,而ACCs组表达趋势逐渐减少。此外,3种细胞组之间的基因表达也有显著区别。在成软骨诱导14天时,PBMSCs和BMMSCs表达COL 2,AGC,COL 1和ALP的水平仍然显著低于ACCs(P<0.05)。在21天时,MSCs组的COL 2和ALP的基因表达显著高于ACCs组(P<0.05);MSCs组AGC的表达虽增加,但仍弱于ACCs(P<0.05);MSCs的COL 1表达水平和ACCs无显著差异(P>0.05)。

图8 RT-PCR法检测3种细胞COL 2,AGC,COL 1以及ALP的基因表达含量(n=3)
3 讨论
本研究比较了PBMSCs、BMMSCs和ACCs三种细胞在DCB支架的3D微环境中的增殖以及成软骨分化能力。发现PBMSCs在DCB中维持增殖,且细胞活性良好;PBMSCs在DCB中可以分化为软骨细胞并且分泌大量软骨特异性细胞外基质;在3D培养条件下,PBM⁃SCs具有与BMMSCs相似的增殖以及向软骨细胞分化的能力。目前对于PBMSCs的生物学行为研究多数是基于2D平面培养的结果,本研究对PBMSCs在体外3D微环境中的细胞生物学特性进行详尽研究,具有创新性。
SEM观察发现,3种细胞均能够贴附在DCB支架的表面和孔的侧壁。体外培养3天后,共聚焦显微镜观察发现PBMSCs在DCB上的分布均匀,支架内部中也有大量细胞,死细胞极少,因此PBMSCs具有BMMSCs和ACCs相似的细胞活性。此外,CCK-8和DNA含量检测发现PBMSCs数量逐渐增加,上述这些结果均表明PBMSCs具有良好的生物增殖和软骨分化能力,同时猪来源的DCB支架具有良好的生物相容性。
DMMB和ELISA检测结果表明在成软骨诱导培养3周后,PBMSCs和BMMSCs产生的GAG和COL 2逐渐增加,在21天时,GAG含量已明显高于ACCs;荧光检测发现3种种子细胞分泌的COL 2水平相似(图6),但ELISA定量检测结果表明MSCs组的COL 2的蛋白水平仍然低于ACCs组。此外,干细胞向软骨细胞分化伴随着一系列软骨特异性基因的表达,包括COL 2,AGC等。3D环境中体外成软骨诱导培养3周后,外周血和骨髓来源的MSCs都能表达AGC和COL 2,且AGC表达水平与ACCs相似,但COL 2的基因表达水平高于ACCs。因为GAG和COL 2是软骨基质中的重要多糖类物质和主要胶原,我们可以认为PBMSCs在3D微环境以及成软骨诱导因子的双重作用下成功分化为软骨细胞。尽管第21天时PBMSCs和BMMSCs的COL 2基因表达水平均强于ACCs组,但ELISA结果提示MSCs的COL 2蛋白表达水平仍然弱于ACCs组。基因表达和蛋白表达的不一致可能与此前报道的mRNA转录后调节有关[9]。例如,miRNAs可以通过对mRNA的降解或者沉默来调控骨关节炎进程以及成软骨过程中的蛋白质转录[10]。此外,本研究中ACCs在21天时仍然分泌更多COL 2可能与我们使用较早代数的ACCs(P3)有关。有研究发现在支架中培养的MSCs分泌的COL 2或者AGC与ACCs相似甚至更多[11-14]。这些研究中所采用的软骨细胞是骨关节炎的ACCs或者体外扩增多次的ACCs。
RT-PCR结果提示ALP和COL 1在体外培养3周后升高,这一现象与MSCs的自发成骨能力有关[15]。但纤维软骨基因COL 1和成骨基因ALP的表达水平远远低于透明软骨基因COL 2和AGC。与基线水平(第3天)相比,在DCB中成软骨诱导培养的条件下MSCs和ACCs仅有低水平的ALP和COL 1水平的表达。此外,纤维软骨基因COL 1和成骨基因ALP的表达还与材料本身的性质有关。有研究表明材料本身影响细胞的粘附、生长和分化[16]。COL 1是骨基质有机物的主要成分,也是纤维软骨的主要成分,被认为可以促进骨生成[17,18],因此可能与DCB支架中种子细胞表达COL 1和ALP有关[19-22]。其他材料制作的支架也发现了这两种基因的升高[12,23,24],这提示在体外条件下维持MSCs或者ACCs的软骨细胞表型,杜绝软骨细胞发生肥大或者分化成为成骨细胞还需要更多深入的研究。
两种来源的MSCs在DCB支架中进行成软骨诱导培养未显示明显成软骨特性的差异,这可能与PBMSCs是由骨髓中的MSCs动员而来[25],而且3D的细胞培养条件比平面培养更能模仿体内的微环境[26,27]有关。不同的3D微环境对MSCs的成软骨能力也有影响[28,29],还需要更多的比较研究进一步评价在不同的3D支架中,PBMSCs增殖和成软骨能力的变化。
DCB是常用的软骨组织工程的3D培养支架[21,30];相对于同种异体骨而言,猪来源的DCB更加广泛和易于获取,也更有可能应用于临床,因此,在本研究中我们选取了猪来源的DCB。DCB的主要成分是COL 1,经过脱蛋白处理后其抗原表面决定簇被破坏,不会导致免疫反应[31],3种细胞和DCB之间良好的生物相容性提示DCB是一种安全的生物活性材料,具有良好的组织工程软骨应用前景。
本研究主要在天然材料DCB中进行,还存在一些不足之处。PBMSCs在其他材料制备的支架,如高分子支架中的生物学特性还需要进一步验证。
4 结论
外周血来源的间充质干细胞在异种脱矿松质骨支架中具有与骨髓间充质干细胞相似的良好的增殖和成软骨能力,但体外培养条件下依然存在肥大软骨细胞基因表达的现象,需要对培养条件进一步优化。鉴于外周血来源广泛,可微创获取,因此外周血来源的间充质干细胞可以作为一种极具应用前景的新型种子细胞用于组织工程软骨构建。
