肺癌肿瘤抑制因子1在雌激素受体、孕激素受体不同表达乳腺癌患者中的临床意义
2017-10-21庄轶轩陈炯玉洪超群
吴 晓,庄轶轩,陈炯玉,洪超群,张 凡
肺癌肿瘤抑制因子1在雌激素受体、孕激素受体不同表达乳腺癌患者中的临床意义
吴 晓,庄轶轩,陈炯玉,洪超群,张 凡
目的分析肺癌肿瘤抑制因子1(tumor suppressor in lung cancer 1,TSLC1)与乳腺癌临床病理和预后关系。方法 收集女性乳腺癌组织125例,采用免疫组织化学技术检测TSLC1表达。结果 TSLC1主要表达在乳腺癌细胞质,其阳性率为38.4%(48/125),与患者的年龄、肿瘤大小、淋巴结转移、临床分期、人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)表达无关,而与雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)表达相关(P<0.001)。 ER+(阳性)患者 TSLC1 阳性率低于ER-(阴性)患者[28.4%(25/88)与62.2%(23/37)];同样,PR+患者TSLC1阳性率低于PR-患者[24.3%(17/70)与56.4%(31/55)]。Z检验显示在ER+PR-的乳腺癌患者中TSLC1-和TSLC1+患者3年生存率差异有统计学意义(83.3%与14.3%,P=0.007),总体生存曲线差异有统计学意义(P=0.003)。Cox多因素回归分析,TSLC1不是ER+PR-乳腺癌患者独立的危险预后因素(比值比10.696,95%可信区间0.988~115.843,P=0.051)。结论 TSLC1在乳腺癌致病机制中与ER、PR相关,可作为临床ER+PR-乳腺癌患者新的预后指标。
乳腺癌;肺癌肿瘤抑制因子1;雌激素受体;孕激素受体;免疫组织化学;预后
乳腺癌是我国女性最常见的恶性肿瘤[1],据世界卫生组织数据显示,2008年我国女性乳腺癌的年龄标化发病率为21.6/10万、占所有癌症新发病例的14.2%,年龄标化病死率5.7/10万、占所有癌症死亡人数6.1%,5年患病率为120.8/10万,可见乳腺癌已成为中国女性健康的巨大威胁。
乳腺癌的致病是一个多阶段、多因素的复杂过程,致病机制包括环境、生活习惯、基因改变等。基因改变涉及转录组、蛋白组以及表观遗传学的变化,已成为目前研究的重点和热点[2]。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)已经普遍用在分子水平对乳腺癌患者进行分型,对乳腺癌预后和治疗的选择有重要的指导意义[3]。ER在约75%的乳腺癌患者中有表达[4],雌激素与ER结合,可以诱导乳腺癌细胞分裂增殖[5];同时,雌激素可以诱导目标细胞PR生成,增强孕激素的作用[6]。孕激素的效应随着组织细胞、环境或培养条件的不同而有差异,既可以促进乳腺癌细胞DNA合成进而促进细胞增殖,也可抑制乳腺癌细胞的生长[7]。ER和PR作为病理常规检测的分子,对乳腺癌内分泌治疗如他莫昔芬具有重要的指导意义。目前,普遍认为辅助内分泌治疗的决定因素是激素受体状况,ER+(阳性)者效果最好,部分 ER-(阴性)但 PR+的患者也可以使用他莫昔芬[8]。虽然ER+的乳腺癌是主要的乳腺癌分子分型,但有研究指出ER+PR-或ER-PR+是在临床上和生物学上均不同于ER+PR+或ER-PR-的类型[9]。因此,将ER和PR联合考虑对乳腺癌研究具有重要意义。
在肺癌中首次发现的肺癌肿瘤抑制因子1(tumor suppressor in lung cancer 1,TSLC1)基因,属于免疫球蛋白超家族成员之一,涉及的功能包括细胞黏附、增殖、分化,在多种癌症包括非小细胞肺癌、宫颈癌、结肠癌、喉癌、头颈部肿瘤、食管癌、卵巢癌等中发挥抑制癌细胞迁移和浸润的作用[10-12]。有研究却指出,在部分肿瘤(如默克尔细胞癌[13]、T细胞血癌、小细胞肺癌[14])中TSLC1-预示低恶性程度和良好生存预后。因此,提示TSLC1很可能在肿瘤致病机制中具有两面性,取决于肿瘤细胞类型以及TSLC1剪接体、转录本、表观遗传调控(包括甲基化、微小RNA)的不同。既往研究显示,乳腺癌组织中TSLC1甲基化与ER和PR相关[15];另外,有研究指出TSLC1与激素受体无关[16]。鉴于其有限样本及ER和PR在乳腺癌研究的重要性,进一步研究TSLC1的表达对ER和PR不同表达乳腺癌致病的作用具有重要意义。作者分析TSLC1在ER、PR不同表达乳腺癌组织中及其临床病理、预后的关系,旨在为乳腺癌患者的预后判断提供指导。
1 资料与方法
1.1 样本来源 2001年10月—2010年12月在汕头大学医学院附属肿瘤医院接受外科手术治疗的125例女性乳腺癌患者,年龄>50岁62例、≤50岁63例,石蜡包埋乳腺癌组织样本均有病理确诊;其中,ER+88例、ER-37例,PR+70 例、PR-55例,HER-2+59例、HER-2-66例。所有患者手术前均未经过放疗、化疗或内分泌治疗。根据2002年美国癌症联合委员会第6版分期标准(肿瘤淋巴结转移分期):肿瘤大小T1~T272例、T3~T452例,缺失1例;淋巴结转移N0~N150例、N2~N374例,缺失 1例;临床分期Ⅰ~Ⅱ期42例、Ⅲ~Ⅳ期为82例,缺失1例。临床病理资料见表1。总生存期是指从患者入院到死于乳腺癌的这段时间。随访资料来自医院随访室(电话随访),109例有随访信息,16例没有随访信息(缺失率12.8%)。根据ER和PR的表达情况,将乳腺癌患者分为 ER-PR-30例、ER+PR-14例、ER-PR+1例、ER+PR+64例 4组。 中位观察时间 38(2~139)个月。本研究由汕头大学医学院附属肿瘤医院伦理委员会审核并批准,所有患者或其亲属均阅读并签订知情同意书。

表1 TSLC1表达与乳腺癌患者临床病理特征的关系[n(%)]
1.2 方法
1.2.1 免疫组织化学法主要试剂及方法 术后样本在常规10%中性甲醛溶液中固定,经脱水、浸蜡、石蜡包埋保存。进行免疫组织化学检测时,石蜡切片经二甲苯脱蜡、梯度乙醇水化,乙二胺四乙酸微波高压抗原修复,3%过氧化氢封闭内源性过氧化氢酶,滴加正常羊血清以封闭非特异性的背景染色。滴加适当稀释一抗(1∶200),兔抗人TSLC1多克隆抗体(英国Abcam公司),磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗后滴加适量GTVision即用型二抗(丹麦DAKO公司)。二氨基联苯胺法(厦门迈新生物技术有限公司)染色,苏木素复染。用已知阳性组织切片作为阳性对照,阴性对照用PBS代替一抗,同时每例取一张切片做苏木素-伊红染色观察形态学[17]。
1.2.2 评分标准 由2位病理医生对染色结果进行评估。采用2种计分法:①按阳性细胞百分比计分,在高倍显微镜下,每张切片随机选择5个视野,观察计数100个肿瘤细胞的阳性百分比,阳性百分比≤5%为0分、6%~25%为1分、26%~50%为2分、51%~75%为3分、>75%为4分;②按着色强度计分,无阳性着色为0分、黄色阳性颗粒为1分、棕黄色阳性颗粒为2分、棕褐色阳性颗粒为3分。将阳性细胞百分比评分与着色强度评分相乘综合评定染色结果,≤2分的为TSLC1-,>2分的为TSLC1+。
1.3 统计学处理 应用SPSS 17.0软件,TSLC1表达与临床病理特征之间的关系采用χ2检验,生存曲线采用Kaplan-Meier法和Log-rank绘制比较,3年生存率比较采用Z检验,生存分析采用Cox回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 TSLC1表达情况及其与乳腺癌患者临床病理特征的关系 在乳腺癌组织中,TSLC1主要表达于细胞质,呈黄色或棕黄色(图1)。125例乳腺癌组织中TSLC1阳性率38.4%(48/125)。ER+患者中,TSLC1阳性率28.4%(25/88),低于ER-患者62.2%(23/37),差异有统计学意义(χ2=12.546、P<0.001);同样,TSLC1阳性率在PR+患者中24.3%(17/70),也低于PR-患者56.4%(31/55),差异也有统计学意义(χ2=13.398、P<0.001)。 此外,TSLC1 的表达与年龄(χ2=0.088、P=0.766)、肿瘤大小(χ2=0.489、P=0.485)、淋巴结转移(χ2=0.018、P=0.894)、临床分期(χ2=0.240、P =0.624)、HER-2 的表达(χ2=0.746、P=0.388)均无关(表 1)。

图1 TSLC1在乳腺癌组织中的表达(免疫组织化学染色×400)
2.2 TSLC1的表达与乳腺癌患者预后的关系 有随访记录的109例中,TSLC1不同表达患者3年生存率(P=0.437,表2)与总体生存曲线(P=0.416,图2)差异均无统计学意义。30例ER-PR-患者中,TSLC1不同表达患者3年生存率(P=0.434,表2)与总体生存曲线(P=0.375,图2)差异均无统计学意义。14例ER+PR-患者中,TSLC1不同表达患者3年生存率(P=0.007,表2)与总体生存曲线(P=0.003,图2)差异均有统计学意义。64例ER+PR+患者中,TSLC1不同表达患者 3年生存率(P=0.343,图2)与总体生存曲线(P=0.686,图2)差异均无统计学意义。因ER-PR+的乳腺癌患者只有1例,未进行生存率分析。

表2 乳腺癌患者3年生存率

图2 TSCL1不同表达的乳腺癌患者总体生存曲线
Cox回归单因素和多因素(校正的因素包括年龄、肿瘤大小和淋巴结转移)分析显示,在所有125例中,TSLC1不是乳腺癌的预后因子(表3)。在ER+PR+患者中,TSLC1也不是乳腺癌预后因子(表3)。而在ER+PR-中,单因素分析显示TSLC1是乳腺癌患者生存危险预后因子(P=0.040,表3);而在校正年龄、肿瘤大小和淋巴结转移后,多因素分析显示TSLC1不是独立的危险预后因子(P=0.051),但P值接近于0.05。且在ER-PR-患者中,未发现TSLC1对乳腺癌患者的生存有显著影响(表3)。
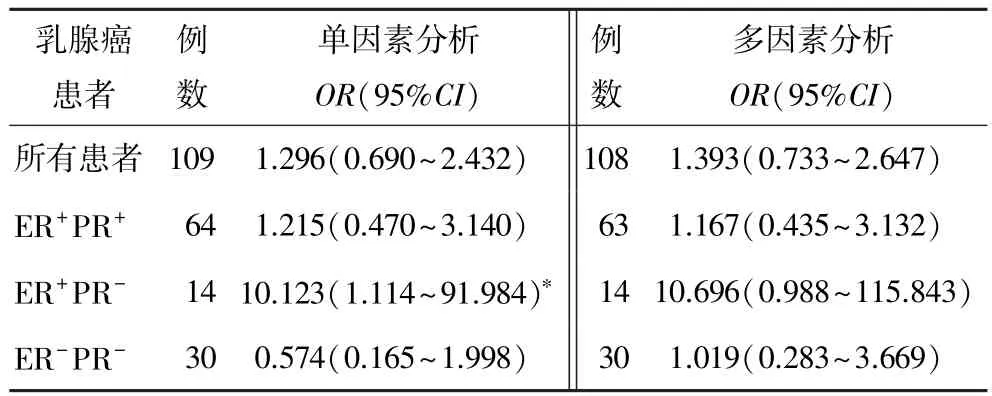
表3 乳腺癌患者生存影响因素的Cox回归分析
3 讨论
TSLC1基因位于染色体11q23.2,编码跨膜糖蛋白包含胞外域、跨膜域和胞质域。TSLC1表达缺失可见于多种癌症,包括乳腺癌。Fukami等[18]指出在3株乳腺癌细胞(YMB-1、OCUB-F和OCUB-M)中,TSCL1在YMB-1中表达缺失;另外,也有研究指出,在乳腺癌组织中检测出较高频率的TSLC1基因杂合缺失或高甲基化水平[19]。Heller等[15]证实TSLC1在多种乳腺癌细胞系(HCC1599、HC202、MDA-MB231、MDA-MB468和BT-20)表达缺失,免疫组织化学显示TSLC1具有较多的低表达率(86%,43/50),与其高甲基化水平有关;同时,提出TSLC1的甲基化水平与ER、PR呈负相关。尽管如此,研究所用的样本量有限,并未直接描述TSLC1和乳腺癌临床病理特征的关系。 另外,Takahashi等[16]却指出,TSLC1-与肿瘤大小相关,与激素受体无关。本研究纳入125例乳腺癌患者,免疫组织化学结果显示TSLC1阳性率为38.4%,主要表达于细胞质,χ2分析显示TSLC1的表达与年龄、肿瘤大小、淋巴结转移、临床分期和HER-2无关(P>0.05),但与ER、PR表达显著相关(P<0.001)。 ER-或PR-的乳腺癌患者 TSLC1阳性率较高。既往研究虽然指出TSLC1高甲基化多见于ER-或PR-的乳腺癌患者,提示TSLC1表达与ER、PR呈正相关关系,但缺乏直接证据[15];而虽然Takahashi等[16]指出TSLC1与激素受体无关,但其未单独考虑ER、PR和TSLC1的关系。本研究分析提示,TSLC1在乳腺癌中与ER、PR呈显著负相关。结论与既往研究不一致的原因可能是实验条件不一致和(或)TSLC1评分标准不一所致。TSLC1与ER、PR的关系仍需进一步扩大样本量进行分析,从而得出可靠的结论。
TSLC1最初是在肺癌研究中发现,并认为其是抑癌基因。TSLC1在正常组织,特别是肺、脑、肝和皮肤组织普遍表达。随后研究发现在多种肿瘤,如胃癌、肝癌、宫颈癌、鼻咽癌、乳腺癌、前列腺癌和乳腺癌中TSLC1低表达[20]。目前,大部分研究认为TSLC1是抑癌基因,在多种癌症致病机制中发挥抑制癌细胞增殖、转移和浸润的作用。近年,有研究却显示TSLC1在肿瘤致病机制中可能发挥双重作用[14,20]。Kikuchi等[14]指出,相对于贴壁培养的小细胞肺癌细胞和非小细胞肺癌细胞,TSLC1倾向于在悬浮的培养基培养的小细胞肺癌细胞中表达。转染过表达TSLC1载体促进肿瘤的形成,因此TSLC1+与癌症的恶性程度高度相关。Sasaki等[21]指出相对于T细胞,TSLC1在成人T细胞血癌中过表达,可作为新的成人T细胞血癌的辅助诊断靶点,并且可以预测肿瘤的浸润和转移等。有研究指出,在Merkel细胞癌中,TSLC1+患者生存率显著降低,可作为该肿瘤预后因子[13]。本研究生存分析显示,在所有125例乳腺癌患者中TSLC1对生存无显著影响。既往研究提示,ER+PR+、ER-PR-、ER+PR-、ER-PR+的乳腺癌在临床上和生物行为上有明显差异[22]。而本研究提示TSLC1与ER、PR显著相关,在ER-PR-组中,TSLC1+患者3年生存率高于TSLC1-患者,但差异无统计学意义(P=0.434);在 ER+PR+组中,TSLC1+患者3年生存率与TSLC1-患者差异无统计学意义(P=0.343);而在 ER+PR-组中,TSLC1+患者的 3 年生存率显著低于TSLC1-的患者,差异有统计学意义(P=0.007)。 生存曲线显示 ER-PR-组中,TSLC1+患者总体生存率高于TSLC1-患者,但差异无统计学意义(P=0.375),考虑到样本量限制,应扩大样本量进一步研究;ER+PR+组中,TSLC1+患者总体生存率与TSLC1-患者比较,差异无统计学意义(P=0.686);而在 ER+PR-组中,TSLC1+患者总体生存率低于TSLC1-患者,差异有统计学意义(P=0.003);但Cox多因素回归分析显示,TSLC1不是ER+PR-组乳腺癌患者独立的危险因子(P=0.051),考虑到样本量的限制,应进一步扩大样本量明确TSLC1对ER+PR-患者预后的预测作用。TSLC1对ER、PR不同表达的乳腺癌患者生存影响不同,提示TSLC1在致癌过程中发挥双重作用,也提示联合ER、PR分析TSLC1对乳腺癌发生、发展作用的重要性。
本研究结果表明,在乳腺癌患者中TSLC1表达与ER、PR显著相关,ER-或PR-的患者中TSLC1的阳性率高。此外,TSLC1与ER+PR-乳腺癌患者的预后明显相关,是生存预后的危险因子,对判断乳腺癌预后有重要的参考价值。推测TSLC1对乳腺癌发生、发展和预后的作用与ER、PR相关,但具体机制尚不明确。鉴于TSLC1在致癌机制中的双重影响和复杂性,应进一步扩大样本量明确ER、PR与TSLC1的关系,探索TSLC1对不同分子分型乳腺癌发生、发展的作用。
[1]黄哲宙,陈万青,吴春晓,等.中国女性乳腺癌的发病和死亡现况——全国32个肿瘤登记点2003—2007年资料分析报告[J].肿瘤,2012,32(6):435-439.
[2]Perou CM,Sørlie T,Eisen MB,et al.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[3]Parsa Y,Mirmalek SA,Kani FE,et al.A review of the clinical implications of breast cancer biology[J].Electron Physician,2016,8(5):2416-2424.
[4]南昊成,吴立刚,刘奇伦.乳腺癌分子标志及分子分型研究进展[J].现代肿瘤医学,2013,21(9):2143-2146.
[5]Foidart JM,Colin C,Denoo X,et al.Estradiol and progesterone regulate the proliferation of human breast epithelial cells[J].Fertil Steril,1998,69(5):963-969.
[6]Lanari C,Molinolo AA.Progesterone receptors--animal models and cell signalling in breast cancer.Diverse activation pathways for the progesterone receptor:possible implications for breast biology and cancer[J].Breast Cancer Res,2002,4(6):240-243.
[7]Lange CA,Richer JK,Horwitz KB.Hypothesis:progesterone primes breast cancer cells for cross-talk with proliferative or antiproliferative signals[J].Mol Endocrinol,1999,13(6):829-836.
[8]江泽飞,徐兵河,宋三泰,等.乳腺癌内分泌治疗的基本共识[J].中华肿瘤杂志,2006,28(3):238-239.
[9]Ozguzer A,Bayol U,Pala EE,et al.Does single receptor positive breast carcinoma differ with regard to age,tumor grade,and HER2 amplification status?[J].J BUON,2016,21(1):21-26.
[10]Vallath S,Sage EK,Kolluri KK,et al.CADM1 inhibits squamous cell carcinoma progression by reducing STAT3 activity[J].Sci Rep,2016,6:24006.
[11]Zeng D,Wu X,Zheng J,et al.Loss of CADM1/TSLC1 expression is associated with poor clinical outcome in patients with esophageal squamous cell carcinoma[J].Gastroenterol Res Pract,2016,2016:6947623.
[12]Hui AB,Lo KW,Kwong J,et al.Epigenetic inactivation of TSLC1 gene in nasopharyngeal carcinoma[J].Mol Carcinog,2003,38(4):170-178.
[13]Iwasaki T,Matsushita M,Nonaka D,et al.Lower expression of CADM1 and higher expression of MAL in Merkel cell carcinomas are associated with Merkel cell polyomavirus infection and better prognosis[J].Hum Pathol,2016,48:1-8.
[14]Kikuchi S,Iwai M,Sakurai-Yageta M,et al.Expression of a splicing variant of the CADM1 specific to small cell lung cancer[J].Cancer Sci,2012,103(6):1051-1057.
[15]Heller G,Geradts J,Ziegler B,et al.Downregulation of TSLC1 and DAL-1 expression occurs frequently in breast cancer[J].Breast Cancer Res Treat,2007,103(3):283-291.
[16]Takahashi Y,Iwai M,Kawai T,et al.Aberrant expression of tumor suppressors CADM1 and 4.1B ininvasivelesionsof primary breast cancer[J].Breast Cancer,2012,19(3):242-252.
[17]洪超群,张凡,吴晓,等.雌激素受体阳性乳腺癌组织PIMT蛋白表达临床意义探讨[J].中华肿瘤防治杂志,2015,22(13):1014-1018.
[18]Fukami T,Fukuhara H,Kuramochi M,et al.Promoter methylation of the TSLC1 gene in advanced lung tumors and various cancer cell lines[J].Int J Cancer,2003,107(1):53-59.
[19]Allinen M,Peri L,Kujala S,et al.Analysis of 11q21-24 loss of heterozygosity candidate target genes in breast cancer:indications of TSLC1 promoter hypermethylation[J].Genes Chromosomes Cancer,2002,34(4):384-389.
[20]Lei W,Liu HB,Wang SB,et al.Tumor suppressor in lung cancer-1(TSLC1)mediated by dual-regulated oncolytic adenovirus exerts specific antitumor actions in a mouse model[J].Acta Pharmacol Sin,2013,34(4):531-540.
[21]Sasaki H,Nishikata I,Shiraga T,et al.Overexpression of a cell adhesion molecule,TSLC1,as a possible molecular marker for acute-type adult T-cell leukemia[J].Blood,2005,105(3):1204-1213.
[22]Liu S,Chia SK,Mehl E,et al.Progesterone receptor is a significant factor associated with clinical outcomes and effect of adjuvant tamoxifen therapy in breast cancer patients[J].Breast Cancer Res Treat,2010,119(1):53-61.
Clinical significance of tumor suppressor in lung cancer 1 for breast cancer with different expression of estrogen receptor and progesterone receptor
WU Xiao, ZHUANG Yixuan, CHEN Jiongyu, HONG Chaoqun, ZHANG Fan
(Department of Central Laboratory, Cancer Hospital of Shantou University Medical College,Shantou Guangdong 515041,China)
ObjectiveTo study the protein expression of tumor suppressor in lung cancer 1(TSLC1)to understand its relationship with clinicopathological parameters and its influence on the prognosis of human breast cancer.Methods We collected tumor tissues from 125 female patients with breast cancer treated at the Cancer Hospital of Shantou University Medical College from October 2001 to December 2010.Immunohistochemistry was performed to detect the protein expression of TSLC1 in breast tumors,and the chi-square test was used to study the relationship between the TSLC1 expression and clinicopathological parameters.The Z test,Kaplan-Meier method and Cox regression model were conducted to study the influence of TSLC1 on the prognosis of breast cancer.Results TSLC1 protein was expressed primarily in the cytoplasm.The positive rate of TSLC1 in 125 breast tumors was 38.4%(48/125).The chi-square test revealed that the TSLC1 expression was not related to age(P=0.766),tumor size(P=0.485),lymph node metastasis(P=0.894),clinical stages(P=0.624),and human epidermal growth factor receptor-2(HER-2)expression(P=0.388),but significantly associated with estrogen receptor(ER)and progesterone receptor(PR)(P<0.001).Out of 88 ER+patients, 25 patients were stained TSLC1+(28.4%), which is significantly lower than that of ER-patients(62.2%,23/37).Similarly,out of 70 PR+patients,17 patients were stained TSLC1+(24.3%), and significantly lower than that of PR-patients(56.4%,31/55).The overall 3-years survival rates were significantly different between the TSLC1-group and the TSLC1+group(83.3%vs.14.3%,P=0.007),and the survival curves in these two groupswere significantly different(P=0.003).Multivariate Cox regression model demonstrated that TSLC1[odds ratio(OR)10.696,95%confidence intervals(CI)0.988—115.843, P=0.051)]were not the independent unfavorable prognostic factors for ER+PR-breast cancer.Conclusion TSLC1 is associated with ER and PR in the progression of breast cancer,and could be a novel prognostic factor for ER+PR-breast cancer.
Breast cancer; Tumor suppressor in lung cancer 1(TSLC1); Estrogen receptor(ER);Progesterone receptor(PR);Immunohistochemistry;Prognosis
R737.9
A
2095-3097(2017)05-0261-06
10.3969/j.issn.2095-3097.2017.05.002
汕头市医疗科技计划项目基金资助(汕府科[2014]62号);广东省医学科学技术研究基金资助(A2017425)
515041广东汕头,汕头大学医学院附属肿瘤医院中心实验室(吴 晓,庄轶轩,陈炯玉,洪超群,张 凡)
张 凡,E-mail:lemon_fan@163.com
2017-05-19 本文编辑:徐海琴)
