大鼠肠道菌群对羊耳菊提取物的代谢作用研究
2017-10-20巩仔鹏侯靖宇李梅吴林霖陈亭亭李勇军王爱民兰燕宇王永林
巩仔鹏+侯靖宇 李梅 吴林霖 陈亭亭 李勇军+王爱民 兰燕宇+王永林

[摘要]考察大鼠肠道菌群对羊耳菊提取物中主要成分的代谢作用,将羊耳菊提取物与大鼠肠道菌液在厌氧条件下共同孵育24 h,通过正丁醇液液萃取处理后,采用色谱联用技术(UPLCQTOFMS/MS)对代谢产物进行定性分析,并结合布鲁克公司研发的数据处理工具Metabolite Tools,Data Analysis等对代谢信息进行综合分析。通过比较空白样品图谱,肠菌样品图谱以及两者的差异图谱,各色谱峰的准分子离子,碎片离子,分析羊耳菊提取物在大鼠肠道菌群作用下可能产生的代谢产物。结果提示,羊耳菊提取物在肠道菌群作用下,检测到14个代谢产物,主要包括单咖啡酰基奎宁酸的异构,水解的小分子化合物和咖啡酸的还原,甲基化和乙酰化等代谢产物,同时仅检测到1个二咖啡酰基奎宁酸的甲基化代谢产物。以此推测,咖啡酰基奎宁酸类成分在肠道菌群的作用下可能多数水解为分子量小,疏水性更强的代谢产物,使得其更容易被肠道吸收。
[关键词]羊耳菊提取物; 肠道菌群; 代谢产物; UPLCQTOFMS/MS
Metabolism of Inula cappa extract by rat intestinal bacteria in vitro
GONG Zipeng1,2,3,4, HOU Jingyu1,2,3,4, LI Mei1,2,3,4, WU Linlin1,2,3,4, CHEN Tingting1,2,3,4,
LI Yongjun1,2,3,4, WANG Aimin1,2,3,4, LAN Yanyu1,2,3,4, WANG Yonglin1,2,3,4*
(1. Guizhou Provincial Key Laboratory of Pharmaceutics, Guizhou Medical University, Guiyang 550004, China;
2. Engineering Research Center for the Development and Application of Ethnic Medicine and Traditional Chinese Medicine
(Ministry of Education), Guizhou Medical University, Guiyang 550004, China;
3. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China;
4. National Engineering Research Center of Miao′s Medicines, Guiyang 550004, China)
[Abstract]To investigate the metabolism of major components in Inula cappa by rat intestinal bacteria in vitro I cappa extract was incubated for 24 h with rat intestinal bacteria under anaerobic environment After the samples were precipitated by nbutanol, UPLCQTOFMS/MS was applied for the qualitative analysis of the metabolites, combined with data software such as Metabolite Tools, Data Analysis and so on The potential metabolites in rat intestinal bacteria were analyzed by comparing the total ion current of the test samples and blank samples and analyzing the quasimolecular ion and fragment ion of all chromatograms The results injected that fourteen metabolites were detected in rat intestinal flora Various types of metabolic reactions happen to caffeoylquinic acid in intestinal flora, including isomerization, hydrolyzation, there were also methylation, hydrogenation and acetylation of caffeic acid At the same time, a methylate of dicaffeoylquinic acid was also detected Presumably, caffeoylquinic acids were gradually transformed into more hydrophobic metabolites with smaller molecular mass, which were better absorbed by the intestinal tract.
[Key words]Inula cappa extracts; intestinal bacteria; metabolites; UPLCQTOFMS/MS
中藥及其制剂的给药方式多数以口服为主,在胃肠道被吸收后分布到靶器官从而发挥疗效,再经代谢作用最后排出体外。胃肠道不仅是药物吸收的主要部位,同时对药物也有一定的代谢作用,部分难以吸收的药物可能在肠道菌群的作用下转变为易吸收的成分,因此肠道菌群对药物疗效的发挥起到了重要的作用。并且中药及其制剂成分复杂,在体内的代谢过程和作用机制尚不明确,直接口服给药后,研究其体内过程和直接药效物质比较困难,因此选择肠道菌群体外代谢实验,研究民族药羊耳菊中主要药效物质的体外代谢规律,能够为药材的体内过程研究奠定一定基础[14]。endprint
羊耳菊为贵州苗族及云南傣族等少数民族常用藥物,常用于感冒发热,咽喉肿痛等症,有独特疗效[5]。羊耳菊中含有较多的咖啡酰基奎宁酸酯类化合物[67],文献报道咖啡酰基奎宁酸酯类化合物有突出的抗菌、抗病毒活性[89]。而这类物质较不容易被吸收,因此容易可在肠道菌群作用下部分水解,发生一系列反应形成小分子物质后被吸收入血发挥其药理作用[1011]。尽管国内外有较多研究报道单体咖啡酰基奎宁酸类成分的代谢特征,但鲜有羊耳菊提取物中此类成分的体外肠道菌群代谢相关报道,且中药提取物成分复杂,对此类成分的代谢过程可能也有所影响,因此本实验采用离体法来研究羊耳菊提取物中的主要代谢产物,研究其在大鼠肠道菌群中的代谢情况,依此来推测羊耳菊提取物的肠道菌群代谢途径,对指导临床合理用药和羊耳菊药材新剂型的研发,具有重要的意义。
1材料
11仪器
CDH6000B Ⅱ电热恒温培养箱(天津市泰斯特仪器有限公司);SWCJ2FD 超净工作台(苏州苏洁净化设备有限公司);YXQLS18SI 手提式压力蒸汽灭菌器(上海博迅实业有限公司);厌氧产气袋(AnaeroPackAnaero,MGC,日本三菱瓦斯化学株式会社);厌氧培养罐(PackRectangular Jars,日本三菱瓦斯化学株式会社);超高压效液相色谱四极杆飞行时间串联质谱仪(Agilent Technologies 1290 Infinity液相色谱系统, 布鲁克道尔顿四极杆飞行时间质谱仪);Allegra 64R低温高速离心机(Beckman Coulter);MTN2800D氮吹仪(天津奥特塞恩斯仪器有限公司)。
12试药
羊耳菊药材购自贵州龙里县,由贵州医科大学药学院生药学教研室龙庆德副教授鉴定为菊科植物羊耳菊Inula cappa(BuchHam) DC的干燥全草。绿原酸对照品(中国食品药品检定研究院,批号110753201415),新绿原酸(批号X2020141012)、隐绿原酸(批号Y5820141012)、1,3O二咖啡酰基奎宁酸(批号1384101215)、3,4O二咖啡酰基奎宁酸(批号1384101215)、3,5O二咖啡酰基奎宁酸(批号S34110121)、4,5O二咖啡酰基奎宁酸对照品(批号1384101215)均购于中药固体制剂制造技术国家工程研究中心。
13动物
健康SD大鼠,雌雄兼用,体质量(250±20)g,由重庆腾鑫生物技术有限公司提供,合格证号SCXK (渝)20150001。
2方法
21色谱条件
色谱柱:Agilent Eclipse Plus C18 RRHD(21 mm×100 mm,18 μm);柱温40 ℃;流动相为01%甲酸乙腈(A)01%甲酸水(B);进样体积为5 μL;流速03 mL·min-1。梯度洗脱条件:0~1 min,5% ~10% A;1~13 min,10%~28%A;13~16 min,28%~100% A;16~17 min,100% A;17~18 min,100%~5% A。
22质谱条件
电喷雾离子源;扫描方式为负离子扫描(ESI-,m/z 50~1 000);毛细管电压35 kV;离子源温度200 ℃;雾化气(N2)压力12 bar;干燥气温度200 ℃;气体体积流量6 L·min-1;准确质量测定采用甲酸钠校正标准液;校正模式选用Enhanced Quadratic;数据分析采用Data Analysis软件、Metabolite Tools等。
23羊耳菊有效组分提取物的制备
通过实验室前期药效学筛选试验,确定羊耳菊有效组分的提取方式。取羊耳菊药材12 kg,充分混匀,取10倍量60%乙醇,回流提取3次,每次1 h,合并3次滤液,减压浓缩,回收乙醇,得12 L浓缩液。上述浓缩液用D101大孔树脂吸附(径高比1∶4),加水洗脱至流出液无颜色后,再用60%乙醇洗脱,收集洗脱液,蒸干,得浸膏,微波真空干燥即得提取物,得膏率为7%。各主要成分的质量分数分别为1,3O二咖啡酰基奎宁酸201%,3,4O二咖啡酰基奎宁酸382%,3,5O二咖啡酰基奎宁酸356%,4,5O二咖啡酰基奎宁酸387%,新绿原酸217%,绿原酸099%,隐绿原酸336%,-4 ℃条件干燥保存,备用。
24供试液样品的制备
称取提取物粉末1 g,精密称定,加入10 mL 50%甲醇水,超声10 min,15 000 r·min-1离心10 min,取上清液,即得,备用。
25对照品溶液的制备
分别精密称取绿原酸等7种对照品,于10 mL量瓶中,加甲醇超声溶解,定容。得绿原酸0740 g·L-1、新绿原酸1032 g·L-1、隐绿原酸1026 g·L-1、1,3O二咖啡酰基奎宁酸1064 g·L-1、3,4O二咖啡酰基奎宁酸1032 g·L-1、3,5O二咖啡酰基奎宁酸1194 g·L-1、4,5O二咖啡酰基奎宁酸1204 g·L-1的对照品溶液。-20 ℃保存,备用。
26样品处理方法
将肠菌样品分别转入进口50 mL离心管中,每管加入10 mL正丁醇,涡旋混合5 min,萃取3次,合并3次正丁醇层萃取液,6 000 r·min-1离心5 min,上清液37 ℃下N2吹干,残渣加入1 mL正丁醇溶解,涡旋混合3 min,超声5 min,15 000 r·min-1 离心10 min,上清液37 ℃下N2吹干,残渣用200 μL 50%甲醇水溶解,涡旋混合3 min,超声5 min,15 000 r·min-1离心10 min,上清液进样UPLCQTOFMS/MS分析。
27羊耳菊活性部位大鼠肠道菌群代谢[12]endprint
271大鼠肠道菌液的制备健康大鼠脱颈处死后,迅速开腹,取结肠段内容物,将其与生理盐水按1∶4混悬,4 000 r·min-1离心10 min后得到上清液,即为肠道菌液。取80 mL菌液,加入720 mL无血清厌氧培养液中,得到肠菌培养液。
272肠菌实验取上述肠菌培养液8 mL,分为4份,再分别加入6 mL已灭菌的厌氧培养液,混匀,置于厌氧条件下培养24 h,培养好后,向其中3份加入已过滤除菌的羊耳菊活性部位厌氧培养液溶液(05,10,20 g·L-1),另1份加入空白厌氧培养液作对照。另取厌氧培养液34 mL,平均分为3份于培养皿中,向其中加入已过滤除菌的羊耳菊提取物厌氧培养液溶液(05,10,20 g·L-1),作为不加肠菌的空白对照组。将上述7份培养皿置于37 ℃,厌氧条件下培养24 h,所得样品按26项下处理,进样UPLCQTOFMS/MS分析。
3结果
31UPLCQTOFMS/MS色谱采集
根据建立的方法,首先运用布鲁克道尔顿公司的Metabolite Predict软件对单咖啡酰基奎宁酸类(绿原酸、新绿原酸、隐绿原酸)和二咖啡酰基奎宁酸类(1,3O二咖啡酰基奎宁酸,3,4O二咖啡酰基奎宁酸,3,5O二咖啡酰基奎宁酸,4,5O二咖啡酰基奎宁酸)等成分进行代谢产物预测,将生成的代谢产物的Masslist导入Metabolite Detect软件,结合对照品,质谱碎片信息和相关文献得到其可能的代谢产物,推测羊耳菊提取物中各成分在体内可能的代谢途径。
32羊耳菊提取物在肠道菌群中的代谢
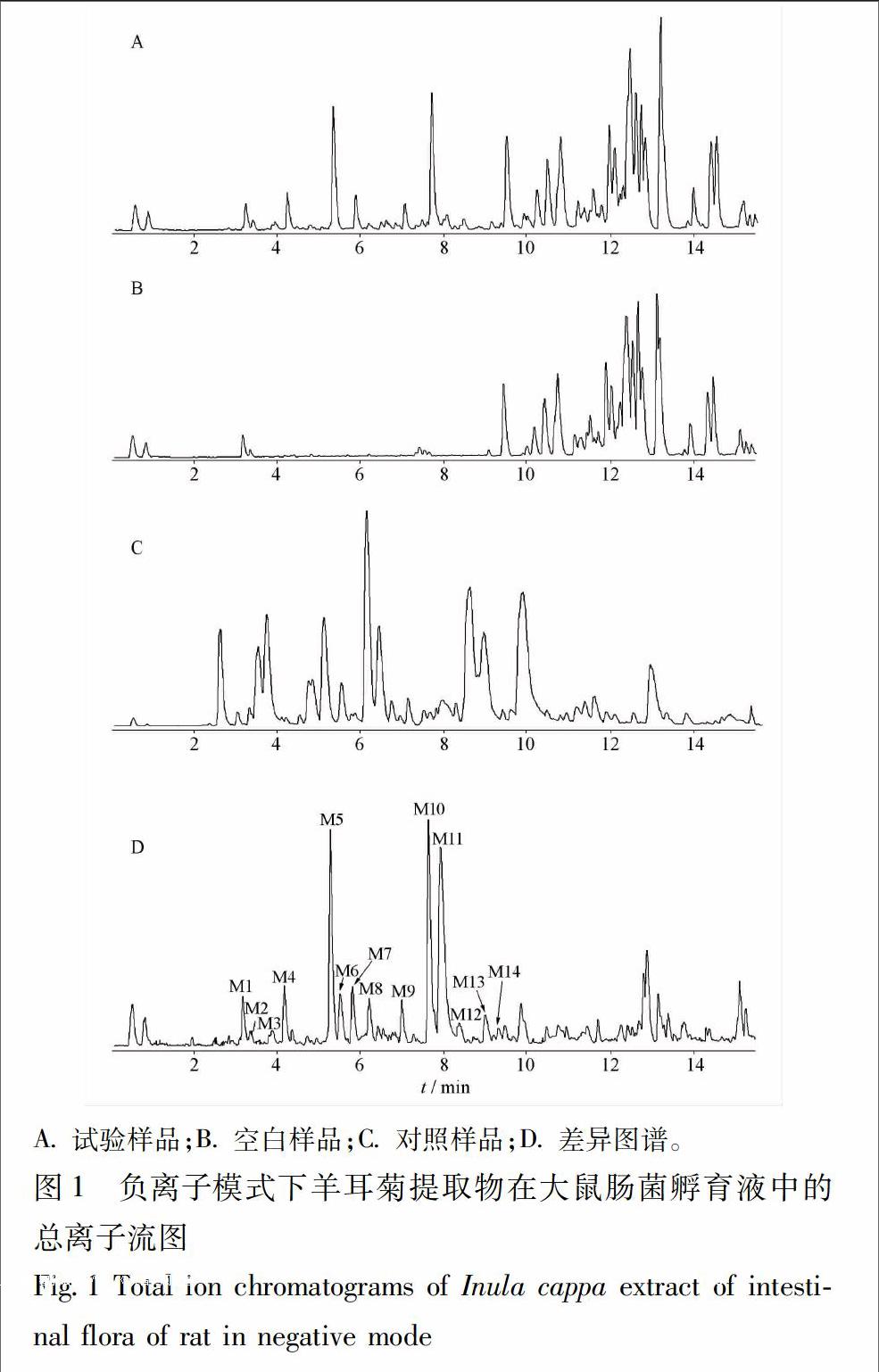
由Metabolite Detect得到空白肠菌孵育样品,提取物肠菌孵育样品,厌氧培养液孵育样品(未加肠菌)及差异图谱见图1。由图1的C图可知羊耳菊提取物在空白厌氧培养液中不干扰代谢产物的测定。
33羊耳菊提取物在肠道菌群中代谢产物的鉴定分析
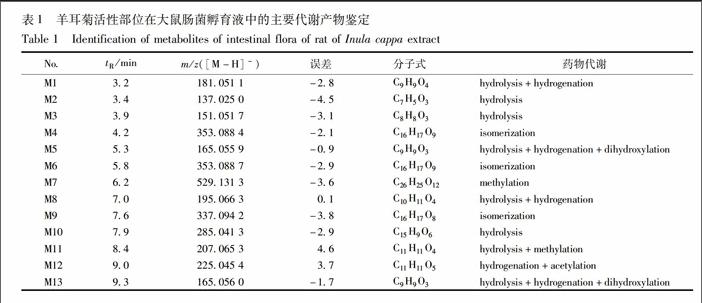
由Metabolite Detect对样品及空白图谱处理后得到的差异图谱以及响应的质谱碎片,并结合文献[1314],对羊耳菊提取物中部分代谢产物进行分析,代謝产物见表1,各代谢产物初步分析如下。
M1由差异图谱中可知,tR=32 min色谱峰的准分子离子为m/z 181051 1[M-H]-,由Smart Formula软件预测化学式为C9H9O4,比咖啡酸负离子多2个H,丢失1分子CO,产生m/z 137060 2 [M-H-CO]-的碎片,因此推测M1为咖啡酸双
键还原后的产物二氢咖啡酸。并且咖啡酸可能为咖啡酰基奎宁酸水解后的产物。
M2由差异图谱中可知,tR=34 min色谱峰的准分子离子为m/z 137025[M-H]-,由Smart Formula软件预测化学式为C7H5O3,分子式与羟基苯甲酸一致,故推测M2可能为咖啡酸的水解产物羟基苯甲酸,本实验数据不能说明取代基的位置,有待进一步研究。
M3由差异图谱中可知,tR=39 min色谱峰的准分子离子为m/z 151051 7[M-H]-,由Smart Formula软件预测化学式为C8H8O3,分子式与羟基苯乙酸一致,故推测M3可能为咖啡酸的水解产物羟基苯乙酸,本实验数据不能说明取代基的位置,有待进一步研究。
M4由差异图谱中可知,tR=42 min色谱峰的准分子离子为m/z 353088 4 [M-H]-,由Smart Formula软件预测化学式为C16H17O9,主要碎片离子为m/z 191055 2[M-H-C9H6O3]-,碎片离子和分子式与单咖啡酰基奎宁酸一致,但保留时间与绿原酸,新绿原酸,隐绿原酸对照品均不一致,并且本实验数据不能说明取代基的位置,有待进一步研究,故推测M4可能为单咖啡酰基奎宁酸酯键位置异构的代谢产物。
M5由差异图谱中可知,tR=53 min,色谱峰的准分子离子为m/z 165055 9 [M-H]-,由SmartFormula软件预测化学式为C9H9O3,分子式与羟基苯丙酸一致,但本实验数据无法确定说明取代基的位置,故推测M5可能为咖啡酸的水解产物羟基苯丙酸。
M6由差异图谱中可知,tR=58 min色谱峰的准分子离子为m/z 353088 4[M-H]-,由Smart Formula软件预测化学式为C16H17O9,主要碎片离子为m/z 191050 [M-H-C9H6O3]-,碎片离子和分子式与M4一致,可能M6与M4互为同分异构体,由于本实验数据不能说明取代基的位置,有待进一步研究,故推测M6同样可能为单咖啡酰基奎宁酸酯键位置异构的代谢产物。
M7由差异图谱中可知,tR=62 min色谱峰的准分子离子为m/z 529131 3[M-H]-,由Smart Formula软件预测化学式为C26H25O12,比二咖啡酰基奎宁酸多14,同时丢失CH2,产生的主要碎片离子为m/z 515119 7 [M-H-CH2]-,提示有甲基化反应,由于本实验数据不能说明取代基的位置,无法判断M7由哪个二咖啡酰基奎宁酸甲基化产生,故推测M7可能为二咖啡酰基奎宁酸的单甲基化产物,具体取代基位置有待进一步研究。
M8由差异图谱中可知,tR=70 min色谱峰的准分子离子为m/z 195066 3[M-H]-,由Smart Formula软件预测化学式为C10H11O4,分子式比阿魏酸负离子m/z 193 (C10H8O4)多2个H,中性丢失CO2,产生的主要碎片离子为m/z 151076 0 [M-H-COO]-,由于本试验数据不能说明取代基的位置,且提取物中存在较多单咖啡酰基奎宁酸和二咖啡酰基奎宁酸的同分异构体,无法判断阿魏酸由哪个咖啡酰基奎宁酸水解而来,故推测M8可能为咖啡酰基奎宁酸水解产生的阿魏酸的还原产物二氢阿魏酸。endprint
M9由差异图谱中可知,tR=76 min色谱峰的准分子离子为m/z 337094 2 [M-H]-,由Smart Formula软件预测化学式为C16H17O8,主要碎片离子为m/z 191049 8 [M-H-C9H6O2]-,173044 2 [M-H-C9H8O3]-的碎片,分子式和碎片离子与香豆酰奎宁酸一致,但本试验数据无法确定其取代基的结合位点,故推测M9可能为香豆酰奎宁酸,有待进一步研究。
M10由差异图谱中可知,tR=79 min色谱峰的准分子离子为m/z 285041 3 [M-H]-,由Smart Formula软件预测化学式为C15H19O6,分子式与木犀草素一致,但提取物中并无木犀草素原型存在,故推测M10可能为提取物中木犀草苷类成分水解产生的木犀草素。
M11由差异图谱中可知,tR=84 min色谱峰的准分子离子为m/z 207065 3 [M-H]-,由Smart Formula软件预测化学式为C11H11O4丢失CH2,产生的主要碎片离子为m/z 193050 8 [M-H-CH2]-,149060 1 [M-H-COO]-,提示存在甲基化反应,而主要碎片離子与阿魏酸一致,故推测M11可能为阿魏酸甲基化产物。
M12由差异图谱中可知,tR=90 min,色谱峰的准分子离子为m/z 225045 4 [M-H]-,由Smart Formula软件预测化学式为C11H11O5,丢失42,产生主要碎片离子为m/z 183050 8 [M-H+4HCOCH3]-,表明存在乙酰化反应,比咖啡酸多4个H,同时存在还原反应,故推测M12可能为咖啡酸还原后的乙酰化产物。
M13由差异图谱中可知,tR=93 min,产生的准分子离子峰为m/z 165056 0[M-H]-,由Smart Formula软件预测化学式为C9H9O3,与M5分子式与一致,但保留时间不同,故推测M13与M5互为同分异构体,但本实验数据无法确定其取代基的结合位点,故推测M13可能为咖啡酸的水解产物羟基苯丙酸。
34羊耳菊提取物主要成分在肠道菌群中可能的代谢途径
羊耳菊提取物在肠道菌群中的代谢以提取物中含量较高的咖啡酰基奎宁酸类成分的代谢为主,但由于提取物中同时存在单咖啡酰基奎宁酸和二咖啡酰基奎宁酸的同分异构体,本试验所得数据无法准确明确其具体取代基的位置。因此,以绿原酸和3,4O二咖啡酰基奎宁酸为例,分析提取物中主要成分可能的代谢产物及代谢途径,见图2~4。
4结论
本试验采用UPLCQTOFMS/MS技术方法,较于一般的四极杆质谱检测器,在负离子模式下对样品进行测定,具有灵敏度高,扫描范围广,快速简便等特点,同时针对不同化合物产生不同的质谱碎片,使检测更具有精度,大大降低了基质干扰。同时采用布鲁克公司的Metabolite ToolsTM对代谢信息进行分析。其中Metabolite Predict含有Metabolite Rules(代谢途径库),根据药物中原型成分的结构特征及其在体内可能发生的代谢变化,选择相应的代谢途径,由此Metabolite Predict则会预测出庞大的代谢产物Masslist;将Masslist导入至Metabolite Detect中,与差异图谱进行匹配,通过差异分析并结合MDF技术来寻找到可能的代谢产物并对其进行定性[15]。
在本试验中,肠菌孵育样品中检测13个代谢产物,主要包括单咖啡酰基奎宁酸的异构化,水解的小分子化合物和单咖啡酰基奎宁酸水解后产生的咖啡酸的还原,甲基化和乙酰化等代谢产物。在代谢产物中仅检测到二咖啡酰基奎宁酸类成分的甲基化产物,可能是由于其在肠道菌群的作用下水解成单咖啡酰基奎宁酸或者咖啡酸等小分子的物质再进行进一步的代谢反应。综合肠道菌群实验结果,说明在中药提取物中的咖啡酰基奎宁酸类物质,在体内吸收的过程中,可能会被肠道菌群代谢为小分子量的物质,如苯甲酸、苯乙酸等,再被吸收进入体内,从而影响咖啡酰基奎宁酸类物质的生物利用度。
咖啡酰基奎宁酸类即绿原酸类物质作为多种中药的主要活性物质,因其具有广泛的生物活性,一直以来是国内外研究的热点[10],研究发现,绿原酸在人体内通过肠道微生物如大肠杆菌、双歧杆菌和加氏乳杆菌产生的酯酶的作用下发生水解形成咖啡酸和奎尼酸,还会发生酯基位置异构,再经肠道微生物作用脱羟基形成香豆酸,也可经还原酶(RA)发生氢化作用。二氢咖啡酸也可能会发生C4位脱羟基作用生成3(3′羟苯基)丙酸,或经辅酶 A(CoA)介导脱去1个亚甲基形成3,4二羟基苯乙酸。3,4二羟基苯乙酸迅速脱亚甲基转化为 3,4二羟基苯甲酸等。人体中肠道菌群的分布与大鼠相类似,提取物中的绿原酸类成分也发生了相类似的代谢反应,生成了苯丙酸,苯乙酸,苯甲酸等代谢产物,说明羊耳菊提取物在肠道菌群中的代谢,可能与大肠杆菌、双歧杆菌等菌类和辅酶A等酶密切相关。
[参考文献]
[1]门薇, 陈颖, 李玉洁, 等肠道菌群对中药有效成分的生物转化研究进展[J]. 中国实验方剂学杂志,2015,21(2):229.
[2]史同瑞,刘宇,王爽,等肠道菌群与中草药有效成分代谢[J]. 中国微生态学杂志,2014,6(4):479.
[3]高霞, 耿婷, 马阳, 等离体大鼠肠道菌对 6 种皂苷类成分代谢研究[J]. 中国中药杂志, 2016, 41(12): 2329.
[4]Keqin O, Liwei G Absorption and metabolism of proanthocyanidins[J]. J Funct Foods, 2014, 7: 43.
[5]国家中医药管理局中华本草编委会 中华本草·苗药卷[M]贵阳: 贵州科技出版社, 2005:273.endprint
[6]Wang Y L, Li Y J, Wang A M, et al Two new phenolic glycosides from Inula cappa[J]. J Asian Nat Prod Res, 2010,12(9): 765.
[7]关焕玉,兰燕宇,廖尚高,等羊耳菊中咖啡酰基奎宁酸类化学成分研究[J]. 天然产物研究与开发,2014(26):1948.
[8]Jiraporn N, Puttinan M, Yingmanee T Inhibition of Inula cappa (Ham ex D Don) DC extracts on herpes simplex virus infection in vitro[J]. Afr J Microbiol Res, 2011,5(24):4049.
[9]Jiraporn N, Pattachai P, Kodchakorn L, et al Inhibition of herpes simplex virus type 2 in vitro by durian (durio zibethinus murray) seed coat crude extracts[J]. Appl Mechan & Mater, 2017,4:855.
[10]李云, 周明眉, 邢麗娜, 等 绿原酸的肠道菌群代谢研究进展[J]. 中草药, 2015, 46(4): 610.
[11]高茹,林以宁,梁鸽,等绿原酸的吸收与代谢研究进展[J]. 中国实验方剂学杂志, 2012, 18(10): 316 .
[12]覃小丽, 孙慧园, 杨武, 等UPLCESIQTOFMS/MS分析槲皮苷在大鼠肠道菌群中的代谢[J]. 中国中药杂志, 2017, 42(2): 357.
[13]Sophie L, Christine M, Claudine M, et al Absorption and metabolism of caffeic acid and chlorogenic acid in the small intestine of rats[J]. Br J Nutr, 2006,96: 46.
[14]Yang B, Meng Z Y, Dong J X, et al Metabolic profile of 1,5dicaffeoylquinic acid in rats, an in vivo and in vitro study[J]. Drug Metab Dispos, 2005,33: 930.
[15]Lekha Sleno The use of mass defect in modern mass spectrometry[J]. J Mass Spectrom, 2012,47: 226
[责任编辑张燕]endprint
