直接氧化法和离子膜电渗析法制备聚合硫酸铁工艺的比较
2017-10-20陈倩如汪小尧汪婷婷刘晓瑞张旭
陈倩如,汪小尧,汪婷婷,刘晓瑞,张旭
直接氧化法和离子膜电渗析法制备聚合硫酸铁工艺的比较
陈倩如,汪小尧,汪婷婷,刘晓瑞,张旭
(合肥工业大学化学与化工学院,安徽合肥230009)
研究并比较了制备聚合硫酸铁(PFS)的两种不同工艺。首先,使用直接氧化法制备PFS,主要考察反应温度、反应时间、原料中硫酸亚铁和硫酸的摩尔比对产品盐基度的影响,研究结果表明当反应温度从室温增加到70℃,盐基度由7.68%增加到9.34%;当原料摩尔比从2.01增加到4.08,盐基度从8.65%增加到11.91%;延长反应时间不能提高盐基度。其次,使用离子膜电渗析法制备PFS,主要考察电流密度和膜堆构型对产品盐基度的影响,研究结果表明电流密度从0增加到30mA/cm2,盐基度从7.68%显著增加到20.13%;改变膜堆构型不影响PFS的盐基度,但是相比BP-A膜堆构型,BP-A-C膜堆构型可减少过程能耗。最后,从产品性能、生产成本两方面比较两种制备工艺,结果表明离子膜电渗析法制得的PFS性能优于直接氧化法的产品性能,但生产成本至少高出1.16$/L PFS。
离子交换;膜;混凝;化学反应
聚合硫酸铁(简称PFS,[Fe2(OH)(SO4)3-n/2],>2,<10)是一种铁盐类无机高分子絮凝剂,其分子量高达105,在水溶液中以OH–为架桥形成多种络合离子,如[Fe2(OH)2]4+、[Fe3(OH)4]5+、[Fe(OH)]2+等[1-4]。PFS安全无害、用量少、吸附絮凝性强、形成的泥浆脱水性好,对水中的BOD、COD、重金属有着良好的去除性能,同时也具备脱色、除臭、破乳及污泥脱水等功能[5-6],因此,被广泛运用于工业用水、城市污水和生活饮用水等领域[7]。
PFS的制备原料主要是硫酸和硫酸亚铁,两者经过氧化、水解和聚合制得PFS[8-9]。PFS的性能指标包括pH(1%水溶液)、密度、盐基度(,OH/Fe摩尔比)、全铁含量等,其中,盐基度是一个相对而言较重要的指标,表明铁离子的水解程度[10],通常来说,盐基度越高,絮凝效果越好[11]。
本文将研究和比较两种不同的工艺方法对PFS性能(主要是盐基度)的影响。第一种方法是直接氧化法,通过改变反应温度、反应时间以及原料中硫酸亚铁和硫酸的摩尔比来提高PFS盐基度。第二种方法是离子膜电渗析法,考察电流密度和膜堆构型对盐基度的影响。
1 实验材料和方法
1.1 试剂与材料
实验所用试剂,如FeSO4、H2SO4、KClO3等,均为分析纯级别,由国药集团化学试剂有限公司提供;实验用水均为去离子水,电阻率约为18.2MΩ·cm。
1.2 实验装置
直接氧化法制备PFS的实验装置如图1(a)所示,图中1为温感器,2为反应液罐,3为温控磁力搅拌器(HJ-3型,常州国宇仪器制造有限公司)。
离子膜电渗析法制备PFS的实验装置如图1(b)所示。其中,4为电渗析膜堆;5为直流电源(RLD-3005D1型,上海寰振电子科技有限公司);6为电极液罐;7为酸室罐;8为盐室罐;9为潜水泵(JY-PG70型,杭州吉印文化艺术有限公司)。本文主要采用两种电渗析膜堆构型:BP-A构型和BP-A-C构型,BP-A构型膜堆由3张阴离子交换膜和3张双极膜组成;BP-A-C构型膜堆由3张阴离子交换膜、3张阳离子交换膜和3张双极膜组成,每张膜的有效面积为0.002m2,膜的性能如表1 所示。
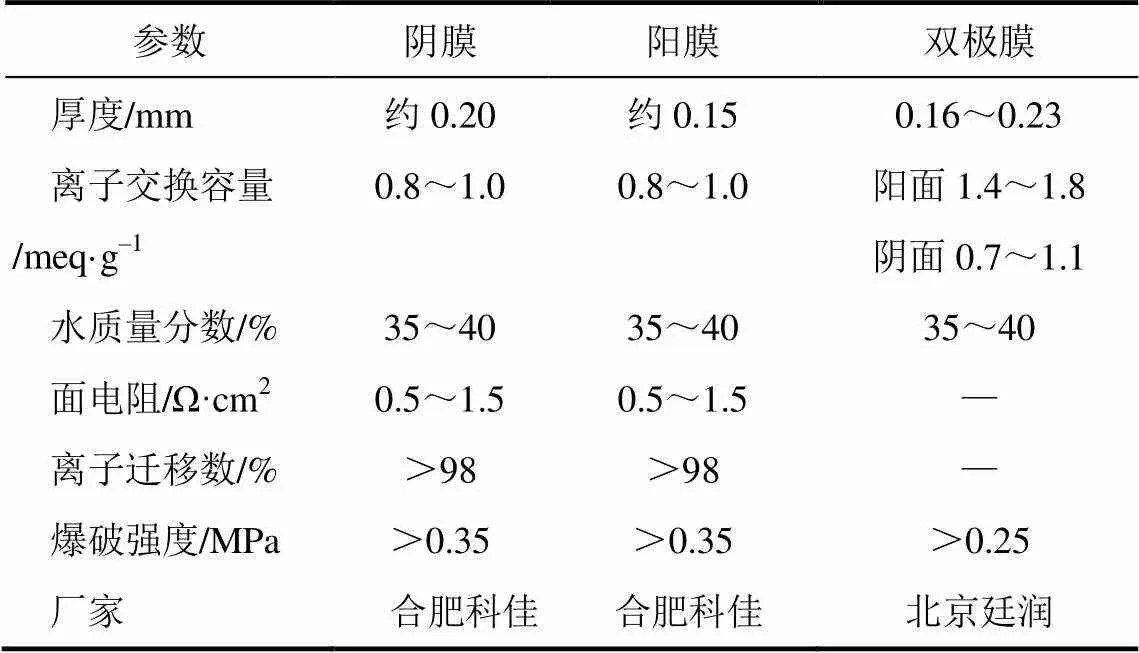
表1 膜的主要技术指标
注:所有数据由膜的生产厂家提供。
1.3 实验步骤
(1)直接氧化法 硫酸亚铁和硫酸的混合溶液(100mL,1.05~2.14mol/L H2SO4+4.30mol/ LFeSO4)加入到反应液罐中,而后加入强氧化剂氯酸钾(约9.2g KClO3),调节反应温度、开启搅拌装置开始反应,反应一段时间关闭温控磁力搅拌器,反应液成化24h以上即可得到液体PFS。所有的实验都在室温 (25℃±3℃)下进行。
(2)离子膜电渗析法 首先,电极液罐中加入硫酸钠溶液(200mL,0.30mol/L Na2SO4),酸室罐中加入稀硫酸溶液(200mL,0.18mol/L H2SO4),反应液罐中加入反应液(65mL,1.67mol/L H2SO4,4.30mol/L FeSO4,0.75mol/L KClO3),盐室罐中加入硫酸钠溶液(200mL,0.30mol/L);然后,开启蠕动泵将溶液泵入对应的膜堆隔室中;最后,采用恒电流模式,开启直流电源给膜堆通电,实验开始。实验中,记录膜堆电压随着时间的变化,每隔一段时间从酸室罐中取出酸溶液分析浓度。实验进行2h后,关闭直流电源,反应液成化24h以上即可得到液体PFS。所有的实验都在室温(25℃±3℃)下进行。
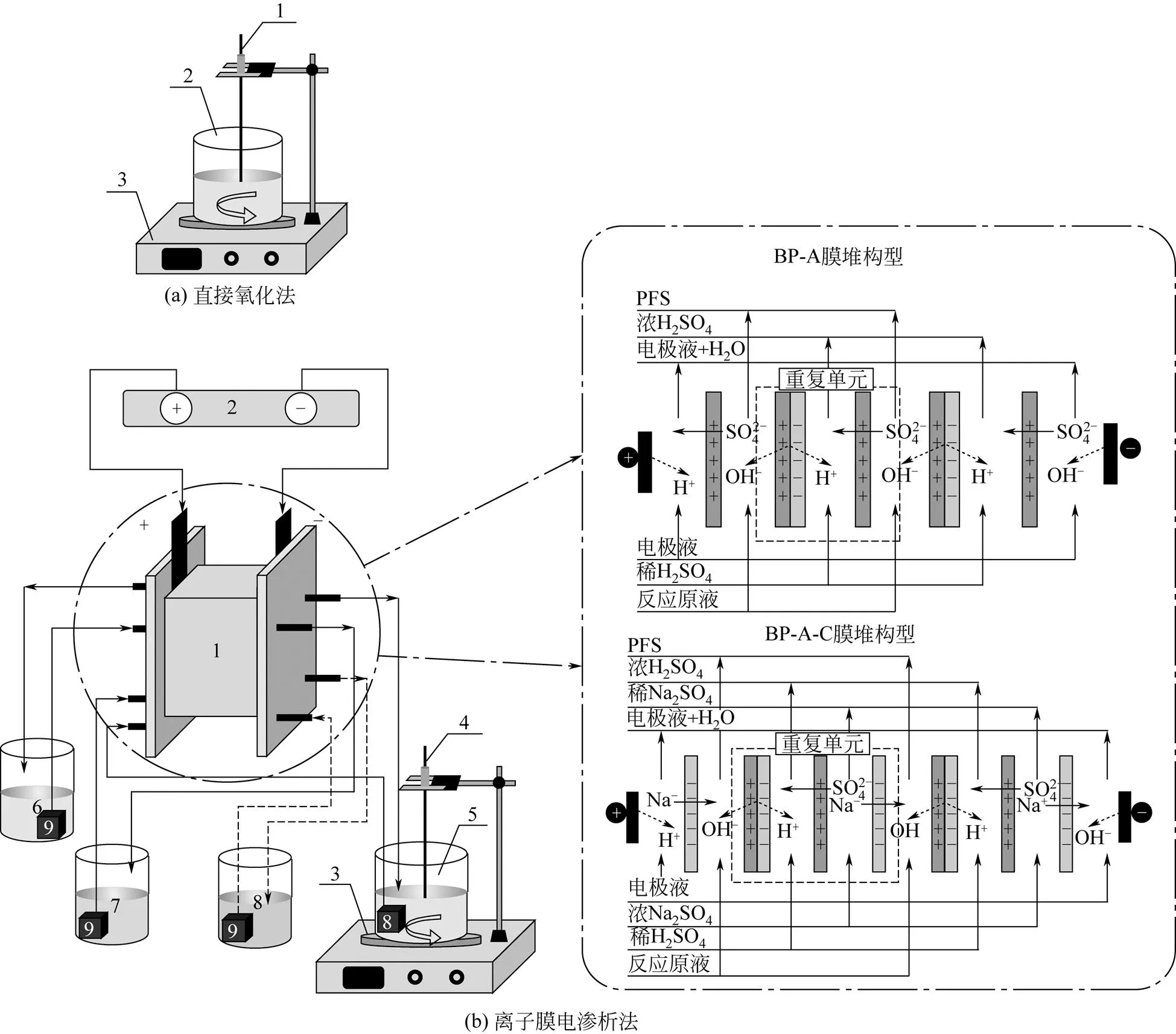
图1 实验装置图
1—温感器;2—反应液罐;3—温控磁力搅拌器;4—电渗析膜堆;5—直流电源;6—电极液罐;7—酸室罐;8—盐室罐(BP-A-C膜堆构型); 9—潜水泵
分析测试方法:H+浓度主要由NaOH滴定法测定;pH(1%水溶液)、盐基度、全铁含量、还原性物质含量等依照GB14591—2006所述方法来测定与计算。
1.4 数据分析与处理
对于离子膜电渗析技术耦合直接氧化法来说,能耗是一个重要指标。本实验中,双极膜产生的OH–量部分结合到PFS中,因此很难测定双极膜产生的总OH-量,所以,能耗的计算基于双极膜产生的H+量,具体计算公式如式(1)。

式中,U是在时间为时膜堆两端的电压,V;是电流,A;0和C分别是在时间为0和时的酸室罐中硫酸浓度,mol/L;是酸室罐体积,L;是硫酸的摩尔质量,g/mol。
2 实验结果与讨论
2.1 直接氧化法
2.1.1 反应温度的影响
操作条件:反应时间为120min,反应原料组成为1.67mol/L H2SO4和4.30mol/L FeSO4(硫酸亚铁和硫酸的摩尔比为2.58),反应温度分别设置为室温、40℃、50℃、60℃、70℃,主要考察反应温度对盐基度的影响,结果如图2所示。
由图2可知,当反应温度从室温增加到70℃,盐基度从7.68%增加到9.34%。温度对盐基度的影响主要包括两方面:一方面,氧化反应是放热反应,升高温度不利于氧化反应的进行;另一方面,水解升高温度不利于氧化反应的进行;另一方面,水解反应是吸热反应,升高温度则会加快反应速度。因此,从图2中盐基度随温度的变化趋势可知,在本实验研究范围内,升高温度对加快水解反应速度的程度高于对减慢氧化反应速度的程度。
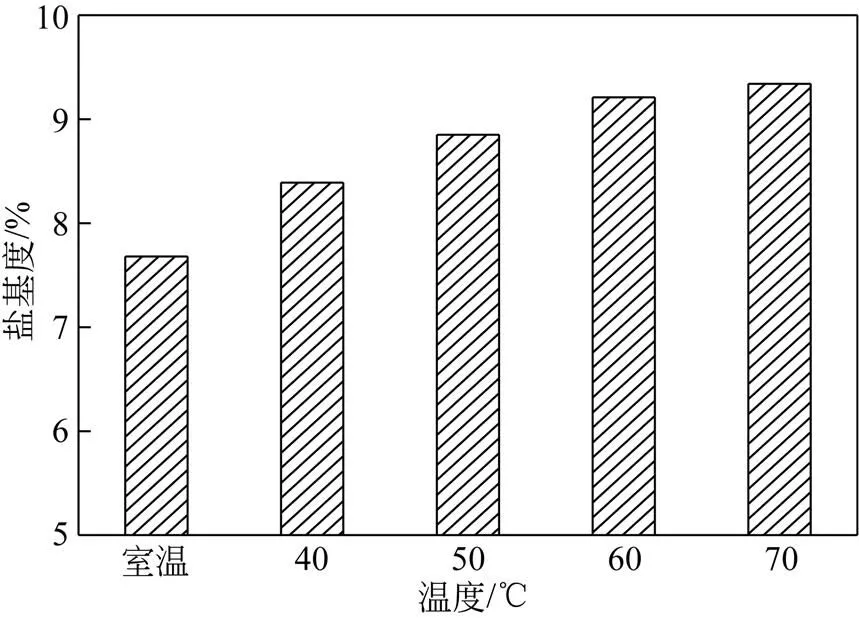
图2 反应温度对PFS盐基度的影响
反应温度对PFS其他性能的影响如表2所示。由表2可知,随着反应温度的升高,密度从1.49g/mol升高到1.70g/mL;反应温度对pH的影响不显著,pH在2.19到2.26之间变化;对于总铁含量来说,一开始从11.46%降低至10.85%,最后又增加至14.20%;而对于还原性物质来说则相反,一开始从0.0047%升高至0.0130%,而后下降至0.0049%。对照GB14591—2006,表2中的各种性质基本符合要求。
由上可知,反应温度在一定程度上可提高PFS的盐基度,而不影响其他性能。
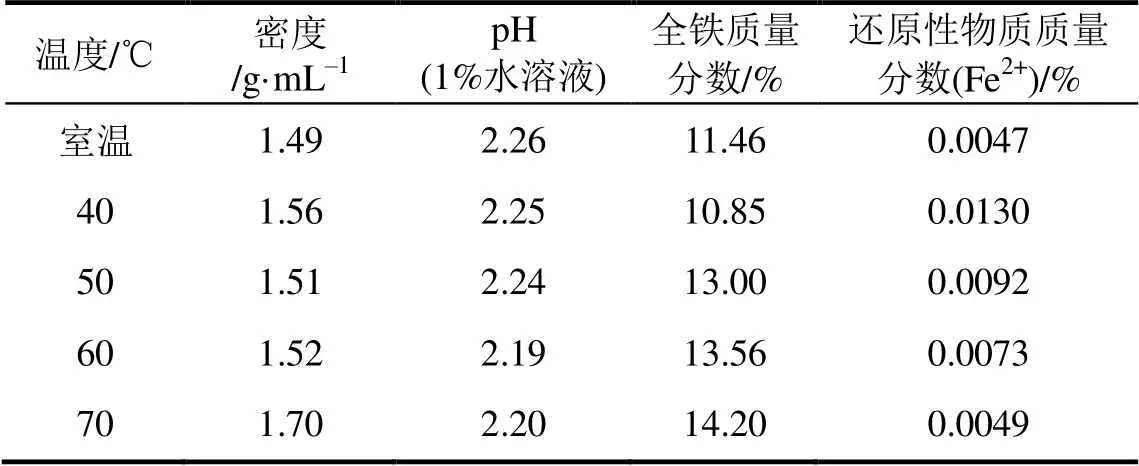
表2 反应温度对PFS其他性能的影响
2.1.2 反应时间的影响
操作条件:反应温度设置为60℃,反应原料组成为1.67mol/L H2SO4和4.30mol/L FeSO4(硫酸亚铁和硫酸的摩尔比为2.58),反应时间分别设置为60min、120min、180min、240min、300min,主要考察反应时间对盐基度的影响,结果如图3所示。由图3可见,反应时间对PFS盐基度的影响不规律,当反应时间为120min时,盐基度为9.21%,为最大值。另外,反应时间为180min和300min时,盐基度不符合GB 14591—2006要求。通过对图3的进一步分析可知,当反应时间达到60min时,原料液中Fe2+已经全部被氧化。
反应时间对PFS其他性能的影响如表3所示,当反应时间从60min延长到240min时,密度从1.48g/mL增加到1.56g/mL,pH、总铁含量和还原性物质含量在2.19%~2.55%、11.40%~13.56%、0.0067%~0.0123%之间变化,且全部符合GB 14591—2006要求。
通过上述分析可知,改变反应时间不能提高PFS的盐基度。
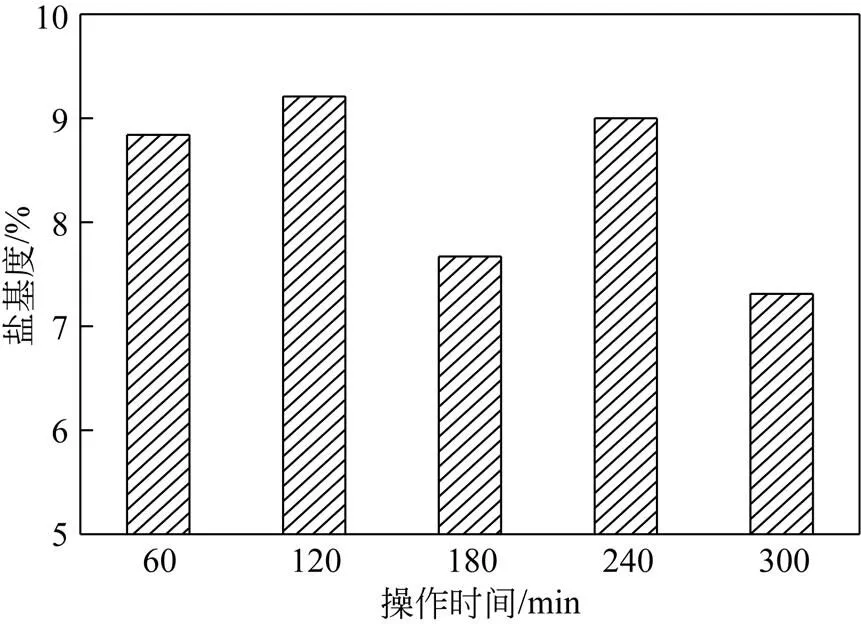
图3 反应时间对PFS盐基度的影响
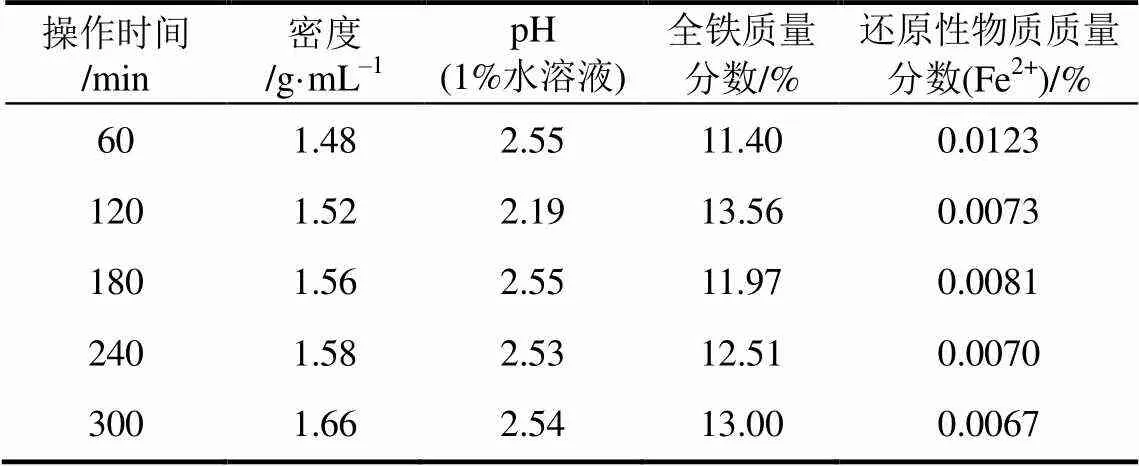
表3 反应时间对PFS其他性能的影响
2.1.3 原料中硫酸亚铁和硫酸摩尔比的影响
操作条件:反应温度设置为60℃,反应时间设置为120min,反应原料中FeSO4浓度为4.30mol/L,原料中硫酸亚铁和硫酸的摩尔比分别设置为2.01、2.58、3.10、4.08,主要考察原料中硫酸亚铁和硫酸的摩尔比对盐基度的影响,结果如图4所示。由图4可知,随着摩尔比从2.01增加到4.08,盐基度相应地从8.65%增加到11.91%。主要原因是原料摩尔比越大,与Fe3+结合的SO42–量越少,因此更多的Fe3+发生水解反应,从而提高盐基度。
原料中硫酸亚铁和硫酸的摩尔比对PFS其他性能的影响如表4所示,可见摩尔比的增加对密度、pH、总铁含量和还原性物质含量的影响不大,这4种性能分别为1.63~1.51g/mL,2.12~2.19,12.96%~13.56%,和0.0073%~0.0086%之间变化,同时全部符合GB14591—2006要求。
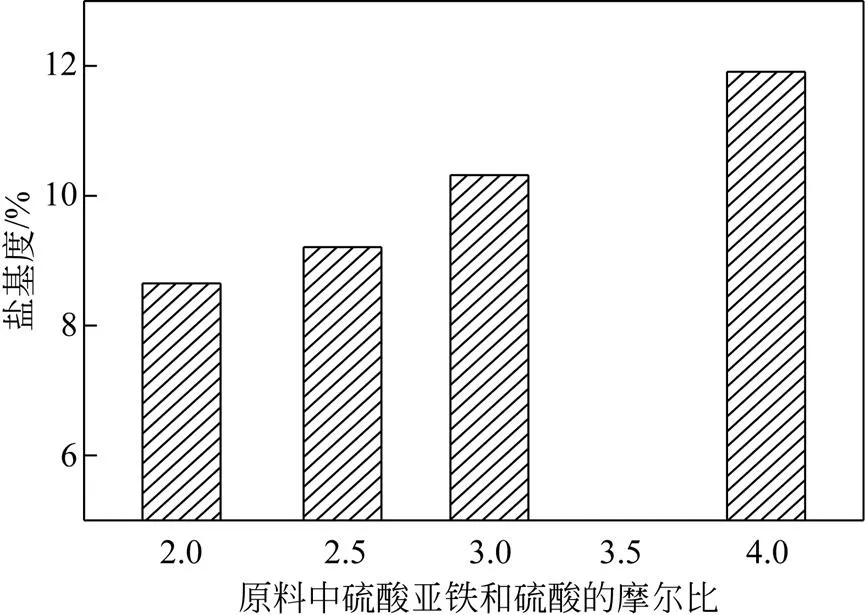
图4 原料中硫酸亚铁和硫酸的摩尔比对PFS盐基度的影响
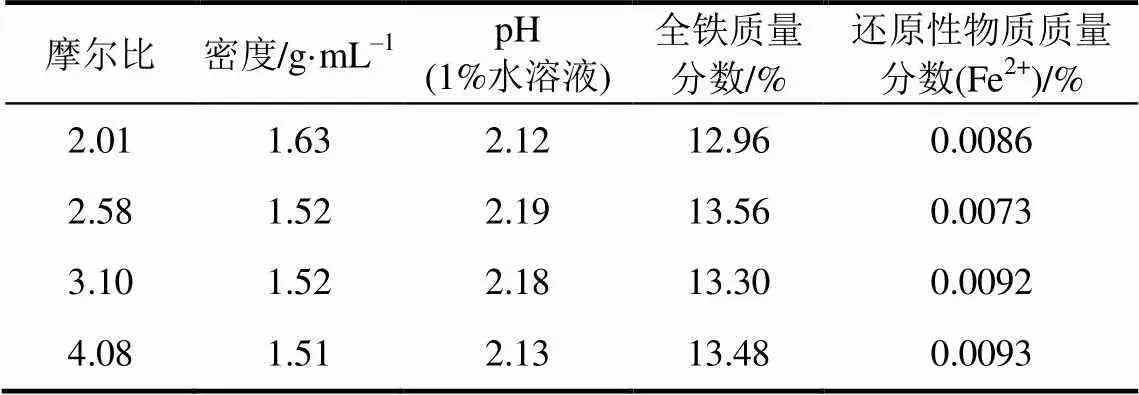
表4 原料中硫酸亚铁和硫酸的摩尔比对PFS其他性能的影响
综上可得,提高硫酸亚铁和硫酸的摩尔比可以提高PFS盐基度,同时不影响其他性能。
2.2 离子膜电渗析法
2.2.1 电流密度的影响
操作条件:反应温度设置为常温,反应时间设置为120min,反应原料组成为1.67mol/L H2SO4和4.30mol/L FeSO4(硫酸亚铁和硫酸的摩尔比为2.58),膜堆为BP-A构型,电流密度设置为0、10mA/cm2、20mA/cm2、30mA/cm2,主要考察电流密度对盐基度的影响。
电流密度对膜堆电压和酸室罐硫酸浓度的影响(BP-A膜堆构型)如图5(a)所示,首先,膜堆电压随着电流密度的增加而上升,说明大部分电能用来克服由电流密度增加而增加的膜堆电阻[15-16];其次,能耗随着电流密度的增加而降低;最后,随着电流密度从10mA/cm2增加到30mA/cm2,酸室中的最终硫酸浓度从0.27mol/L升高到0.42mol/L,原因在于电流密度增加导致双极膜发生水解离的驱动力增加[12-13],此外,硫酸浓度的增加程度与电流密度的增加程度不成比例,原因在于氢离子透过阴离子交换膜发生泄漏[14-16],且电流密度越高、泄漏越严重[17]。电流密度对PFS盐基度的影响如图5(b)所示,电流密度从0增加到30mA/cm2,盐基度从7.68%增加到20.13%,提高程度很显著。主要原因在于电流密度增大,双极膜产生的OH–量越多,更多的OH-参与水解反应,从而增加盐基度。
电流密度对PFS其他性能的影响(BP-A膜堆构型)如表5所示,随着电流密度的增加,pH从2.26缓慢增加到2.49,而密度、总铁质量分数、还原性物质质量分数在1.43~1.56g/mL、10.69%~12.34%、0.0047%~0.0061%之间变化。
综上可得,增加电流密度可显著提高PFS盐基度,同时降低能耗。
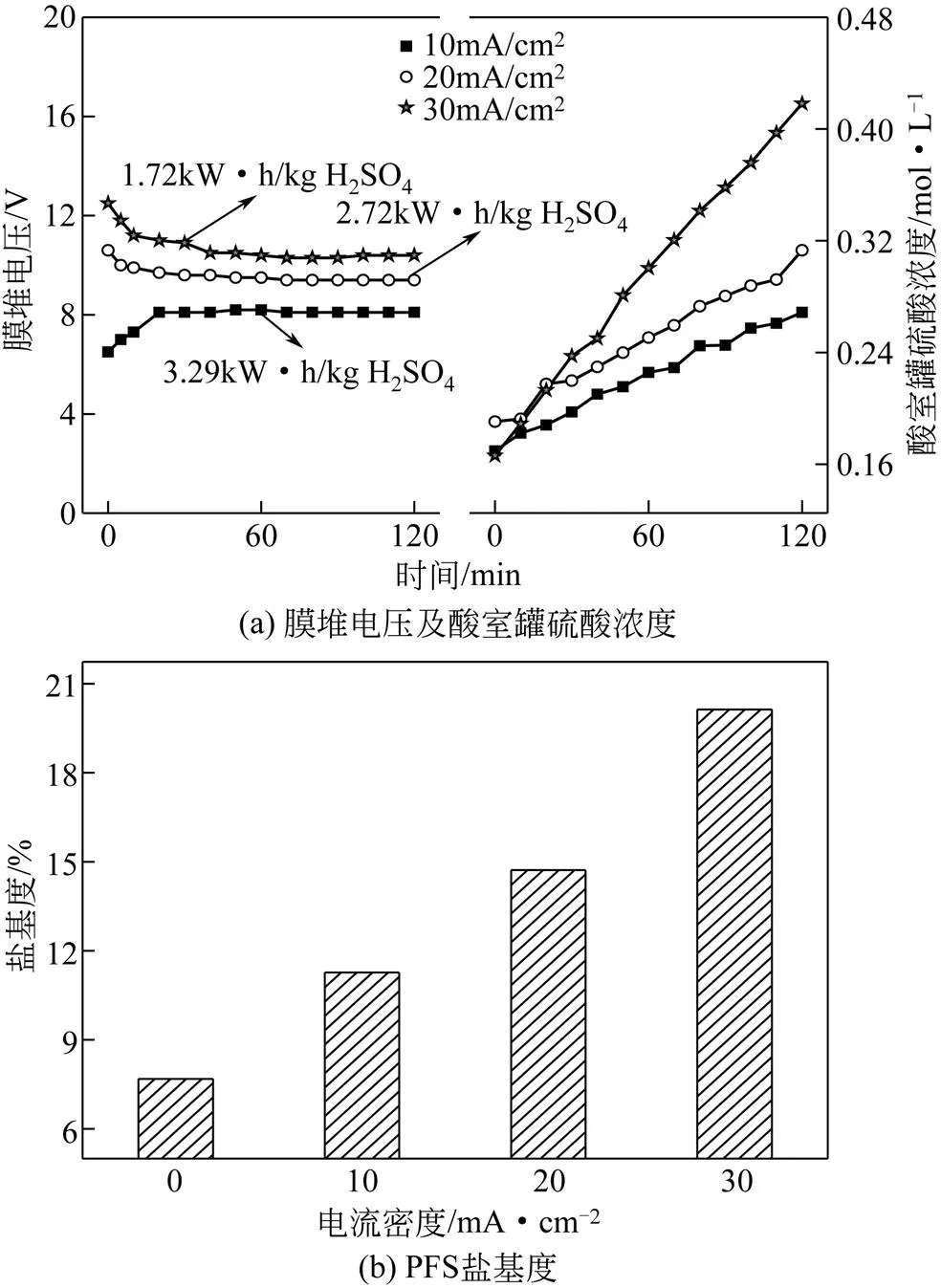
图5 电流密度对膜堆电压、酸室罐硫酸浓度及PFS盐基度的影响
(BP-A膜堆构型)

表5 电流密度对PFS其他性能的影响(BP-A膜堆构型)
2.2.2 膜堆构型的影响
操作条件:反应温度设置为常温,反应时间设置为120min,反应原料组成为1.67mol/L H2SO4和4.30mol/L FeSO4(硫酸亚铁和硫酸的摩尔比为2.58),膜堆为BP-A-C构型,电流密度设置为0、10mA/cm2、20mA/cm2、30mA/cm2。
图6是电流密度对膜堆电压、酸室罐硫酸浓度以及PFS盐基度的影响(BP-A-C膜堆构型)。对比图5可知:第一,同样的电流密度下,BP-A构型的膜堆电压要比BP-A-C的高,因此BP-A构型的膜堆能耗比BP-A-C的高,主要原因是本实验中制得的PFS是无机高分子聚合物,其电导率较小,相比BP-A膜堆构型,BP-A-C膜堆构型增加一个盐室,可以提供多余的电解质离子导电,因此降低了膜堆电阻;第二,同样的电流密度下,两种膜堆构型最终得到的硫酸浓度相似;第三,相同的电流密度下,两种不同构型膜堆制备出来的PFS盐基度差别不大,因此,膜堆构型对盐基度的改善作用不明显。

图6 电流密度对膜堆电压、酸室罐硫酸浓度及PFS盐基度的影响
(BP-A-C膜堆构型)
表6是电流密度对PFS其他性能的影响(BP-A-C膜堆构型)。由表6可见,电流密度在0~30mA/cm2之间变化时,pH、密度、总铁质量分数、还原性物质质量分数分别在2.26~2.54、1.48~1.55g/mL、8.30%~14.17%、0.0031%~0.0099%之间变化。对比表5可知,膜堆构型对PFS其他性能的影响不大。
基于上述分析可知,BP-A-C膜堆构型对盐基度的改善作用不明显,但可降低膜堆电压从而减少过程能耗。
2.3 两种工艺比较
2.3.1 产品特性
对比2.1节和2.2节两种不同工艺制得的PFS性能可知:①直接氧化法制备的PFS盐基度低于离子膜电渗析法的产品盐基度。②除盐基度外,两种工艺制得的PFS其他性能差别不大。

表6 电流密度对PFS其他性能的影响(BP-A-C膜堆构型)
2.3.2 生产成本
离子膜电渗析法相比直接氧化法成本较高,原因在于不仅引入了新的电渗析装置,同时运行装置还需要消耗电能。结合作者之前对离子膜电渗析法制备PFS的研究[18],选择一个最佳的工艺条件对该过程进行成本估算[19],如表7所示。成本估算显示,离子膜电渗析法制备PFS的成本比直接氧化法至少高出1.16$/L PFS。
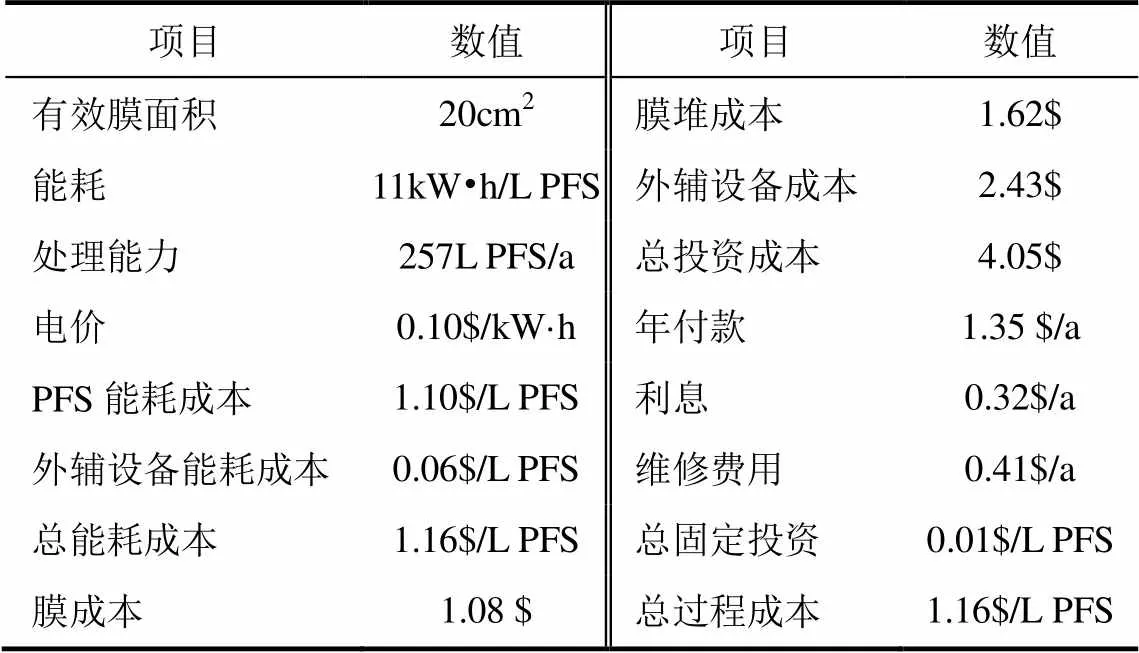
表7 离子膜电渗析法过程工艺成本估算
3 结论
(1)直接氧化法制备聚合硫酸铁的过程中,增加反应温度和原料中硫酸亚铁和硫酸的摩尔比可以提高聚合硫酸铁的盐基度,同时不影响其他性能,而延长反应时间不能提高聚合硫酸铁的盐基度。
(2)离子膜电渗析法制备聚合硫酸铁的过程中,增加电流密度可以显著提高聚合硫酸铁的盐基度,同时降低过程能耗;相比BP-A膜堆构型,BP-A-C膜堆构型可减少过程能耗。
(3)离子膜电渗析法制得聚合硫酸铁性能优于直接氧化法的产品性能,但生产成本相对较高。
[1] BULTE A D,FAN M,BROWN R C,et al. Absorption of dilute SO2gas stream with conversion to polymeric ferric sulfate for use in water treatment[J]. Chem. Eng. J.,2004,98:265-273.
[2] FAN M H,SUNG S H,BROWN R C,et al. Synthesis,characterization,and coagulation of polymeric ferric sulfate[J]. J. Environ. Eng.,2002,128:136-143.
[3] CHANG Q,WANG H Y. Preparation of PFS coagulant by sectionalized reactor[J]. J. Environ. Sci.,2002(14):345-350.
[4] 洪金德. 净水剂聚合硫酸铁的制备[J]. 化工进展,2001,20(3):33-36.
HONG J D.A new water treatment agent polymerized ferric sulfate and its preparation[J]. Chem. Ind. Eng. Prog.,2001,20(3):33-36.
[5] JIANG J Q,GRAHAM N J D. Observations of the comparative hydrolysis/precipitation behavior of polyferric sulphate and ferric sulphate[J]. Water Res.,1998,32:930-935.
[6] 王艳. 聚合硫酸铁絮凝剂的制备及应用研究[J]. 化学与生物工程,2011,28(2):1-3.
WANG Y.Preparation and application of polymeric ferric sulfate flocculant[J].Chem. & Bioeng.,2011,28(2):1-3.
[7] EDZWALD J K,TOBIASON J E. Enhanced coagulation:US requirements and a broader view[J]. Water Sci. Technol.,1999,40 (9):63-70.
[8] 卫艳新. 铁系高分子改性絮凝剂的制备及其性能分析[D]. 长沙:中南大学,2003.
WEI Y X. The preparation of iron-polymer modified flocculant and its performance analysis[D]. Changsha:Central South University,2013.
[9] 潘碌亭,吴锦峰. 聚合硫酸铁制备技术的研究与进展[J]. 工业水处理,2009,29(9):1-5.
PAN L T,WU J F.Research and progress of the preparation technologies of polyferric sulphate[J].Industrial Water Treatment,2009,29(9):1-5.
[10] TANG H X,STUMM W. The coagulating behaviors of Fe(Ⅲ)polymeric species-I[J]. Water Res.,1987(21):115-121.
[11] 解立平,徐向荣,曾凡. 聚合硫酸铁盐基度与絮凝性能关系的研究[J]. 工业水处理,2001,21(1):26-28.
XIE L P,XU X R,ZENG F. The study of the relation between OH/Fe of polymeric ferric sulfate and flocculation efficiency[J]. Industrial Water Treatment,2001,21(1):26-28.
[12] JIANG C X,WANG Y M,XU T W. An excellent method to produce morphpline by bipolar membrane electrodialysis[J]. Sep. Purif. Technol.,2013,115:100-106.
[13] YAN H Y,WU C M,WU Y H. Optimized process for separating NaOH from sodium aluminate solution:coupling of electrodialysis and electrodialysis[J]. Ind. Eng. Chem. Res.,2015,54:1876-1886.
[14] LIN J Y,YE W Y,HUANG J,et al. Toward resource recovery from textile wastewater:dye extraction,water and base/acid regeneration using a hybrid NF-BMED process[J]. ACS Sustainable Chem. Eng.,2015,3:1993-2001.
[15] KIM W,KIM S,KIM K. Enhanced electrokinetic extraction of heavy metals from soils assisted by ion exchange membranes[J]. J. Hazard. Mater.,2005,B118:459-468.
[16] TRAN A,MONDAL P,LIN J,et al. Simultaneous regeneration of inorganic acid and base from a metal washing step wastewater by bipolar membrane electrodialysis after pretreatment by crystallization in a fluidized pellet reactor[J]. J. Membr. Sci.,2015,473:118-127.
[17] HUANG C H,XU T W. Regenerating flue-gas desulfurizing agents by bipolar membrane electrodialysis[J]. AIChE J.,2006,52:393-401.
[18] ZHANG X,WANG X Y,CHEN Q R,et al. Batch preparation of high basicity polyferric sulfate by hydroxide substitution from bipolar membrane electrodialysis[J]. ACS Sustainable Chem. Eng.,2017,5(3):2292-2301
[19] ZHANG X,WANG X L,WANG Y M,et al. Production of yellow iron oxide pigments by integration of the air oxidation process with bipolar membrane electrodialysis[J]. Ind. Eng. Chem. Res.,2014,53:1580-1587.
The comparison of direct oxidation process and electrodialysis process for preparing polyferric sulphate
CHEN Qianru,WANG Xiaoyao,WANG Tingting,LIU Xiaorui,ZHANG Xu
(School of Chemistry and Chemical Engineering,Hefei University of Technology,Hefei 230009,Anhui,China)
Two different processes for preparing polyferric sulphate(PFS) were investigated and compared. Firstly,PFS was generated through direct oxidation process with ferrous sulfate and sulfuric acid as raw materials,and with the potassium chlorate as oxidizing agent. The effect of reaction temperature,reaction time,and the molar ratio of ferrous sulfate to sulfuric acid in raw materials on basicity was investigated. Results showed that basicity improved from 7.68% to 9.34% when reaction temperature increased from room temperature to 70℃. As the molar ratio in raw materials increased from 2.01 to 4.08,basicity increased from 8.65% to 11.91%. However,The increase of the reaction time did not improve the basicity. Secondly,ion exchange membrane electrodialysis was used to prepare PFS. The effects of current density and membrane stack configuration on basicity were investigated. Results showed that the basicity increased from 7.68% to 20.13% remarkablywhen current density increased from 0 to 30mA/cm2. And basicity was not affected by membrane stack configurations. Compared with BP-A configuration,BP-A-C configuration could decrease membrane stack voltage drops and energy consumption. Thirdly,the two processes were compared in terms of PFS performance and production cost. Results showed that the performance of PFS generated by electrodialysis process was better than that of PFS generatedby direct oxidation process,while the former cost was 1.16$/L PFS higher that the latter cost.
ion exchange;membrane;coagulation;chemical reaction
TQ028.8
A
1000–6613(2017)10–3800–07
10.16085/j.issn.1000-6613.2017-0232
2017-02-16;
2017-03-01。
国家级大学生创新实验项目基金(201610359037)及安徽省自然科学基金(1608085QB41)项目。
陈倩如(1996—),女,本科生。
张旭,博士,讲师。E-mail:xzhang@hfut.edu.cn。
