反应结晶制备工业级磷酸二氢钾过程的粒度控制
2017-10-20丁一刚韩永红骆万智龙秉文余莹居丽
丁一刚,韩永红,骆万智,龙秉文,余莹,居丽
反应结晶制备工业级磷酸二氢钾过程的粒度控制
丁一刚1,韩永红1,骆万智1,龙秉文1,余莹2,居丽2
(1武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北武汉430205;2湖北祥云(集团)化工股份有限公司,湖北武汉 435405)
以工业级磷酸一铵为原料与氢氧化钾复分解反应结晶制备磷酸二氢钾是一种成本低廉、极具发展前景的方法,实验确定了采用该法制备的磷酸二氢钾产品粒度主要受反应阶段控制,继而研究分析了反应时间、搅拌速度、原料浓度和加入速率对磷酸二氢钾产品粒度分布的影响,探讨了磷酸二氢钾反应结晶机理,筛选出较优的反应结晶工艺。在控制磷酸一铵和氢氧化钾质量分数为50%,氢氧化钾溶液在30min内加入完毕,反应结晶时间为3h,搅拌速率为300r/min的条件下,获得的磷酸二氢钾产品中位粒径为1070µm,分布均匀,晶体形貌为规则的四方晶。
磷酸二氢钾;反应结晶;粒度分布;过程
磷酸二氢钾是一种重要的精细磷酸盐,在工业、农业、医药、食品行业均有广泛的应用,既可用作农用高浓度高效磷钾复合肥,也可在食品行业用作食品添加剂,发酵促进剂、调味剂,在工业上磷酸二氢钾也是多种钾盐的原料,因此近年来我国磷酸二氢钾的市场需求量迅速增长[1-2]。
磷酸二氢钾的制备方法有很多种,概括起来可以分为中和法、复分解法、萃取法、离子交换法、直接法、结晶法和电解法等,其中前两种方法在工业上采用较多[3-4]。中和法以磷酸为原料与氢氧化钾通过酸碱中和反应,控制中和溶液pH为4.2~4.6,反应生成磷酸二氢钾。该法的优点是反应速率快、产品质量稳定可靠,然而若以热法磷酸为原料,则原料成本较高,若以湿法磷酸为原料,则存在杂质含量高、钾的利用率低等缺点[5]。而复分解法以钾离子与正磷酸的钠盐或铵盐中的磷酸二氢根离子通过复分解反应生成磷酸二氢钾[6]。复分解法有较明显的原料成本优势,尤其对于有磷铵产品的生产企业,是目前较先进、具有发展前途的工业生产方法,而其缺点是反应速度较慢,反应时间较长,因此常常需要在较高温度下反应来提高反应速率[7]。
本工作研究以工业级磷酸一铵为原料与氢氧化钾发生复分解反应制备磷酸二氢钾的过程[8],如式(1)。
NH4H2PO4+KOH—→KH2PO4+H2O+NH3↑ (1)
为提高反应速率和及时移除副产品氨气和水,反应常在体系的沸点下操作,随着反应的进行和水分的不断蒸出,产品磷酸二氢钾也不断结晶析出[6]。
根据磷酸二氢钾实际用途的不同,工业上对其晶体大小也有相应的控制要求,小粒径的磷酸二氢钾适用于肥料、水泥制造、医药等行业,中等粒径的可以用于材料等领域,而大粒径的可以用于材料包裹等工业领域[9-10]。因此,本文结合复分解法制备磷酸二氢钾的实际过程,实验研究了以磷酸一铵为原料反应结晶制备磷酸二氢钾过程中各种操作因素对产品晶粒尺寸的变化规律,提出了大颗粒磷酸二氢钾的适宜制备条件。
1 实验材料与方法
1.1 主要实验试剂
实验中用到的磷酸一铵(>99.5%)、氢氧化钾(>85%)均为分析纯,购自国药集团化学试剂有限公司。所用到的水为实验室自制二次蒸馏水。
1.2 主要仪器设备
反应结晶器为一容积为1000mL的玻璃釜,釜内采用锚式搅拌桨,聚四氟乙烯材质,直径50mm,搅拌转速通过恒速电机控制,采用激光测速仪测定。反应温度通过一根量程为200℃的温度计测量,精度±1℃。氢氧化钾溶液通过一台输液泵(SYS-6010型)计量输入反应结晶器内。
1.3 实验流程
为接近工业实际反应条件,将230.06g磷酸一铵(2mol)配制成质量分数50%的溶液加入到反应结晶器内,再将112.22g氢氧化钾(2mol)配制质量分数为48%的溶液,在10min内匀速加入与磷酸一铵混合进行复分解反应,控制搅拌转速为250r/min。为提高反应速率和及时移除副产品氨气和水,控制溶液温度在沸点下进行(约104℃)。随着大量水分蒸出后和磷酸二氢钾的析出,溶液逐渐变黏稠,流动性差,以致反应在后期无法继续进行,因此在此阶段,需通过恒压漏斗向系统内补水,每次加入蒸馏水50mL,控制滴加时间为15min,以保证液相反应继续进行。反应完成后,将溶液冷却至常温后,离心过滤,干燥后得磷酸二氢钾产品。产品的粒度分布利用标准筛分法测量,并采用-分布函数拟合来获得样品的连续微分分布曲线。
2 结果与讨论
2.1 反应结晶与冷却结晶对过程的影响
通过上述实验过程可知,整个磷酸二氢钾的结晶分为两个阶段,第一个阶段是复分解反应结晶过程,另一个是反应完成后的自然冷却结晶。首先实验比较了在1.3节反应条件下不同反应时间下两个阶段所得到的产品的收率和粒度分布,结果见图1和图2。从图1可以看到,在不同反应时间下,反应结晶阶段和反应-冷却结晶阶段的磷酸二氢钾产品的收率相差很小(4%左右),这主要是因为反应结晶阶段已经将体系绝大部分的水分蒸出,冷却阶段尽管温差较大,但总体水量很少,所以仅有少量的磷酸二氢钾析出。同时,在反应2h时,收率较低,通过测量母液中的氮含量表明此时反应尚未进行完全,而反应时间在3h以上时,磷酸二氢钾收率基本不变,达到73%左右,意味着反应基本完成,而液相中的氮含量的测试结果也证实了这点。从图2最终产品的中位粒径来看,在不同反应时间下,两阶段的产品相差也不大(20µm左右),与收率所反映的规律类似。在反应结晶阶段,绝大部分晶体已经析出,绝大部分的水也已经蒸发,因此冷却结晶过程是在已有晶种条件下进行的,那么析出的固体消耗于二次成核的部分非常少,绝大部分消耗于晶体的生长,即增加晶体的粒径,但由于体系中剩余水量较少,冷却过程所提供的溶质仅增加了约4%,故对晶体的粒径的提高非常有限。综上所述,冷却结晶对整个结晶过程的影响程度较小,而磷酸二氢钾最终产品的粒度分布主要受反应结晶过程控制。因此,本文接下来将主要考察反应结晶过程主要操作因素对磷酸二氢钾最终产品的粒度分布的影响规律。

图1 不同反应时间下反应结晶阶段和反应-冷却结晶阶段的磷酸二氢钾产品的收率对比

图2 不同反应时间下反应结晶阶段和反应-冷却结晶阶段的磷酸二氢钾产品的中位粒径对比
2.2 反应时间的影响
从图2可以看到,随着反应时间的增加,产品粒径不断增加,在反应时间达到6h时,产品中位粒径达到了1558µm。图3给出了不同反应时间下产品具体的粒度分布情况。从图3可以看到,随着反应时间的增加,磷酸二氢钾产品的平均粒径不断增加,在反应时间达到5h时,已有粒径大于3mm的晶体,平均粒径达到了1.210mm,然而在反应时间小于3h时,复分解反应尚未完全完成,溶液中析出的磷酸二氢钾能由复分解反应新产生的磷酸二氢钾及时补充,因此溶液中过饱和度能保持相对稳定,相应的成核和生长速率也较为稳定,产品的平均粒径为690µm,且分布较均匀。而当反应时间进一步延长后,随着反应溶液中水分的大量蒸出以及晶浆密度的增加,溶液中磷酸二氢钾的过饱和度也相应增加,高饱和度能同时促进二次成核速率和生长速率的提高,导致细晶的生成和现有晶体的生长,综合作用的结果是导致粒度分布变宽[11-12]。同时可以看到,当反应时间大于3h后,粒度分布曲线上晶体的粒径总体上是增加的,而小粒径的颗粒所占的百分比基本保持不变,表明此时溶液中过饱和度主要消耗于晶体的生长,过饱和度对晶体生长速率的促进大于成核速率。图4反映了不同反应结晶时间下磷酸二氢钾产品的平均粒径,可见二者呈良好的线性关系,表明所有粒子具有基本相同的生长速率,即磷酸二氢钾的生长速率与粒径无关。通过该线性关系的斜率,可以估算出平均生长速率约为3.3µm/min,这个结果与唐爱利[13]报道的磷酸二氢钾生长速率的实验结果(0.9~14µm/min)有较好的可比性,然而磷酸二氢钾在不同条件下准确的生长和成核速率则需要进一步的结晶动力学研究。
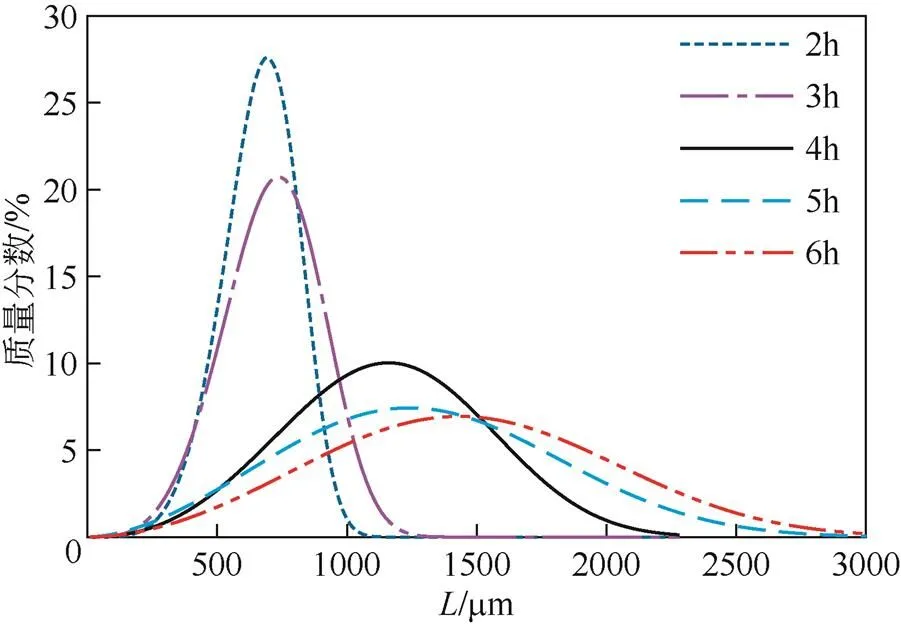
图3 反应时间对磷酸二氢钾粒度分布的影响

图4 磷酸二氢钾产品平均粒径与反应时间的关系
2.3 搅拌桨速对粒度分布的影响
搅拌是影响结晶产品粒度分布最重要的操作参数之一,适宜的搅拌能够使得晶体和溶液充分接触,液相的过饱和度能迅速地消耗于晶体的生长,从而有利于产生粒径较大、分布均匀的晶体产品,因此在保持反应过程中结晶器和搅拌器的构型以及总持液量相同的基础上,进一步考察了搅拌转速对磷酸二氢钾最终产品的粒度分布的影响。在1.3节所述的操作条件下,控制反应时间为3h,选择了6个搅拌转速进行了考察,结果如图5所示。由图5可知,搅拌转速在150~250r/min之间对产品粒度分布的影响不大,此时产品的平均粒径在700μm左右,分布较为均匀。在此转速区间,磷酸二氢钾的生成速率并不快,随着转速增加而提高的过饱和度能够被所有晶体均匀地消耗。随着转速进一步增加至300r/min时,氨气和水分的快速溢出从而使反应平衡快速向有利于磷酸二氢钾生成的方向进行,浓缩更快,更容易形成充裕的过饱和度,溶质的固液传质速率和晶体的生长速率均迅速增加,因而产品的平均粒径迅速增加,分布中大颗粒所占比例大幅增加,而小颗粒占比也大幅减少,此结果也表明磷酸二氢钾的结晶为表面反应控制,过饱和度对生长的影响大于成核[14]。而随着转速增加到350r/min时,晶体与搅拌桨叶的碰撞强度进一步增加,此时由于晶体与晶体之间、晶体与搅拌桨和容器壁之间的激烈碰撞而产生的二次成核现象和晶体破碎现象的概率大大增加,因而产品的平均粒径反而下降[15]。因此,如果要生成平均粒径大于1000µm的大颗粒磷酸二氢钾产品,转速300r/min是较为适宜的。

图5 不同转速下生成的磷酸二氢钾的粒度分布
2.4 原料浓度对反应影响
在基准结晶实验中,将磷酸一铵和氢氧化钾的浓度控制在质量分数分别为50%和48%是为了和实际生产中的原料条件保持一致。在保持其他条件不变的情况下,进一步考察了原料磷酸一铵和氢氧化钾的浓度对产品粒度分布的影响,结果分别见图6和图7。从图6和图7可以看到,原料磷酸一铵和氢氧化钾的浓度对磷酸二氢钾产品的粒度分布呈现相似的影响规律。在原料浓度较低时,复分解反应速率相对较慢,3h可能并没有使复分解反应完全,溶液中水分含量高,磷酸二氢钾过饱和度低,产品中小颗粒所占比重大。当磷酸一铵质量分数达到60%时,滴入的氢氧化钾与过量的磷酸一铵反应,反应速率加快,溶液始终处于高过饱和度状态,从而能促进晶体生长,因而产品的平均粒径迅速增加。

图6 原料磷酸一铵浓度对磷酸二氢钾粒度分布的影响

图7 原料氢氧化钾浓度对磷酸二氢钾粒度分布的影响
2.5 加料速率对反应影响
氢氧化钾的加入速率是控制产品粒度的重要参数之一。较快的加入速率能使单位时间内有更多的反应物参与反应,生成更多的磷酸二氢钾进入溶液,从而提高其过饱和度。图8反映了在基准结晶实验条件下,不同氢氧化钾加料时间下磷酸二氢钾的粒度分布。
从图8可以看出,随着加料速率的增加,磷酸二氢钾产品粒径呈现先逐渐减小再变大的规律。当氢氧化钾加料时间为10min和15min时,磷酸二氢钾产品的中位粒径分别为628.92μm、447.72μm,说明过快的滴加速度,形成大量的磷酸二氢钾溶解在水中,提高了溶液的沸点,从而降低了水分的蒸发速率,导致溶液的过饱和度较低,诱导期变长,只有等溶液浓缩到一定程度后,自发成核,晶体才能进行后续的生长[16]。而控制氢氧化钾的加料时间为30min时,溶液中反应速率较为均匀,粒度分布的中位粒径变大,因为延长加料时间溶液水分蒸发增加,溶液总体积减少,溶质浓度变高,滴加进去的氢氧化钾可以迅速和磷酸一铵反应提高过饱和浓度,有助于晶体的生长。在加料时间为60min时,水分蒸发更多,溶液的浓度更高,已经出现了成核现象,在滴加氢氧化钾发生反应的时候会提高过饱和度,使得晶体更易于产生成核,也就是相当于加入晶种,增加碰撞的的次数进行二次成核,有利于晶体的继续生长[17]。

图8 氢氧化钾加料速度对磷酸二氢钾粒度分布的影响
根据以上实验结果,确定了反应结晶制备大粒度磷酸二氢钾较为适宜的条件为:磷酸一铵和氢氧化钾质量分数为50%,氢氧化钾在30min内加入完毕,反应结晶时间为3h,搅拌速率为300r/min。在该条件下,进行了验证实验,所获得的磷酸二氢钾产品的粒度分布曲线和晶体照片见图9。可以看到,所获得的磷酸二氢钾产品晶体形貌为规则的四方晶,分布均匀,中位粒径达到了1070µm。
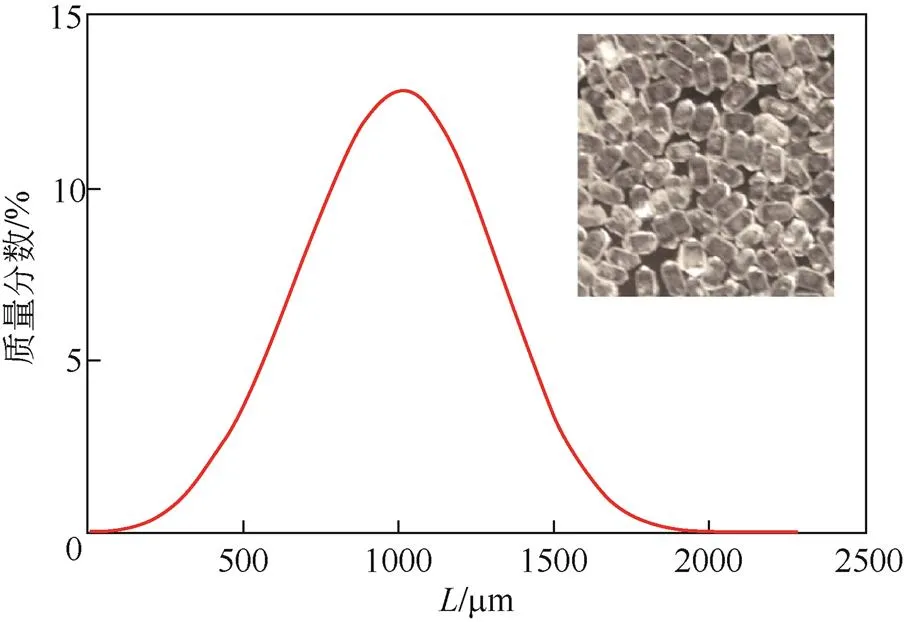
图9 适宜条件下的制备的磷酸二氢钾产品的粒度分布曲线和晶体照片
3 结论
(1)以工业级磷酸一铵为原料与氢氧化钾复分解反应结晶制备磷酸二氢钾可分为反应结晶和冷却结晶两个阶段,而磷酸二氢钾产品的粒度分布主要受反应阶段控制。
(2)反应时间、搅拌速度、原料浓度和加入速率对磷酸二氢钾产品的粒度分布有明显的影响,通过各因素间合理的控制,可以制备出晶形规整,分布均匀,平均粒径较大的磷酸二氢钾产品。
(3)过饱和度是控制磷酸二氢钾产品粒度分布的最关键因素,其对磷酸二氢钾晶体生长速率的影响远大于成核速率。磷酸二氢钾的生长速率与粒径无关,通过不同反应时下粒度分布数据估算的平均生长速率约为3.3µm/min。
[1] 罗建洪,李军,王英豪,等. 磷酸二氢钾市场投资现状分析[J]. 四川化工,2012,15(4):7-8.
LUO J H,LI,J,WANG Y H,et al. The market investment status of potassium dihydrogen phosphate[J]. Sichuan Chemical Industry,2012,15(4):7-8.
[2] 樊蕾,赵建国. 我国磷酸二氢钾现状及前景展望[J]. 磷肥与复肥,2006,21(3):34-37.
FAN L,ZHAO J G. The current status and prospect of potassium dihydrogen phosphate in China[J]. Phosphate & Compound Fertilizer,2006,21(3):34-37.
[3] 吴宇川,何兵兵,薛绍秀,等. 磷酸二氢钾的制备与应用研究进展[J]. 磷肥与复肥,2017,32(3):30-34.
WU Y C,HE B B,XUE SX,et al. Research progress on preparation and application of potassium dihydrogen phosphate[J]. Phosphate & Compound Fertilizer,2017,32(3):30-34.
[4] 王东头,石香玉. 磷酸二氢钾的生产方法综述[J]. 无机盐工业,2001,11(33):23-24.
WANG D T,SHI X Y. The summary of the production method for potassium dihydrogen phosphate[J]. Inorganic Chemicals Industry,2001,11(33):23-24.
[5] 杨位红,李新柱,胡兆平. 湿法磷酸制备磷酸二氢钾综述[J]. 无机盐工业,2014,46(4):7-9.
YANG W H,LI X Z,HU Z P. Summary for preparation of potassium dihydrogen phosphate from wet-process phosphoric acid[J]. Inorganic Chemicals Industry,2014,46(4):7-9.
[6] 刘倩. 复分解法与结晶法联合制备磷酸二氢钾的研究[D]. 上海:华东理工大学,2014.
LIU Q. Study of double decomposition combining with crystallization preparation of KDP[D]. Shanghai:East China Institute of Chemical Technology,2014.
[7] 谭淑珍,张罡,沈晃宏. 复分解四步循环法制取硫酸钾新工艺[J]. 化工进展,2002,21(12):949-951.
TAN S Z,ZHANG G,SHEN H H. New process of manufacturing potassium sulfate by four- step- circulation method of double decomposition reaction[J]. Chemical Industry and Engineering Progress,2002,21(12):949-951.
[8] 孙健,周贵云,吴岩,等. 磷铵法生产工业级磷酸二氢钾工艺技术的研究[J]. 磷肥与复肥,2015,30(5): 5-8.
SUN J,ZHOU G Y,WU Y,et al. Research on production technology of industrial grade potassium dihydrogen phosphate by ammonium phosphate method[J]. Phosphate & Compound Fertilizer,2015,30(5):5-8.
[9] 段新勇,吕淑珍,赖振宇,等. 磷酸二氢钾粒度对磷酸钾镁水泥性能影响[J]. 功能材料,2015,46(7):62-66.
DUAN X Y,LV S Z,LAI Z Y,et al. Effect of size of potassium dihydrogen phosphate on properties of magnesium potassium phosphate cement[J]. Journal of Functional Materials,2015,46(7):62-66.
[10] 党亚固,胡秀英,费德君,等. 磷酸二氢钾结晶的影响因素研究[J]. 无机盐工业,2008,40(6):16-18.
DANG Y G,HU X Y,FEI D J,et al. Research on influencing factors of crystallization of potassium dihydrogen phosphate[J]. Inorganic Chemicals Industry,2008,40(6):16-18.
[11] LONG B,YANG H,DING Y. Impact of seed loading ratio on the growth kinetics of mono-ammonium phosphate under isothermal batch crystallization[J]. Korean Journal of Chemical Engineering,2016,33(3):623-628.
[12] KUBOTA N,DOKI N,YOKOTA M,et al. Seeding effect on product crystal size in batch crystallization[J]. Journal of Chemical Engineering of Japan,2002,35(11):1063-1071.
[13] 唐爱利. 晶体生长行为的实验研究[D]. 广州:华南理工大学,2014.
TANG A L. Study on crystal growth behavior[D]. Guangzhou: South China University of Technology,2014.
[14] UTOMO J,MAYNARD M,ASAKUMA Y,et al. Experimental kinetics studies of seeded batch crystallization of mono-ammonium phosphate[J]. Advanced Powder Technology,2010,21(4):392-400.
[15] LI H,KAWAJIRI Y,GROVER M A,et al. Modeling of nucleation and growth kinetics for unseeded batch cooling crystallization[J]. Industrial & Engineering Chemistry Research,2017,56(14):4060-4073.
[16] ZHOU L,WANG Z,ZHANG M,et al. Determination of metastable zone and induction time of analgin for cooling crystallization[J]. Chinese Journal of Chemical Engineering,2017,25(3):313-318.
[17] WARSTAT A,ULRICH J. Seeding during batch cooling crystallization:an initial approach to heuristic rules[J]. Chemical Engineering & Technology,2006,29(2):187-190.
Size control for the reactive crystallization of potassium dihydrogen
DING Yigang1,HAN Yonghong1,LUO Wanzhi1,LONG Bingwen1,YU Ying2,JU Li2
(1The Hubei Key Laboratory of New-Type Reactors and Green Chemical Technology,Key Laboratory for Green Chemical Process of Ministry of Education,School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430205,Hubei,China;2Hubei Xiangyun(Group)Chemical Co.,Ltd.,Wuhan 435405,Hubei,China)
Potassium dihydrogen phosphate(KH2PO4)was prepared by reactive crystallization of ammonium phosphate(MAP)and potassium hydroxide(KOH),which was promising for industrialization due to low cost. It was experimentally proved that the crystal size of final KH2PO4product was mainly determined in the reaction stage. Therefore,the effect of reaction time,stirring speed,feed concentration,and feeding time on the crystal size distribution of KH2PO4,was studied and the reaction crystallization mechanism was discussed. Proper reaction crystallization conditions were proposed as:MAP and KOH solution mass percentage of 50%,KOH feeding time of 30min,reaction time of 3h,and stirring speed of 300r/min. Under those conditions,the median size of KH2PO4product was 1070µm with fairly uniform distribution and regular tetragonal crystal morphology.
potassium dihydrogen phosphate;reaction crystallization;crystal size distribution;process
TQ134.1
A
1000–6613(2017)10–3590–06
10.16085/j.issn.1000-6613.2017-0260
2017-02-22;
2017-05-07。
湖北省科技支撑计划(2015BCB248)及湖北省重大科技创新计划(2016ACA179)项目。
丁一刚(1963—),男,教授,博士生导师。E-mail:dygzhangli@163.com。
龙秉文,教授。E-mail:Bingwen_ long@163.com。
