草莓表面典型微生物鉴定、16SrDNA同源性分析及附着能力研究(Ⅱ)
2017-10-20郭灵安代晓航杨文婷
魏 超,郭灵安 ,代晓航,杨文婷
(1. 四川省农业科学院分析测试中心,四川 成都 610066;2. 乐山市农业局,四川 乐山 614000)
草莓表面典型微生物鉴定、16SrDNA同源性分析及附着能力研究(Ⅱ)
魏 超1,郭灵安1,代晓航1,杨文婷2
(1. 四川省农业科学院分析测试中心,四川 成都 610066;2. 乐山市农业局,四川 乐山 614000)
研究草莓表面微生物分布状况,分析其附着能力为草莓安全食用提供保障。按照草莓生长的3个阶段进行2年度连续抽样,对分离草莓的表面典型微生物进行生化分析及16SrDNA测序鉴定,对分离种最多的泛菌采用最大简约法(MP)进行系统进化分析,并观察沙雷菌和泛菌附着能力。 结果表明,3种典型的沙雷菌属微生物在草莓表面均有检出,泛菌属微生物检出种类较多,且基因型差异较明显。在电镜下,能明显观察到泛菌属泛菌和粘质沙雷菌对草莓表皮的附着,含氯清洗剂和10 %生理盐水可对其有效祛除。草莓表面附着多种属微生物,有效的清洗方法可以清除大部分微生物,此研究为草莓食用的风险评估提供理论依据。
草莓;微生物;同源性;食用安全控制
草莓果肉多汁,营养丰富但容易腐烂,因其糖量高、含水量高并且质地柔软,较易成为微生物的繁殖生长的温床。草莓表面微生物的大量增殖加快草莓腐烂速度,使草莓很难长久保鲜,同时草莓表面共生的致病微生物也为草莓的食用安全带来隐患。
在对草莓表面微生物的菌落结构的研究中,发现草莓表面长期分布多种细菌,以肠杆菌科微生物为主,共生其他致软腐微生物及其条件致病微生物[1]。沙雷菌属(Serratia)的细菌革兰氏染色阴性直杆菌,无荚膜,无芽孢,通常靠周身鞭毛运动,兼性厌氧,《伯杰鉴定细菌学手册》(Bergey’s Manual of Determinative Bacteriology)将沙雷菌属细菌分为10个种,并进一步明确了生物型,沙雷菌属在营养琼脂培养基上培养过夜可形成直径为1.5~2.0 mm的菌落,在12~36 ℃培养菌落产灵菌红素(prodigiosin)和比羧酸(pyrimine)2种不同色素,在培养基上表现为菌落红色[2]。沙雷菌属的部分种为条件致病菌多以受到医学界的重视,被认为是医院内感染的重要病原菌。泛菌属(Pantea)也被成为多源菌属,菌内包括多个种,一般为革兰氏染色阴性直杆菌,无荚膜,无芽孢,一些菌株可以形成长链或者类似球体的结合体,被称为公质体(symplasmata),在营养琼脂培养基上的菌落光滑,半透明,菌落为黄色、浅米色至淡橘黄色[2],可从植物、种子、水果、及人体(尿液、血液、伤口等)分离得到,有些菌株是植物病原体,有些菌株也可造成人类感染[3-6]。16SrDNA 序列测定在细菌鉴定中已广泛应用,利用保守区域设计的通用引物几乎能与所有种属靶位点核糖体结合,对未知细菌及特殊细菌的鉴定具有优势[7],在对草莓表面微生物进行整理后,采用16SrDNA 分子检测方法对不同时期草莓上细菌的分布情况进行调查,对出现率高的泛菌和沙雷菌进行同源性分析,研究草莓表面微生物种群的的分布关系,用电镜等方法对微生物在草莓的附着进行观察研究,并用常见多种清洗方法对草莓表面几种微生物的去除比较。研究草莓表面微生物分布及附着,旨在对食用草莓表面微生物的风险进行分析,为草莓上细菌污染的干预方法提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试材料 草莓(FragariaananassaDuch.)来源为四川省成都市某草莓无公害种植基,根据生长阶段连续2年在12月份青果期,2月份冬草莓成熟期及4月份春草莓成熟期各选取5个批次共30份样品进行微生物筛查。
1.1.2 仪器与试剂 微生物培养及生化鉴定:用蛋白质缓冲水(BPW)、营养琼脂平板购于广东环凯,微生物鉴定仪器为法国生物梅里埃公司ATB细菌鉴定仪;鉴定试剂条ID 32 E为法国生物梅里埃公司。高压灭菌锅为上海三申,MJX-500 培养箱。
微生物分子鉴定:作引物正向引物(F27):5-AGAGTTTGATCMTGGCTCAG-3;反向引物(R1492):5-TACGYTACCTTGTTACGACT-3,测序为成都伟杰生物技术有限公司。 MasterMix 购于成都博瑞克生物技术有限公司; 微生物裂解液的 Lysis Buffer为 Takara 公司。附着能力研究:显微镜L-1800,扫描电子显微镜KYKY280-B,
1.2 试验方法
1.2.1 微生物分离培养 称取25 g样品,用蛋白质缓冲水(BPW)1∶10增菌,将增菌液分别置于有氧、厌氧条件下36 ℃培养18~24 h后将增菌液按照一定比例稀释后涂布于营养琼脂平板, 36 ℃培养24 h,挑取各平板上不同类型菌落形态微生物于营养琼脂平板上反复经典纯化。
1.2.2 生化鉴定 营养琼脂挑取可分离的单菌落,进行革兰氏染色和镜检,G-菌使用ID 32 E试剂条。鉴定微生物时挑取营养琼脂培养12~24 h微生物菌落至比浊管,振荡分散,将菌液调至0.5麦氏浊度,由ATB系统自动读取试剂条信息分析并给出最终结果。
1.2.3 微生物分子试验 ①DNA 模板制备。用灭菌枪头将单菌落挑至50 μl Lysis Buffer裂解液中,混合,沸水浴15 min,10 000 r/ min离心冰浴,取裂解后上清液作为PCR反应模板。②PCR 反应体系 反应体系体积为25 μl,Taqmix(2×) 12.5 μl,上下游引物各1 μl,模板DNA 1 μl,ddH2O补齐,PCR 反应条件为:预变性3 min 94℃,变30 s 94 ℃,退火30 s 55 ℃,延伸2 min 72 ℃,30个循环,72 ℃保温10 min。③测序及比对。PCR产物直接提交测序公司进行测序,测序结果比对目标16srDNA序列进行双向测序并拼接,并提交NCBI比对。④系统发育树构建。在GeneBank上进行比对,用MAGA6软件进行序列分析,相似程度较高的采用最大简约法(Maximum parsimony)进行系统发育树构建。
1.2.4 草莓表面微生物附着及清洗试验 对生化检测同属种类最多的泛菌属泛菌及沙雷菌属粘质沙雷菌进行附着和清洗试验,选取分离微生物编号为7Y2和SW8进行靶微生物添加性试验。7Y2,SW8在营养琼脂平板上表现为明显的菌落黄色和菌落红色的生物学特征,较其它同属微生物更易分辨,36 ℃培养24 h显微观察其菌落形态;挑取营菌落至无菌生理盐水,振荡分散,将菌液调至0.5麦氏浊度(菌体约为1.5×108个/mL),分别取10、1、0.1 mL于150 mL无菌生理盐水中,将草莓浸泡10 min,无菌表面烘干,电子扫描显微镜观察微生物附着情况;模拟日常清洗手段,进行3项平行试验,处理分别为:①自来水连续冲洗10 min;②10 % NaCl溶液浸泡10 min; ③机清洗剂洗洁精浓度为1 %浸泡5 min,自来水冲洗5 min和④空白对照,处理后的草莓进行泛菌和粘质沙雷菌检测。
泛菌检测方法为:取待试样品于无菌均质袋均质,按照1∶10,1∶100,1∶1000比例用无菌生理盐水将样品稀释到合理区间,取1 mL稀释液涂布于营养琼脂平板,36 ℃培养24 h后,对黄色菌落分离纯化36 ℃培养24 h,接种ID 32 E试剂条36 ℃培养24 h后读取鉴定结果,结果为泛菌且ID %>95 %记为阳性结果每个稀释度设3组重复。粘质沙雷菌检测方法为取待试样品于无菌均质袋均质,按照1∶10,1∶100, 1∶1000比例用无菌生理盐水将样品稀释到合理区间,取1 mL稀释液涂布于营养琼脂平板,36 ℃培养24 h后,对红色菌落分离纯化36 ℃培养24 h,接种ID 32 E试剂条36 ℃培养24 h后读取鉴定结果,结果为沙雷菌且ID %>95 %记为阳性结果。每样品设3个平行,根据泊松分布原理计算结果。
2 结果与分析
2.1 草莓表面典型微生物的分离鉴定
采用1.2.1方法对草莓表面上的细菌进行分离,对出种类最高的3属共15种微生物进行鉴定,其中泛菌属8种、假单胞菌属4种、沙雷菌属3种,鉴定结果见表1,生化图谱见表2,生化鉴定结果 16SrDNA分子鉴定结果基本一致,其中*表示微生物自动鉴定仪数据库中种编号。实验结果表明分离种类最多的是泛菌属微生物,泛菌属微生物为多源菌属,具有生态学的广泛性,但生化反应结果表明分离的8种泛菌属微生物在19个生化反应中表现一致,分离的泛菌属微生物均能分解d-葡萄糖,d-麦芽糖,d-海藻糖,L-鼠李糖和蔗糖等左旋糖类物质,为泛菌属微生物典型生物学性状;但肌醇、α-麦芽糖、d-甘露醇、丙二酸盐、d-山梨醇、α-半乳糖苷酶和d-阿拉伯醇等生化反应中差压较大,为同属不同种类微生物的差异性。草莓中基本分离得到典型沙雷菌属典型种微生物,分别为液化沙雷菌、粘质沙雷菌、气味沙雷菌,其中粘质沙雷菌为沙雷菌属微生物的模式种,3种微生物在营养琼脂培养基上都表现为明显的红色菌落且在生化反应中表现沙雷菌属微生物典型生物学特征。假单胞菌属微生物在32个生化反应中阳性表现率低,但鉴定的3种微生物均在丙二酸盐反应中表现阳性,其中鉴定为荧光假单胞菌生化反应中ID %较低为可疑生化谱,但分子鉴定结果为荧光假单胞菌99 %置信结果(表3)。

表1 微生物生化鉴定结果

表2 草莓微生物鉴定图谱
注:ID 32 E 试剂条:LIP 酯酶,βNAG β氮乙酰葡萄糖胺,MAL d-麦芽糖,GLU d-葡萄糖,SAC 蔗糖,GAT d-半乳糖酸盐同化,URE 尿素酶,AHD 精氨酸双水解酶,INO 肌醇,aMAL a-麦芽糖,CEL d-纤维二糖,βGAL 半乳糖苷酶,AspA L-天门冬素芳胺酶,TRE d-海藻糖,aGLU a-葡萄糖苷酶,LARA L-阿拉伯糖,ODC 鸟氨酸脱羧酶,IND 吲哚,MAN d-甘露醇,RP 酚红,5KG 5酮基·葡萄糖酸钠,LARL L-阿拉伯醇,LDC 赖氨酸脱羧酶,βGLU β-葡萄糖苷酶,MNT 丙二酸盐,SOR d-山梨醇,βGUR β葡萄糖醛缩酶,ADO 侧金盏花醇,RHA L-鼠李糖,aGAL a-半乳糖苷酶,DARL D-阿拉伯醇, PLE 古老糖。
Note: Reagent Strips ID 32 E: LIP Esterase, βNAG β-Nitrogen acetyl glucosamine, MAL d-Maltose, SAC sucrose, GAT d- Galactose formate assimilation,URE Urease,AHD Arginine dihydrolase,INO Inositol,aMAL a-Maltose,CEL d-Cellobiose,βGAL β-Galactosidase,AspA L-Asparagine aminotransferase,TRE d- Trehalose,aGLU a- Glucosidase,LARA L-Arabinose,ODC Ornithine decarboxylase,IND Indole,MAN d- Mannitol,RP Phenol red,5KG 5 Keto sodium gluconate,LARL L- Arab alcohol,LDC Lysine decarboxylase,βGLU β- Glucosidase,MNT Malonate,SOR d- Sorbitol,βGUR β-glucose aldolase,ADO Amurensis alcohol,RHA L- Rhamnose,aGAL a- Galactosidase,DARL D- arabitol.Reagent Strips ID 32 GN::FUC L- Fucose,SAC Sucrose,SOR D-sorbitol,MAL Maltose,ARA L-arabinose,ITA Itaconic acid,PROP Propionate,SUB Suberate,CAP Caprate,MNT Malonate,VALT Valerate,ACE Acetate,CIT Citrate,LAT DL-lactate, HIS Histidine,ALA L-alanine,5KG Keto sodium gluconate,3OBU 3 - hydroxy - butyrate,GLYG Glycogen,POBE 4 - hydroxy - benzoate,mOBG 3 - hydroxy - ben.

表3 微生物测序比对结果
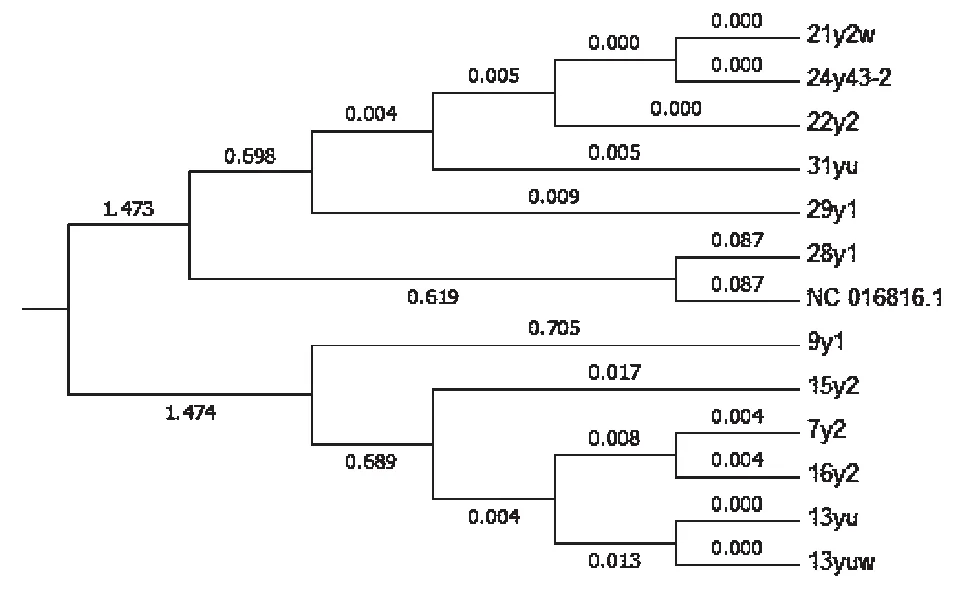
图1 泛菌属系统发育树Fig.1 Phylogenetic tree of Pantoea
2.2 典型微生物16SrDNA同源性分分析
对分离种类最多且种间差距较明显的泛菌属微生物进行16srDNA同源性分析,采用最大简约法(Maximum parsimony),构建生物的系统发育树,并分析生物物种之间的演化关系。系统发育树结果见图1。由系统发育树可以看出泛菌属微生物分子间差异也较明显,泛菌属微生物为多源菌属,具有生态学的广泛性和生物学的广泛性[2],从系统发育树的树形上来看8种泛菌属微虽然在同一谱系但基因差异较明显从而佐证泛菌属微生物在生物存在具有一定的广泛性。
2.3 微生物附着与清洗试验
编号为7Y2和SW8的泛菌属泛菌及沙雷菌属粘质沙雷菌营养琼脂36 ℃培养24 h条件下革兰氏染色100倍观察图见图2;微生物添加附着草莓表面的扫描电镜观察图见图3。由图2可以看出,微生物在营养琼脂培养条件下,保持短杆菌的菌落形态。由图3可以看出泛菌和粘质沙雷菌可以吸附在草莓外表皮,并且粘附紧密。
附着与清洗试验结果见表4,处理①~④分别为①自来水连续冲洗10 min,② 10 %NaCl溶液浸泡10 min,③有机清洗剂洗洁精浓度为1 %浸泡5 min,自来水冲洗5 min和④空白对照。由清洗试验可以看出,清洗可以有效的降低草莓上泛菌和沙雷菌的数量值,盐水浸泡清洗对微生物的降低作用最为明显,有机清洗剂中添加有杀菌作用的物质,对2种微生物的减低作用也较明显,相较之下清水冲洗对微生物的附着降低数量较小,这与草莓浆果的表皮构成有关,微生物的菌毛性结构与草莓表面种子形成的凹凸结构可以帮助微生物的附着。
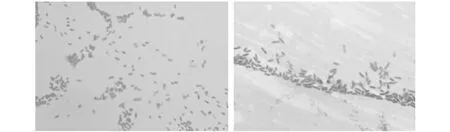
图2 泛菌和粘质沙雷菌在100倍显微镜菌体形态 Fig.2 Bacterial modality of Serratia marcescens and Pantoea spp. in the 100× microscope

图3 泛菌和粘质沙雷菌草莓表面的附着Fig.3 Adhesion of Serratia marcescens and Pantoea spp. to the surface of strawberry

表4 草莓泛菌和粘质沙雷菌的附着与清洗
3 结 论
3.1 草莓表面微生物种类的多样性
试验在莓表面上的细菌进行分离3属共15种微生物,其中泛菌属8种、假单胞菌属4种、沙雷菌属3种。且生化检测结果和分子鉴定结果基本一致,由微生物16srDNA构建由系统发育树可以看出泛菌属微生物分子间差异也较明显,泛菌属微生物为多源菌属,具有生态学的广泛性和生物学的广泛性。
3.2 微生物附着与清洗
对出现草莓表面出现率较高的几种微生物进行了显微观察和电镜试验,表明泛菌和粘质沙雷菌可以吸附在草莓外表皮,并且粘附紧密。根据微生物的生化性质建立了草莓表面清洗计数试验,试验结果表明盐水浸泡清洗对微生物的降低作用最为明显,有机清洗剂中添加有杀菌作用的物质,对泛菌和粘质沙雷菌的减低作用也较明显,试验验证与微生物的菌毛性结构与草莓表面种子形成的凹凸结构可以帮助微生物的附着,是微生物较难清洗的主要原因。
4 讨 论
4.1 草莓表面微生物种类的多样性
综合对草莓表面典型微生物的研究,表面收集的微生物种类较多,其原因由于草莓质地柔软且含糖量高,且种植过程中较易暴露在高微生物介质中。草莓是富营养作物,植过程中有机肥主要来源于猪粪、鸡粪、牛粪,其中含有大量的致病微生物;在草莓的采摘运输环节,其的自然属性决定其具有易受微生物侵染而腐烂变质的特点,操作过程若造成产品受外部挤压或受到机械损伤,伤处也极易受到空间微生物侵染。本研究中沙雷菌属多种典型微生物在不同时期的草莓上检出,泛菌属多个种微生物在草莓表面均有附着,可以看出部分对营养要求不是特别高,且生殖环境要求不严苛的微生物均可在草莓上附着或寄生。危害识别是风险评估的一部分,是指对可能存在于特定的一种或一类食品中能引起有害健康的包括生物因素的识别[8]。对于草莓食用安全的风险评估而言,草莓表面微生物种类的多样性是其危害识别的重点和难点。
4.2 草莓微生物的食用安全控制
草莓为浆果,颗粒籽镶嵌在果实表面,清洗过程中易出现在微观疏水区,微生物表面鞭毛蛋白帮助其附着在草莓表面[9],本实验研究可得清洗可以清除草莓表面部分微生物,有效的清洗方法可以大量去除部分微生物但不能将其表面的微生物全部清除。本实验研究的微生物虽非致病微生物,但部分为条件致病微生物,且微生物可通过遗传物质交换(例如,结合、传导、转化)获取新的基因,基因水平的转移被认为是毒素基因转移到其他新的细菌菌株的途径之一[10]。微生物的污染存在于生产和销售的各个环节,除了加强草莓表面微生物的附着控制的研究,相关部门也应该建立相关的农产品使用安全风险评估机制,对易染且不易清洗果蔬微生物进行预警,为食果蔬食用安全提供指导。
[1]魏 超,郭灵安,代晓航. 草莓微生物学检查及肠杆菌和霉菌鉴定[J].西南农业学报,2012, 25(6):2104-2107.
[2]房 海,陈翠珍,张晓君. 肠杆菌科病原细菌 [M]. 北京:中国农业科学技术出版社,2011:348-349.
[3]Aly N Y, Saleen H N, Lila R A,et al.Pantoea agglomerans bloodsteam infection in preterm neonates[J]. Medical Principles and Practice, 2008, 17(6):500-503.
[4]Cruz A T, Cazacu A C, Allen C H, et al. a plant pathogen causing human disease[J]. Journal of Clinical Microbiology, 2007, 45(6):1989-1992.
[5]Eullerton D G, Lwin A A, Lal s. Pantoea agglomerans liver abscess presenting with a painful thigh[J]. European Journal of Gastroenterology & Hepatology, 2007,19(5):433-435.
[6]Gitaitis R D, Walcott R R, Sanders H F, et al. Effects of much and irrigantion system on sweet onion: II. The epidemiology of center rot[J]. Journal of the American Society for Horticultural Science, 2004, 129(2): 225-230.
[7]刘朝军.16SrDNA 序列测定在细菌鉴定中的应用[J]. 军医进修学院学报,2011,32(7): 774-776.
[8]Stephen J Forsythe.The Microbiological Risk Assessment of Food,[M].2002.
[9]Gillian A. Turnbull, J. Alun W. Morgan. The role of motility in the in vitro attachment ofPseudomonasputidaPaW8 to wheat roots[J]. FEMS Microbiol.Ecol, 2001, 35(3):57-65.
[10]Lederberg. Infectious disease as an evolutionary paradigm[J]. Emerg. Infect. Dis, 1997(3):417-423.
(责任编辑 陈 虹)
ResearchonHomologyandAdhesionofTypicalMicroorganismsonSurfaceofStrawberry(Ⅱ)
WEI Chao1, GUO Ling-an1, DAI Xiao-hang2, YANG Wen-ting2
(1.Sichuan Academy of Agricultural Analysis and Testing Center, Sichuan Chengdu 610066, China;2.Leshan Municipal Bureau of Agriculture, Sichuan Leshan 614000, China)
The distribution of microorganisms on the surface of strawberry and their adhesion were studied to provide protection for the safe consumption of strawberry. Strawberry was continuously sampled within two years according to its three growing stages, the biochemical identification and 16SrDNA sequencing identification of the microorganisms on the surface of the sampled strawberry were conducted. Most isolatedPantoeaby Maximum Parsimony (MP) phylogenetic analysis was conducted, and the adhesions ofSerratiaspp. andPantoeaspp. also were observed.The result showed that three typicalSerratiaspp. on the surface of strawberry were detected, and there were many kinds ofPantoeaspp. with obviously different genotypes. Under the electron microscope, the adhesions ofPantoeaspp. andSerratiamarcescenson the surface of strawberry were clearly observed, which could be effectively eliminated by Chlorine-containing detergent and 10 % saline.Most of microorganisms existing on the surface of strawberry could be removed by effective cleaning methods. This research would provide theory basis for the risk assessment of the consumption of strawberry.
Strawberry; Microorganism; Enteropathogenic bacteria; Hazard analysis critical control
1001-4829(2017)3-0650-06
10.16213/j.cnki.scjas.2017.3.030
S668.4
A
2016-03-20
四川省财政创新能力提升工程项目(2013XXXK-022);四川省重要技术标准研究项目(ZYBZ 2013-40);国家农产品质量安全风险评估重大专项(GJFP201601302)
魏 超(1985-),女,黑龙江哈尔滨人,助理研究员,微生物相关检测及风险评估,E-mail:cc123qqq@163.com。
