广西东南沿海生姜茎腐病病原菌鉴定
2017-10-20龙艳艳刘增亮张金莲陈廷速
龙艳艳,刘增亮,汪 茜,龙 游,张金莲,陈廷速*
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.广西物宝农业微生物应用联合实验室,广西 南宁 530007)
广西东南沿海生姜茎腐病病原菌鉴定
龙艳艳1,2,刘增亮1,2,汪 茜1,2,龙 游1,2,张金莲1,2,陈廷速1,2*
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.广西物宝农业微生物应用联合实验室,广西 南宁 530007)
茎腐病是生姜种植业最具破坏性的病害之一,具有发病时间短、病程进展快、病株致死率高的特点。本研究从广西东南沿海生姜种植区采集到生姜茎腐病病株,经过分离纯化得到多个腐霉菌株,通过形态学观察、分子生物学和致病性鉴定,将病原菌鉴定为群结腐霉(Pythiummyriotylum)。该病原菌的鉴定,对控制广西地区生姜茎腐病的发生和扩散具有重要的理论指导意义。
生姜;茎腐病;群结腐霉;致病性
生姜(ZingiberofficinaleRosc.)是一种高效高产的经济作物,在我国大部分地区均有种植,广西是主要产区之一。随着生姜种植面积的不断扩大和规模化生产的发展,生姜病害也日益严重,逐渐成为制约生姜产业健康发展的关键因素之一,病害的控制及防治也成为不可忽视的问题。生姜茎腐病又称为生姜软腐病、生姜腐霉软腐病、生姜根腐病等,俗称生姜烂脖子病、生姜黑脚病,是生姜生产中破坏力极强的一种卵菌病害,已成为姜瘟病之后又一个急需解决的灾变病害,在国内外植保领域引起广泛关注。通常情况下,由该病引起的生姜减产在5 %~30 %之间,病害严重甚至会导致绝收[1-2]。生姜茎基腐病在我国的首次报道出现在台湾地区[3],随后,广东及山东的生姜种植区也相继报道了该病的普遍发生[4-5]。生姜茎基腐病在这些种植区发病时间短,传播迅速,为害严重,且呈逐年加重的趋势,部分地块绝产绝收。因此,明确该病病原及发生规律,对控制广西地区生姜茎腐病的发生和扩散具有重要意义。
关于引起生姜茎基腐病的病原菌,世界各地的报道不尽相同。由于地理环境和气候条件的差异,不同国家及地区间的优势致病菌种类会出现较大差异。多数国家以腐霉为主,包含的种类有瓜果腐霉(Pythiumaphanidermatum)、德里腐霉(P.deliense)、禾生腐霉(P.graminicola)、群结腐霉(P.myriotylum)、满器腐霉(P.pleroticum)、刺腐霉(P.spinosum)、华丽腐霉(P.splendens)、终极腐霉(P.ultimum)、钟器腐霉(P.vexans)和姜腐霉(P.zingiberis)等[6-8]。也有些研究者认为该病是由腐霉和镰刀菌复合侵染引起[8],还有少数学者认为该病是由镰刀菌单独侵染引起[9]。在我国,生姜茎腐病的病原菌研究相对滞后,台湾地区和山东生姜产区报道了该病是由群结腐霉引起[3,5]。而广州生姜产区的生姜根茎腐烂是由青枯细菌和腐霉单独或共同侵染引起,主要致病腐霉为瓜果腐霉、群结腐霉、禾生腐霉和简囊腐霉(P.monospermum)[4]。而广西尚未发现有生姜茎腐病的报道。本研究对广西省东南沿海地区生姜种植地块进行调查,首次发现并采集出现典型症状的生姜茎基腐病的病株,对其进行病原菌分离、鉴定及致病性测定,明确了引起该病的病原菌种类。
1 材料与方法
1.1 病害症状描述及样品采集
2016年8月,前往广西北海、合浦、防城和钦州调查生姜茎腐病发病情况,描述病害症状,并采集病株。
1.2 病原菌的分离和纯化
将采集到的生姜茎腐病病株的根茎用自来水轻轻冲洗数遍后,剪成2 cm左右的根段,用75 %酒精表面消毒5 min,无菌水冲洗3遍,再用95 %次氯酸钠消毒2 min,无菌水再冲洗3遍,最后用消毒的解剖刀切掉两端后,取0.2 cm内部小段病组织,移到玉米粉琼脂培养基(Cornmeal agar, CMA)平板上,于25 ℃下培养。菌丝长出后随即切取菌丝尖端转入新的CMA平板中进行纯化培养。
1.3 病原菌致病性测定
根据柯赫法则,选取6个致病腐霉,采用盆栽接种测定方法测定它们的致病性。用PDA培养基活化病原菌,待菌落长满整个培养皿后,用打孔器制成小菌饼,接种到经过针扎处理的健康生姜苗的茎基部伤口附近,随后覆盖上无菌沙土。以未接病原菌的健康生姜苗为对照,每个处理设置3个重复,每天早上浇水保湿。观察和记录发病情况,且进行病原菌再分离,鉴定是否与原接种菌株相同。
1.4 菌株鉴定
形态鉴定:在CMA平板上观察菌株培养形态。观测孢子囊、藏卵器和卵孢子的大小、形状等指标。主要根据van der Plaats-Niterink(1981)的腐霉专著进行形态鉴定[10]。
分子鉴定:将纯化好的病原菌移植到PDA平板培养基上,在25 ℃的培养箱中培养4~7 d,待长满浓密的气生菌丝后,置于5 ℃冰箱中备用。配制PCR扩增体系,将适量菌丝直接加入体系中进行PCR扩增。25 μl PCR体系成分如下: 2×EasyTaqPCR SuperMix(北京全式金生物技术有限公司) 12.5 μl、引物ITS5和ITS4各1 μl、ddH2O 10.5 μl、病原菌菌丝适量。热循环反应程序设置如下:95 ℃下初始变性3 min,接下来为94 ℃下变性40 s,54 ℃下引物退火50 s,72 ℃下延伸60 s,35个循环结束后,在72 ℃下延伸10 min。反应结束以后,再次以1 μl第一次PCR的产物为模板,用相同的PCR体系及热循环反应程序进行第2次PCR。扩增中利用水代替DNA模板为空白对照。用琼脂糖凝胶电泳法检测PCR反应结果,吸取4 μl PCR产物加入0.8 %(W/V)琼脂糖凝胶,凝胶置于1 × TAE缓冲液(0.4 M Tris, 50 mM NaOAc, 10 mM EDTA, pH 7.8)中,在75 V下电泳40 min,最后在紫外灯下拍照检测。检测出明显亮条带的样品送到北京诺赛基因组研究中心有限公司用相同的引物在ABI 3730-XL DNA测序仪进行双向测序。拿到测序结果后,在 NCBI(National Center for Biotechnology Information)中进行 Blast 同源性搜索,初步确定病原菌的分类地位。使用Clustal-X(1.83)软件对所测得的生姜茎腐病病原菌及其近缘种的ITS基因序列(表1)进行多重序列比对分析,所有的位点都作无序、不加权处理,碱基缺失被看做数据缺失。比对好的文件将其保存为Neux文件格式以备后续分析使用。系统发育树的构建是通过 PAUP*4.0b10 软件完成的,采用最大简约法(Maximum parsimony, MP),在分析过程中采用启发式搜索算法,应用二分树重联法(tree-bisection-reconnection, TBR)来进行分枝交换,每次搜索重复1000次随机序列添加,并保留每次重复得到的所有的树,树的内部分枝的强度用相同的设定进行1000次自展检验。
2 结果与分析
2.1 症状表现
成株期染病,先在姜苗茎基部形成黄褐色水渍状病斑,接着下部叶片先从叶尖、叶缘处黄化并向叶背卷曲,之后逐渐往上部叶片扩展直至嫩芽,最后因茎基部缢缩倒伏导致全株黄化枯死(图1,A)。
2.2 病原菌的分离和致病性测定
从病株上分离纯化到一批菌落形态一致的腐霉菌株,挑选了6个代表菌株进行致病性测定。盆栽结果显示,6个菌株均能使带有伤口的姜苗发病(图1,C),而对照组的姜苗正常生长(图1,B)。该病发病过程短,发病进程快,接种后第2天陆续开始出现田间典型病害症状,8 d以后陆续出现全株枯死,半个月后基本全部枯死。通过对发病植株体内病原菌的重新分离与形态鉴定,发现重新分离得到的病原菌与原接种病原菌为相同的物种,表明该批菌株为生姜茎腐病的致病菌。

表1 构建系统发育树的腐霉物种名单

A.田间发病症状;B.致病性测定——对照;C.致病性测定——回接发病症状A.Symptoms in field; B.CK in pathogenicity tests; C.Symptoms in pathogenicity tests图1 病害症状Fig.1 Symptoms of soft rot
2.3 病原菌的鉴定
形态描述:菌落在PDA培养基上白色,放射状,气生菌丝密集。菌落在CMA培养基上半透明状,呈树枝状向外延伸,未长满平皿时菌落边缘不整齐,菌丝基内生。附着孢瘤状突起,常成簇着生。孢子囊为膨大或不膨大的丝状结构,膨大部分指状或香肠状。球形菌丝膨大体常见。藏卵器球形或近球形,偶尔囊袋形,直径23.1~38.2(av. 29.9)μm,顶生或间生,偶尔2个串生。雄器大多数异丝生,雄器柄分枝或不分枝,常或多或少松散包裹着藏卵器;雄器细胞曲颈状或棍棒状,通过顶端与藏卵器接触。卵孢子球形,偶尔椭圆形,直径17.0~29.7(av. 24.6)μm,不满器,偶尔满器,每个藏卵器有1个卵孢子(图2)。
该菌株的形态特征与van der Plaats-Niterink(1981)描述的群结腐霉基本一致,只是本研究中分离到的菌株出现的球形菌丝膨大体未见van der Plaats-Niterink(1981)进行描述[10]。
在NCBI中用BLAST 搜索相似序列结果显示,与菌株的ITS序列(已经提交GenBank,收录号LT634147)相似度最高的物种为群结腐霉。根据Lévesque和de Cock(2004)对腐霉属进化枝的划分标准,本研究中分离到的腐霉菌株被归入进化枝B(clade B)[13]。因此,从GenBank 中下载归属于腐霉进化枝B的目前已知物种的代表菌株的ITS 序列用于系统发育分析,以瓜果腐霉P.aphanidermatum(属于进化枝A)为外群。
在分子系统演化分析中共包括41条序列,序列比对数据集由842个碱基位点组成,其中591(70.2 %)个为保守位点,190(22.6 %)个为信息位点。简约法分析得到12个等价的最大简约树(tree length =613, CI=0.5889, RI=0.8143, RC=0.4795, HI=0.4111)。在分子系统发育树上,本研究中分离到的生姜茎腐病病原菌和群结腐霉P.myriotylum的模式菌株CBS695.79聚在同一个分枝中(图3)。

A.附着孢;B~C.孢子囊;D.球形菌丝膨大体;E~H.藏卵器、雄器和卵孢子。标尺= 10 μmA.appressoria; B-C.sporangia; D.globose hyphal swellings; E-H.oogonia, antheridia and oospores.Bars = 10 μm图2 群结腐霉形态Fig.2 Morphology of P. myriotylum
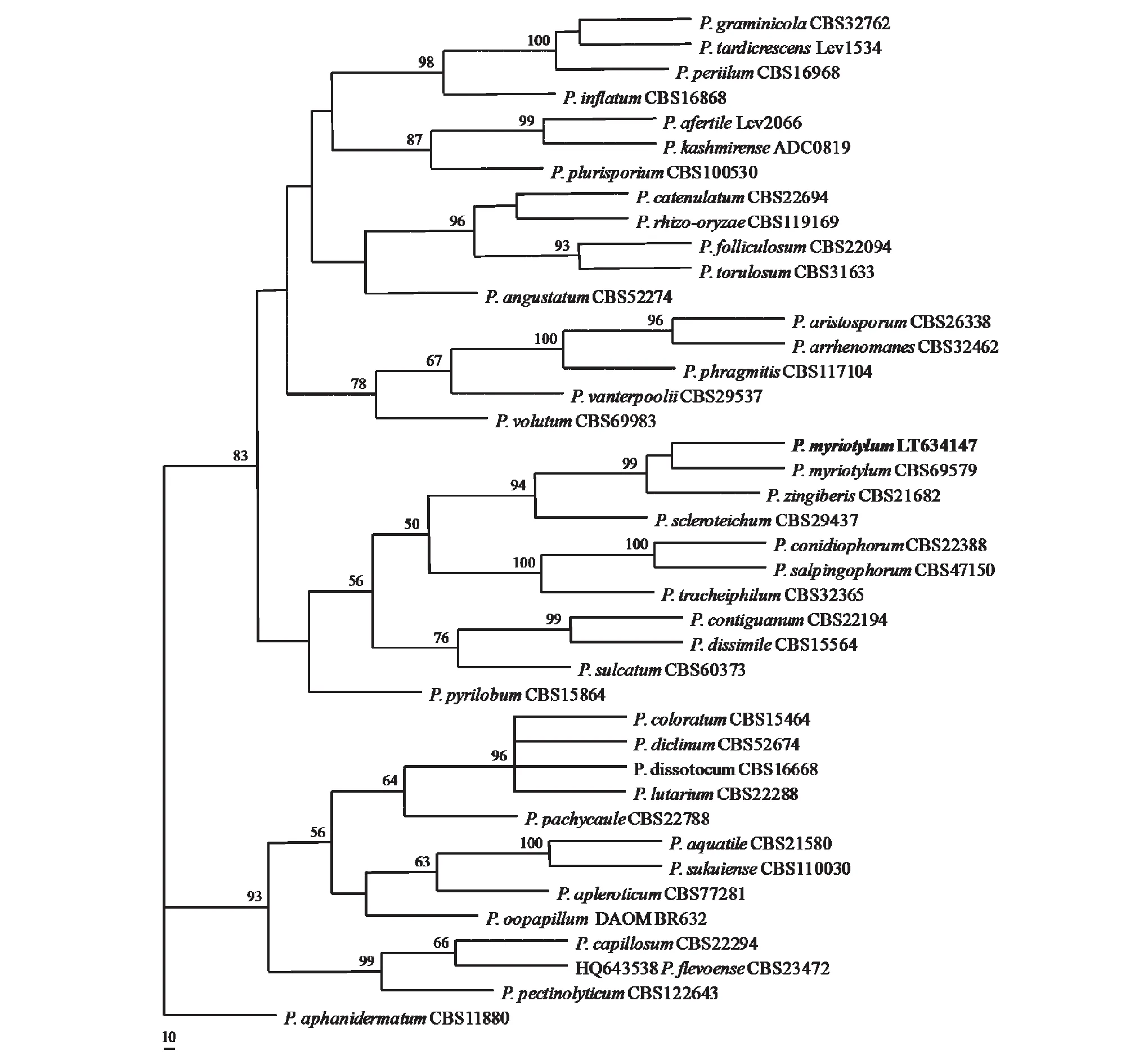
每个分枝节点上的数字代表1000次重复自展检验的支持率(50 %以下未显示)。标尺代表每位点有10个期望变异The numbers at each branch point represented percentage bootstrap support calculated from 1,000 replicates (less than 50 % were not shown). Bar indicates 10 expected changes per site图3 基于ITS的系统发育树Fig.3 Phylogenetic tree based on ITS sequences
因此,从形态和分子方面都证明该病原菌为群结腐霉。
3 讨 论
研究结果表明,生姜茎腐病对生姜的为害很严重,具有发病时间短、病程进展快、病株致死率高的特点。生姜茎腐病和姜瘟病是生姜种植过程中的两大灾变病害,都会给生姜生产带来毁灭性打击。两种病害发病症状相似,易于混淆。但是前者的病原物属于卵菌,后者的病原物属于细菌。所以在湿度较大的环境下,生姜茎腐病病株茎基部出现白色霉层,植株容易倒伏,不会发臭;而姜瘟病的病株基部或根茎部的维管束变褐色,用手挤压,可见污白色菌脓从维管束溢出,还会散发臭味。姜子德等报道了生姜根茎腐烂由腐霉和细菌共同侵染引起,在人工接种情况下,青枯细菌表现典型的“青枯型”症状,腐霉则呈典型的“黄腐型”症状,两类病原菌混合表现为“黄枯型”症状[4]。从作者的症状描述可以判断由青枯细菌引起的姜根茎腐烂属于姜瘟病,而腐霉类引起的属于生姜茎腐病。两大病害可以同时发生在一个植株上,使得发病更加严重。因此,今后开展相关病害的研究时,应该综合考虑这两类病原菌的为害。
在广西东南沿海地区引起该病的病原菌为管毛生物界(Stramenopila,藻物界为其同物异名)腐霉属的群结腐霉。群结腐霉于1930年在美国的番茄上首次被发现并被作为新物种发表[10]。该物种主要出现在温度较高的地区,但有时在温带地区的温室作物上也能分离到。它的寄主范围很广,世界各地广泛分布,在高温条件下可以引起包括生姜在内的多种植物的组织腐烂病[9]。
姜腐霉与群结腐霉是两个亲缘关系很近的物种,卵菌的DNA条形码ITS和COI两个分子片段都无法区分开[11, 14],本研究中分离到的菌株的ITS序列与姜腐霉的代表菌株(CBS 216.82)之间的相似度高达99.6 %,但是在形态上与姜腐霉的原始描述有差异[15],表现在本文中菌株雄器以顶端小面积接触藏卵器为主,而姜腐霉的雄器常以侧面大面积接触并缠绕藏卵器为主,此外,本文中菌株的卵孢子以不满器为主,而姜腐霉的卵孢子以满器为主。因此,从形态上来看,本文分离到的菌株不能鉴定为姜腐霉。至于群结腐霉和姜腐霉形态上的差异是属于种内变异还是种间变异,需要分类学家们的进一步研究。
根据现有文献报道,生姜茎腐病的病原可以归结为两大类:腐霉类和镰刀菌类(真菌类),它们单独侵染或复合侵染。由于生态条件和耕作习惯的差异,不同区域的致病菌种类会出现较大差异。国内报道的生姜茎腐病的致病菌以群结腐霉单独侵染为主[3-5],只有广东地区报道了姜根茎腐烂腐是由腐霉类和细菌类共同侵染,其中腐霉类的除了群结腐霉外,还出现了瓜果腐霉、禾生腐霉和简囊腐霉[4]。本研究只针对广西东南沿海地区的小范围样地进行初步调查,得到的结论与广东的报道有较大差异。广西比邻广东,地理环境和气候条件极为相似,引起生姜茎腐病的病原菌种类是否存在相同规律值得进一步研究。
[1]刘振伟,史秀娟. 生姜茎腐病的研究进展[J]. 中国植保导刊,2008,10:12-14.
[2]Stirling G R, Turaganivalu U, Stirling A M, et al. Rhizome rot of ginger (Zingiberofficinale) caused byPythiummyriotylumin Fiji and Australia [J]. Australasian Plant Pathology, 2009, 38(5): 453-460.
[3]黄德昌. 姜软腐病之研究[J]. 台东区农业改良场研究学报,1987(1):97-109.
[4]姜子德,戚佩砷. 腐霉对姜根茎腐烂的作用[J]. 华南农业大学学报,1992,13(4):97-101.
[5]刘振伟,史秀娟. 莱芜生姜茎腐病的病原鉴定[J]. 中国植保导刊,2009,29(7):9-11.
[6]Ichitani T, Shinsu T.Pythiumzingiberumcausing rhizome rot of ginger plant and its distribution [J]. Japanese Journal of Phytopathology 1980, 46(4): 435-441.
[7]Anila D, Mathur S. Symptomatology, interaction and management of rhizome rot of ginger by xenobiotics [J]. Korean Journal of Plant Protection, 1987, 26: 261-265.
[8]Dohroo N P. Diseases of ginger. In: Ravindran P N, Babu K N (eds), Ginger, the genus Zingiber [M]. Boca Raton, Florida, USA: CRC Press, 2005: 305-340.
[9]Stirling A M. The causes of poor establishment of ginger (Zingiberofficinale) in Queensland, Australia [J]. Australasian Plant Pathology, 2004, 33(2): 203-210.
[10]Van der Plaats-Niterink A J. Monograph of the GenusPythium[J]. Studies in Mycology, 1981, 21: 1-242.
[11]Bala K, Robideau G P, Desaulniers N, et al. Taxonomy, DNA barcoding and phylogeny of three new species ofPythiumfrom Canada [J]. Persoonia, 2010, 25: 22-31.
[12]Robideau G P, De Cock A W A M, Coffey M D, et al. DNA barcoding of oomycetes with cytochrome coxidase subunit I and internal transcribed spacer[J]. Molecular Ecology Resources, 2011, 11: 1002-1011.
[13]Lévesque C A, De Cock A W A M. Molecular phylogeny and taxonomy of the genusPythium[J]. Mycological Research, 2004, 108: 1363-1383.
[14]龙艳艳.腐霉属的DNA条形码和分子系统学研究[D].广西大学博士论文,2014.
[15]Takahashi M. On the morphology and taxonomy of some species of the genusPythiumwhich cause crop diseases [J]. Annals of Phytopathological Society of Japan, 1954, 3: 113-118.
(责任编辑 王冠玉)
IdentificationofPathogenofStemRotDiseaseonGinger(Zingiberofficinale)inSoutheasternGuangxi
LONG Yan-yan1,2, LIU Zeng-liang1,2, WANG Qian1,2, LONG You1,2, ZHANG Jin-lian1,2, CHEN Ting-su1,2*
(1.Microbiology Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007, China; 2.Microbial Lab of Guangxi Wubao Agricultural Technology, Guangxi Nanning 530007, China)
Stem rot of ginger is one of the most destructive disease in ginger planting industry, with a short incubation period, rapid disease progress and a high lethality rate. Ginger rhizomes suffered with stem rot disease were sampled from ginger planting areas in Southeastern Guangxi. SeveralPythiumstrains were isolated and identified to bePythiummyriotylum. the pathogen of ginger, by morphological observation, molecular characteristics and pathogenicity test. So the identification of the pathogen of stem rot disease on ginger is of great importance to study the theory of disease control in Guangxi.
Ginger; Soft rot;Pythiummyriotylum; Pathogenicity
1001-4829(2017)3-0584-06
10.16213/j.cnki.scjas.2017.3.018
S435.661
A
2016-11-07
广西科技计划项目(桂科AD16380054)
龙艳艳(1984-),女,博士研究生,主要从事土壤微生物资源的利用与开发研究,E-mail:longyanyan2014@foxmail.com,*为通讯作者,E-mail:chen20409@hotmail.com。
