硫解法和正相色谱法测定山竹壳原花青素
2017-10-19,,
,,
(暨南大学食品科学与工程系,广东广州 510632)
硫解法和正相色谱法测定山竹壳原花青素
黄文烨,李星星,黄雪松*
(暨南大学食品科学与工程系,广东广州 510632)
为分析山竹壳中原花青素的组成和含量,采用硫解衍生法和反相HPLC对山竹壳中可提原花青素(EP)和不可提原花青素(NEP)进行了测定,采用正相HPLC、ESI-MS对不同聚合度EP进行了分析和定量。山竹壳中原花青素的主要组成单体为表儿茶素,EP和NEP含量分别为(131.69±11.24)、(36.92±2.38) g/kg(以原花青素B2计),平均聚合度为(4.27±0.08)、(5.41±0.04)。检测出三种不同聚合度EP分别为:B型原矢车菊素二聚体(40.51±8.30) g/kg、三聚体(38.70±8.69) g/kg和四聚体(13.95±3.93) g/kg。这些结果为山竹壳原花青素的利用提供了一定的依据。
山竹壳,原花青素,硫解,测定
山竹(GarciniamangostanaL.)又称莽吉柿、凤果、倒捻子、山竺等,属藤黄科藤黄属,是一种原产马来群岛马鲁古的热带水果,果实柔软多汁、酸甜适口、营养丰富,有“热带果后”之称。山竹以鲜食为主,也可将果肉加工制成果脯、罐头和果汁,但果皮即山竹壳常被废弃[1]。然而,山竹壳在泰国、印度传统医药中,用于治疗腹泻、霍乱、痢疾、皮肤与伤口感染等,具有独特的药用价值。大量研究显示,山竹壳中的原花青素是这些药用活性的来源之一[2-3]。
原花青素又被称为缩合单宁(Condensed tannin),以分子骨架为C6-C3-C6的黄烷-3-醇、黄烷-4-醇或黄烷-3,4-二醇单体聚合而成,分子量在500~3000左右[4],具有抗氧化、抗癌、预防心血管疾病、降血压、降血脂、降血糖等生物活性[5]。根据是否能被水和有机溶剂提取,可以将原花青素分为可提原花青素(Extrac
Table proanthocyanidings,EP)和不可提原花青素(Nonextrac
Table proanthocyanidins,NEP)[6]。由于NEP不被提取、一般地,分析原花青素时常常忽略NEP,也不被肠道菌群发酵、吸收而发挥其应有的抗氧化[7]、抗病毒[8]调节肠道pH等生物活性,故研究快速、方便、正确地测定NEP含量的方法,对于其有效利用有重要意义。
硫解法能方便地分析EP、NEP的组成和含量,其反应过程如图1。原花青素B2结构为(-)-表儿茶素-(4β→8)-(-)-表儿茶素,若根据图1硫解,应只会生成表儿茶素和表儿茶素硫解衍生物(EC-thiol)。EP、NEP衍生后可以通过HPLC分析出它们的单元组成,并计算平均聚合度(Mean degree of polymerization,mDP)。
Fu等[9]研究发现,山竹壳中原花青素以原矢车菊素为主,含少量原天竺葵素(Propelargonidins)和原飞燕草素(Prodelphinidins),表儿茶素是主要构成单体,连接方式以B型为主,平均聚合度为6.6。周海超等[10]应用MALDI-TOF-MS分析了山竹壳原花青素三到十一聚物的分布,其中五聚物离子峰最强。但是这些研究均因未准确定量或无定量关系,而未能测得总原花青素和不同聚合度原花青素的含量。为此,本论文将采用硫解法和正相HPLC分析测定山竹壳中的EP、NEP和不同聚合度EP。
1 材料与方法
1.1材料与仪器
山竹 大小均一,于暨南大学小西门水果店购买后剥取新鲜果皮,加水打浆(1∶1)、冻干磨粉后,过20目筛,得到山竹壳干粉,置于4 ℃冰箱备用;苄硫醇≥98% 阿拉丁试剂(上海)有限公司;儿茶素,99% 美国Sigma-Aldrich公司;原花青素B2,表儿茶素≥98%(HPLC级) 上海源叶生物有限公司;甲醇,丙酮,冰醋酸 分析纯。
旋转蒸发仪 RE-52,上海嘉鹏科技有限公司;高效液相色谱,LC-20AT 日本岛津公司;液相色谱质谱联用仪ABI 4000 Q TRAP 美国应用生物系统公司。
1.2实验方法
1.2.1 山竹壳中原花青素的提取分离 称取0.5 g山竹壳冻干粉,2瓶25 mL的正己烷超声处理去酯后,以甲醇-水-冰乙酸(80∶20∶1,v/v/v)、丙酮-水-冰乙酸(70∶29.5∶0.5,v/v/v)先后室温超声提取EP各三次,合并所有提取液,即EP粗提液。残渣加水冻干、称重,待测定其中的NEP[6]。
事实上,我们在今年3月的巴塞尔展现场,也听到了一些“明年不来”的传言,品牌觉得参展成本高,而回报不够令人满意。
EP粗提液经40 ℃ 旋蒸浓缩后,加入等体积的二氯甲烷萃取三次,进一步去酯。浓缩液经0.45 μm滤膜过滤后,过Sephadex LH-20(20 cm×1.5 cm)柱。Sephadex LH-20柱先用甲醇-水(1∶1,v/v)平衡,上样后,继续用甲醇-水(1∶1,v/v)洗提至红色消失,以去除含色素、糖、酸等杂质,再用丙酮-水(7∶3,v/v)洗脱EP。EP提取液真空浓缩后,用1 mL甲醇溶解,即得到纯化的EP提取液,供HPLC分析测定用。
1.2.2 硫解法测定EP和NEP(1)原花青素的硫解衍生化 配制浓度为0.51、1.02、1.53、2.04、2.55 g/L的原花青素B2标准溶液,进行硫解衍生处理,绘制标准曲线。硫解衍生化步骤为:取200 μL标准溶液,加入200 μL酸化甲醇(3.3%浓盐酸甲醇溶液,v/v)和400 μL卞硫醇溶液(5%卞硫醇甲醇溶液,v/v),混匀,密封,40 ℃ 反应30 min后,室温保持10 h,经0.45 μm滤膜过滤后,放入-20 ℃ 冰箱中保存至HPLC上样[8]。同法硫解EP稀释液后,待HPLC分析;对于NEP,准确称取0.01 g冻干残渣粉,加入2倍的酸化甲醇、衍生化试剂处理后待HPLC测定。
配制浓度为0.00、7.65、15.30、30.60、61.20 g/L儿茶素和0.00、24.75、49.50、99.00、198.00 g/L的表儿茶素标准溶液,做标准曲线,分别定量硫解后生成的儿茶素、表儿茶素。分别取同样浓度范围的儿茶素、表儿茶素单独作硫解衍生化处理,以计算相互转化率(如式(1))、校正测定结果。
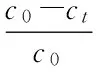
式(1)
式(1)中:R为转化率(%),c0为(表)儿茶素初始浓度,ct为硫解处理后(表)儿茶素浓度。
反相HPLC分析条件:
反相HPLC的分析条件[7]为:Diamonsil C18色谱柱(250 mm,× 4.6 mm,5 μm);检测温度:40 ℃;检测波长:280 nm;进样量:10 μL;流动相:2%(v/v)冰乙酸水溶液(A)、甲醇(B);梯度洗脱程序:0 min:85%A、15% B;45 min:15%A、85%B;流速:1.0 mL/min。
ESI-MS参数:CUR(气帘气):10 Psi;TEM(雾化温度):0 ℃;GS1(雾化气):30 Psi;GS2(辅助气):0 Psi;IS(喷雾电压):5500 V;DP(去簇电压):30 V;EP(聚焦电压):10 V;扫描范围:50~2000 amu;扫描时间:3 s。
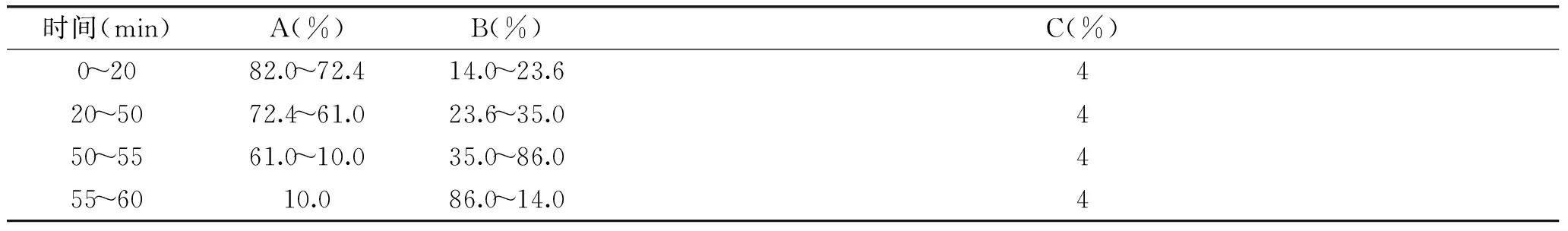
表1 正相HPLC梯度洗脱程序Table 1 Gradient elution of normal HPLC
不同聚合度EP的定量分析:配制浓度为0.05~0.6 g/L 的原花青素B2标准溶液,按1.2.3.1 EP的条件分析并绘制标准曲线。同法分析EP提取稀释液。以原花青素B2计算不同聚合度EP的相对含量。计算公式如下:
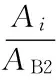
式(2)
式中:wi为组分i的相对含量(mg/kg),Ai为组分i的峰面积,AB2为原花青素B2的峰面积,wB2为原花青素B2的含量(mg/kg)。
1.2.4 mDP的计算公式如下 参考文献[11-12]。
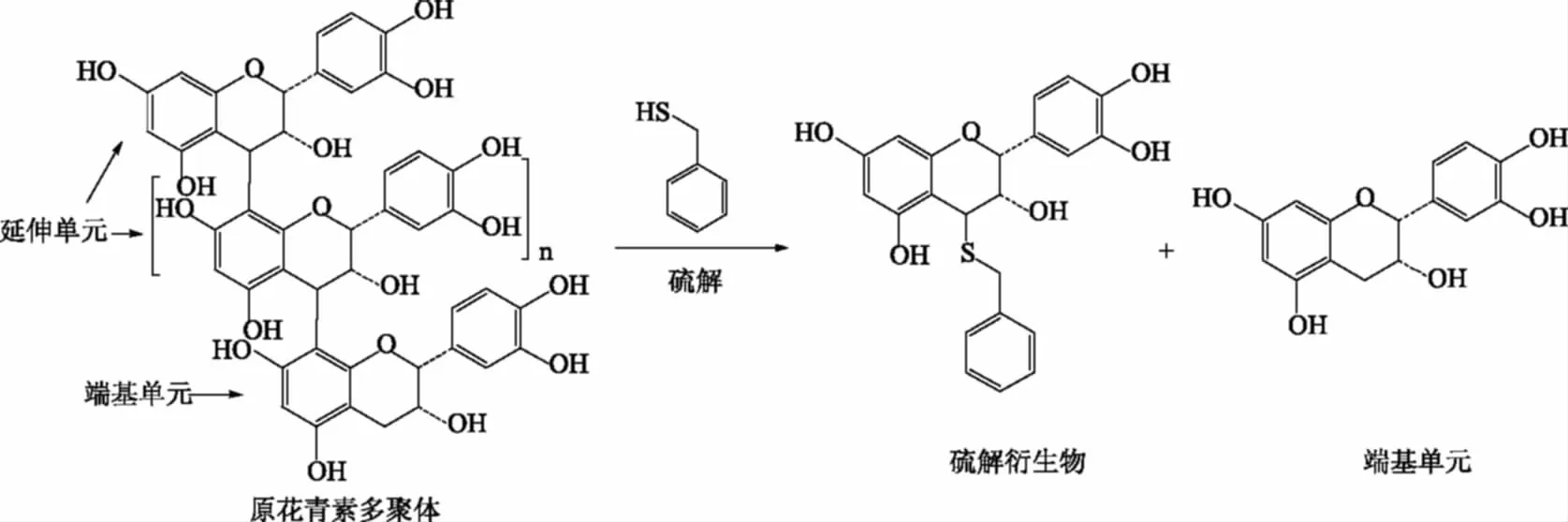
图1 原花青素硫解衍生过程[9-10]Fig.1 Thiolysis procedure of proanthocyanidins[9-10]
mDP=儿茶素衍生物峰面积+表儿茶素衍生物峰面积/儿茶素峰面积+表儿茶素峰面积+1
式(3)
2 结果与分析
2.1硫解法测定EP和NEP的结果
2.1.1 硫解法对EP和NEP的定性 图2a是儿茶素和表儿茶素未经硫解的色谱图,其保留时间分别为10~11 min和14~15 min。图2b可以看出,原花青素B2硫解衍生后的产物主要为儿茶素、表儿茶素和表儿茶素硫解衍生物(EC-thiol)。由图1知,原花青素B2硫解后应仅生成一个表儿茶素和一个EC-thiol。但硫解条件下,儿茶素和表儿茶素之间存在一定比例的相互转换[11],峰儿茶素的存在是硫解过程中部分表儿茶素转换成儿茶素的结果。由图2c和图2d可以看出,山竹壳EP、NEP硫解衍生后的主要产物[9]也是这三种,峰表儿茶素很小,因此,可以判定组成山竹壳原花青素的主要单体是表儿茶素。
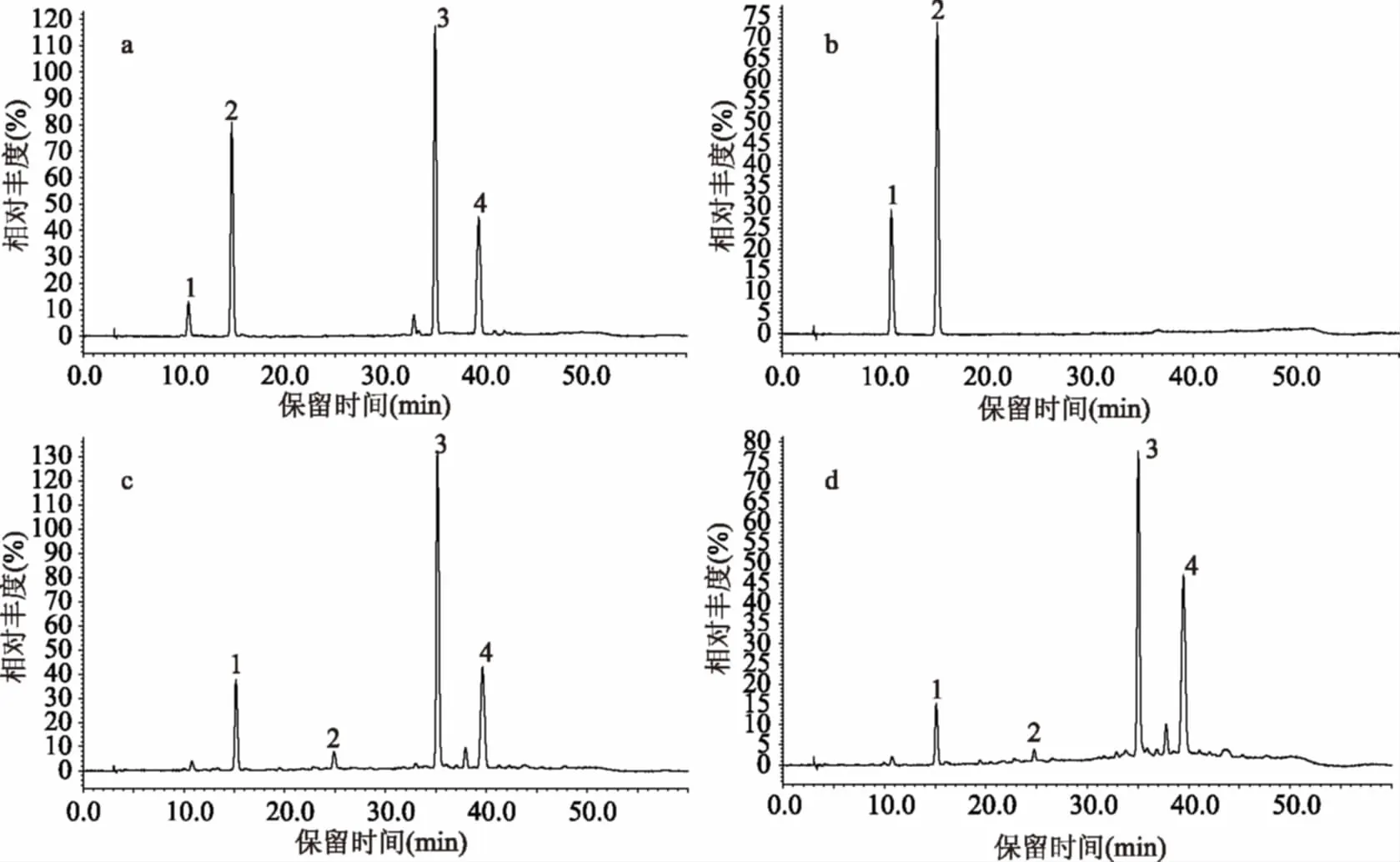
图2 儿茶素和表儿茶素(a)、原花青素B2硫解衍生(b)、山竹壳EP硫解衍生(c)、NEP硫解衍生(d)的色谱图Fig.2 Chromatogram of catechin and epicatechin(a),thiolysis derivations ofprocyanidin B2(b),EP(c)and NEP(d)from mangosteen husk注:(1)峰:儿茶素,(2)峰:表儿茶素,(3)峰:EC-thiol,(4)峰:硫解衍生剂。
2.1.2 硫解法对EP和NEP的定量 表2所示是各标准品的回归方程和山竹壳EP、NEP的组成和含量。山竹壳总原花青素含量为(168.61±13.40)×103mg/kg,其中NEP占到近22%,说明一般忽略NEP的原花青素测定,会严重低估山竹壳原花青素的含量。EP和NEP的mDP分别为4.27±0.08和5.41±0.04,低于Fu等[9]测得的结果(mDP=6.6),这应该是山竹的品种、成熟度和处理方式不同造成的差异。
Gu等[7]的研究显示,儿茶素、表儿茶素在硫解环境会相互转化。对(表)儿茶素分别单独硫解处理的分析结果,并未测得有儿茶素转化生成表儿茶素,而表儿茶素在衍生条件下生成儿茶素的转化率为7.85%±1.50%。而Gu等[11]测得硫解过程中,9.0%±0.7%的儿茶素转化成了表儿茶素,28.7%±1.5%的表儿茶素转化为儿茶素;Prieur等[13]在90 ℃,2 min硫解处理后测得的转化率则分别为:4%的儿茶素转化成了表儿茶素、15%的表儿茶素转化为儿茶素。本研究结果与这些文献均不同,这可能是在不同研究,两者转化率的差异应当是受到处理条件的影响。
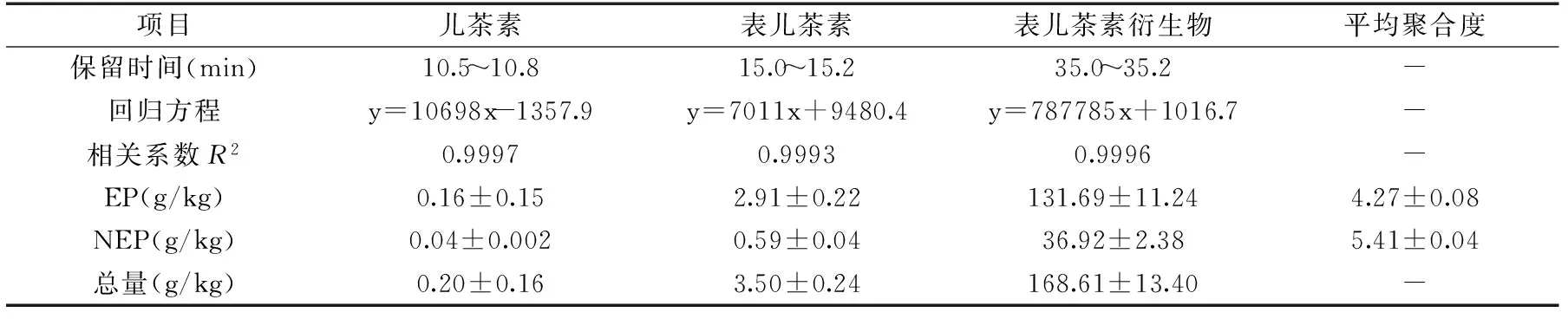
表2 原花青素B2、山竹壳原花青素硫解衍生物组成Table 2 Thiolysis results of procyanidin B2 and proanthocyanidins from mangosteen husk
2.2正相HPLC测定不同聚合度EP的结果
由图3可以看出,保留时间在55 min前,低聚原花青素有比较好的分离效果;55 min后在86%甲醇的等度洗脱下,高聚合度的原花青素形成了一个大的单峰,该结果与文献[11]类似。
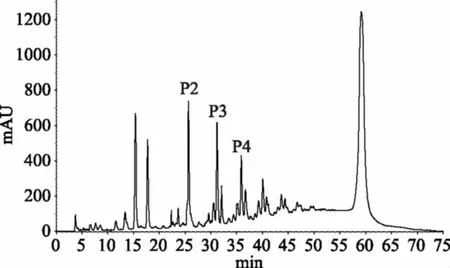
图3 山竹壳EP的正相HPLC色谱图 Fig.3 Normal phase HPLC chromatograph ofEP from mangosteen husk注:P2:B型原矢车菊素二聚体,P3:B型原矢车菊素三聚体,P4:B型原矢车菊素四聚体。
由图3看出:P2、P3、P4峰分离效果好。单独收集这些峰样液后所做MS分析结果见图4,其中P2峰的[M+H]+=579.5(m/z),[M-H]-=577.5(m/z),即P2的Mr=M=578.5,与原花青素B2[B型原矢车菊素二聚体,(表)儿茶素-β-(表)儿茶素]的分子量一致。根据P2峰的面积计算出其相对含量为:(40.51±8.30) g/kg(以原花青素B2)。
P3的[M+H]+=867.6(m/z),[M-H]-=865.6 (m/z),说明P3的Mr=866.6,为B型原矢车菊素三聚体:(表)儿茶素-β-(表)儿茶素-β-(表)儿茶素,P3的相对含量(38.70±8.69)g/kg(以原花青素B2计)。
P4的[M+H]+=1155.6(m/z),[M-H]-=1153.7(m/z),证实P4的Mr=1154.0,为B型原矢车菊素四聚体:(表)儿茶素-β-(表)儿茶素-β-(表)儿茶素-β-(表)儿茶素,P4的相对含量(13.95±3.93)g/kg(以原花青素B2计)。
由图3还可以看出:保留时间60 min时,有一个大且分离效果好的峰,但由于其分子量大、结构复杂,属于混合多聚体原花青素类物质,还难于对其进行分析。
3 讨论
原花青素测定方法有很多,常用的包括:正丁醇-盐酸法、香草醛-盐酸法[4]和DMAC法[14]等,这些传统比色法价廉、便捷,但是它们缺乏特异性,容易受到测定样品中其他化合物干扰。相比之下,色谱法分析更加特异、准确,但受到原花青素聚合度高、异构体多的限制,分离分析也比较困难。采用硫解法柱前衍生,能通过降解多聚物、特异性衍生和HPLC分离,分析并定量EP和NEP两类原花青素的组成单元、含量和平均聚合度,不受高聚物分离困难的限制。对于不同聚合度EP的分离和定量,反相HPLC一般仅能分析至四聚物,而正相HPLC以增大极性的方式洗脱,能有效地分离和分析聚合度达10甚至更高的原花青素,极大地扩展了高聚体原花青素的研究空间[15]。近年,随着MALDI-TOF-MS的普及,可被分析的原花青素聚合度在不断提高[16]。
4 结论
本文采用硫解HPLC法、正相HPLC分析了山竹壳中原花青素的组成和含量。山竹壳原花青素的主要组成单体为表儿茶素,总原花青素含量为(168.61±13.40)×103mg/kg(以原花青素B2计),EP和NEP的聚合度分别为:4.27±0.08,5.41±0.04。硫解衍生过程中,有部分表儿茶素转化为儿茶素,转化率为 7.85%±1.50%。分离出三种不同聚合度EP分别为:B型原矢车菊素二聚体、B型原矢车菊素三聚体和B型原矢车菊素四聚体。
[1]蒋侬辉,李春雨,戴宏芬,等. 山竹的食用药用价值及综合利用研究进展[J]. 广东农业科学,2011,38(3):50-53.
[2]José P C,Noemí C R,Marisol O I,et al. Medicinal properties of mangosteen(Garciniamangostana)[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2008,46(10):3227-3239.
[3]Tjahjani S,Widowati W,Khiong K,et al. Antioxidant properties of garcinia mangostana,L(Mangosteen)Rind[J]. Procedia Chemistry,2014,13:198-203.
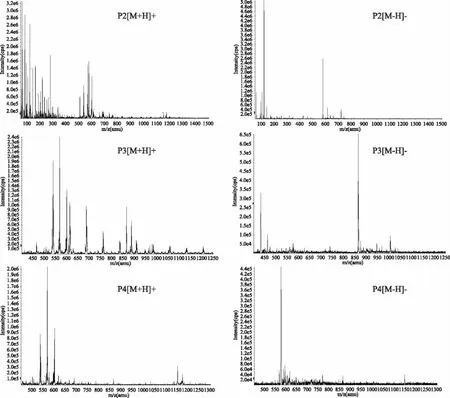
图4 山竹壳原花青素二聚物(P2)、三聚物(P3)、四聚物(P4)的质谱图Fig.4 Mass spectrum of proanthocyanidin dimer,trimer and tetramer from mangosteen husk注:左图为正离子模式 右图为负离子模式。
[4]石碧. 植物多酚[M]. 科学出版社:石碧,狄莹,2000.
[5]张华,曾桥. 原花青素功能及应用进展[J]. 安徽农业科学,2011,39(9):5349-5350.
[6]Di Y,Arranz S,Saura-Calixto F. Proanthocyanidin content in foods is largely underestimated in the literature data:An approach to quantification of the missing proanthocyanidin[J]. Routledge,1999,42(10):1381-1388.
[7]王金晶,单岩,刘春凤,等. 酒花原花青素抗氧化性能研究[J]. 食品工业科技,2013(8):118-126.
[8]周秋枝、黄蕾、沈丹华,等. 火棘果中原花青素含量测定方法的建立[J]. 食品工业科技,2013(7):314-318.
[9]Caili F,Loo A E K,Chia F P P,et al. Oligomeric proanthocyanidins from mangosteen pericarps.[J]. Journal of Agricultural & Food Chemistry,2007,55(19):7689-94.
[10]周海超,魏淑东,李敏,等. 基质辅助激光解吸附飞行时间质谱方法分析山竹果皮缩合单宁[J]. 分析化学,2010,38(10):1492-1496.
[11]Gu L,Mark K,Hammerstone J F,et al. Fractionation of polymeric procyanidins from lowbush blueberry and quantification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method[J]. Journal of Agricultural & Food Chemistry,2002,50(17):4852-60.
[12]Guyot S,Nathalie Marnet A,Drilleau J F. Thiolysis-HPLC Characterization of Apple Procyanidins Covering a Large Range of Polymerization States[J]. Journal of Agricultural & Food Chemistry,2001,49(1):14-20.
[13]Prieur C,Rigaud J,CheyniGu L,Mark K,Hammerstone J F,et al. Fractionation of polymeric procyanidins from lowbush blueberry and quantification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method.[J]. Journal of Agricultural & Food Chemistry,2002,50(17):4852-60.
[14]黄雪松,黄文烨. 对-二甲基氨基肉桂醛法测定山竹原花青素[J]. 现代食品科技,2013(7):1687-1690.
[15]Hümmer W,Schreier P. Analysis of proanthocyanidins[J]. Molecular Nutrition & Food Research,2008,52(12):1381-98.
[16]Monagas M,Quintanilla-López JE,Gómez-Cordovés C,et al. MALDI-TOF MS analysis of plant proanthocyanidins[J]. Journal of Pharmaceutical and Biomedical Analysis,2010,51(2):358-372.
Determinationofproanthocyanidinsfrommangosteenhuskbythiolysis-HPLCandnormal-phaseHPLC
HUANGWen-ye,LIXing-xing,HUANGXue-song*
(Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
To investigate the content of proanthocyanidins from mangosteen husk,thiolysis-HPLC was used to analyze and quantify extractable(EP)and nonextractable(NEP)proanthocyanidins,then normal-phase HPLC was applied to isolate and determinate EP in different degrees of polymerization. Proanthocyanidins from mangosteen husk mainly consisted of epicatechin,contents and mean degree of polymerization of EP and NEP were(131.69±11.24),(36.92±2.38) g/kg procyanidin B2/kg and(4.27±0.08),(5.41±0.04)respectively. Contents of B-type procyanidin dimer,trimer and tetramer from EP were(40.51±8.30),(38.70±8.69),(13.95±3.93) g/kg. These results can provide reference for the use of proanthocyanidins from mangosteen husk.
GarciniamangostanaL. husk;proanthocyanidins;thiolysis;determination
TS255.1
A
1002-0306(2017)19-0260-05
10.13386/j.issn1002-0306.2017.19.048
2017-03-06
黄文烨(1992-),女,硕士研究生,研究方向:食品科学,E-mail:hwendyy@sina.com。
*通讯作者:黄雪松(1957-),男,博士,教授,研究方向:功能食品,E-mail:thxs@jnu.edu.cn。
广东省农产品加工重点实验室开放基金(201504);公益性行业(农业)科研专项(2013030775-5)。
