响应面法优化紫甘薯花青素微胶囊制备工艺
2017-10-19,,,,,,,
,,, ,,,,
(天津科技大学食品工程与生物技术学院,天津 300457)
响应面法优化紫甘薯花青素微胶囊制备工艺
王立爽,蒋裕琪,于凤桐,李翔,叶江稳,张天爽,王建新,吕晓玲*
(天津科技大学食品工程与生物技术学院,天津 300457)
目的:以紫甘薯花青素为芯材,筛选能提高其水相稳定性的壁材并采用响应面法优化微胶囊制备工艺条件。方法:以包埋率为考察指标,利用Box-Behnken实验和方差分析,从包埋温度、包埋时间、壁材浓度、壁材芯材质量比四个方面优化微胶囊制备工艺条件。并对所制备的微胶囊进行电镜扫描和稳定性研究。结果:筛选玉米朊作为壁材,获得优化制备工艺条件为:包埋时间30 min、包埋温度32 ℃、壁材浓度1%、壁材芯材质量比5∶2.2 (w/w),此时紫甘薯花青素微胶囊包埋率达到81.55%±0.89%,其密度为2.88 g/mL,含水率为4.42%,紫甘薯花青素微胶囊为类似圆球状的紫色粉末,该工艺明显提高了紫甘薯花青素水相热稳定性,pH稳定性和室外光稳定性。结论:实验结果表明,以玉米朊作为壁材进行紫甘薯花青素微胶囊化是提高其水相稳定性的一种较好方法。
紫甘薯花青素,微胶囊,响应面法,包埋率,水相稳定性
紫甘薯花青素是一种天然食用红色素,与其他花色苷类色素相比具有较好的光热稳定性[1],除了可以作为一种天然着色剂以外还具有一定的生理功能,适用于酸性饮料等食品。但由于紫甘薯花青素中具有多个酚羟基,其具有很强的亲水性,用于固态或半固态食品时,会出现颜色扩散或在水中掉色等问题,限制了其使用范围。国内文献中紫甘薯花青素微胶囊化研究已有很多报道,但对于水不溶性紫甘薯花青素微胶囊的研究鲜有报道。通过微胶囊技术可以达到改变芯材的溶解性等目的。Wang对叶黄素进行微胶囊化,将脂溶性的叶黄素转变为水溶性的叶黄素[2];郭立华对水溶性的5-氟尿嘧啶和葡萄糖进行微胶囊化,制备的微胶囊具有较好的缓释效果[3]。
本实验以紫甘薯花青素为芯材,筛选壁材,采用冷冻干燥法包埋紫甘薯花青素,以包埋率为主要考察指标,在单因素实验基础上,进一步采用响应面分析法优化制备工艺参数,考察包埋温度、包埋时间、壁材浓度、壁材芯材质量比对紫甘薯花青素微胶囊化效果的影响规律,并对所得紫甘薯花青素微胶囊进行了电镜扫描和稳定性实验,旨在得到水不溶性紫甘薯花青素微胶囊,在提高稳定性的同时扩大了其使用范围,如在拼色冰激淋、花青素面条等应用可减少边界颜色扩散及水煮掉色问题,有较好的应用价值。
1 材料与方法
1.1材料与试剂
紫甘薯固体粉末色素(色价为78) 葫芦岛茂华生物有限责任公司;无水乙醇、磷酸氢二钠、玉米朊、可得然、乙基纤维素 天津北方天医化学试剂厂;氢氧化钠 天津市化学试剂一厂;柠檬酸 天津大学科威公司;明胶 国药集团化学试剂有限公司;壳聚糖 天津市耀华化工厂。
1.2 仪器与设备
SY-1-2电热恒温水浴锅 天津市欧诺仪器仪表有限公司;UV-2101 PCS紫外可见分光光度计 尤尼柯(上海)仪器有限公司;LGJ0.5冷冻干燥机 北京四环科学仪器厂;RE-2000旋转蒸发仪 上海亚荣生化仪器厂;SU1510扫描电子显微镜 株式会社日立高新技术那珂事业所。
1.3实验方法
1.3.1 紫甘薯花青素微胶囊的制备工艺流程 采用直接包合法,对紫甘薯花青素进行微胶囊化,制备工艺如下:

选择合适的壁材用80%乙醇溶液充分溶解[3],在水浴加热环境下进行磁力搅拌,然后缓慢加入紫甘薯花青素溶液,包埋一段时间后,静置冷却至室温,置于-80 ℃环境中存放12 h,然后冷冻干燥处理24 h,所得粉末颗粒即为紫甘薯花青素微胶囊产品[4]。
冻干机运行参数:温度-52 ℃;真空度22300 Pa。
1.3.2 壁材选择 本实验选用的壁材有:壳聚糖[5]、明胶[6]、可得然胶[7]、乙基纤维素[8-9]、玉米朊[10]。
先使用上述单一壁材进行包埋,通过测定包埋率来选择包埋效果好的壁材与其他几种壁材复配,依据实验结果,选择单一壁材或复合壁材作为本实验的微胶囊壁材。
1.3.3 微胶囊化的效果评价 包埋率(微胶囊化效率):以紫甘薯花青素为芯材实际被包埋量与理论被包埋量的比值,是衡量色素被包埋程度的有效指标。[11]
包埋率(%)=(1-m/M)×100
式(1)
式(1)中:M:微胶囊全部色素含量;m:微胶囊表面色素含量。
本实验中,主要采用包埋率作为评价微胶囊化效果的指标。
1.3.3.1 标准曲线的制备 分别以蒸馏水和pH3的柠檬酸-磷酸氢二钠缓冲溶液作溶剂配制得紫甘薯花青素含量为1 mg/mL的标准溶液,用移液管分别移取0、1.0、1.25、1.5、1.75、2.0 mL至25 mL容量瓶中,稀释定容至25 mL,摇匀,再相应的以蒸馏水和pH3的柠檬酸-磷酸氢二钠缓冲溶液为空白对照,在530 nm处测定吸光度值,以吸光度(A)对浓度(C)进行线性回归,绘制标准曲线。
1.3.3.2 测定微胶囊表面花青素含量 精确称取定量紫甘薯花青素微胶囊产品,然后用pH3.0的柠檬酸-磷酸氢二钠缓冲溶液反复洗涤振荡,并过滤,将滤液转移到100 mL容量瓶中,用缓冲溶液定容,通过测定波长530 nm下稀释液的吸光值来测定滤液中紫甘薯花青素的含量。
1.3.3.3 测定微胶囊全部花青素含量 准确称取定量紫甘薯花青素微胶囊产品,溶于200 mL 60%的乙醇溶液中,当混合液体积蒸发至剩余80 mL时,过滤,取澄清滤液,用蒸馏水先稀释定容到250 mL,通过测定波长530 nm下稀释液的吸光值来测定滤液中紫甘薯花青素的含量[12]。
1.3.4 微胶囊工艺优化
1.3.4.1 单因素实验 单因素实验在包埋温度30 ℃、包埋时间30 min、壁材浓度1%、壁材芯材质量比5∶3 (w/w)的基础上,依次变换下列各因素的水平:包埋温度选择20、30、40、50、60 ℃;包埋时间选择15、30、45、60、75 min;壁材浓度选择0.5%、1.0%、1.5%、2.0%、2.5%;壁材芯材质量比选择5∶1、5∶2、5∶3、5∶4、1∶1、6∶1、8∶1 (w/w)。上一单因素实验结束后,选择其最优值进行下一单因素实验,按1.3.1节的方法制备紫甘薯花青素微胶囊,考察各因素对微胶囊包埋率的影响。
1.3.4.2 响应面实验设计 根据Box-Behnken的中心组合实验设计原理,基于单因素实验结果,选择对包埋效率影响显著的包埋温度(A)、包埋时间(B)、壁材芯材质量比(C)为自变量,以包埋效率为响应值,设计了三因素三水平响应面分析实验,其中壁材浓度恒定为1%,实验方案及结果见表1,采用Design-Expert V8.0.6.1软件对实验数据进行二次响应面回归分析,因素水平编码表如表1所示:
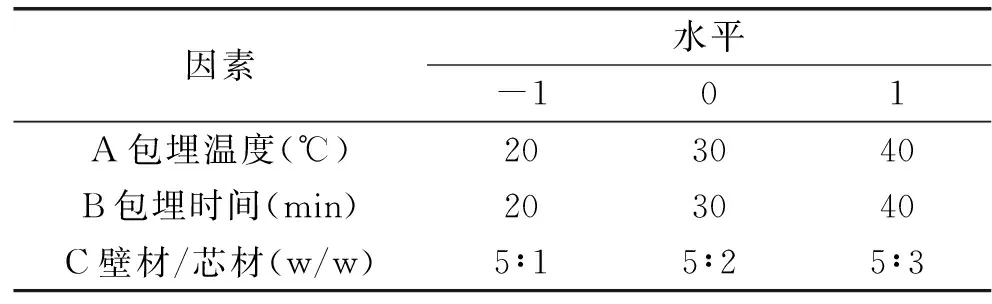
表1 响应面实验因素水平编码表Table 1 Factors and levels tablein response surface methodology
根据响应面软件Design Expert 8.0.6.1设计结果,对紫甘薯花青素微胶囊工艺进行优化,得出最优工艺后,进行重复性实验验证。
1.3.5 紫甘薯花青素微胶囊产品的理化性质
1.3.5.1 微胶囊产品的外观观察 取少量的紫甘薯色素微胶囊产品,均匀分散在样品台上,喷金后置于扫描电镜下,观察微胶囊颗粒的外部形态和结构[12]。
1.3.5.2 微胶囊产品密度的测定 选取干燥清洁的10 mL量筒,将微胶囊产品倒入其中,通过测定单位体积的微胶囊颗粒的质量计算微胶囊产品的密度[12]。
1.3.5.3 微胶囊产品含水率的测定 根据GB5009.3-2016,采用直接干燥法测定紫甘薯花青素微胶囊产品的含水率。
1.3.6 紫甘薯花青素微胶囊产品的稳定性评价 取一定量的紫甘薯花青素和微胶囊样品,分别置于以下不同条件下,定期取样测定紫甘薯花青素的保存率,考察微胶囊产品的光稳定性、热稳定性、pH稳定性和水相稳定性。以保存率反映稳定性大小,保存率越高,稳定性越好。保存率计算见式(2):
保存率(%)=(A1/A0)×100
式(2)
式中:A0:对照吸光度值;A1:不同条件作用后吸光度值。
1.3.6.1 光照对微胶囊产品稳定性影响的实验 取等量的微胶囊产品,分别置于室外自然光、室内自然光、暗处三种不同的外界环境中,每隔1 d测定色素的保存率,连续测定5 d,记录花青素的保存率的变化[1]。吸光度测定方法同1.3.3.3所示方法。
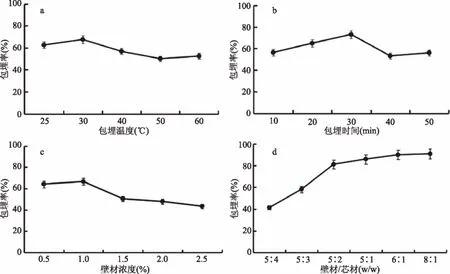
图1 单因素实验结果Fig.1 Results of single factor experiments
1.3.6.2 干燥状态加热对微胶囊产品稳定性影响的实验 取等量紫甘薯花青素和微胶囊产品,分别置于密闭容器中,在烘箱70 ℃条件下避光保存,每隔5 h从两个密闭容器中取样品,测定吸光度[1]。
1.3.6.3 pH对微胶囊产品稳定性影响的实验 取等量紫甘薯花青素和微胶囊产品,分别用10 mL pH3,pH4,pH5,pH6,pH7的缓冲液处理2 h,过滤,然后加pH3的缓冲液稀释定容至100 mL,测定吸光度[1]。
1.3.6.4 水相加热对微胶囊产品稳定性影响的实验 取等量紫甘薯花青素加60 mL pH3的缓冲液溶解,90 ℃分别加热15、30、45、60、75 min,用蒸馏水将溶液稀释定容到100 mL,测定吸光度。
取等量微胶囊产品加10 mL pH3的缓冲液,90 ℃分别加热15、30、45、60、75 min,过滤,取澄清滤液,用缓冲溶液稀释定容到50 mL,测定吸光度。
1.4数据统计分析
数据分析采用Design-Expert 8.0.6.1,利用Microsoft Excel 2007和Design-Expert8.0.6.1作图。
2 结果与分析
2.1微胶囊壁材的选择
实验选择可得然胶、玉米朊、乙基纤维素、明胶、壳聚糖+可得然胶五种壁材组合进行紫甘薯花青素微胶囊化。根据实验结果,玉米朊制备的微胶囊样品颗粒较小且性质上方便测量效率,微胶囊化效果理想。最终选择玉米朊作为壁材进行下一步研究。
2.2单因素实验
选取包埋温度、包埋时间、壁材浓度和壁材芯材质量比为优化因素进行单因素实验,结果如图1所示。
随着包埋温度升高、包埋时间的延长和壁材浓度的增加包埋率均先升高后降低,随着壁材芯材质量比的增加,包埋率呈先逐渐增大后趋于平稳的趋势,如图1a所示,探究包埋温度的影响时,发现包埋温度30 ℃,微胶囊包埋率最高;如图1b所示,探究包埋时间的影响时,发现包埋时间30 min,微胶囊包埋率最高;如图1c所示,探究壁材浓度的影响时,发现壁材浓度1%,微胶囊包埋率最高;如图1d所示,探究壁材芯材质量比的影响时,发现壁材芯材质量比为5∶2 (w/w),微胶囊包埋率较高。
2.3响应面实验
2.3.1 响应面实验设计与结果 在上述单因素实验的基础上,以微胶囊包埋率为响应值,以对微胶囊包埋率影响较显著的3个因素(包埋时间、包埋温度、壁材芯材质量比)

表3 回归模型的方差分析表Table 3 ANOVA for the regression model
注:*为差异显著,p<0.05;**为差异极显著,p<0.01。为自变量进行了Box-Behnken响应面优化实验。Box-Behnken实验设计与结果见表2。
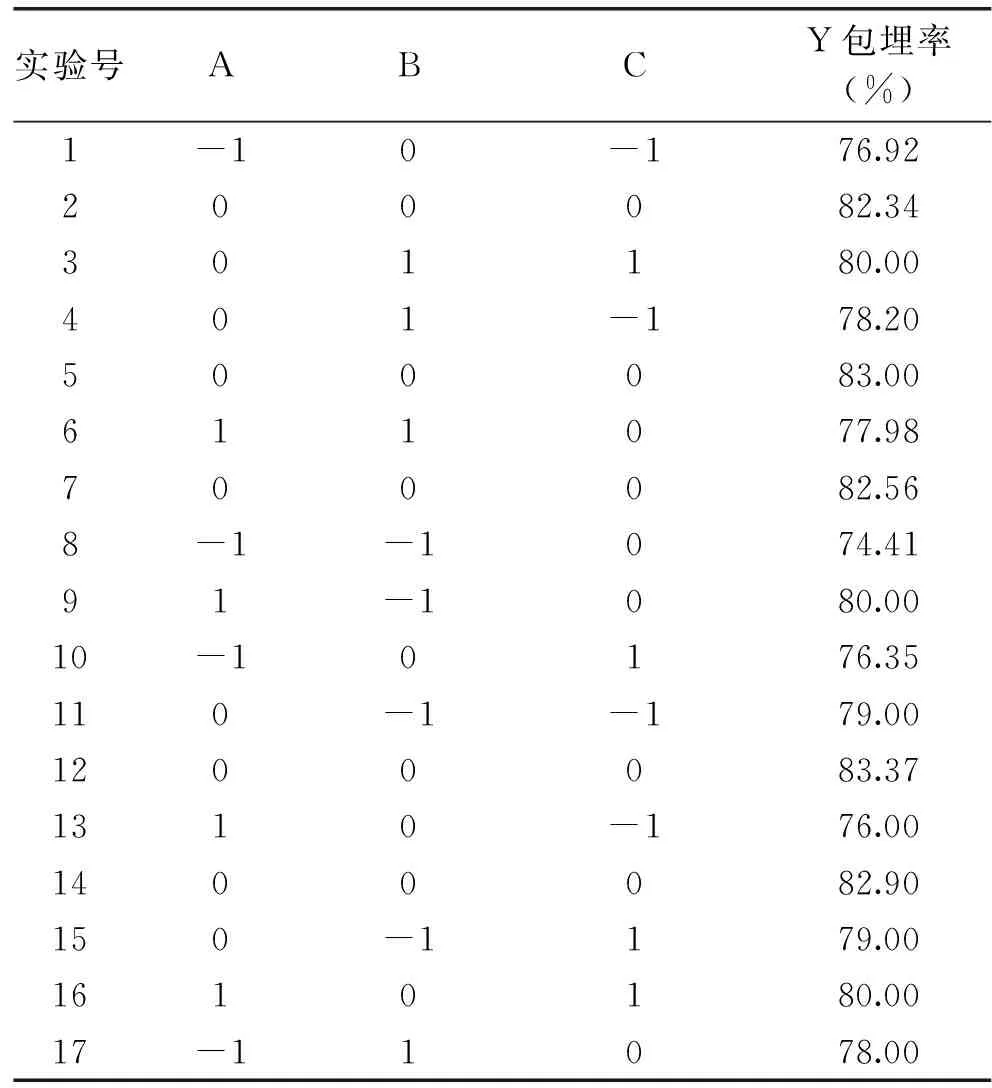
表2 响应面设计方案与实验结果Table 2 The design and results of response surface experiment
利用Design-Expert 8.0.6.1软件对表2数据进行分析,得到响应值包埋率(Y)对包埋温度(A)、包埋时间(B)、壁材芯材质量比(C)的二次回归实际模型方程:Y(%)=82.83+1.04A+0.22B+0.65C-1.40AB+1.14AC+0.45BC-3.48A2-1.75B2-2.03C2
2.3.3 响应面分析 通过Design-Expert软件分析,做出如图2~图4所示的响应曲面图和等高线图,可以直观的看到各因素之间的交互情况。
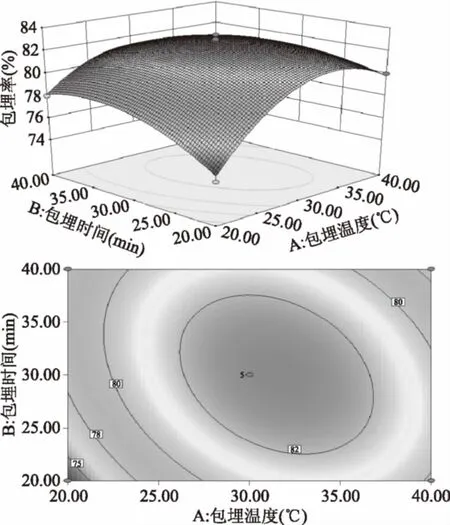
图2 Y=f(A,B)的响应面图与等高线图Fig.2 Response surface and contour plots of Y=f(A,B)
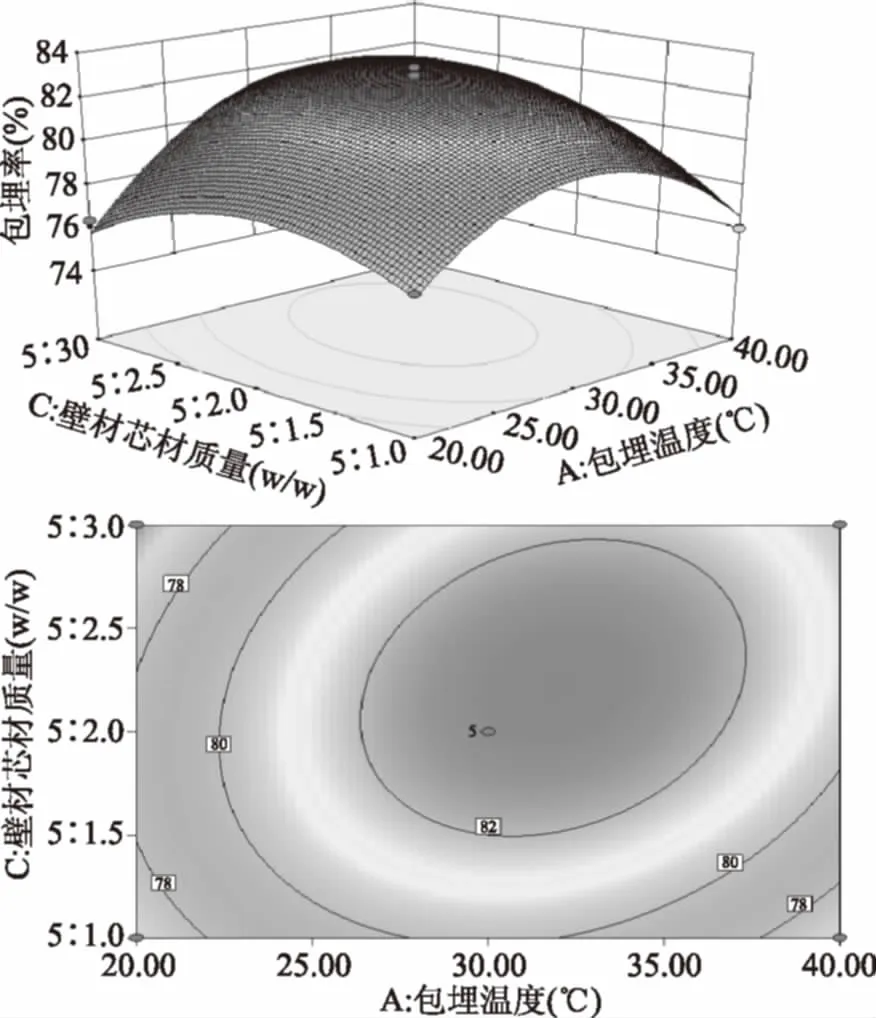
图3 Y=f(A,C)的响应面图与等高线图Fig.3 Response surface and contour plots of Y=f(A,C)
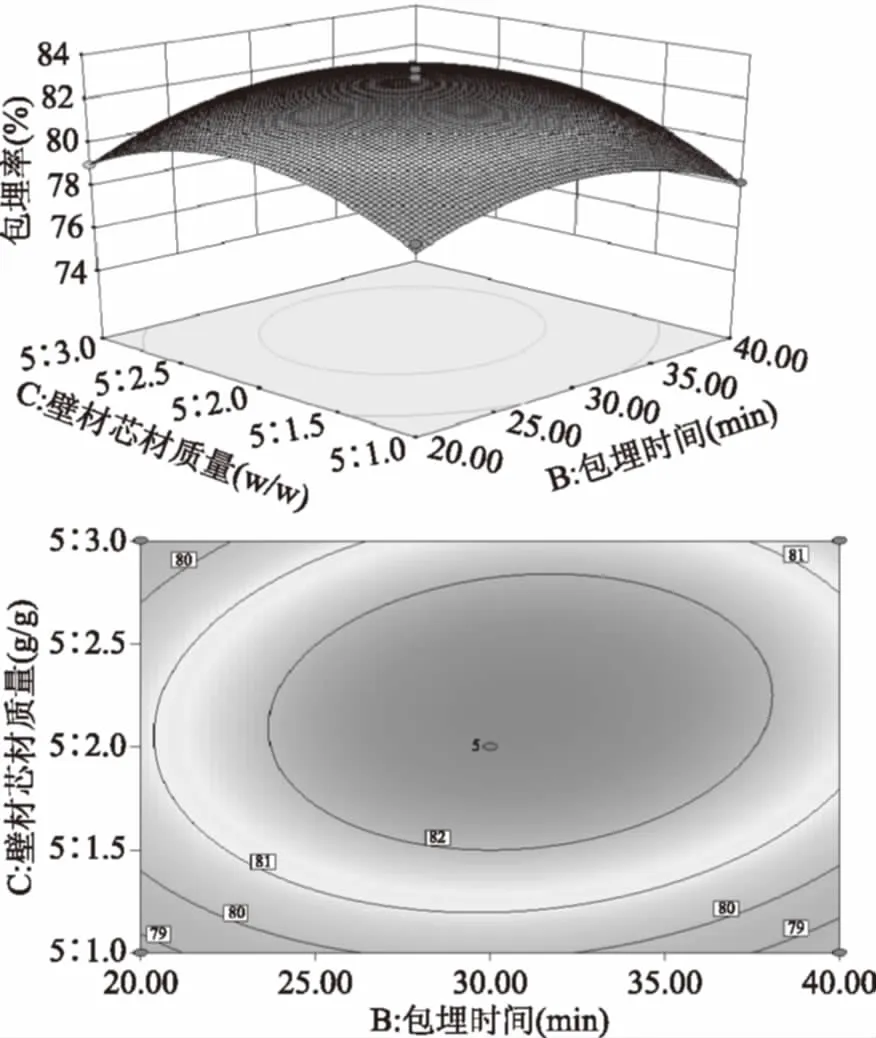
图4 Y=f(B,C)的响应面图与等高线图Fig.4 Response surface and contour plots of Y=f(B,C)
如图2所示,随着包埋温度和包埋时间的增大,包埋率先升高后降低,响应曲面非常陡峭,等高线为椭圆形,说明包埋温度与包埋时间交互作用显著;如图3所示,随着包埋温度和壁材芯材质量比的提高,包埋率先升高后降低,等高线为椭圆形,说明包埋温度与壁材芯材质量比交互作用显著;如图4所示,随着包埋时间和壁材芯材质量比的增大,包埋率先升高后降低,等高线接近圆形,说明包埋时间与壁材芯材质量比交互作用不显著。
2.4验证实验
通过Design-Expert软件分析,模拟得出包埋率最高的优化组合为A=31.80 ℃、B=30.18 min、C=5∶2.21,即包埋温度31.80 ℃、包埋时间30.18 min、壁材芯材质量比5∶2.21 (w/w)时,紫甘薯花青素微胶囊的包埋率最高,为83.00%。为了实际操作的便利,将最佳工艺条件修正为包埋温度32 ℃、包埋时间30 min、壁材芯材质量比5∶2.2 (w/w)。按照此条件制备紫甘薯花青素微胶囊,进行三次重复性实验,将三次测定的微胶囊效率取平均值,结果为81.55%±0.89%,预测值与实际值接近,响应面优化结果可靠。利用响应面优化紫甘薯花青素微胶囊工艺是可行的。
2.5紫甘薯花青素微胶囊的电镜扫描图
按照优化后的工艺参数制备了紫甘薯花青素微胶囊产品,并用电镜扫描观察微胶囊颗粒的外观结果,如图5所示。
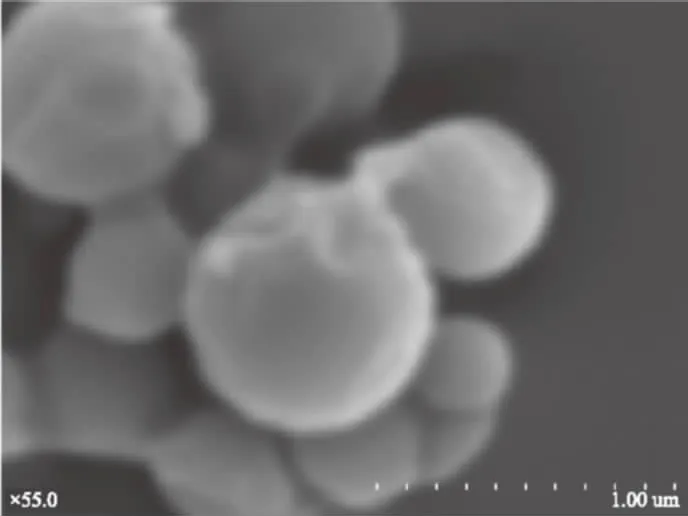
图5 紫甘薯花青素微胶囊SEM电镜扫描图Fig.5 SEM of purple sweet potato anthocyanins microcapsule
由图5电镜扫描图可以清晰的看出微胶囊化产品形状结构较光滑完整,壁材结构的致密性较好,少有破壁情况,且产品颗粒明显变小,微胶囊化效果良好。
2.6微胶囊的理化参数
在优化工艺条件下制备的紫甘薯花青素微胶囊的理化性质如表4所示。

表4 微胶囊的理化性质Table 4 The physical and chemical properties of microcapsules
2.7紫甘薯花青素微胶囊的稳定性评价
微胶囊处理对紫甘薯花青素水、热、光和pH稳定性的影响,结果如图6所示。
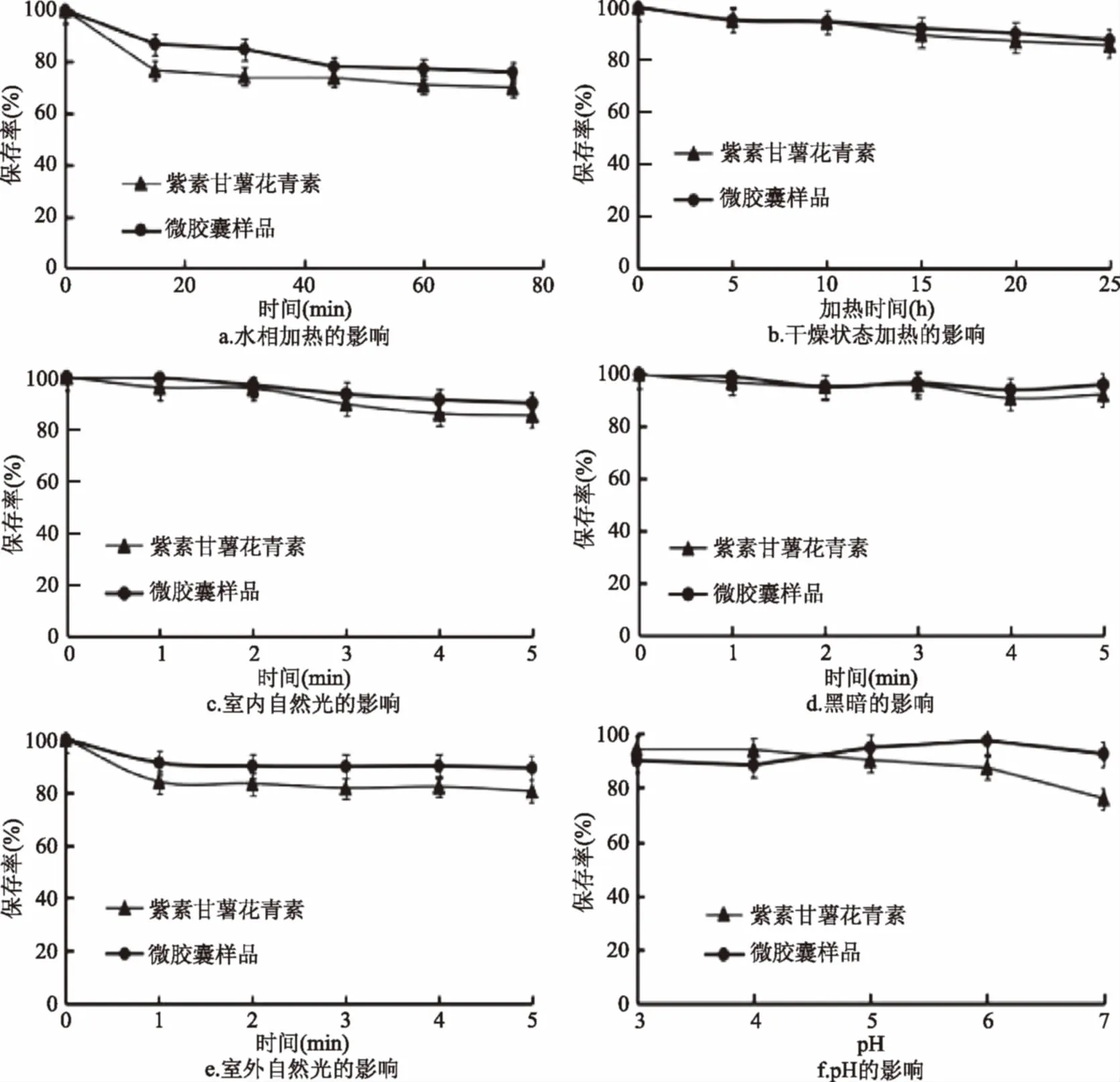
图6 各因素对花青素微胶囊化前后稳定性的影响Fig.6 Effect of various factors on the stability of native and microencapsulated anthocyanins
由图6可以看出,紫甘薯花青素对干燥加热(图6b)和光照比较稳定(图6c~图6e),而受水中加热和pH影响较大,随着90 ℃水相加热时间的延长(图6a)和溶液pH的增大(图6f),花青素的保存率明显降低;而紫甘薯花青素微胶囊化之后,减缓了环境的影响,保存率降低趋势相对较小。对比实验结果可以看出,微胶囊处理提高了其水相热稳定性、pH稳定性和室外光稳定性。
3 结论
本实验筛选得到玉米朊作为壁材,通过单因素实验和Box-Behnken实验确定了紫甘薯花青素微胶囊化的优化工艺条件:包埋温度32 ℃、包埋时间30 min、壁材芯材质量比5∶2.2 (w/w),壁材浓度1%,该条件下通过冷冻干燥的方法制备的紫甘薯花青素微胶囊包埋率验证值为81.55%±0.89%,响应面结果可靠。
扫描电镜结果显示紫甘薯花青素微胶囊为类似圆球状的紫色粉末,稳定性实验结果显示该工艺明显提高紫甘薯花青素水相热稳定性,同时也提高了其室外光和pH稳定性,可为紫甘薯花青素微胶囊的实际生产提供参考,具有重要的应用价值。
[1]王超.紫甘薯色素制剂产品开发及代谢研究[D].天津:天津科技大学,2015.
[2]Guo ying Wang,Juan Chen,Yan ping Shi. Preparation of microencapsulated xanthophyll for improvi-ng solubility and stability by nanoencapsulation[J]. Journal of Food Engineering,2003,117:82-88.
[3]郭立华.玉米醇溶蛋白微胶囊的制备及性质研究[D].天津:天津科技大学,2012.
[4]陈洪波,徐保明.壁材组成对原花青素微胶囊化的影响[J].食品研究与开发,2010,31(9):68-71.
[5]付志英.壳聚糖包覆水溶性药物微胶囊的制备与表征[D].广东:华南理工大学,2013.
[6]聂芊. 明胶包埋壳聚糖/海藻酸钠茶多酚的缓释性能[J]. 哈尔滨商业大学学报,2005,21(4):418-420.
[7]肖素荣,高青山,李京东. 新型食品添加剂可得然胶的性质及应用[J]. 中国食品与营养,2008(1):25-26.
[8]李书国. 乙基纤维素微胶囊化VC工艺参数及其活性保护的研究[J]. 食品工业科技,2005(5):143-148.
[9]李颖畅.乙基纤维素微胶囊化蓝莓花色苷的研究[J].食品工业科技,2009,30(6):250-252.
[10]吉宏武.玉米醇溶蛋白的特性与应用[J].粮食与食品工业,2000(2):27-29.
[11]马雪松.紫甘薯色素的微乳化和微胶囊化[D].天津:天津科技大学,2015.
[12]赵辰辰.天然红米红色素稳态化研究[D].天津:天津科技大学,2015.
Optimizationofpurplesweetpotatoanthocyaninsmicrocapsulesbyresponsesurfacemethodology
WANGLi-shuang,JIANGYu-qi,YUFeng-tong,LIXiang,YEJiang-wen,ZHANGTian-shuang,WANGJian-xin,LVXiao-ling*
(College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Objective:The wall materials for the microcapsulation of purple sweet potato anthocyanins were selected to improve their stabilization in aqueous phase and the response surface was used to optimize the process conditions.Methods:The selected parameters including microcapsulation tempreture,time,wall material concentration,wall/core material ratio were optimized using Box-Behnken experimental design with variance analysis based on the microcapulation efficiency. The prepared microcapsules were subjected to electron microscopic observation and stability test.Results:The zein was selected as the wall material. The results showed that the optimal microcapsulation results were obtained under the conditions:microcapsulation time 30 min,tempreture 31 ℃,wall material concentration 1%,wall/core material ratio 5∶2.2 (w/w). Under these optimal conditions,the microcapulation efficiency was up to 81.55%±0.89%,their density was 2.88 g/mL,moisture content was 4.42%.The anthocyanins microcapsules were purple with a cylinder-like shape. The microcapsules were more s
Table than the native anthocyanins when exposed to aqueous phase,pH and outdoor light.Conclusion:Therefore,microcapsulation is a good way to improve the stabilization of purple sweet potato anthocyanins in aqueous phase.
purple sweet potato anthocyanins;microcapsule;response surface methodology;microcapulation efficiency;aqueous phase stability
TS202.3
B
1002-0306(2017)19-0191-06
10.13386/j.issn1002-0306.2017.19.035
2017-04-11
王立爽(1996-),女,本科,研究方向:食品科学与工程,E-mail:wlswls2@126.com。
*通讯作者:吕晓玲(1960-),女,硕士,教授,研究方向:天然产物的研究与开发,E-mail:lxling@tust.edu.cn。
天津科技大学大学生创新创业训练计划资助项目(201610057089)。
