鳞柄小奥德蘑多糖提取工艺的优化及抗氧化活性
2017-10-19,,,,,,,,*
, ,,,,, ,,*
(1.廊坊师范学院生命科学学院,河北廊坊 065000;2.河北省高校食药用菌应用技术研发中心,河北廊坊 065000;3.廊坊市食用菌技术重点实验室,河北廊坊 065000)
鳞柄小奥德蘑多糖提取工艺的优化及抗氧化活性
王晶1,2,3,费爽1,孟煜晗1,孙天玉1,侯晓强1,2,3,付亚娟1,2,3,杜娟1,吴智艳1,2,3,*
(1.廊坊师范学院生命科学学院,河北廊坊 065000;2.河北省高校食药用菌应用技术研发中心,河北廊坊 065000;3.廊坊市食用菌技术重点实验室,河北廊坊 065000)
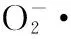
鳞柄小奥德蘑多糖,正交设计,抗氧化能力
鳞柄小奥德蘑(Oudemansiellafurfuracea)又名长根小奥德蘑鳞柄变种(O.radicatavar.furfuracea)或鳞腿长根金钱菌(Collybiaradicatavar.furfuracea),现为蘑菇目(Agaricales)膨瑚菌科(physalacriaceae)狭义小奥德蘑属(Oudemansiella)一独立种[1]。其味道鲜美,营养价值丰富,经济价值较高[2],在河北、北京和山东均有人工种植。目前该菌的研究工作主要集中在育种和栽培等方面[3],而有关鳞柄小奥德蘑多糖提取分离方面未见相关报道。
1 材料与方法
鳞柄小奥德蘑 廊坊市;DNA提取试剂盒 北京艾德莱生物科技有限公司;实验中所用其他试剂均为分析纯。
MLS-3750高压蒸汽灭菌锅 日本SONYA公司;S1000 PCR仪 美国Bio-Rad公司;Hei-VAp Advantage旋转蒸发仪 德国Heidolph公司;752N紫外分光光度计 上海棱光技术有限公司;Allegra 25R台式高速离心机 美国Beckman Coulter公司;HHS电热恒温水浴锅 上海博迅实业科技有限公司;FD-1D-50真空冷冻干燥机 北京博医康实验仪器有限公司。
1.2实验方法
1.2.1 菌种鉴定 采用ITS-rDNA 序列分子鉴定法进行菌种鉴定[10]。蘑菇DNA采用试剂盒提取,琼脂糖凝胶电泳检查后,-20 ℃保存备用。采用真菌通用引物ITS1(5′-TCCGTA GGTGAA CCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS1,5.8 S和ITS2的全序列[10]。PCR反应体系25 μL:7.5 μL无菌超纯水,12.5 μL 2×PCR Master,1 μL DNA模板,1 μL ITS 1,1 μL ITS2,2 μL 25 mg/mL BSA),反应参数:94 ℃预变性4 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸45 s,30个循环;72 ℃延伸10 min。扩增产物经琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序。
1.2.2 鳞柄小奥德蘑粗多糖的提取 参考张保等[11]方法,并改进。鳞柄小奥德蘑子实体干品粉碎后过200目筛,称取样品1.0 g,添加蒸馏水,水浴浸提,4000 r/min 离心20 min,重复提取若干次,收集上清液,Sevage(氯仿∶正丁醇=4∶1)试剂除蛋白,重复几次,直至中间层无白色沉淀,蒸馏水透析,旋转蒸发浓缩,真空冷冻干燥得鳞柄小奥德蘑子实体粗多糖。
1.2.3 单因素实验设计 选择料液比、提取温度、提取时间及提取次数4 个单因素[12]分别进行如下实验:料液比设置1∶10、1∶20、1∶30、1∶40、1∶50 (g∶mL)五个梯度,提取温度、提取时间及提取次数分别是80 ℃、3 h和3次。提取温度设置60、70、80、90、100 ℃ 5个梯度,提取时间、料液比和提取次数分别是3 h、1∶30和3次;提取时间设置1、2、3、4、5 h 5个梯度,提取温度、料液比和提取次数分别是80 ℃、1∶30和3次;提取次数设置1、2、3、4、5次5个梯度,料液比、提取温度和提取时间分别是1∶30、80 ℃和3 h。
大年三十前夕,大雪依然纷纷扬扬。父亲将我们召集到一起,问想吃什么,明天是年前最后一次逢集,都给买回来。
1.2.4 鳞柄小奥德蘑粗多糖提取工艺的正交实验设计 在单因素实验的基础上,以粗多糖得率为筛选指标,对影响鳞柄小奥德蘑多糖提取的四种因素(提取温度、提取时间、料液比和提取次数)[12]进行正交实验L9(34),确定提取鳞柄小奥德蘑粗多糖的最佳提取工艺参数。
1.2.5 多糖含量的测定方法 采用蒽酮比色法测定总糖含量(mg/mL),3,5-二硝基水杨酸法测定还原糖的含量(mg/mL),多糖含量=总糖含量-还原糖含量[13];多糖得率(%)=提取液中多糖含量/鳞柄小奥德蘑的重量×100。
1.2.6 鳞柄小奥德蘑多糖抗氧化活性的测定
1.2.6.1 还原能力的测定 采用普鲁士蓝法[14-15]。取不同质量浓度(0.25、0.5、1.0、1.5和2.0 mg/mL)的鳞柄小奥德蘑粗多糖溶液1 mL,加入磷酸盐缓冲溶液(pH6.6)和1%(质量体积比)K3[Fe(CN)6]各2.5 mL,混合均匀后,50 ℃中反应20 min,再加入2.5 mL 10%(体积分数)的三氯乙酸溶液,振荡混匀后,3000 r/min离心10 min,取上清液5 mL,分别加入蒸馏水5.0 mL和0.1%(质量体积比)的FeCl3溶液1.0 mL,混匀后反应10 min,利用分光光度计测定波长700 nm下的吸光值(A700),阳性对照为相同质量浓度梯度的VC水溶液。每组设三个重复。
1.2.6.2 清除羟基自由基(·OH)能力的测定 采用水杨酸法[16]。取不同质量浓度(0.25、0.5、1.0、2.0和4.0 mg/mL)的鳞柄小奥德蘑粗多糖溶液1 mL,加入9 mmol/L的FeSO4溶液1 mL和9 mmol/L水杨酸-乙醇溶液1 mL,置37 ℃恒温水浴锅中,添加8.8 mmol/L的H2O2溶液1 mL,恒温反应30 min,以蒸馏水调零,利用分光光度计测定510 nm波长下的吸光值(Ax),空白组以1 mL蒸馏水代替样品溶液,其余处理同上,测定吸光值(A0);对照组以1 mL 蒸馏水代替H2O2溶液,其余处理同上,于510 nm 波长处测定吸光值(Ax0);阳性对照为相同质量浓度梯度的VC水溶液。每组设三个重复。清除率计算公式(1)计算。
式(1)

式(2)
1.3统计学处理
2 结果与分析
2.1鳞柄小奥德蘑菌种确定
使用引物ITS1/ITS4对总DNA进行扩增,在约800 bp处得到明亮清晰的单一条带(见图1)送生工生物工程(上海)股份有限公司测序后,与GenBank 数据库中的已知序列进行BLAST比对分析,与鳞柄小奥德蘑(Oudemansiellafurfuracea)(GenBank Accession:AF321482.1)相似性为100%[18],因此,本实验菌种归属确定为鳞柄小奥德蘑。
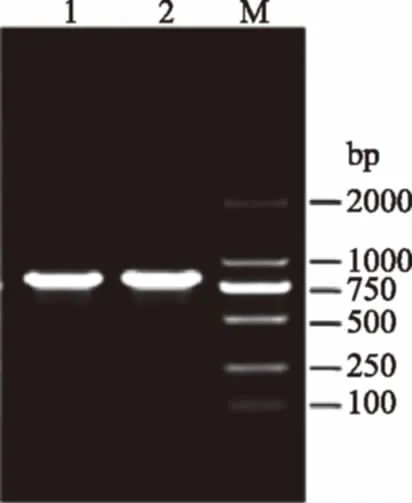
图1 PCR扩增产物的琼脂糖凝胶电泳检测Fig.1 Agarose gel electrophoresis for PCR product注:1和2,PCR扩增产物;M,DNA分子质量标准。
2.2单因素实验
2.2.1 料液比对鳞柄小奥德蘑粗多糖得率的影响 由图2可知,料液比在1∶10~1∶30范围内,鳞柄小奥德蘑粗多糖的得率差异不显著(p>0.05),当料液比从1∶30降低为1∶40时,粗多糖得率显著增大(p<0.05),料液比进一步降低为1∶50时,粗多糖得率无显著变化(p>0.05),由此可得,当料液比为1∶40时,浸提液中含有足够量的溶剂溶解菌体组织中扩散出的多糖。由于提取液用量过低,不利于多糖的浸出[19],而提取液用量过高,对多糖的得率无明显的增加效果,反会增加后续浓缩工艺的负担[20]。因此,选择1∶40的液料比,提取鳞柄小奥德蘑粗多糖较为合适。
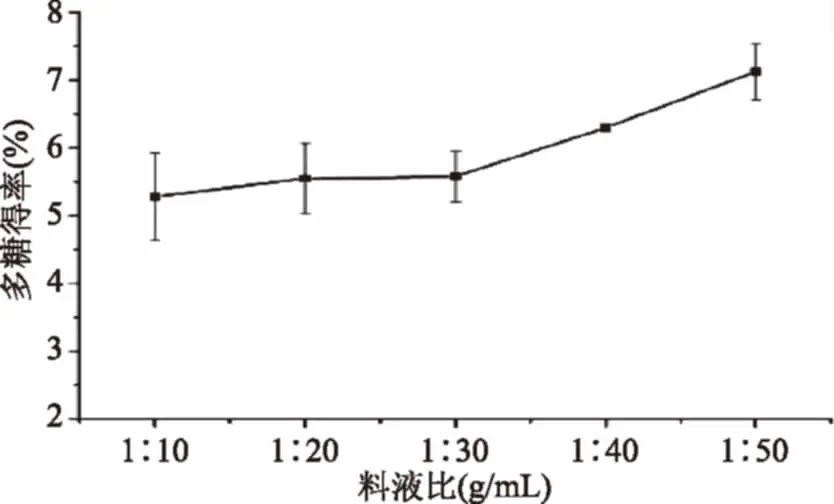
图2 料液比对鳞柄小奥德蘑多糖得率的影响Fig.2 Effect of solid/liquid ratio on polysaccharideyields from Oudemansiella furfuracea
2.2.2 提取温度对粗多糖得率的影响 由图3可知,提取温度为60 ℃时,粗多糖的得率较低,之后随着温度的升高,粗多糖的得率大幅度升高(p<0.05),说明,随着提取温度的升高,多糖分子在水中的扩散系数和溶解度升高,多糖能够更大程度的扩散到提取溶剂中[21]。当温度高于80 ℃后,多糖的得率的增幅减缓,当温度上升为100 ℃时,多糖得率达到最高,考虑到100 ℃的高温会导致溶剂水的沸腾,降低溶剂的体积,故选择80~90 ℃的提取温度较为合适。
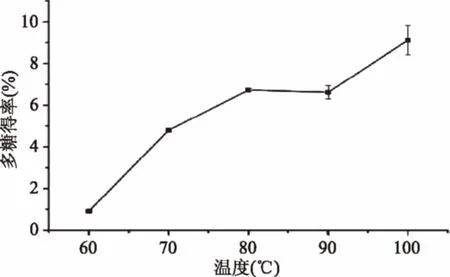
图3 温度对鳞柄小奥德蘑多糖得率的影响Fig.3 Effect of temperature on polysaccharideyields from Oudemansiella furfuracea
2.2.3 提取时间对粗多糖得率的影响 由图4可知,提取时间在1~2 h 内,鳞柄小奥德蘑粗多糖的得率随提取时间的增加而增大(p<0.05),说明热水浸提法中,在一定时间范围内随着提取时间的延长,多糖从细胞内逐渐进入浸提液中,导致浸提液中多糖的浓度不断增加,多糖得率不断增大,直至细胞内外多糖浓度趋于平衡,浸提液中多糖的得率逐渐趋于稳定[22]。因此,鳞柄小奥德蘑粗多糖的提取时间选择2 h较为合适。
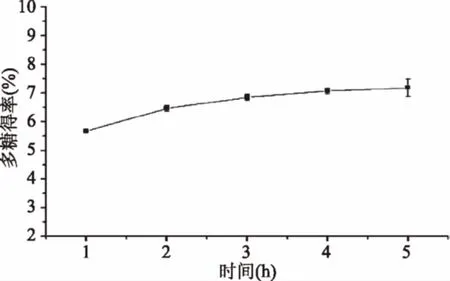
图4 提取时间对鳞柄小奥德蘑多糖得率的影响Fig.4 Effect of extraction time on polysaccharideyields from Oudemansiella furfuracea
2.2.4 提取次数对粗多糖得率的影响 由图5 可知,鳞柄小奥德蘑粗多糖的得率随着提取次数的增加而增大,原因可能是热水浸提时,可溶性多糖不断从蘑菇组织(多糖浓度较高)向热水(多糖浓度较低)中扩散,直至浓度达到动态平衡,将多糖的饱和溶液滤出后,连续多次添加新的热水,可将组织中含有的多糖组分进一步溶出[22],故随着提取次数的增加,多糖的得率逐渐增大,但从图5可发现,当提取次数达到3 次时,增加提取次数并没有显著(p<0.05)的增加多糖的得率,而且工作时间延长,工作量加大[22],故最佳提取次数选择为3 次。
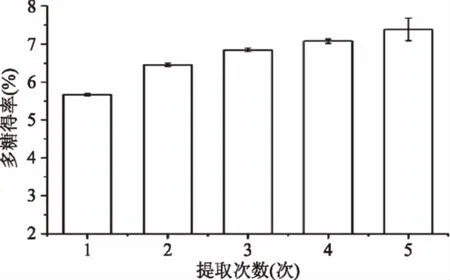
图5 提取次数对鳞柄小奥德蘑多糖得率的影响Fig.5 Effect of extraction times on polysaccharideyields from Oudemansiella furfuracea
2.3正交实验优化多糖提取工艺
在单因素实验基础上,按照四因素三水平进行L9(34)正交实验,分析提取料液比、提取温度、提取时间和提取次数对鳞柄小奥德蘑粗多糖提取的影响[19],实验结果见表1。由直观分析可知,料液比(A)、温度(B)、时间(C)和提取次数(D)四种因素对鳞柄小奥德蘑粗多糖得率的影响顺序为:A>C>B>D,即料液比>提取时间>提取温度>提取次数,最优组合为:A2B3C1D3,即提取鳞柄小奥德蘑粗多糖的最佳条件为:料液比1∶40,提取时间1h,提取温度90 ℃,提取次数3 次。但正交表中无此实验组合,故追加该组合和第6组(多糖得率最高组)比较,结果表明,在A2B3C1D3提取条件下,鳞柄小奥德蘑多糖的得率较高,约为8.84%。故鳞柄小奥德蘑粗多糖提取的条件为料液比1∶40 (g/mL),提取时间1h,提取温度90 ℃,提取次数3 次。
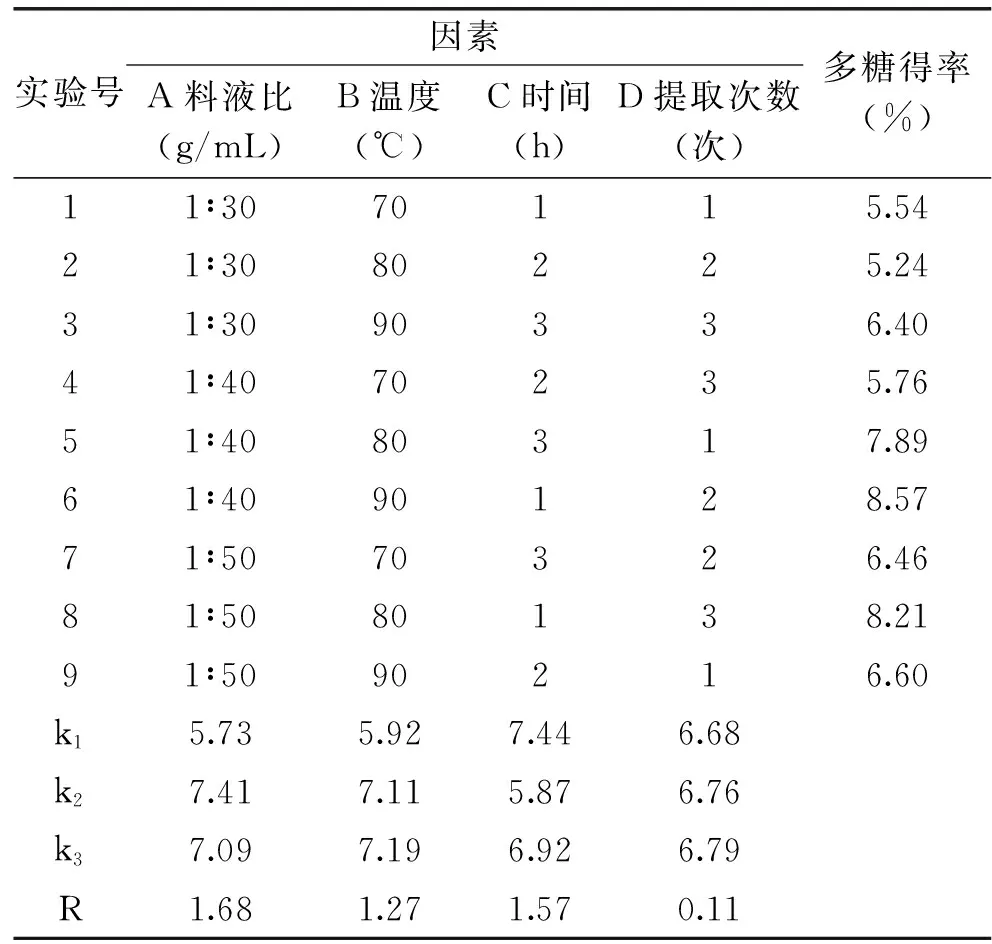
表1 鳞柄小奥德蘑多糖提取正交实验结果Table 1 Orthogonal experiment results ofpolysaccharide yields from Oudemansiella furfuracea
2.4鳞柄小奥德蘑抗氧化能力
2.4.1 鳞柄小奥德蘑粗多糖的还原能力 具有还原能力的样品可将铁氰化钾K3[Fe(CN)6]还原成亚铁氰化钾K4[Fe(CN)6],亚铁氰化钾与FeCl3中的Fe3+形成普鲁士蓝Fe4[Fe(CN)6]3。普鲁士蓝最大吸收波长为700 nm,此波长处吸光值反映普鲁士蓝的生成量,吸光值越大,样品还原能力越强[23-24]。由图6可知,在0.25~2 mg/mL实验浓度范围内,鳞柄小奥德蘑粗多糖的还原能力随着多糖质量浓度的增加而增大,说明鳞柄小奥德蘑粗多糖具有一定的还原能力[25]。
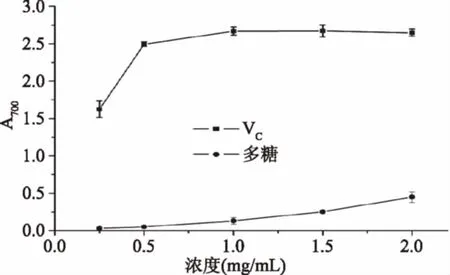
图6 鳞柄小奥德蘑粗多糖的还原能力Fig.6 Reducing power of crudepolysaccharides from Oudemansiella furfuracea
2.4.2 鳞柄小奥德蘑粗多糖对羟基自由基(·OH)的清除作用 H2O2与Fe2+通过Fenton反应产生羟自由基·OH,后者能与水杨酸反应生成在510 nm处有强吸收的有色产物二羟基苯甲酸[26],若反应体系中添加具有清除羟自由基功能的被测样品,便会与水杨酸竞争·OH,从而使有色产物的生成量减少。510 nm处测得的吸光度越小,·OH越少,待测样品对羟自由基清除效果越好[23]。
由图7 可见,0.25~1 mg/mL鳞柄小奥德蘑粗多糖对·OH清除能力较弱;当质量浓度提高到2 mg/mL和4 mg/mL时,粗多糖对·OH的清除率显著提高(p<0.05),为38.63%±9.25%和48.94%±12.32%,说明鳞柄小奥德蘑粗多糖对·OH 的清除能力与多糖质量浓度正相关,即随着粗多糖质量浓度的增加,对·OH 的清除效果随之增加,高质量浓度的鳞柄小奥德蘑粗多糖对·OH 有着较明显的清除作用,但与同质量浓度的VC相比,清除能力较弱。

图7 鳞柄小奥德蘑粗多糖对·OH 的清除作用Fig.7 Effect of crude polysaccharidesfrom Oudemansiella furfuracea on scavenging hydroxyl radicals
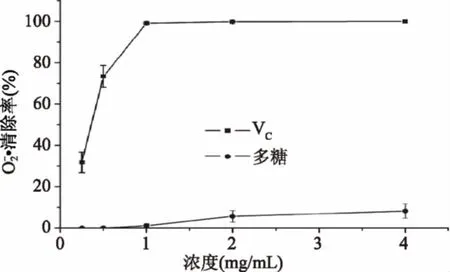
图8 鳞柄小奥德蘑粗多糖对的清除作用Fig.8 Effect of crude polysaccharides from Oudemansiellafurfuracea on scavenging superoxide anion radicals
3 结论

[1]杨祝良,张丽芳. 狭义小奥德蘑属(膨瑚菌科,蘑菇目)的一个新系统[J]. 菌物学报,2009,28(1):1-13.
[2]于富强,纪大干,宋美金,等. 鳞柄小奥德蘑两变种栽培比较[J]. 中国食用菌,2002,21(5):13-15.
[3]李传华,尚晓冬,曲明清,等. 中国奥德蘑属栽培研究进展[J]. 食用菌学报,2011,18(4):95-98.
[4]You L,Gao Q,Feng M,et al. Structural characterisation of polysaccharides from Tricholoma matsutake and their antioxidant and antitumour activities[J]. Food chemistry,2013,138(4):2242-2249.
[5]Liu Q,Tian G,Yan H,et al. Characterization of polysaccharides with antioxidant and hepatoprotective activities from the wild edible mushroom Russula vinosa Lindblad[J]. Journal of agricultural and food chemistry,2014,62(35):8858-8866.
[6]Tong H,Liu X,Tian D,et al. Purification,chemical characterization and radical scavenging activities of alkali-extracted polysaccharide fractions isolated from the fruit bodies of Tricholoma matsutake[J]. World Journal of Microbiology and Biotechnology,2013,29(5):775-780.
[7]Sun Y,Zhou X. Purification,initial characterization and immune activities of polysaccharides from the fungus,Polyporus umbellatus[J]. Food Science and Human Wellness,2014,3(2):73-78.
[8]Sun Y,Sun T,Wang F,et al. A polysaccharide from the fungi of Huaier exhibits anti-tumor potential and immunomodulatory effects[J]. Carbohydrate polymers,2013,92(1):577-582.
[9]Wang Z B,Pei J J,Ma H L,et al. Effect of extraction media on preliminary characterizations and antioxidant activities of Phellinus linteus polysaccharides[J]. Carbohydrate polymers,2014,109:49-55.
[10]侯晓强,任秀艳,付亚娟,等. 北沙参内生真菌的抑菌活性与分类研究[J]. 中草药,2015,46(19):2932-2936.
[11]张保,李立天,张萌,等. 拐枣枝多糖提取工艺优化与其抗氧化性研究[J]. 中国酿造,2016,35(7):155-160.
[12]徐静静,艾训儒,李琴,等. 正交实验优选延龄草多糖提取工艺研究[J]. 中药材,2013,36(2):305-307.
[13]李强,唐微,石园园,等. 蒽酮-硫酸法和3,5-二硝基水杨酸法测定杜仲水提液多糖含量[J]. 食品工业科技,2010,31(10):370-371,374.

[15]王金玺,顾林,孔凡伟,等. 鸡腿菇粗多糖的体外抗氧化性[J]. 食品科学,2012,33(13):79-82.
[16]李谷才,袁立华,张儒,等. 花椒水溶性多糖的提取及其体外抗氧化活性研究[J]. 食品工业科技,2011,32(8):258-260.
[17]李姣,王珂,王瑞坡,等. 芦笋多糖提取纯化工艺及其体外抗氧化研究[J]. 食品科学,2011,32(8):65-69
[18]Landeweert R,Leeflang p,Kuyper T W,et al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Applied and Environmental Microbiology,2003,69(1):327-333.
[19]孙颖颖,雷琪瑶,刘筱潇,等. 球等鞭金藻胞内和胞外多糖的提取工艺[J]. 食品科学,2010,31(6):55-59.
[20]鲍康德,张小平,郑维发. 海洋浮游硅藻胞外多糖研究进展[J]. 安徽师范大学学报:自然科学版,2005,28(2):214-217.
[21]张丽娟,闫静芳,乐田,等. 长根菇多糖的分离提取[J]. 食品与发酵工业,2015,41(8):225-228.
[22]孟繁磊,陈瑞战,张敏,等. 刺五加多糖的提取工艺及抗氧化活性研究[J]. 食品科学,2010,31(10):168-174.
[23]赵平,任鹏,张月萍. 原花青素抗氧化活性测定方法比较[J]. 现代化工,2012,32(5):119-122.
[24]何婷,张红雨. 9种常见植物秸秆抗氧化活性的比较研究[J]. 化工时刊,2010,24(4):19-21.
[25]封燕,贡小辉,韦德群,等. 金蝉花多糖的抗氧化活性及结构分析[J]. 食品科学,2016,37(13):19-24.
[26]颜军,苟小军,邹全付,等. 分光光度法测定Fenton反应产生的羟基自由基[J]. 成都大学学报:自然科学版,2009,28(2):91-93,103.
[27]韩少华,朱靖博,王妍妍. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造,2009,6:155-157.
ExtractionandantioxidantactivityofpolysaccharidesfromOudemansiellafurfuracea
WANGJing1,2,3,FEIShuang1,MENGYu-han1,SUNTian-yu1,HOUXiao-qiang1,2,3,FUYa-juan1,2,3,DUJuan1,WUZhi-yan1,2,3,*
(1.College of Life Sciences,Langfang Teachers University,Langfang 065000,China;2.Edible and Medicinal Fungi Research and Development Center of Hebei Universities,Langfang 065000,China;3.Edible Fungi Key Laboratory of Langfang City,Langfang 065000,China)
To investigate the optimum extracting process of polysaccharides fromOudemansiellafurfuraceaand its antioxidant activityinvitro. Extraction process of polysaccharides fromOudemansiellafurfuraceawas optimised by orthogonal test. And the concentration of total sugar and reducing sugar in water extraction was determined by anthrone-sulfuric acid method and DNS method,respectively. The antioxidant properties were tested by prussian blue method,salicylic acid method and pyrogallol method,respectively. The results showed that the impact sequence of the factors on the extraction rate of polysaccharide fromOudemansiellafurfuraceawas as follows:solid-liquid ratio>extraction time>extraction temperature>extraction times. The optimal extraction condition was solid-liquid ratio of 1∶40,extraction time of 1h,extraction temperature of 80 ℃,and extracted three times,and under this conditions,the extraction rates of polysaccharide fromOudemansiellafurfuraceawas 8.84%. In addition,crude polysaccharides fromOudemansiellafurfuraceacould obviously scavenge hydroxyl radicals in a dose-dependent manner(p<0.05),and at the concentration of 4 mg/mL,crude polysaccharides was observed to possess strong free radical-scavenging effects against scavenge hydroxyl radicals,with a value of 48.94%±12.32%. In addition,crude polysaccharides fromOudemansiellafurfuraceahad a certain reducing power lower and its scavenging effects on superoxide anion radical was ineffective. So crude polysaccharides fromOudemansiellafurfuraceahad certain antioxidant activity and could be used for polysaccharide drugs and health food.
polysaccharide fromOudemansiellafurfuracea;orthogonal test;antioxidant activity
TS255.1
B
1002-0306(2017)19-0172-06
10.13386/j.issn1002-0306.2017.19.032
2016-11-11
王晶(1983-),女,博士,讲师,研究方向:动物细胞工程和生物活性物质,E-mail:oucflora@163.com。
*通讯作者:吴智艳(1962-),女,硕士研究生,教授,研究方向:食用菌栽培与深加工,E-mail:lfwuzhiyan@126.com。
河北省高等学校科学技术研究青年基金项目(QN2016019);河北省高校食药用菌应用技术研发中心项目(YF201411-321);河北省高等学校遗传学重点发展学科项目(201221);廊坊师范学院微生物学重点学科项目(201501);廊坊师范学院大学生创新训练计划项目(201510100036)。
