传统酸面团中抗霉菌乳酸菌的筛选及其在蒸蛋糕中的应用
2017-10-19,,,,,,
, ,,, ,,
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.无锡麦吉贝可生物食品有限公司,江苏无锡 214131;3.江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡 214122;4.三菱化学食品株式会社,日本东京 100-8251)
传统酸面团中抗霉菌乳酸菌的筛选及其在蒸蛋糕中的应用
何艳霞1,王凤2,杨文丹1,陈佳芳1,徐岩3,黄卫宁1,小川晃弘4
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.无锡麦吉贝可生物食品有限公司,江苏无锡 214131;3.江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡 214122;4.三菱化学食品株式会社,日本东京 100-8251)
蒸蛋糕含水量高,不易贮藏。因此,筛选具有抑菌活性的乳酸菌,并将其应用于蒸蛋糕的防腐保鲜具有巨大的应用价值。采用牛津杯法初筛、微量孔板复筛,从传统酵头中筛选得到一株对蒸蛋糕中主要腐败菌具有高抑菌活性的乳酸菌,对该乳酸菌进行分子生物学鉴定,并分析其抑菌活性的有效成分;以该乳酸菌酸面团发酵粉替代低筋粉(替代率分别为0、25%、50%、75%),研究其对蒸蛋糕的质构、感官和微生物的影响。实验结果:经鉴定该乳酸菌为植物乳杆菌(Lactobacillusplantarum),对不同蛋白酶的处理表现出不同的敏感性,发酵液对热稳定,对pH变化最为敏感,推测抑菌作用主要是有机酸。有机酸分析可知,苯基乳酸的含量高达95.91 mg/L。随着替代率的增加,微生物数显著降低;当替代率为25%和50%时,可以显著降低蒸蛋糕的硬度和咀嚼性;当替代率为50%时,蒸蛋糕的感官评价和空白接近,可以被消费者接受。
蒸蛋糕,乳酸菌,抑菌活性,传统酸面团
乳酸菌是食品加工业不可缺少的主要工业用菌,它赋予了食品独特的风味[1-2],改善了食品的营养和品质[3],抑制食品中腐败菌和致病菌的生长[4-5]。乳酸菌发酵酸面团是使用乳酸菌发酵制得的面团。乳酸菌的一些代谢产物如有机酸[6]、乳酸菌素[7]、过氧化氢和特殊的酶系[8]可以起到抑菌作用。已有大量应用实例证明,乳酸菌能提高食品安全性,延长食品保质期[9-10]。因此,对乳酸菌抑菌物质的研究,尤其是对其作用机理和在食品中的应用研究显得尤为重要。
近年来在中国市场上出现了具有中国传统特色的蛋糕-蒸蛋糕,因其组织细腻、弹性好、口感绵软、入口即化且采用蒸制工艺,所以广受现代人的追捧[11]。但是蒸蛋糕含水量高达28%~33%,几乎是烤制蛋糕的一倍[12],是糕点中最难贮存的品种之一,因此蒸蛋糕的防霉保鲜值得重视和深入研究。
目前,乳酸菌酸面团发酵技术在面包中的应用研究较多,例如植物乳杆菌发酵紫薯粉对酸面团面包影响[13]、乳酸菌发酵栗粉对无麸质面包的影响[14]和乳酸菌对面包贮藏性的研究[15-16]等。有关在蒸蛋糕中的应用鲜有报道。因此本论文从传统老酵头中筛选了具有较高抑菌活性的乳酸菌,研究了其抑菌特性,并用其制备酸面团发酵粉应用于蒸蛋糕中,研究其对蒸蛋糕质构特性、感官特性和微生物的影响。从而为蒸蛋糕的天然生物防腐保鲜提供理论基础和技术支持。
1 材料与方法
1.1材料与仪器
低筋粉 江苏省南顺食品有限公司;白砂糖和奶粉 福临门食品有限公司;鸡蛋和盐 均为市售食品级;植物油 金龙鱼葵花籽油;菱友TM MFC-68 三菱化学食品有限公司;糖醇和丙三醇 珠海市宏泰生物科技有限公司;泡打粉 焙乐道公司;蒸蛋糕 日本三菱化学有限公司;米粉发酵液、酒醅和老面酵头 采集自中国各个地区(广西、湖南、贵州和云南等地);菌落总数计数培养基、孟加拉红培养基、甘油、无水乙醇、异丙醇、琼脂、氯化钠、琼脂糖、胰蛋白酶、胃蛋白酶 国药集团化学有限公司;MRS肉汤培养基 杭州百思生物技术有限公司;蛋白酶k、苯基乳酸和过氧化氢 美国Sigma公司。
KitchenAid打蛋器 美国Heavy Duty公司;美的中式电蒸锅 广州美的电器有限公司;SM-25搅拌机 上海梅颖浦仪器仪表制造有限公司;苏州安泰净化工作台SW-CJ-2F 苏州安泰净化公司;APX-150C型恒温恒湿培养箱 上海博讯实业有限公司医疗设备厂;JY20002型电子天平 上海良平仪器仪表有限公司;NanoDrop2000分光度计、Legend Micro17型离心机 Thermo公司;PC300 型PCR仪、DYY-8C 型电泳仪 Bio-Rad;T-XT2i质构仪 英国S
Table Micro Systems公司;荧光倒置显微镜Zeiss Axio Vert.A1 蔡司中国;Agilent1100 高效液相色谱仪 美国安捷伦公司。
1.2实验方法
1.2.1 蒸蛋糕的制作 根据表1中的配方准确称取各种原料,首先将除去低筋粉和奶粉的所有原料搅拌均匀,然后加入低筋粉和奶粉高速打发。将搅拌好的面糊分装到模具中在蒸锅中蒸熟即可。室温冷却1 h后装入塑封袋中,放置在室温(20±2) ℃贮藏待用[17]。
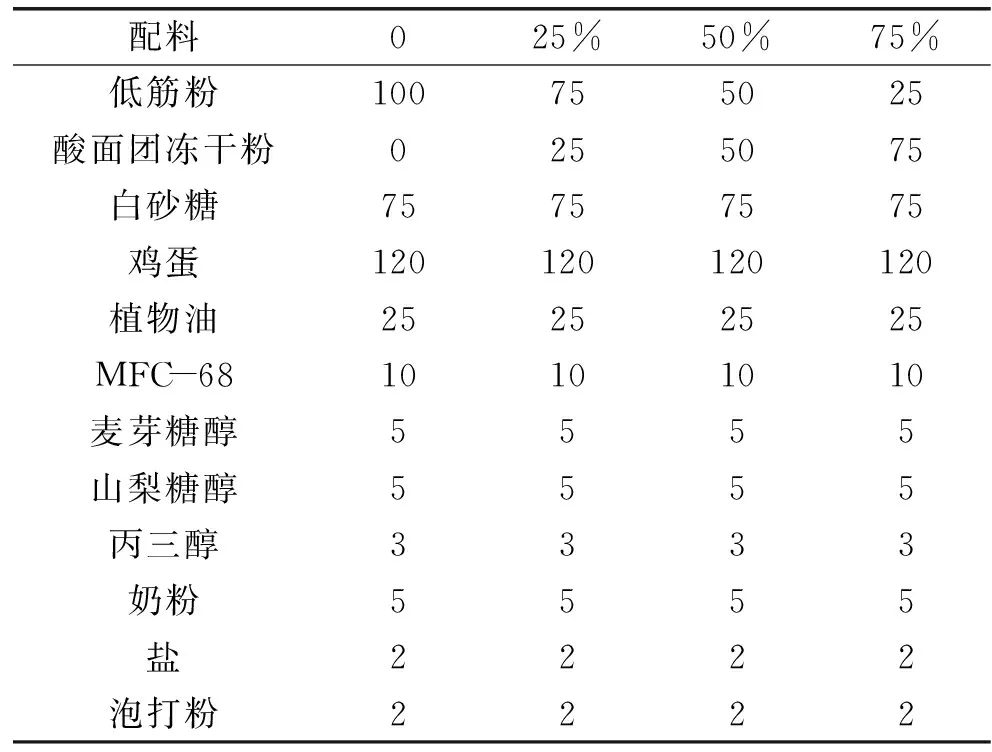
表1 蒸蛋糕配方Table 1 Formulations of steamed cake
1.2.2 蒸蛋糕中主要腐败菌的分离纯化及鉴定 无菌操作下取25 g蒸蛋糕,加入225 mL无菌水中,振荡器振荡30 min,再取1 mL稀释液加入9 mL无菌水中,依次稀释成10-1,10-2、10-3倍稀释液,分别取0.1 mL稀释液接种到菌落总数培养基和营养琼脂培养基上,每个处理3次重复,置于恒温培养箱中37 ℃培养48 h,计数并挑取不同形态的单菌落。无菌操作下取不同形态的细菌单菌落于营养琼脂培养基、YPD和孟加拉红培养基上划线纯化[18],纯化后的单菌落用于显微镜镜检和分子鉴定。细菌采用16S rRNA基因扩增测序,真菌采用26S rDNA基因扩增测序[19]。
1.2.3 乳酸菌的纯化及保藏 将米粉发酵液、酒醅和老面酵头中分离得到的近500株乳酸菌进行了纯化和保藏。乳酸菌的菌株接入MRS液体培养基中,37 ℃培养24 h。菌落在MRS固体培养基上反复划线纯化,并保藏于MRS 斜面上保藏(4 ℃),备用[20]。
1.2.4 具有抑菌活性乳酸菌的初筛
1.2.4.1 产酸菌上清液的制备 从传统酸面团中分离纯化的产酸菌中进行筛选,首先将菌株在37 ℃ 24 h下传代活化两次,然后将活化好的菌株接种到MRS液体培养基中培养24 h后,将发酵菌液以10000 r/min 离心 10 min,后经0.22 μm滤膜过滤制得乳酸菌无菌体发酵液(Cell free supernatant,CFS),4 ℃保存备用[21]。
1.2.4.2 指示菌孢子悬液的制备 将从蒸蛋糕中分离得到的霉菌接种在 PDA平板,28 ℃,培养4~7 d后,用无菌水刮取孢子。然后将孢子液经已灭菌的纱布过滤,除去菌丝体即为孢子悬液。采用血球计数板,将孢子浓度调整为105个/mL[22]。
1.2.4.3 抑菌实验 牛津杯法[23]将培养好的指示菌曲霉和青霉分别吸取0.1 mL于PDA固体培养基上,用涂布器涂抹均匀。将每个固体培养基6等分,于每个区域放置一只高压灭菌过的牛津杯,即每个培养基放6只。用移液枪吸取 0.20 mL乳酸菌上清液于牛津杯中。操作完成后,放入30 ℃恒温培养箱中培养4 d,通过抑菌圈大小以判断抑菌效果。
1.2.5 具有抑菌活性的乳酸菌的复筛 采用微量孔板法[24]。96孔板每孔加入190 μL的乳酸菌无菌体发酵液以及10 μL浓度为104孢子/mL的指示菌悬液。在30 ℃条件下培养48 h后于酶标仪580 nm下测定其吸光值。乳酸菌的抑菌活性以其对指示真菌的抑菌率表示。
抑菌率(%)=(1-ODLAB/ODControl)×100
1.2.6 具有抑菌活性乳酸菌的鉴定 使用细菌基因组DNA 提取试剂盒提取乳酸菌的DNA,用微量紫外分光光度计检测其OD值(A260/A280)和浓度。对其进行PCR(Polymerase Chain Reaction)扩增,得到的产物通过琼脂糖凝胶电泳检测纯度,将纯度符合要求的16S rRNA 片段送往上海桑尼生物技术有限公司进行测序。得到的菌株序列在GenBank 数据库中进行BLAST(http://www.ncbi.nlm.nih.gov/blast/)同源性比对分析。检索与16S rRNA序列同源性最高的已知分类的菌种,确定其种属[20]。
1.2.7 乳酸菌抑菌作用的分析 pH的影响:将乳酸菌CFS用1.0 mol/L NaOH和1.0 mol/L乳酸分别将MRS肉汤培养基的初始pH调到为3.0、4.0、5.0、6.0、7.0、8.0,同时将MRS 液体培养基调制相同的pH为对照,按1.2.4的方法进行测定。
热处理的影响:将乳酸菌CFS分别在60、80和100 ℃下作用30 min,在121 ℃下作用15 min,同时以乳酸菌CFS作为对照,按1.2.4的方法进行测定。
酶处理的影响:将乳酸菌CFS分别用1.0 mol/L NaOH或1.0 mol/L HCl调至酶的最佳pH(胃蛋白酶pH2.0,胰蛋白酶pH7.4,蛋白酶K pH7.4),分别添加至乳酸菌CFS使其终浓度为1 mg/mL。在 37 ℃下处理4 h,调pH至代谢产物初始pH,同时以乳酸菌CFS为对照,按1.2.4的方法进行测定。
过氧化氢作用的排除:取2.0 mL的菌株发酵液,将其pH调为7.0,加入20 mg过氧化氢酶,轻轻摇晃至溶解,置于37 ℃保温2 h,再将pH调为排除酸作用时所确定的对照pH,以未经过氧化氢酶处理的发酵液作为对照,测定抑菌活性。
1.2.8 乳酸菌无细胞上清液中有机酸含量的测定 HPLC条件:流动相为0.05%的三氟乙酸/甲醇(A)和0.05%的三氟乙酸/水(B)的混合液,梯度洗脱程序为:0~20 min由10%A线性变化至100%,20~23 min保持100%A,23~25 min由100%A线性变化至10%。流速1 mL/min,检测波长210 nm,柱温30 ℃[25]。
1.2.9 具有抑菌活性的乳酸菌在蒸蛋糕中的应用
1.2.9.1 植物乳杆菌酸面团发酵粉的制备 低筋粉与水的比例为1∶1 (m/m),将筛选出的高抑菌活性的植物乳杆菌活化培养至对数生长后期,取其菌液5000 r/min离心10 min,用无菌生理盐水冲洗两次后,加入水中,与低筋粉混合均匀,放入恒温恒湿培养箱中进行培养,培养温度为38 ℃,培养时间为24 h。
将上述酸面团放入保鲜袋后与-40 ℃预冻,然后真空冷冻干燥48 h。样品冷冻干燥后进行磨粉,过80目筛,4 ℃储藏备用[26]。
1.2.9.2 蒸蛋糕全质构分析 将蒸蛋糕于室温下冷却1 h后,切割成1.2 cm厚的均匀薄片,采用TA-XT2I质构仪进行全质构分析,实验参数设定为:测试前速率1.0 mm/s,测试速率1.0 mm/s,测试后速率1.0 mm/s,压缩程度50%,两次压缩间隔时间30 s。测定的指标包括硬度、弹性、内聚性和回复性。
1.2.9.3 蒸蛋糕感官分析采用九分嗜好评分法 对不同替代比例的酸面团发酵粉的蒸蛋糕感官品质进行评分。测试前产品随机编号,测试所用感官评定人员为江南大学本校学生,年龄在20~30岁之间,感官评定人员按男女比例3∶7进行分类。筛选20名经过严格培训的评定人员分别对编号后的产品色泽、质构、风味、口感、滋味以及总体可接受度进行评分[28]。
1.2.9.4 储藏期的测定 菌落总数的测定按GBT4789.2-2010《食品卫生微生物学检验菌落总数测定》[29]。
酵母菌和霉菌的计数按GBT4789.15-2010《食品卫生微生物学检验霉菌和酵母计数》[30]。
1.3数据分析
所有数据均为三次平行测量的平均值,运用SPSS软件进行方差分析(ANOVA)和最小显著差异分析(LSD),显著差异df水平取p<0.05。
2 结果与分析
2.1蒸蛋糕中主要腐败菌的分离鉴定
从蒸蛋糕中总共分离出11种霉菌,7种细菌。其中Staphylococcuswarneri和Staphylococcusepidermidis是主要腐败细菌,Penicillium、Cladosporium和Aspergillus是主要腐败霉菌,其中青霉最为主要的腐败霉菌,且蒸蛋糕在贮藏过程中主要以霉变为主。EunjongBaek等[27]发现Cladosporium,Neurospora和Penicillium是烘焙和米制品中的主要霉菌,Legan 等[31]发现青霉是面包霉变的主要霉菌,与本实验的研究结果相一致。部分霉菌的平板图如图1所示,显微镜图如图2所示。
2.2具有抑菌活性乳酸菌的分离纯化、筛选及鉴定
从不同地区的传统酸面团中分离得到的近150株乳酸菌中筛选对蒸蛋糕中主要霉菌具有抑菌活性的乳酸菌,经过初筛,筛选得到25株具有抑菌活性的菌株。从25株中复筛得到11株具有抑菌活性的菌株(表2),选择其中抑菌活性最好的菌株DT2-4作为应用菌株进行研究。DT2-4对不同霉菌的抑菌圈如图3所示。
DT2-4菌株菌落形态为乳白色圆形,表面光滑,中央凸起,边缘整齐,直径约1 mm,是典型的乳酸菌菌落特征(图4a),可初步判断为乳酸菌,革兰氏染色镜检确定为杆菌(图4b)。16S rRNA基因测序结果与基因库中参考菌株Lactobacillusplantarumstrain Z55对比,相似性达100%,所以将其鉴定为植物乳杆菌(Lactobacillusplantarum,Lp),登录号为KC887524。
2.3抑菌作用的研究
从图5分析可知,当pH≥5时,对四种霉菌的抑制作用明显减弱,与发酵原液之间的差异具有较大的显著性(p>0.05),当pH<5时,和发酵原液的差异不显著(p<0.05)。pH对菌液抑菌作用的影响依次为产黄青霉、聚多曲霉、球孢枝孢和黄曲霉。由此可知pH对每种霉菌抑制效果的影响是不一样的。

表2 DT2-4发酵液对蒸蛋糕中主要霉菌的抑制作用Table 2 Antifungal of lactic acid bacterium DT2-4 culture supernatants to molds isolated from steamed cake
注:牛津杯内径 7.8 mm,外径 8.0 mm;+++:抑菌圈直径>20 mm;++:抑菌圈直径:14~20 mm;+:抑菌圈直径:<14 mm;-:无抑菌活性。
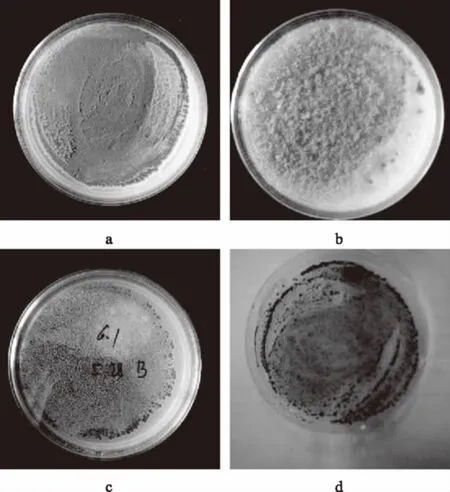
图1 产黄青霉(a)、黄曲霉(b)、球孢枝孢(c)和聚多曲霉(d)培养基平板图Fig.1 Colonies of Penicillium chrysogenum strain,Spergillus flavus strain,Cladosporiumsphaerospermumstrain and Aspergillus sydowii strain
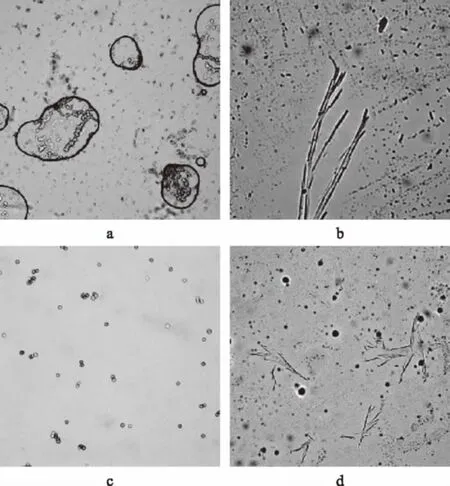
图2 产黄青霉(b)、黄曲霉(a)、球孢枝孢(c)、聚多曲霉(d)显微镜图(40×)Fig.2 Morphology of Penicillium chrysogenum strain,Spergillus flavus strain,Cladosporium sphaerospermumstrain and Aspergillus sydowii strain
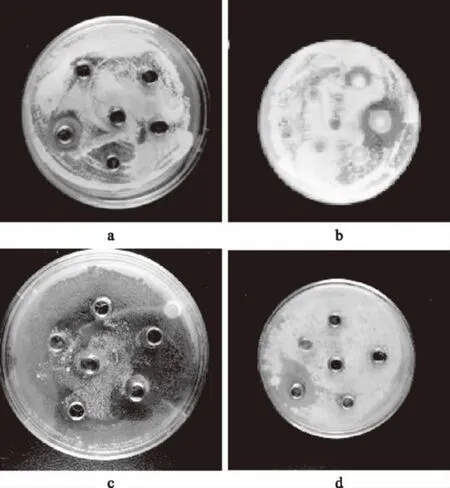
图3 DT2-4对产黄青霉(a)、黄曲霉(b)、球孢枝孢(c)、聚多曲霉(d)的抑菌圈Fig.3 Inhibitory effect of lactic acid bacterium DT2-4on Penicillium chrysogenum strain,Spergillus flavus strain,Cladosporium sphaerospermum strain and Aspergillus sydowii strain
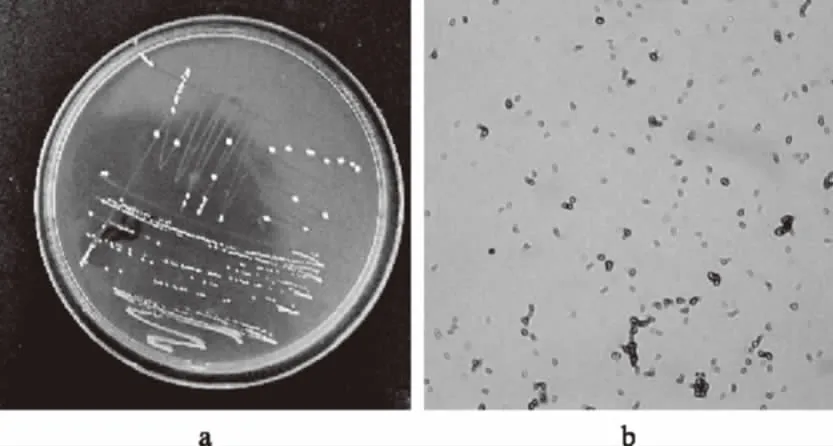
图4 植物乳杆菌的平板图(a)和显微镜图(b)(40×)Fig.4 Colonies(a)and morphology(b)of Lp(40×)
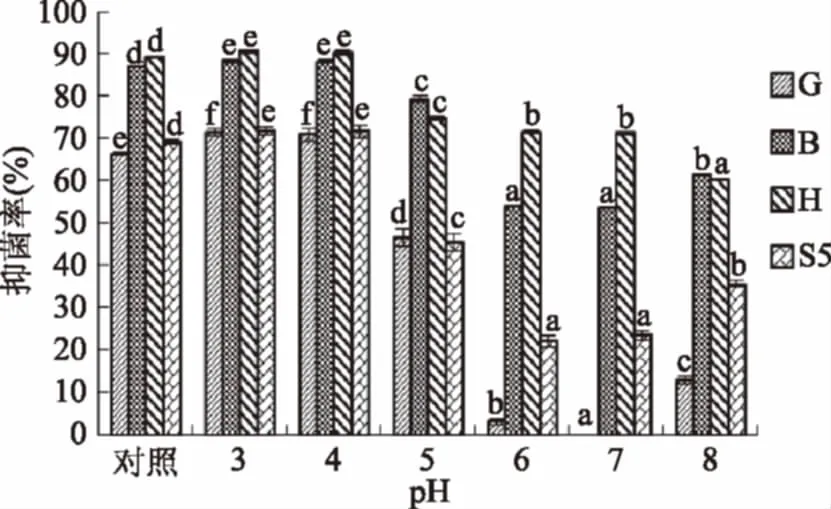
图5 不同pH对菌株CFS抑菌活性的影响Fig.5 Effects of pH on the anti-bacterial activity of CFS注:G:产黄青霉;B:球孢枝孢;H:黄曲霉;S5:聚多曲美,下同。相同图案的柱子上小写字母不同表示差异显著(p<0.05),下同。
图6是将菌株DT 2-4的发酵液分别在60、80、100 ℃处理30 min,121 ℃处理15 min后的抑菌效果,在60 ℃和80 ℃处理后对四种指示菌的抑菌性没有显著性差异,在121 ℃处理后与原液有一定的显著差异,可能是高温使某些抑菌物质失活。总体来看,温度对黄青霉、聚多曲霉、球孢枝孢和黄曲霉的抑菌活性影响较小。
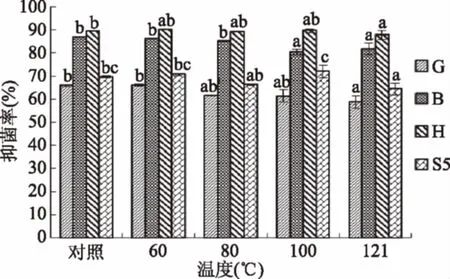
图6 热处理对乳酸菌DT2-4CFS抑菌活性的影响Fig.6 Influence of heat treatment on the effect ofDT2-4 CFS to indicator bacteria
图7为采用胰蛋白酶、胃蛋白酶和蛋白酶K酶解菌株2-4后测得的抑菌率。经过胰蛋白酶、胃蛋白酶和蛋白酶K酶解后,植物乳杆菌发酵液对四种指示菌的抑菌活性有一定的提高,可能是经过蛋白酶酶解后形成了新的具有抑菌活性的小分子的多肽或蛋白质[32]。除胰蛋白酶对黄曲霉的抑制作用无显著性差异外,其他几种酶对各种霉菌的抑制作用均有显著性差异。

表3 株乳酸菌CFS中有机酸和苯乳酸含量Table 3 Organic acid and phenyllactic acid contents of strain DT2-4 CFS
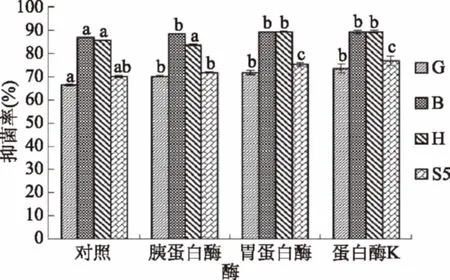
图7 酶处理对菌株CFS抑菌活性的影响Fig.7 Effects of proteases treatmenton the anti-bacterial activity of DT2-4 CFS
由图8可知,MRS发酵液经过过氧化氢处理后抑菌活性变化不显著,说明过氧化氢不是主要抑菌物质。
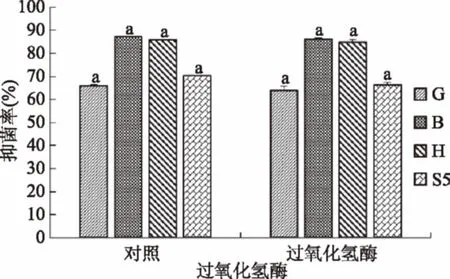
图8 排除过氧化氢后的抑菌效果Fig.8 Inhibitory effects after eliminating hydrogen peroxide
通过抑菌性质的研究发现有机酸是该植物乳杆菌抑菌作用的主导因素,李院[33]从市售酱菜中筛选得到三株对酱菜中分离的青霉菌有抑制作用的乳酸菌,pH调节对抑菌活性影响较大,不同蛋白酶处理乳酸菌发酵浓缩液的抑菌活性会有不同影响,但是三种加热处理并不改变抑菌效果。石金鑫等[10]筛选得到的菌株PC3和SC3对扩展青霉和黑曲霉均有较强的拮抗作用,对青霉和黑曲霉抑制活性物质主要为酸性物质。马妙莲[34]筛选分离得到六株对指示霉菌有抑菌作用的乳酸菌,其抑菌作用的主要成分初步确定为有机酸混合物。
图9是苯基乳酸的标准样品色谱图,其峰值的保留时间为22.907 min。图10是菌株DT2-4发酵液色谱图,表3是利用高效液相色谱法测定菌株DT2-4 中苯基乳酸、乳酸、乙酸、柠檬酸、苹果酸结果。由表3可知,菌株DT2-4产苯基乳酸的能力较强。产生其他酸的能力一般。Valerio等[35]对在发酵食品中作为发酵剂或非发酵剂的几乎所有代表乳酸菌进行了研究,根据在MRS培养基中的苯乳酸和羟基苯乳酸的产生情况将乳酸菌分为3个类群:第一大类:既产生苯乳酸又产生羟基苯乳酸的乳酸菌,苯乳酸浓度范围为26. 56~76. 36 mg/L、羟基苯乳酸的浓度范围为12. 74~52. 78 mg/L;第二大类:只产生苯乳酸的乳酸菌,浓度为28. 22~94. 62 mg/L;第三大类:苯乳酸和羟基苯乳酸均不产生的乳酸菌,苯乳酸≤16. 6 mg/L、羟基苯乳酸≤3. 64 mg/L。按照此分类方法,菌株DT2-4应属于第2类群,其产量与第2类群中苯基乳酸产量最高的Leuconostocmesenteroidessubsp. mesenteroides ITMY30(94. 62 mg/L)相近。表明该菌株产苯基乳酸的能力比较好。李兴峰[36]等人从泡菜中筛选得到一株高产苯基乳酸的植物乳杆菌,经过发酵条件的优化确定该菌株30 ℃下在MRS培养基中培养72 h后苯乳酸的含量可达91 mg/L。已有相关文献证明苯基乳酸是一种新型的光谱生物防腐剂,对多种致病菌(革兰氏阳性和阴性细菌)以及引起食品腐败的真菌(如青霉和曲霉)都有抑制作用[37-38]。说明苯基乳酸的抑菌作用对该菌株的抑菌活性的贡献较大,使该菌株具有较高的抑菌能力。

图9 苯基乳酸标品色谱图Fig.9 The chromatograms of phenyllactic acid
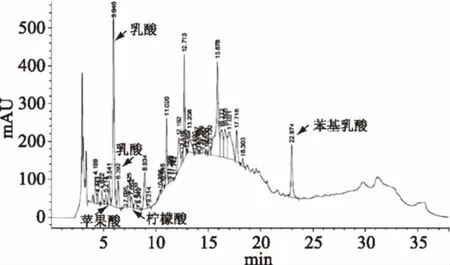
图10 菌株DT2-4 CFS中有机酸测定色谱图Fig.10 The determination of organic acidsin the chromatograms of DT2-4 CFS
2.4具有抑菌活性的乳酸菌在蒸蛋糕中的应用
2.4.1 蒸蛋糕全质构分析 硬度是蛋糕芯部达到一定形变所需的力,是评价蛋糕质构的主要指标,它与蛋糕品质呈负相关,硬度值越小,蛋糕更加柔韧、绵软,口感更佳。从表4中可以看出,当发酵粉替代率为25%和50%时,其硬度均显著小于空白组,当替代率为75%时,硬度大于空白组,主要因为发酵后面粉的淀粉和蛋白质发生变化,持气能力减弱,导致最后产品收缩与硬度增加。由于低筋粉经过发酵后,淀粉和蛋白质被分解,导致最终蒸蛋糕产品弹性,内聚性,胶着性和咀嚼性下降。这与张思佳等[39]发现发酵酸面团可以降低面包的硬度的研究结果相一致。
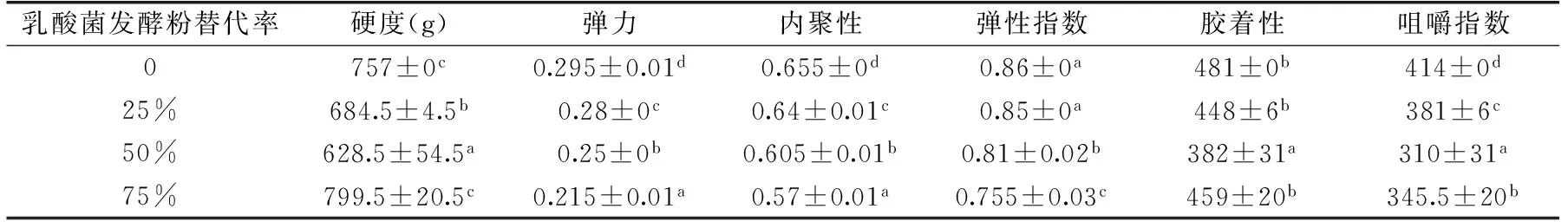
表4 不同发酵粉替代率对蒸蛋糕质构的影响Table 4 Effect of fermented cake flour substitution at various levels on texture parameters of steamed cakes
注:小写字母不同表示差异显著(p<0.05)。
2.4.2 蒸蛋糕感官分析 从图11可以看出,当替代率为25%和50%时,蒸蛋糕的质地,气味和色泽没有显著性差异,在滋味和整体可接受度有差异。75%替代率的蒸蛋糕与其他实验组存在明显差异。因为乳酸菌发酵,导致蒸蛋糕呈现较为明显的酸味。从整体感官评定可以看出25%和50%的添加量的蒸蛋糕的整体可接受度和空白相近,可以被消费者接受。
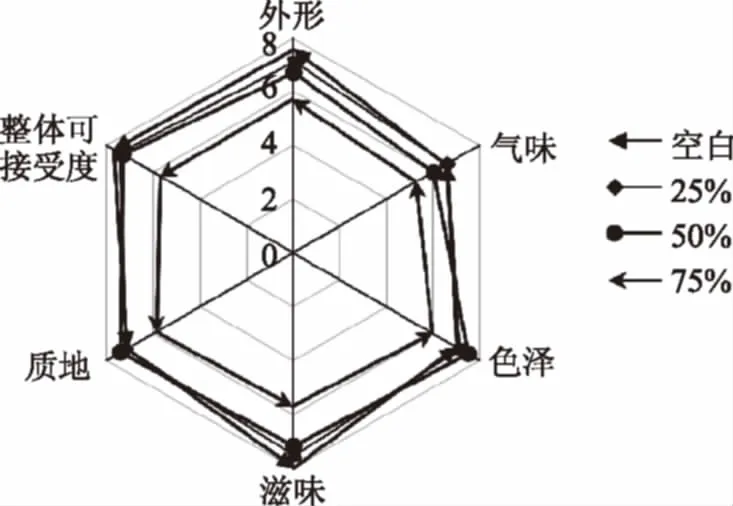
图11 不同替代比例的发酵粉对蒸蛋糕感官评定的影响Fig.11 Effect of fermented cake flour substitutionat various levels on sensory characteristics of steamed cakes
2.4.3 微生物的变化 由表5可得,在室温条件(20±2) ℃,随着贮藏时间延长,所有实验组的菌落总数和真菌数都呈现出上升趋势。经过5 d贮藏后,其菌落总数已经超过国标范围(<1500 cfu/g)。添加发酵粉实验组的菌落总数均小于空白组,且随着发酵粉替代率增加,菌落总数呈现下降趋势。
随着发酵粉替代率的增加,酵母菌和霉菌总数呈下降趋势。5 d贮藏期后,空白组和25%的实验组真菌总数超过国标范围(<100 cfu/g),替代率为50%的实验组在第7 d才超过国标范围,第9 d时所有实验组都超过国标。从蒸蛋糕表观观察可知,经过7 d贮藏期后,空白组表皮出现霉点,而替代率为25%,50%实验组在第9 d出现霉点,替代率为75%的实验组直至第10 d才出现霉点。说明发酵粉替代率的增加,可以延缓蒸蛋糕发霉。综上所述,添加乳酸菌发酵粉可以抑制蒸蛋糕中微生物的生长,从而延长蒸蛋糕保质期。这与Samapundo等[40]的研究相一致,其主要原因是发酵粉中含有大量有机酸从而降低了其pH,延长了蒸蛋糕保质期。
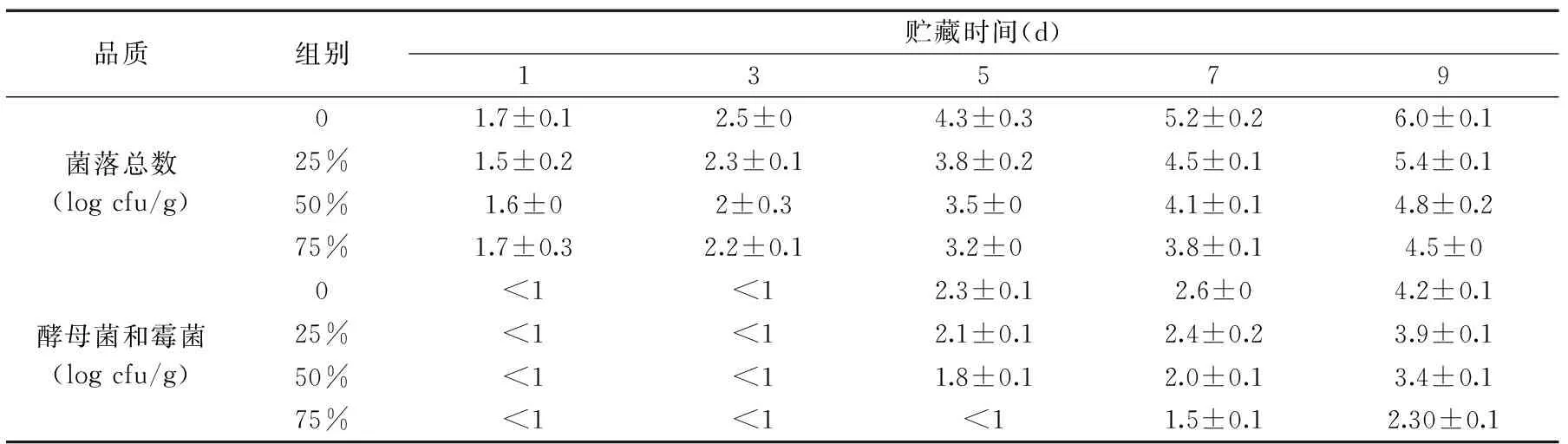
表5 蒸蛋糕在贮藏期间微生物的变化Table 5 Effect of fermented cake flour substitution at various levels on microorganism of steamed cakes
3 结论
从蒸蛋糕中分离得到10种霉菌,7种细菌,且发现蒸蛋糕的腐败以霉变为主,其中Penicillium、Cladosporium和Aspergillus是主要腐败霉菌。以分离得到的主要霉菌为指示菌,经过牛津杯初筛、微量孔板法复筛从传统酵头中分离得到1株具有高抑菌活性的乳酸菌。经16S rRNA基因测序鉴定为植物乳杆菌(Lactobacillusplantarum)。
对乳酸菌抑菌活性有效成分的分析显示,抑菌活性成分对热稳定,对蛋白酶的处理表现出不同的敏感性,对pH变化最为敏感,推测抑菌作用主要是有机酸起主导作用。有机酸分析可知,苯基乳酸的含量为95.91 mg/L,与只产苯基乳酸的乳酸菌类群中产苯乳酸最高产量94.62 mg/L相近。
TPA结果表明,当替代率为25%和50%时,可以显著降低蒸蛋糕硬度和咀嚼性。微生物研究结果表明,随着乳酸菌发酵粉替代率增加,其抑菌活性增加。综合感官评分结果显示,当乳酸菌发酵粉的替代率为50%时,蒸蛋糕品质和空白接近,可以被消费者接受。将乳酸菌发酵粉应用于蒸蛋糕,不仅可以延长蒸蛋糕的保质期,而且提高了蒸蛋糕的质构,具有潜在的市场前景。
[1]刘若诗,万晶晶,黄卫宁,等. 冻干酸面团发酵剂对发酵面团及面包香气的影响[J]. 食品科学,2011(7):11-15.
[2]张庆,钟京,王凤,等. 植物乳杆菌燕麦酸面团发酵面包风味化合物的特征[J]. 北京工商大学学报:自然科学版,2011(4):12-18.
[3]钟京,王凤,刘娜,等. 乳酸菌发酵麸皮酸面团对高纤维面包面团流变发酵学及烘焙特性的影响[J]. 食品工业科技,2013(9):49-54.
[4]Samapundo S,Devlieghere F,Vroman A,et al. Antifungal properties of fermentates and their potential to replace sorbate and propionate in pound cake[J]. International Journal of Food Microbiology,2016,237:157.
[5]Baek E,Kim H,Choi H,et al. Antifungal activity of Leuconostoc citreum,and Weissella confusa,in rice cakes[J]. Journal of Microbiology,2012,50(5):842-849.
[6]Presser K,Ratkowsky D,Ross T. Modelling the growth rate of escherichia coli as a function of ph and lactic acid concentration[J]. Applied and Environmental Microbiology,1997,63(6):2355-2360.
[7]蒋志国,杜琪珍.乳酸菌素研究进展[J].中国酿造,2008,1(18):1-3.
[8]Fernández M F,Boris S,Barbés C. Probiotic properties of human lactobacilli strains to be used in the gastrointestinal tract[J]. Journal of Applied Microbiology,2003,94(3):449-455.
[9]王善辉.乌拉特半荒漠草原牧区绵山羊乳及乳制品中乳酸菌生物学特性的研究[D].呼和浩特:内蒙古农业大学硕士论文,2004.
[10]霍雨霞,韩文凤,吕银德,等. 复配胶体对蒸蛋糕品质的影响[J]. 食品研究与开发,2016,37(5):29-31.
[11]Delavenne E,Ismail R,Pawtowski A,et al. Assessment of lactobacilli strains as yogurt bioprotective cultures[J]. Food Control,2013,30(1):206-213.
[12]吴思泗,李红光,姚争鸣,等. 蒸蛋糕脱氧保鲜实验[J]. 食品科学,1987,11∶32-34.
[13]王宏兹,王凤,黄卫宁,等. 植物乳杆菌发酵紫薯粉对酸面团面包的抗氧化特性及品质影响[J]. 食品科学,2012(13):40-44.
[14]Rinaldi M,Maria P,Augusta C,et al. Sourdough fermentation and chestnut flour in gluten-free bread:A shelf-life evaluation[J]. Food Chemistry,2017,224:144-152.
[15]方靖,陈中,林伟锋,等. 乳酸菌发酵剂对直接发酵法生产面包贮藏特性的影响[J]. 食品与发酵工业,2014(5):101-105.
[16]Ryan L A,Zannini E,Dal B F,et al. Lactobacillus amylovorus DSM 19280 as a novel food-grade antifungal agent for bakery products[J]. International Journal of Food Microbiology,2011,146(3):276-283.
[17]豆康宁,王飞,程谦伟. 对面包防腐剂防腐效果的研究[J]. 食品工业,2014,04:57-58.
[18]程晓燕. 酸面团乳酸菌优势菌群及发酵馒头品质与风味特性研究[D].无锡:江南大学,2015.
[19]孙银凤,徐岩,黄卫宁,等. 不同发酵基质的酸面团对酵母面团体系面包烘焙及老化特性的影响[J]. 食品科学,2015,13:37-42.
[20]苏晓琴,张可欣,黄卫宁,等. 高γ-氨基丁酸绿豆酸面团面包营养与烘焙特性[J]. 食品工业科技,2016(13):340-345.
[21]Gerez C L,Torino M L,Rollánet G,et al. Prevention of bread mould spoilage by using lactic acid bacteria with antifungal properties[J].Food Control,2009,20(2):144-148.
[22]唐雨蕊,倪学勤,曾东. 乳酸杆菌对黄曲霉生长抑制的研究[J]. 中国饲料,2008(5):42-45.
[23]Magnusson J,Schnurer J. Lactobacillus coryniformis subsp. Coryniformis strain Si3 produces a Broad-Spectrum proteinaceous antifungal compound[J]. Applied and Environmental Microbiology,2001,67(1):1-5.
[24]Moreno C,Romero J,Espejo R T.Polymorphism in repeated 16S rRNA genes is a common property of type strains and environmental isolates of the genus Vibrio[J]. Microbiology,2002,148(4):1233-1239.
[25]李兴峰,江波,潘蓓蕾,等. 产苯乳酸的乳酸菌分离筛选及菌种鉴定[J]. 食品与发酵工业,2007(2):1-4.
[26]杨新宇. 冻干乳酸菌酸面团发酵剂的制备及在馒头中的应用研究[D].无锡:江南大学,2013.
[27]豆康宁,王飞,程谦伟. 对面包防腐剂防腐效果的研究[J]. 食品工业,2014,04:57-58.
[28]张薇,程晓燕,黄卫宁,等. 含天然酵母粉发酵面包的营养与老化特性及风味化合物特征[J]. 食品科学,2014,35(23):33-38.
[29]GB/T7099-2003,糕点、面包卫生标准[S].
[30]GB/T47892-2010,食品卫生微生物学检验霉菌和酵母计数[S].
[31]Legan J.D..Mould spoilage of bread:the problem and some solutions[J]. International Biodeterioration& Biodegradation,1993,32(1):33-53.
[32]李院. 酱菜中抑霉菌的乳酸菌分离、鉴定及抑菌活性物质分析[D].杨凌:西北农林科技大学,2015.
[33]李院,魏新元,王静,等. 抑制青霉菌乳酸菌的分离、鉴定及抑菌物质分析[J]. 食品科学,2015(21):150-155.
[34]马妙莲. 抑霉菌乳酸菌的分离和鉴定及抑菌物质的分析[D].合肥:安徽农业大学,2011.
[35]Valerio F,Lavermicocca P,Pascale M,et al. Production of phenyllactic acid by lactic acid bacteria:an approach to the selection of strains contributing to food quality and preservation[J]. FEMS Microbiology Letters,2004,233(2):289-295.
[36]李兴峰,江波,潘蓓蕾,等. 产苯乳酸的乳酸菌分离筛选及菌种鉴定[J]. 食品与发酵工业,2007(2):1-4.
[37]Ohhira I,Kuwaki S,Morita H,et al. Identification of 3-phenyllactic acid as a possible antibacterial substance produced by enterococcus faecalis th10[J]. Biocontrol Science,2004,9(3):77-81.
[38]Lee J Y,Hwang K Y,KIM,et al. Characteristics of antimicrobial organic acids produced by lactobacillus pentosus k34 isolated from small intestines of korean native chicken[J]. Sanoeb Misaengmul Haghoeji,2002,7(2):23-40.
[39]张思佳,张薇,苏晓琴,等. 乳杆菌发酵对荞麦面包抗氧化及烘焙特性影响[J]. 食品工业科技,2015,19:49-53.
[40]Samapundo S,Devlieghere F,Vroman A,et al. Antifungal properties of fermentates and their potential to replace sorbate and propionate in pound cake[J]. International Journal of Food Microbiology,2016,237:157-163.
Screeningofantifungallacticacidbacteriafromtraditionalsourdoughanditsapplicationinthesteamedcake
HEYan-xia1,WANGFeng2,YANGWen-dan1,CHENJia-fang1,XUYan3,HUANGWei-ning1,AkihiroOgawa4
(1.State Key of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Magibake International Co.,Ltd.,Wuxi 214131,China;3.Key Laboratory of Industrial Biotechnology of Ministry of Education,School ofBiotechnology,Jiangnan University,Wuxi 214122,China;4.Mitsubishi-Kagaku Foods Corporation,Tokyo 100-8251,Japan)
To isolate and identify lactic acid bacteria which could inhibit mainly molds from steamed cake. The antifungal activity was determined by oxford cup method firstly and then 96-microwells plates method,and analysis of the active components of bacteriostatic activity of lactic acid bacteria,and the molecular biology identification of lactic acid bacteria. The sourdough fermented flour was used to substitute for the cake flour(0,25%,50%,75%)and studied the influence of it on the quality,structure,the senses and the shelf life of steamed cake. Results indicated that the culture supernatant of lactic acid bacteria treatmenting with different proteases had different effects on the antibacterial activity. It was very sensitive to pH,while three heat treatments did not hardly affect the inhibitory efficiency. Organic acid analysis showed that the content of phenyl lactic acid was 95.91 mg/L. The lactic acid bacteria was identified asL.plantarum. Adding sourdough fermented flour can significantly reduce the hardness and chewiness of steamed cake when replacement rate was 25% and 50%. With the increasing of replacement rate,bacteriostatic activity increased. Sensory results showed that when the replacement rate was 50%,it had no significant changes,which can be accepted by consumers.
steamed cake;lactic acid bacteria;antibacterial activity;traditional sourdough
TS201.3
A
1002-0306(2017)19-0088-08
10.13386/j.issn1002-0306.2017.19.017
2017-03-22
何艳霞(1991-),女,硕士研究生,研究方向:烘焙科学、加工配料与食品添加剂,E-mail:yanxiachrissa@163.com。
