紫娟茶提取物对血管紧张素转换酶、α-淀粉酶和胰脂肪酶的体外抑制作用
2017-10-19黎明
,,,,黎明,
(华东理工大学,生物反应器工程国家重点实验室,发酵工业分离提取技术研发中心,上海 200237)
紫娟茶提取物对血管紧张素转换酶、α-淀粉酶和胰脂肪酶的体外抑制作用
赵瑜,周家春,张靖伟,张宛昕,赵黎明*,蒋丽华*
(华东理工大学,生物反应器工程国家重点实验室,发酵工业分离提取技术研发中心,上海 200237)
目的:探究紫娟茶提取物是否具有一定潜在的降血压、降血糖和减肥功效,并分析紫娟茶提取物中茶多酚和花色苷在其中起到的作用。方法:对紫娟茶进行提取,将紫娟茶粗提物(ZTE1)再分离为花色苷的粗提物(ZTE2)与茶多酚的粗提物(ZTE3),将ZTE2进一步纯化分离出两种纯化花色苷——飞燕草-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷(delphinidin-3-O-β-D-(6-(E)-p-coumaroyl)galactopyranoside,AN3)和矢车菊-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷(cyanidin-3-O-β-D-(6-(E)-p-coumaroyl)galactopyranoside,AN4);分别评价ZTE1、ZTE2、ZTE3、AN3和AN4对血管紧张素转换酶(Angiotensin converting enzyme,ACE)、α-淀粉酶和胰脂肪酶的体外抑制作用,并与表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)进行比较,评价了AN3和AN4对三种酶的抑制类型。结果:ZTE1、ZTE2、ZTE3、AN3和AN4对三种酶均有一定的抑制作用,粗提取物中,ZTE3对三种酶、ZTE1对α-淀粉酶和胰脂肪酶、ZTE2对α-淀粉酶的抑制超过或相当于EGCG的效果,其中ZTE3对ACE、ZTE2对α-淀粉酶、ZTE1对胰脂肪酶的抑制效果最强;纯化花色苷中,AN3对α-淀粉酶的抑制效果较好,与EGCG无显著性差异,AN3对三种酶的抑制效果均优于AN4;此外,AN3和AN4对三种酶均为非竞争性抑制,抑制常数Ki分别为:0.33、0.37 mmol/L;0.39、0.41 mg/mL;0.22、0.78 mg/mL。结论:紫娟茶对高血压、高血糖和肥胖症有一定的潜在功效。
紫娟茶提取物,总酚,花色苷,茶多酚,血管紧张素转换酶,α-淀粉酶,胰脂肪酶
代谢综合症,包括高血压、高血糖、高血脂和肥胖症等,已经在世界各地迅速蔓延,严重威胁了人类的健康。血管紧张素转换酶(Angiotensin converting enzyme,ACE)是参与维持血管张力过程中的重要酶[1],抑制这种酶被认为是一个控制高血压患者血压的有效治疗方法,而ACE抑制模型被证明是一个有效筛选抗高血压药物和功能食品的方法。α-淀粉酶抑制剂可以减缓高血糖或糖尿病患者碳水化合物的消化,导致葡萄糖吸收速度的降低,从而减弱餐后血糖的上升[2]。脂肪酶对脂肪在生物体内的转移发挥着重要的作用,抑制胰脂肪酶在肥胖治疗中一直被作为靶标使用[3]。
许多研究已经证明,一些天然产物对高血压、高血糖和肥胖具有预防或治疗的效果,茶就是其中之一。紫娟茶,山茶科(Theaceae)山茶属(Camellia)茶组植物(Camelliasinensis(L.)O. Kuntze)茶种(Camelliasinensis)中的普洱茶变种(C.sinensisvar.assamica),源于云南大叶群体国家级茶树良种——勐海大叶茶中单株培育而成[4]。紫娟茶富含多酚成分,特别是茶多酚和花色苷,已被学者们所关注。在前期研究中,本实验室利用高分辨率飞行时间质谱(highresolution time of flight mass spectrometry HRTOF-MS)和核磁共振(nuclear magnetic resonance,NMR)分离鉴定出紫娟茶中的四种花色苷,分别是飞燕草-3-O-β-半乳糖苷(delphinidin-3-O-β-D-galactoside,AN1)、矢车菊-3-O-β-半乳糖苷(cyanidin-3-O-β-D-galactoside,AN2)、飞燕草-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷(delphinidin-3-O-β-D-(6-(E)-p-coumaroyl)galactopyranoside,AN3)和矢车菊-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷(cyanidin-3-O-β-D-(6-(E)-p-coumaroyl)galactopyranoside,AN4),后两种花色苷占到了紫娟茶花色苷总量的75%,并且仅在三种茶树品种中发现,被证实具有良好的清除自由基能力,并且优于合成的抗氧化剂2,6-二叔丁基-4-甲基苯酚(2,6-Di-tert-butyl-4-methylphenol,BHT)[5]。
虽然我们对紫娟茶进行了部分研究,但对它的生理活性,特别是降血压、降血糖和抗肥胖特性等都还不清楚。本研究提取并量化了紫娟茶中的总酚、花色苷和茶多酚,探究了紫娟茶提取物对ACE、α-淀粉酶和胰脂肪酶的抑制作用,通过比较紫娟茶的粗提取物、纯化花色苷AN3和AN4、表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)对三种酶的抑制作用,探寻紫娟茶中对降血压、降血糖和抗肥胖起重要作用的关键组分。并且针对AN3和AN4对三种酶的抑制类型、抑制常数等也进行了实验探讨。
1 材料与方法
1.1材料与仪器
紫娟茶叶 市售;Amberlite XAD-7HP大孔吸附树脂 美国罗门哈斯公司;Silica gel 60 C18树脂(45~63 μm) 德国默克公司;三氟乙酸(Trifluoroacetic acid,TFA) 阿拉丁化学试剂有限公司;没食子酸(Gallic acid,GA)、(+)-儿茶素(Catechin,C)、(-)-儿茶素没食子酸酯(Catechin gallate,CG)、(-)-表儿茶素(Epicatechin,EC)、(-)-表儿茶素没食子酸酯(Epicatechin gallate,ECG)、(-)-表没食子儿茶素(Epigallocatechin,EGC)、(-)-表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)、(-)-没食子儿茶素(Gallocatechin,GC)、(-)-没食子儿茶素没食子酸酯(Gallocatechin gallate,GCG)、矢车菊-3-O-β-D-葡萄糖苷、血管紧张素转换酶-来源于兔肺(ACE)(EC 3.4.15.1)、马尿酰-组氨酰-亮氨酸水合物(N-Benzoyl-Gly-His-Leu,HHL)、猪胰腺α-淀粉酶(EC 3.2.1.1) Sigma-Aldrich(中国)贸易有限公司;甲醇、乙醚、氯仿、乙酸乙酯、乙腈(HPLC级)、盐酸(HCl)、三羟甲基氨基甲烷(Tris(hydroxymethyl)methyl aminomethane,Tris)、氯化钠(NaCl)、可溶性淀粉、麦芽糖、月桂酸4-硝基苯酯(4-Nitrophenyl laurate,p-PNL)、醋酸钠、猪胰腺脂肪酶(EC 3.1.1.3)、聚乙二醇辛基苯基醚(曲拉通X-100) 国药集团化学试剂有限公司;3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS) 上海科丰实业有限公司;氢氧化钠(NaOH)、酒石酸钾钠、苯酚、无水亚硫酸钠(Na2SO3)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4) 上海凌峰化学试剂有限公司;其中化学试剂均为国产分析纯或色谱纯。
CP214C电子天平 奥豪斯仪器(上海)有限公司;循环水式多用真空泵 上海豫康科教仪器设备有限公司;BT-100SD定时恒流泵 上海沪西仪器有限公司;旋转蒸发仪 上海申生科技有限公司;自流柱(Φ25 mm×600 mm) 上海华美实验仪器厂;真空冷冻干燥机 北京四环科学仪器厂;磁力搅拌机 上海精科实业有限公司;移液枪 Dragon Lab;超声波清洗器 昆山禾创超声仪器有限公司;岛津10A高效液相色谱仪 岛津有限公司;FE20精密pH计 梅特勒托利多仪器(上海)有限公司;HHS-21-4孔型电热恒温水浴锅 上海医疗机械五厂;高速离心机 Thermo Fisher;UV-2000紫外可见分光光度计 尤尼克(上海)仪器有限公司。
1.2实验方法
1.2.1 紫娟茶的提取 紫娟茶提取物(Zijuan tea extract,ZTE)的制备参照实验室已总结的方法[5]:利用含0.1%三氟乙酸(TFA)的85%甲醇溶液提取干燥的紫娟茶叶,然后用乙醚和氯仿分别萃取。将浓缩水溶液缓慢滴入已处理好的Amberlite XAD-7HP层析柱中,先用去离子水洗涤,再用含0.1%TFA的100%甲醇溶液洗脱,直至无有色物质洗脱下来为止,收集甲醇洗脱液,旋转蒸发浓缩,冷冻干燥,得到紫娟茶粗提物(ZTE1)。随后,将ZTE1粉末用乙酸乙酯萃取,得到不溶物——花色苷的粗提物(ZTE2)和可溶物——茶多酚的粗提物(ZTE3),分别旋转蒸发,冷冻干燥待用。
1.2.2 花色苷的分离和纯化 将ZTE2用5%甲醇溶液溶解后缓慢滴入经过预处理的Silica gel 60 C18柱中,依次用0%、10%、20%、30%、40%和50%的甲醇溶液(含0.1% TFA,分别使用1 L洗脱液)进行梯度洗脱。得到四段红色组分,分别定义为AN1、AN2、AN3和AN4,分段回收,旋转蒸发,冷冻干燥。
1.2.3 总酚含量的测定 分别配制1 mg/mL的ZTE1、ZTE2和ZTE3溶液测定其总酚含量,总酚的含量利用Folin-Ciocalteu法进行测定[6],结果以没食子酸当量表示。
1.2.4 茶多酚的定性和定量测定 配制不同浓度的GA、C、CG、EC、ECG、EGC、EGCG、GC和GCG的混合标准品溶液,制备所需浓度梯度后,进行HPLC分析,以峰面积对其相应浓度进行线性回归计算。定性和定量测定1 mg/mL的ZTE1、ZTE2和ZTE3溶液中的茶多酚。
1.2.5 花色苷的含量测定 配制不同浓度的矢车菊-3-O-β-D-葡萄糖苷标准品溶液,进行HPLC分析,以峰面积对其相应浓度进行线性回归计算,结果以矢车菊-3-O-β-D-葡萄糖苷当量表示。
1.2.6 HPLC-DAD分析 所有样品,包括ZTE1、ZTE2、ZTE3、AN1、AN2、AN3、AN4和矢车菊-3-O-β-D-葡萄糖苷、GA、GC、EGC、C、EC、EGCG、GCG、ECG、CG的标准品,均使用如下检测条件:
色谱柱:Inertsil/Wondasil ODS色谱(250 mm×4.6 mm;i.d.:5 μm);
检测波长:280 nm和520 nm;柱温:28 ℃;进样量:10 μL;流速:0.8 mL/min;
流动相条件:流动相A:10%乙腈溶液(含0.1% TFA);
流动相B:50%乙腈溶液(含0.1% TFA);
梯度洗脱:0~45 min,B相0~75%;45~50 min,B相75%~75%。
每个样品进样前需经过0.22 μm微孔滤膜去除杂质。
1.2.7 ACE、α-淀粉酶和胰脂肪酶的抑制实验 紫娟茶提取物ZTE1、ZTE2和ZTE3,纯化花色苷AN3和AN4,以及EGCG标准品均被作为三种酶的抑制剂样品进行实验。AN3和AN4作为花色苷的典型代表,EGCG作为儿茶素的代表,分别进行测试比较。
1.2.7.1 ACE的抑制实验 ACE活性的测定参照Actis-Goretta等人的方法[7]并稍加改动,以马尿酰-组氨酰-亮氨酸水合物(HHL)作为底物,与ACE反应后测定其生成的马尿酸含量,生成的马尿酸通过比对马尿酸标准品的HPLC谱图来定性和定量。
色谱条件:色谱柱:WondaSil C18(250 mm×4.6 mm;i.d.:5 μm);检测波长:228 nm;柱温:30 ℃;进样量:20 μL;流速:1 mL/min;流动相:超纯水(含0.1% TFA)和100%乙腈;洗脱条件:75%/25%(v/v)等度洗脱。
每个样品进样前经过0.22 μm微孔滤膜去除杂质。
取20 μL ACE溶液(0.1 U/mL),加入100 μL样品,37 ℃水浴30 min,加入100 μL已预热的HHL溶液(5.0 mmol/L),再在37 ℃水浴中反应60 min,加入300 μL 1 mol/L HCl终止反应,过0.22 μm滤膜,进HPLC分析马尿酸的生成量。以不加样品作为对照组,不加样品和ACE作为空白组。因为紫娟茶提取物具有颜色,对实验结果可能有影响,因而以加样品不加ACE作为实验空白组以除去抑制剂本身颜色可能引起的影响。

表1 ACE抑制率体外测定方法Table 1 Determination of the inhibition rate of ACE in vitro
样品对ACE的抑制率按如下公式计算:
式(1)
式中:A表示实验组的峰面积,B表示实验空白组的峰面积,C表示对照组的峰面积,D表示空白组的峰面积。
计算出各样品的抑制率后,使用半数抑制浓度(IC50)计算软件——药物抑制浓度计算软件(LOGIT法,版本1.0.0)计算各样品对ACE的半数抑制浓度。
1.2.7.2 紫娟茶提取物和EGCG对α-淀粉酶的抑制作用 抑制α-淀粉酶活性的检测参照Marcia等人的方法[8]并稍加改动。取0.5 mLα-淀粉酶溶液,加入0.5 mL样品,25 ℃水浴10 min,加入0.5 mL已预热10 min的1%淀粉溶液,再在25 ℃水浴中反应10 min,加入1 mL DNS显色剂,沸水浴10 min,迅速流水冷却,加入15 mL去离子水稀释,混匀后以缓冲液为参比液,使用紫外-可见分光光度计在540 nm下测定其吸光度,制作麦芽糖标准曲线以计算麦芽糖的生成量。以不加样品作为对照组,不加样品和α-淀粉酶作为空白组,加样品不加α-淀粉酶作为实验空白组。

表2 α-淀粉酶抑制率体外测定方法Table 2 Determination of the inhibitionrate of α-amylase in vitro
样品对α-淀粉酶的抑制率及半数抑制浓度(IC50)的计算同1.2.7.1。
1.2.7.3 紫娟茶提取物和EGCG对胰脂肪酶的抑制作用 抑制胰脂肪酶活性的检测参照McDougall等人的方法[9]并稍加改动。取0.5 mL 胰脂肪酶溶液,加入0.5 mL待测样品和3 mL 0.1 mol/L pH8.2的Tris-HCl缓冲液,37 ℃水浴10 min后,加入1.5 mL已预热10 min的p-PNL溶液,继续在37 ℃水浴中反应2 h,4 ℃、16000 r/min离心2.5 min后取上清,以缓冲液为参比液,使用紫外-可见分光光度计在400 nm下测定其吸光度。以不加样品作为对照组,不加样品和胰脂肪酶作为空白组,加样品不加胰脂肪酶作为实验空白组。

表3 胰脂肪酶抑制率体外测定方法Table 3 Determination of the inhibition rate ofpancreatic lipase in vitro
样品对胰脂肪酶的抑制率及半数抑制浓度(IC50)的计算同1.2.7.1。
1.2.8 血管紧张素转换酶(ACE)、α-淀粉酶和胰脂肪酶的酶动力学实验
1.2.8.1 紫娟茶中花色苷单体AN3和AN4对ACE作用的动力学研究 分别配制3.0、4.0、5.0、6.0、7.0 mmol/L的HHL底物溶液,0、0.4、0.6 mg/mL的AN3和0、0.5、1.0 mg/mL的AN4样品溶液,分别在不同底物浓度和不同样品浓度的条件下按1.2.7.1的方法仅反应10 min即终止,通过HPLC谱图测定ACE的反应速率,采用双倒数作图法(Lineweawer-Burk),以底物浓度的倒数为横坐标,相应的反应速率的倒数为纵坐标,绘制动力学曲线。AN3和AN4对ACE的抑制类型可根据图来判断:直线相交于X轴为非竞争性抑制,直线相交于Y轴为竞争性抑制,直线相交在象限内为混合型抑制,直线平行不相交的则为反竞争性抑制。所得直线的纵坐标截距为1/Vmax,横坐标截距即为-1/Km。
1.2.8.2 紫娟茶中花色苷单体AN3和AN4对α-淀粉酶作用的动力学研究 分别配制0.5%、0.75%、1.0%、1.25%和1.5%的淀粉溶液,0、0.8、1.6 mg/mL的AN3和0、1.2、2.0 mg/mL的AN4样品溶液作为抑制剂,分别在不同底物浓度和不同抑制剂浓度的条件下按1.2.7.2的方法反应5 min即终止,测定α-淀粉酶的反应速率,采用双倒数作图法(Lineweawer-Burk),以底物浓度的倒数为横坐标,相应的反应速率的倒数为纵坐标,绘制动力学曲线。同1.2.8.1,根据图判断AN3和AN4对α-淀粉酶的抑制类型。
1.2.8.3 紫娟茶中花色苷单体AN3和AN4对胰脂肪酶作用的动力学研究 分别配制0.06%、0.07%、0.08%、0.09%、0.10%的p-PNL底物溶液,0、0.4、0.6 mg/mL的AN3和0、0.5、1.0 mg/mL的AN4样品溶液作为抑制剂,分别在不同底物浓度和不同抑制剂浓度的条件下按1.2.7.3的方法反应30 min即终止,测定胰脂肪酶的反应速率,采用双倒数作图法(Lineweawer-Burk),以底物浓度的倒数为横坐标,相应的反应速率的倒数为纵坐标,绘制动力学曲线。根据图判断AN3和AN4对胰脂肪酶的抑制类型。
1.3统计学处理
采用SigmaPlot 10.0作图,SPSS 19.0软件进行统计学分析,实验数据用平均值±标准差表示。多组间比较采用单因素方差分析。进一步进行组间两两比较,若方差齐时,采用LSD检验;若方差不齐,采用Tamhane’s检验,差异显著水平为p<0.05。
2 结果与分析
2.1紫娟茶提取物中的总酚、茶多酚和花色苷
300 g紫娟茶经过提取后得到31.2 g ZTE1,20 g ZTE1经乙酸乙酯萃取后得到4.3 g ZTE2和14.6 g ZTE3,分别占21.5%和73%。1 mg/mL的ZTE1、ZTE2和ZTE3中总酚含量分别为(1.65±0.27)、(0.74±0.21)和(0.98±0.29) mg/mg(以没食子酸为当量)。图1为GA、C、CG、EC、ECG、EGC、EGCG、GC和GCG的混标HPLC图谱,比对该混标图谱及实验室前期对花色苷的鉴定,得到图2所示的三种提取物在280 nm和520 nm下的HPLC谱图。从280 nm的谱图中可见,ZTE1中除了几种常见的茶多酚外,还有一些其他尚未鉴定的酚类物质。

图1 混标高效液相色谱图(280 nm)Fig.1 The HPLC profile determined at 280 nm

图2 紫娟茶提取物ZTE1,ZTE2,ZTE3高效液相色谱图(280 nm和520 nm)Fig.2 The HPLC profile of ZTE1,ZTE2,and ZTE3(determined at 280 nm and 520 nm)
几种主要的茶多酚的标准曲线方程如表4所示,所有曲线在一定的范围内均呈现了良好的线性关系。根据标准曲线得到三种紫娟茶提取物中各个茶多酚的含量如表5所示。ZTE3中的茶多酚总量最多,是ZTE2的7倍多,可知紫娟茶中的茶多酚经过乙酸乙酯的洗涤大多被分配到了ZTE3中。酯型儿茶素(EGCG、ECG、GCG和CG)的总量在三种提取物的茶多酚中各占69%、28%和83%。最重要的茶多酚——EGCG,在ZTE3中的含量是ZTE2中的约20倍,在三种提取物的茶多酚中分别占到了46%、18%和49%;ECG在ZTE3中的含量是ZTE2中的100倍以上;而GCG和CG在ZTE2和ZTE3中差异不大。非酯型儿茶素(C、EC、GC和EGC)的总量在ZTE2((33.15±1.23) mg/g)和ZTE3((57.47±2.56) mg/g)中也有显著性差异。

表4 茶多酚的标准曲线方程Table 4 The calibration curve equations of catechins
注:*:x单位μg;y单位×105。
本实验室前期工作已鉴定出ZTE2分离纯化后得到的4种红色组分——AN1、AN2、AN3和AN4分别为飞燕草-3-O-β-半乳糖苷、矢车菊-3-O-β-半乳糖苷、飞燕草-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷和矢车菊-3-O-β-D-(6-(E)-对香豆酸)吡喃半乳糖苷[5],ZTE1和ZTE2中花色苷总量分别为(5.11±0.13)、(17.12±0.41) mg/g(以矢车菊-3-O-葡萄糖苷为当量),ZTE3中未检出花色苷。可见,紫娟茶中的花色苷经过乙酸乙酯的洗涤已基本完全转移到ZTE2中,这也证实了Määttä-Riihinen等人的研究:乙酸乙酯可以有效地分离花色苷和大多数的儿茶素[10]。
分别观察通过1.2.1~1.2.2制备得到的AN3和AN4在280、520 nm的HPLC谱图(图3和图4),二者分别在两种波长下的峰型几乎重合,可得知样品中无其他酚类物质,证明该制备方法可以很好的将AN3和AN4从紫娟茶中分离出来,纯度分别达到96.7%和98.4%。而AN1和AN2在280 nm的HPLC谱图中,除了在与520 nm的HPLC谱图相同的保留时间处出峰外,还有其他杂峰的产生。并且,AN3和AN4占据了紫娟茶中花色苷总量的约75%[5],因而二者被应用于后续实验中。

表5 茶多酚在紫娟茶提取物(ZTE1,ZTE2和ZTE3)中的含量Table 5 The contents of catechins in Zijuan tea extracts(ZTE1,ZTE2,and ZTE3)

图3 紫娟茶中花色苷单体AN3的高效液相色谱图Fig.3 The HPLC profile of AN3

图4 紫娟茶中花色苷单体AN4的高效液相色谱图Fig.4 The HPLC profile of AN4
2.2ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对ACE酶、α-淀粉酶和胰脂肪酶的抑制作用和动力学研究
2.2.1 对ACE酶的抑制作用和动力学研究 ZTE1、ZTE2和ZTE3对ACE的抑制效果如图5所示。三种提取物中,ZTE3对ACE的抑制效果最强,其次是ZTE1,最后是ZTE2。样品在0.025~0.4 mg/mL的浓度范围内对ACE的抑制效果随着浓度的升高而有所增加,在0.4 mg/mL的浓度下,三种提取物对ACE的抑制效果均超过了70%,其中ZTE1和ZTE3甚至超过了90%。

图5 ZTE1、ZTE2和ZTE3对ACE的抑制作用Fig.5 ACE inhibitory activities ofZTE1,ZTE2 and ZTE3
AN3和AN4对ACE的抑制效果如图6所示。由图中可看出,在0.4~1.2 mg/mL的浓度范围内,AN3对ACE的抑制效果明显强于AN4。在1.2 mg/mL的浓度下,AN4对ACE的抑制率略高于50%,而AN3对ACE的抑制率则超过了80%。

图6 AN3和AN4对ACE的抑制作用Fig.6 ACE inhibitory activities of AN3 and AN4

图7 EGCG对ACE的抑制作用Fig.7 ACE inhibitory activity of EGCG
EGCG对ACE的抑制效果如图7所示。由图可知,在0.02~0.30 mg/mL的浓度范围内,EGCG对ACE的抑制效果随着浓度的升高而增强。EGCG对ACE的抑制效果在浓度为0.02~0.05 mg/mL时有一显著升高,而在0.05~0.20 mg/mL抑制效果趋于在平缓中小幅度增加,而在0.30 mg/mL的浓度下,其对ACE的抑制率已接近90%。Hara等人[11]早在1987年即报道了EGCG对ACE的抑制效果在主要的几种茶多酚中是最强的,所以我们选择EGCG作为阳性对照,将紫娟茶提取物的ACE抑制效果与EGCG相比较。由图6和图7可看出,紫娟茶中的两种花色苷单体AN3和AN4对ACE的抑制效果明显低于EGCG,可知AN3和AN4在紫娟茶的降压效果中并未起到主要的作用。
紫娟茶提取物和纯化花色苷,包括ZTE1、ZTE2、ZTE3、AN3和AN4,以及EGCG对ACE的IC50值如图8所示。提取物中,ZTE3对ACE的抑制效果最强,ZTE1、EGCG均与其没有显著性差异(p>0.05),而ZTE2则逊色于二者(p<0.05)。纯化花色苷单体AN3和AN4对ACE的IC50值明显高于EGCG,尤其是AN4((1.17±0.03) mg/mL),是EGCG((0.04±0.00) mg/mL)的近30倍。提取物ZTE2和单体AN3、AN4对ACE较弱的抑制效果、含大量茶多酚的ZTE3对ACE最强的抑制效果表明,紫娟茶的降血压功效可能由茶多酚引起。
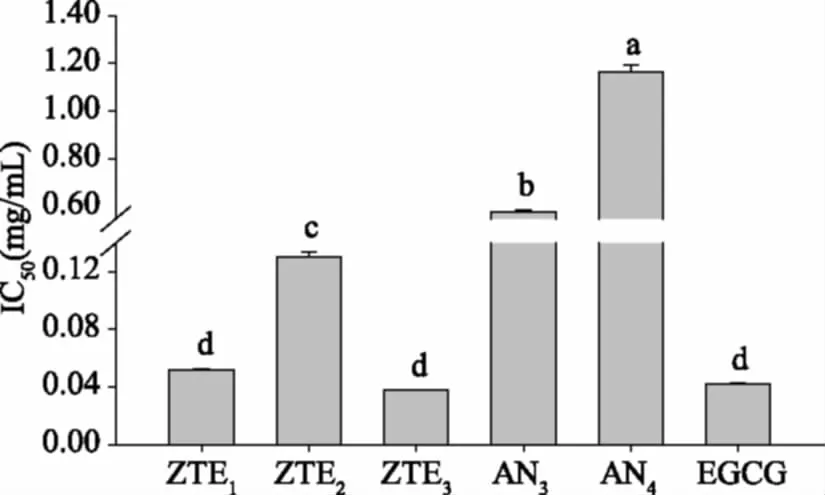
图8 ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对ACE的半数抑制浓度Fig.8 ACE IC50 of ZTE1、ZTE2、ZTE3、AN3、AN4 and EGCG注:标注不同字母表示数据有显著差异(p<0.05),图12、图18同。
根据酶动力学理论,以底物浓度的倒数为横坐标,反应速率的倒数为纵坐标绘制双倒数曲线图(Lineweaver-Burk)。如图9和图10所示,由直线分别相交于X轴负半轴上——即米氏常数Km不变,反应速率随着抑制剂浓度的升高而降低——即表观最大反应速率降低可知,紫娟茶提取物中的花色苷AN3和AN4对ACE的抑制类型为非竞争性抑制,即抑制剂、底物能同时与ACE结合,但此复合物不能进一步分解为产物。根据酶动力学理论,AN3和AN4对ACE的抑制常数Ki分别为0.33、0.37 mmol/L。抑制常数Ki也就是酶与抑制剂复合物的解离常数,其倒数1/Ki反映了抑制剂与酶的亲和力,Ki值越小,其亲和力越大,因此AN3对ACE的亲和力大于AN4可能是AN3的抑制作用强于AN4的原因之一。尽管AN3和AN4的Ki值远大于典型的ACE抑制剂型化学合成降压药物——卡托普利的Ki值(1.4 nmol/L)[12],但作为一种天然产物,其效果仍然值得关注。

图9 AN3对ACE的Lineweaver-Burk双倒数曲线Fig.9 Lineweaver-Burk of AN3 on ACE
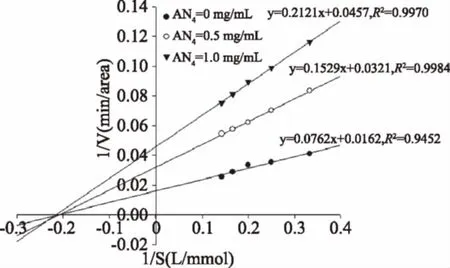
图10 AN4对ACE的Lineweaver-Burk双倒数曲线Fig.10 Lineweaver-Burk of AN4 on ACE
2.2.2 对α-淀粉酶的抑制作用和动力学研究 紫娟茶提取物、纯化花色苷和EGCG对α-淀粉酶的抑制效果如图11所示。所有样品的抑制率都随着浓度的增加而增加。粗提物中,与ZTE1和ZTE3相比,ZTE2展现出明显优于其他样品的抑制效果(p<0.05)。而纯化的花色苷AN3和AN4相比,AN3具有更好的抑制α-淀粉酶的效果。EGCG抑制α-淀粉酶的效果与AN3相当。含有主要花色苷的粗提物组分ZTE2具有最强的抑制α-淀粉酶的效果,且单体花色苷AN3的效果与EGCG相当,可推测紫娟茶的降血糖功效主要由花色苷引起。

图11 ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对α-淀粉酶的抑制作用Fig.11 α-Amylase inhibitory activities ofZTE1,ZTE2,ZTE3,AN3,AN4 and EGCG
如图12所示,ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对α-淀粉酶的IC50值分别为(0.89±0.01)、(0.65±0.01)、(1.18±0.03)、(1.57±0.02)、(1.98±0.01)、(1.54±0.01) mg/mL。Hara等人研究了茶多酚抑制人体唾液α-淀粉酶,其中EGCG的IC50为260 μmol/L(0.12 mg/mL)[13];Matsui等人研究了一些花色苷对人体唾液α-淀粉酶的抑制作用[14]。二者同本实验一样,均使用淀粉作为反应底物。而Tadera等人使用一种合成底物——BPNPG7进行反应,该实验中EGCG和矢车菊素对猪胰腺α-淀粉酶的抑制作用较弱。但随后他们又使用水溶性淀粉作为底物探讨EGCG和矢车菊素对猪胰腺α-淀粉酶的抑制效果,结果显示EGCG和矢车菊素对猪胰腺α-淀粉酶的IC50值分别为400、80 μmol/L(0.18、0023 mg/mL)[15]。由此可见,不同的检测方法中因使用的底物和酶的浓度及用量不同会产生不同的结果。但本实验的结果与Tadera等人证实的花色苷对猪胰腺α-淀粉酶的抑制效果优于茶多酚保持一致。

图12 ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对α-淀粉酶的半数抑制浓度Fig.12 α-Amylase IC50 ofZTE1,ZTE2,ZTE3,AN3,AN4 and EGCG
根据酶动力学理论,以底物浓度的倒数为横坐标,反应速率的倒数为纵坐标绘制双倒数曲线图。如图13和图14所示,紫娟茶提取物中的花色苷AN3和AN4对α-淀粉酶的抑制类型为非竞争性抑制,AN3和AN4对α-淀粉酶的抑制常数Ki分别为0.39、0.41 mg/mL。AN3的抑制常数Ki小于AN4,即AN3对α-淀粉酶的亲和力比AN4大,因此AN3对α-淀粉酶的亲和力大于AN4可能是AN3的抑制作用强于AN4的原因之一。
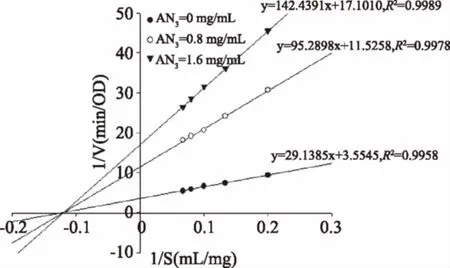
图13 AN3对α-淀粉酶的Lineweaver-Burk双倒数曲线Fig.13 Lineweaver-Burk ofAN3 on α-amylase

图14 AN4对α-淀粉酶的Lineweaver-Burk双倒数曲线Fig.14 Lineweaver-Burk of AN4 on α-amylase
2.2.3 对胰脂肪酶的抑制作用和动力学研究 ZTE1、ZTE2和ZTE3对胰脂肪酶的抑制效果如图15所示。从图中可看出,各样品在0.2~1.0 mg/mL的浓度范围内对胰脂肪酶的抑制效果随着浓度的升高而有所增加,然而在不同的浓度下三种粗提物对胰脂肪酶抑制效果的强弱却明显不同——在高浓度(1.0 mg/mL)下,样品的抑制效果由强到弱依次是ZTE3>ZTE1>ZTE2,而在低浓度(0.2 mg/mL)下,样品对胰脂肪酶的抑制效果的顺序完全相反。可看出在此浓度变化范围内,ZTE2随着浓度的降低对胰脂肪酶抑制效果的降低程度最小,在低浓度下也能维持一定的抑制率。
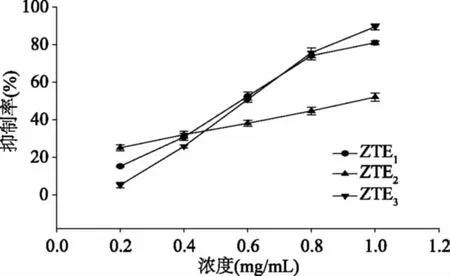
图15 ZTE1、ZTE2和ZTE3对胰脂肪酶的抑制作用Fig.15 Pancreatic lipase inhibitory activities ofZTE1,ZTE2 and ZTE3
从图16中可看出两种紫娟茶花色苷单体AN3和AN4在0.2~1.8 mg/mL的浓度范围内随着浓度的增加对胰脂肪酶的抑制率有所增加,且AN3对胰脂肪酶的抑制效果明显强于AN4。

图16 AN3和AN4对胰脂肪酶的抑制作用Fig.16 Pancreatic lipase inhibitory activities of AN3 and AN4
EGCG对胰脂肪酶的抑制效果如图17所示。由图中可知,EGCG对胰脂肪酶的抑制效果与浓度存在接近线性的依存性,且其效果明显强于紫娟茶纯化花色苷单体AN3和AN4。

图17 EGCG对胰脂肪酶的抑制作用Fig.17 Pancreatic lipase inhibitory activities of EGCG
紫娟茶提取物,包括ZTE1、ZTE2、ZTE3、AN3和AN4,以及EGCG对胰脂肪酶的IC50值如图18所示。粗提物中,ZTE1对胰脂肪酶的抑制效果最强,ZTE3、EGCG与其均无显著性差异(p>0.05),ZTE2的效果最弱(p<0.05)。而纯化的花色苷AN4对胰脂肪酶的IC50值(2.47±0.13)mg/mL明显高于AN3和EGCG,是EGCG(0.55±0.02)mg/mL的约4.5倍。

图18 ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对胰脂肪酶的半数抑制浓度Fig.18 Pancreatic lipase IC50 ofZTE1,ZTE2,ZTE3,AN3,AN4 and EGCG
ZTE1和ZTE3对胰脂肪酶的抑制效果略强于EGCG,符合Koo & Noh[16]所研究的绿茶提取物的降脂效果强于单一的EGCG这一结论。Ikeda等人[17]提出,没食子酸酯型儿茶素更有益于胆固醇的吸收,紫娟茶粗提物ZTE1、ZTE2和ZTE3中酯型儿茶素含量的总和分别为(143.22±2.97)、(12.85±2.45)、(278.61±12.01) mg/g,可以为解释ZTE1和ZTE3对胰脂肪酶的抑制效果提供一定的依据。
粗提物ZTE1对胰脂肪酶最强的抑制效果、含大量茶多酚的ZTE3和花色苷单体AN3对胰脂肪酶较强的抑制效果表明,紫娟茶中的茶多酚和花色苷对胰脂肪酶的抑制具有一定的协同作用,其减肥功效由多酚类化合物共同引起,且酯型儿茶素可能具有重大贡献。
根据酶动力学理论,以底物浓度的倒数为横坐标,反应速率的倒数为纵坐标绘制双倒数曲线图(Lineweaver-Burk)。如图19和图20所示,紫娟茶提取物中的花色苷AN3和AN4对胰脂肪酶的抑制类型为非竞争性抑制,AN3和AN4对胰脂肪酶的抑制常数Ki分别为0.22、0.78 mg/mL。AN3的抑制常数Ki远小于AN4,即AN3对胰脂肪酶的亲和力比AN4大,因此AN3对胰脂肪酶的亲和力大于AN4可能是AN3的抑制作用强于AN4的原因之一。

图19 AN3对胰脂肪酶的Lineweaver-Burk双倒数曲线Fig.19 Lineweaver-Burk of AN3 on pancreatic lipase

图20 AN4对胰脂肪酶的Lineweaver-Burk双倒数曲线Fig.20 Lineweaver-Burk of AN4 on pancreatic lipase
3 结论
本实验通过考察ZTE1、ZTE2、ZTE3、AN3、AN4和EGCG对ACE酶、α-淀粉酶和胰脂肪酶的体外抑制作用,证实了长期饮用紫娟茶可能具有潜在的降血压、降血糖和减肥效果。AN3和AN4对三种酶的抑制作用均为非竞争性抑制,且均为AN3强于AN4,这可能与它在B环3′、4′、5′位上的三羟基结构有关[18]。本研究对后期探索紫娟茶在体内对代谢综合症的影响具有一定的借鉴作用,并对茶叶的功能性研究具有一定的意义。
[1]Schmieder R E,Hilgers K F,Schlaich M P,et al. Renin-angiotensin system and cardiovascular risk[J]. Lancet,2007,369(9568):1208-1219.
[2]Ali H,Houghton P J and Soumyanath A.α-Amylase inhibitory activity of some Malaysian plants used to treat diabetes;with particular reference to Phyllanthus amarus[J]. Journal of Ethnopharmacology,2006,107,449-455.
[3]Birari R B and Bhutani K K. Pancreatic lipase inhibitors from natural sources:unexplored potential[J]. Drug Discovery Today,2007,12(10):879-889.
[4]杨兴荣,包云秀,黄玫. 云南稀有茶树品种“紫娟”的植物学特性和品质特征[J]. 茶叶,2009,35(1):17-18.
[5]Jiang Li-hua,Shen Xiao-jia,SHOJI T,et al. Characterization and activity of anthocyanins in Zijuan tea(Camelliasinensisvar. kitamura)[J]. Journal of Agricultural and Food Chemistry,2013,61(13):3306-3310.

[7]Actis-Goretta L,Ottaviani J I,Fraga C G. Inhibition of angiotensin converting enzyme activity by flavanol-rich foods[J]. Journal of Agricultural and Food Chemistry,2006,54:229-234.
[8]Da Silva Pinto M,Kwon Y I,Apostolidis E,et al. Potential of Ginkgo biloba L. leaves in the management of hyperglycemia and hypertension usinginvitromodels[J]. Bioresource Technology,2009,100(24):6599-6609.
[9]McDougall G J,Kulkarni N N,Stewart D. Berry polyphenols inhibit pancreatic lipase activityinvitro[J]. Food Chemistry,2009,115(1):193-199.
[10]Määttä-Riihinen K R,Kamal-Eldin A,Mattila P H,et al. Distribution and contents of phenolic compounds in eighteen Scandinavian berry species[J]. Journal of Agricultural and Food Chemistry,2004,52(14):4477-4486.
[11]Hara Y,Matsuzaki T,Suzuki T. Angiotensin I converting enzyme inhibiting activity of tea components[J]. Nippon Nogeikagaku Kaishi,1987,61(7):803-808.
[12]Kim H M,Shin D R,Yoo O J,et al. Crystal structure of Drosophila angiotensin I-converting enzyme bound to captopril and lisinopril[J]. FEBS Letters,2003,538(1-3):65-70.
[13]Hara Y,Honda M. The inhibition of alpha-amylase by tea polyphenols[J]. Agricultural and Biological Chemistry,1990,54(8):1939-1945.
[14]Matsui T,Ueda T,Oki T,et al.α-Glucosidase inhibitory action of natural acylated anthocyanins. 1. Survey of natural pigments with potent inhibitory activity[J]. Journal of Agricultural and Food Chemistry,2001,49(4):1948-1951.
[15]Tadera K,Minami Y,Takamatsu K,et al. Inhibition of alpha-glucosidase and alpha-amylase by flavonoids[J]. Journal of Nutritional Science and Vitaminology,2006,52(2):149-153.
[16]Koo S I,Noh S K. Green tea extract(GTE)is more effective than epigallocatechin gallate(EGCG)and epicatechin(EC)in inhibiting the lymphatic absorption of cholesterol(CH)and other lipids. The FASEB Journal,2008,22(1-Meeting Abstracts).
[17]Ikeda I,Imasato Y,Sasaki E,et al. Tea catechins decrease micellar solubility and intestinal absorption of cholesterol in rats[J]. Biochimica et biophysica acta,1992,1127(2):141-146.
[18]Higdon J V and Frei B. Tea catechins and polyphenols:health effects,metabolism,and antioxidant functions[J]. Critical Reviews in Food Science and Nutrition,2003,43(1):89-143.
InhibitoryeffectsofZijuantea(Camelliasinensisvar.kitamura)extractsonangiotensinconvertingenzyme,α-amylaseandpancreaticlipaseinvitro
ZHAOYu,ZHOUJia-chun,ZHANGJing-wei,ZHANGWan-xin,ZHAOLi-ming*,JIANGLi-hua*
(State Key Laboratory of Bioreactor Engineering,R&D Center of Separation and Extraction Technology inFermentation Industry,East China University of Science and Technology,Shanghai 200237,China)
Objective:To explore whether the extracts of Zijuan tea has the potential to anti-hypertensive,anti-hyperglycemic and anti-obesity. Methods:The crude polyphenol fraction(defined as ZTE1)was extracted from Zijuan tea. ZTE1was then separated to the precipitated(defined as ZTE2)and the soluble(defined as ZTE3)with ethyl acetate. Subsequently,delphinidin-3-O-β-D-(6-(E)-p-coumaroyl)galactopyranoside(AN3)and cyanidin-3-O-β-D-(6-(E)-p-coumaroyl)galactopyranoside(AN4)were purified from ZTE2. The inhibitory activities of the three crude fractions and two anthocyanins towards angiotensin converting enzyme(ACE),α-amylase and pancreatic lipase were evaluated comparing with epigallocatechin gallate(EGCG). The inhibitory type of AN3and AN4towards ACE,α-amylase and pancreatic lipase was also explored. Results:All the Zijuan tea extracts had inhibitory activities towards the three enzymes. The inhibitory activities of ZTE3towards the three enzymes,ZTE1towardsα-amylase and pancreatic lipase,ZTE2towardsα-amylase were stronger than EGCG. Furthermore,ZTE3had the highest inhibitory acitivity against ACE,whereas ZTE2and ZTE1had the highest inhibitory acitivity againstα-amylase and pancreatic lipase,respectively. And the inhibitory activity of AN3towardsα-amylase was not significantly different to EGCG. The inhibitory activity of AN3was higher than AN4towards all the three enzymes. In addition,AN3and AN4were noncompetitive inhibitors of ACE,α-amylase and pancreatic lipase withKivalues of 0.33,0.37 mmol/L,0.39,0.41 mg/mL and 0.22,0.78 mg/mL. Conclusion:The extracts of Zijuan tea has the potential to anti-hypertensive,anti-hyperglycemic and anti-obesity.
Zijuan tea extracts;total phenols;anthocyanin;tea polyphenol;angiotensin converting enzyme;α-amylase;pancreatic lipase
TS201.2
A
1002-0306(2017)19-0012-10
10.13386/j.issn1002-0306.2017.19.003
2017-03-08
赵瑜(1989-),女,硕士,研究方向:天然产物的分离提取和应用,E-mail:rita_yu_zhao@163.com。
*通讯作者:赵黎明(1977-),男,博士,教授,研究方向:食品加工技术,E-mail:zhaoliming@ecust.edu.cn。
蒋丽华(1970-),女,博士,副教授,研究方向:天然产物的分离提取和应用,E-mail:lhjiang@ecust.edu.cn。
