基于改进的银镜反应生成的银纳米粒子比色法 测定环境中Cr(Ⅲ)
2017-10-18王惠英陈丁龙
王惠英, 陈丁龙
(石家庄学院化工学院,河北石家庄 050035)
Cr(Ⅲ)在人体及动物体内的各种生物化学反应中都扮演着关键的角色,是一种必需的微量元素[1]。它不仅可以调节生物体内血糖浓度,还会影响代谢过程,帮助酶、胰岛素、胆固醇、氨基酸在体内保持着正常的运转[2]。但当人或动物体内的Cr(Ⅲ)处于高浓度时,将影响机体内正常的运作而产生遗传毒性[3]。同时Cr(Ⅲ)还是制革、催化剂、染料和玻璃等工业和农业的环境污染物之一[4]。传统测定Cr(Ⅲ)的方法如电感耦合等离子质谱法[5]、原子吸收光谱法[6]和高效液相色谱法[7]等需要昂贵的精密仪器,也不能进行实时的、现场的测试或需要繁琐的样品预处理。
近年来,纳米粒子尤其是银纳米粒子(AgNPs)以其高的摩尔吸光系数、价格便宜和制备简单而被广泛应用于比色传感器中[8 - 11]。基于改进的银镜反应,我们制备了没食子酸(GA)还原和稳定的AgNPs,发现在酸性条件下,Cr(Ⅲ)的加入可以引起AgNPs的特异性聚集,而其它常见金属离子不干扰,据此建立了比色测定湖水中Cr(Ⅲ)的方法,取得了较好的结果。
1 实验部分
1.1 仪器与试剂
TU-1950型紫外可见分光光度计(北京普析通用仪器有限责任公司);H-7500型透射电子显微镜(日本,日立公司);MVS-1型漩涡搅拌仪(北京金北德工贸有限公司)。实验所用玻璃器皿需在浓HNO3中浸泡12 h,然后用蒸馏水冲洗3遍,干燥后方可使用。比色皿在每次使用前需要用浓HNO3清洗后再用蒸馏水冲洗干净。
AgNO3(分析纯,天津市赢达稀贵化学试剂厂);Cr(NO3)3、3,4,5-三羟基苯甲酸(GA)(分析纯,北京化工厂),其它试剂均为分析纯。实验用水均为超纯水。
1.2 实验方法
1.2.1GA修饰的AgNPs的制备AgNPs参照改进后的银镜方法[9,12]获得。具体实验步骤如下:将配制好的50 mL 1.0×10-3mol/L AgNO3溶液,加入到100 mL洗净干燥的容量瓶中,然后加入2 mL 0.01 mol/L NaOH溶液,迅速振荡均匀,再加入1.6 mL 0.25 mol/L的NH3·H2O,迅速振荡均匀,最后加入3 mL 2 mmol/L GA溶液,混合均匀,30 min后溶液呈现深绿色。将此溶液稀释一倍后用紫外-可见分光光度计测其最大吸收波长为410 nm。制得的AgNPs置于冰箱中冷藏以便于后续实验,且溶液要保证能够稳定存在一个月。
1.2.2实验步骤取1 mL制备的AgNPs溶液于具塞比色管中,然后加入0.1 mL 0.01 mol/L HNO3,迅速漩涡混匀溶液,再滴加Cr(Ⅲ)溶液,定容至5 mL,再次漩涡混匀,静置30 min后测试及表征。
1.3 实验原理
本实验采用修改后的经典银镜反应,在室温下用GA快速还原银氨溶液生成AgNPs,Cr(Ⅲ)的加入会引起AgNPs的特异性聚集,使溶液发生由黄绿色到棕红色的颜色变化。反应机理是六配位的Cr(Ⅲ)与AgNPs表面吸附的GA的羧酸根配位,引起相邻的AgNPs的聚集,因此引发AgNPs溶液的颜色变化。
2 结果与讨论
2.1 AgNPs及AgNPs与Cr(Ⅲ)作用后的实验表征
为了验证测定方法的可行性,向新制备的1 000 μL AgNPs溶液中加入250 μL 1.0×10-4mol/L的Cr(Ⅲ)溶液,并做空白实验,结果如图1所示。由图1(A)可以看出,随着Cr(Ⅲ)加入到AgNPs溶液中,溶液的可见吸收光谱发生明显变化。相较于AgNPs在410 nm的最大吸收波长,加入Cr(Ⅲ)后的溶液出现两个峰,在410 nm的峰的吸光度相比空白溶液降低,另一吸收峰出现在长波长530 nm附近处,这是由AgNPs聚集后吸收引起的。图1(A)的内插图记录的是AgNPs加入Cr(Ⅲ)后的溶液颜色变化,发生从黄绿色到棕红色的明显颜色变化。为了进一步验证溶液吸收光谱和颜色的变化是由于Cr(Ⅲ)的加入引起了AgNPs的聚集,我们采集了加入前后的透射电镜照片。图1(B)是单独AgNPs分散的电镜图,在加入Cr(Ⅲ)后,AgNPs发生聚集(图1(C))。

图1 (a) AgNPs在加入Cr(Ⅲ)前(a)和后(b)的吸收光谱(内插图为相应的颜色变化);(B)和(C)加入Cr(Ⅲ)前后对应的透射电镜(TEM)图Fig.1 (a) Absorption spectra of AgNPs in the absence(a) and presence(b) of Cr(Ⅲ)(Inset:corresponding to color change);TEM images of AgNPs in the absence (B) and presence (C) of Cr(Ⅲ) concentration of Cr(Ⅲ) is 5 μmol/L.

图2 GA用量对加入Cr(Ⅲ)后AgNPs吸光度的影响Fig.2 Influence of the amount of GA on the absorbance of AgNPs in the presence of Cr(Ⅲ) GA:a,1 mL;b,2 mL;c,3 mL;d,4 mL;e,5 mL;the concentration of Cr(Ⅲ) is 5 μmol/L.
2.2 分析条件的选择
2.2.1GA用量对实验的影响首先对反应时间进行了优化,发现在30 min时聚集最明显,之后达到稳定。我们推测Cr(Ⅲ)与稳定剂GA中的羧酸根配位速度很快,但是引起相邻AgNPs之间的聚集需要一定的时间,故30 min时才能达到一个聚集最优值。以此时间作为后续的反应时间。GA在本实验中承担两种角色:还原剂和稳定剂[13],所以必须选择适当的浓度。如图2所示,当1 mmol/L GA在生成100 mL AgNPs中的占比为3 mL时,加入Cr(Ⅲ)后AgNPs在530 nm的聚集峰明显。这是由于随GA用量的增加,生成的AgNPs越来越稳定,在3 mL时达到一个最优值,此时AgNPs表面被GA覆盖均匀,加入Cr(Ⅲ)后,由于Cr(Ⅲ)与AgNPs表面吸附的GA的羧酸根配位,引起相邻的AgNPs聚集,在530 nm出现AgNPs特征聚集峰。随着GA用量继续增加,由于AgNPs表面已被GA吸附均匀,只会引起溶液中游离的GA浓度增加,在Cr(Ⅲ)的浓度固定不变的情况下,Cr(Ⅲ)优先与游离的GA配位,不会引起AgNPs的聚集,所以530 nm没有吸收峰出现。实验选定1 mmol/L GA在100 mL AgNPs溶液中占比为3 mL。
2.2.2溶液pH的影响制备的AgNPs溶液pH在9.5左右,此条件下AgNPs与Cr(Ⅲ)几乎没有反应,主要由于Cr(Ⅲ)在碱性条件下无法与AgNPs表面的稳定剂GA的羧酸根配位;酸性太强,AgNPs溶液自身发生聚沉。我们优化了Cr(Ⅲ)引起AgNPs聚集的pH,如图3(A)所示,HNO3浓度为2.0×10-4mol/L时,AgNPs聚集最明显,故选定此pH用于后续实验。同时考察了酸的加入顺序对实验的影响。图3(B)是酸和Cr(Ⅲ)的先后加入顺序的影响,先加酸(曲线b)时在530 nm处出现了明显的AgNPs聚集峰,同时410 nm的AgNPs峰高下降。主要是先加酸使溶液的pH降低,然后Cr(Ⅲ)加入后以离子形式存在,与AgNPs的羧酸根配位,引起聚集。故以此加入顺序进行后续实验。
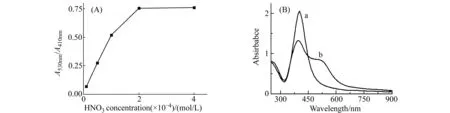
图3 (a) HNO3浓度对AgNPs聚集的影响;(B)试剂加入顺序对AgNPs吸光度的影响Fig.3 (a) Effect of the HNO3 concentration on the aggregation of as-prepared AgNPs;(B) Effect of the order of addition of reagents(the addition of acid after (a) and before (b) Cr(Ⅲ))
2.3 标准曲线及检出限
优化实验条件下,对Cr(Ⅲ)进行测定,实验显示随着Cr(Ⅲ)浓度不断增大,AgNPs溶液颜色从黄绿色渐变至棕红色,同时可以看出当Cr(Ⅲ)的浓度为0.8 μmol/L时,通过肉眼即可观测到AgNPs溶液比空白溶液颜色稍深,说明当Cr(Ⅲ)的浓度为0.8 μmol/L及以上时,此方法可实现 Cr(Ⅲ) 的可视化半定量测定。测定不同浓度Cr(Ⅲ)的吸收光谱。结果表明AgNPs的吸光度比值(A530nm/A410nm)与Cr(Ⅲ)在0.4~5 μmol/L浓度范围内呈良好的线性关系,线性方程为:A530nm/A410nm=0.06794+0.13342c,相关系数R=0.994,检出限为0.1 μmol/L。以上表明合成的AgNPs可以实现对Cr(Ⅲ)的定量分析。

图4 不同金属离子对应的AgNPs溶液的吸光度比值(金属离子浓度都为5 μmol/L)Fig.4 The absorbance ratio of AgNPs in the presence of metal ions(metal ion concentration in all cases is 5 μmol/L)
2.4 干扰的测定
优化实验条件下,将0.5 mL 5.0×10-5mol/L的含有Cu(Ⅱ)、Ni(Ⅱ)、Fe(Ⅲ)、Zn(Ⅱ)、Hg(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅲ)等金属离子的溶液分别加入到AgNPs溶液中,用紫外-可见分光光度计记录其吸收光谱。从图4可看出,除Cr(Ⅲ)外的7种金属离子的AgNPs溶液的A530nm/A410nm值几乎一致,与空白AgNPs溶液的值相差在3%以内。同时实验中可见其它金属离子的加入不会引起AgNPs溶液的颜色变化。因此环境中常见的金属离子对Cr(Ⅲ)的测定无影响。
2.5 样品的测定
向1 mL AgNPs中加入100 μL煮沸后冷却过滤的湖水(石家庄学院)水样后,然后按实验方法测定,通过线性方程计算Cr(Ⅲ)浓度。测定结果表明湖水中Cr(Ⅲ) 浓度在本方法的检测限以下。为了进一步验证方法的准确性,采用标准加入法测定了湖水水样中Cr(Ⅲ)的回收率(表1),测得回收率在93%~106.3%之间,表明该法用于湖水水样中Cr(Ⅲ)浓度的测定结果准确。

表1 湖水中Cr(Ⅲ)的检测结果Table 1 Determination results of Cr(Ⅲ) in lake water sample
3 结论
采用改进的经典的银镜反应,在室温下用GA快速还原银氨溶液生成AgNPs后,加入Cr(Ⅲ)可引起AgNPs的特异性聚集,使溶液发生由黄绿色到棕红色的颜色变化。据此建立了简单、快速且成本较低的测定金属离子Cr(Ⅲ)的方法。方法选择性较好,检出限比较低,可以运用在环境水样中Cr(Ⅲ)浓度检测中,以此实现环境水中Cr(Ⅲ)的可视化半定量检测和定量分析。
