石墨烯-壳聚糖-纳米金修饰的免疫传感器 应用于1-芘丁酸的检测研究
2017-10-18许双姐柳建设金利通
许 贺, 许双姐, 柳建设, 金利通
(1.东华大学环境科学与工程学院,上海 201620; 2.华东师范大学化学与分子工程学院,上海 200062)
多环芳烃(PAHs)是一类具有致癌、致畸和致突变的持久性有机化合物,它在环境中极难降解和消除,已有16种PAHs被美国环境保护署(USEPA)列为优先控制污染物[1]。其中,1-芘丁酸(PBA)是芘类PAHs最常见的衍生物,对人体的血液、神经和免疫系统等存在严重危害。因此,PAHs及其衍生物的快速检测对于保护生态系统和人类健康具有重要的现实意义。
目前,测定PAHs及衍生物的主要方法有气相色谱法、高效液相色谱法、高效液相色谱-质谱法等。这些方法虽然具有较高的灵敏度和准确性,但前处理麻烦,成本较高,操作复杂,且不适用于现场快速检测[2]。近年来,电化学免疫传感器作为一种有效的微量和痕量分析手段,基于抗原与抗体的特异性反应和电化学检测的特点[3 - 4],具有常规理化分析技术无可比拟的高选择性和高灵敏度,非常适合于复杂基质中的痕量组分分析[5]。同时还具有价格便宜,前处理方法简单,分析速度快,操作简便等优点。构建电化学免疫传感器,不需要光源、光栅等光学元件,设备和检测原理相对简单,更易做到集成化和小型化[6],为突发污染事件的现场检测提供了重要方法。
本文采用成膜性极好的壳聚糖(CS)分散具有大比表面积和导电性高的石墨烯(GS)作为平台,并结合生物兼容性极好的纳米金(Nano-Au)固定抗体,构建性能良好的生物识别界面,制备一种无标记的电流型免疫传感器,并应用于PAHs衍生物PBA的高灵敏检测。该免疫传感器具有制作过程简单、检测限低、稳定性好等优点,对痕量PBA检测具有良好的结果。
1 实验部分
1.1 仪器和试剂
CHI 660D电化学工作站(上海辰华仪器有限公司);JEM-2100透射电子显微镜(日本,JEOL)。
多环芳烃抗体(Mouse Monoclonal BAP-13,美国Abcam公司)。研究表明,该anti-PAHs抗体对PBA具有优异的特异性和亲和性,交叉反应率达205%[7]。其它试剂均为分析纯,购于国药集团化学试剂有限公司。Nano-Au按照文献方法[8]制备。实验用水为蒸馏水。
1.2 电化学免疫传感器的制备
采用玻碳电极(GCE,直径3 mm)作为基底电极,用0.05 μm的Al2O3粉末仔细打磨抛光成镜面,并先后于HNO3(1+1)、无水乙醇和蒸馏水中各超声5 min,最后将电极在室温下晾干。将0.02 g CS加入100 mL 1%的HAc水溶液中,持续搅拌至无气泡,得透明CS溶液。在10 mL蒸馏水中加入0.1 g GS,超声得到分散均匀的GS悬浊液。取5 mL该悬浊液加入上述CS溶液中,超声分散0.5 h,得到GS-CS悬浊液。在静电吸附自组装GS-CS之前,先将GCE放入0.5 mol/L H2SO4中,于-0.3~+1.5 V 范围内循环伏安扫描进行电化学氧化预处理,在氮气氛围晾干。然后取10 μL的GS-CS溶液滴于GCE表面,在室温下自然晾干。取10 μL已制备好并且超声分散的Nano-Au溶液,滴涂在电极表面,室温下放置40 min后,将10 μL anti-PAHs滴于电极上,于35 ℃孵育30 min后,将电极于37 ℃下浸泡在3%(m/m)的BSA/PBS(pH=7.4)溶液中30 min,以封闭活性基团,得到GS-CS-Nano-Au修饰的电化学免疫传感器,于4 ℃保存待用(图1)。

图1 免疫传感器的制备过程Fig.1 Fabrication steps of the immunosensors
1.3 电化学表征和检测
利用循环伏安法表征电极在修饰过程中不同阶段的电化学性能。采用三电极体系,电化学免疫传感器为工作电极,Ag/AgCl电极为参比电极,铂丝为对电极,于0.1 mol/L KCl + 5 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH=7.0)的测试底液中,在-0.2~+0.6 V电位范围内进行循环伏安扫描,扫速为50 mV/s。电化学免疫传感器在含不同浓度的PBA溶液中,于35 ℃条件下孵育30 min后,进行DPV测量,脉冲范围为-0.2~+0.6 V,间隔时间为50 ms。
2 结果与讨论
2.1 电极修饰材料的透射电镜(TEM)表征
图2为GS(A)和GS-CS(B)复合物的透射电子显微镜(TEM)表征图。如图2(B)所示,GS均匀分散在CS中,该表征结果与文献报道[9]相一致。图2(C)为Nano-Au的TEM表征图,可看出颗粒大小均匀,分散性良好,几乎没有重叠现象,粒径大小约为16 nm。

图2 石墨烯(A)、石墨烯-壳聚糖(B)和纳米金(C)的透射电镜(TEM)图Fig.2 TEM images of GS(A),GS-CS composites(B) and Nano-Au(C)
2.2 免疫传感器的电化学表征

图3 不同电极在0.1 mol/L KCl + 5 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH=7.0)中的循环伏安图Fig.3 Cyclic voltammograms of the different electrodes in 0.1 mol/L KCl+5 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH=7.0)(a) bare GCE;(b) GS-CS/GCE;(c) Nano-Au-GS-CS/GCE;(d) anti-PAHs/Nano-Au-GS-CS/GCE;(e) BSA/anti-PAHs/Nano-Au-GS-CS/GCE.

为了证实GS-CS-Nano-Au修饰电极具有更大的电活性面积和更快的电子转移速率,采用Randles-Sevcik方程进行计算。从图3可看出,Fe3+/Fe2+电对在Nano-Au-GS-CS/GCE上展现了最好的电流响应。根据Randles-Sevcik方程[12],电极的电活性面积由以下方程式求出:Ip=2.69×105AD1/2n3/2γ1/2C。其中,n为参与氧化还原反应的电子数,A为有效电极面积(cm2),D为扩散系数(cm2/s),γ是电位变化速率(V/s)。本实验用到的[Fe(CN)6]4-/3-是电化学中使用最广泛的氧化还原体系,显示了不同种类的单电子转移(n=1)。C为5 mmol/L,扩散系数(D)为6.7×10-6cm2/s。根据计算,Nano-Au-GS-CS/GCE、GS-CS/GCE 、CS/GCE和裸GCE的电活性面积分别为0.184 cm2、0.139 cm2、0.031 cm2和0.066 cm2。由此可见,CS大大提高了修饰电极的比表面积和电化学性能,GS-CS修饰的电极活性面积约为裸电极活性面积的2倍,Nano-Au的存在进一步提高了电极的电化学性能,电极活性面积最大,约为裸电极活性面积的3倍。

图4 电化学免疫传感器在不同扫速下的循环伏安图Fig.4 Cyclic voltammograms of the anti-PAHS/Nano-Au-GS-CS/GCE at the different scan rates
图4为anti-PAHs/Nano-Au-GS-CS/GCE电化学免疫传感器在0.1 mol/L KCl+5 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH=7.0)测试底液中,以不同扫速进行扫描得到的循环伏安图。由图4可以看出,随着扫速的增加,氧化还原峰电流明显的增加,在10~500 mV/s的扫速范围内,其峰电流与扫速的平方根成良好的线性关系,回归方程分别为:ipc=9.206v1/2+66.58,R2=0.9965和ipa=-9.508v1/2-56.58,R2=0.9926说明该电极反应受扩散过程控制。
2.3 实验条件的优化
2.3.1抗体浓度和pH对免疫传感器性能影响图5A为抗体浓度对免疫传感器测定电流的影响。随着抗体浓度的增加,固定到免疫传感器上的anti-PAHs量增多,电极表面的阻抗增加,从而使峰电流减小。在抗体浓度大于100 μg/mL时,峰电流值不再继续减小,说明此浓度下的抗体在电极表面的固定量达到饱和。传感器界面抗体的结合位点有限,若继续加大抗体的浓度,则会出现抗体量过剩现象,因此,选择100 μg/mL的抗体溶液浓度作为最佳抗体浓度。
测试底液的pH对免疫传感器的性能也具有重要影响,一方面pH影响蛋白质的活性,另一方面pH影响抗体在电极表面的固定。如图5B所示,pH在6.5~7.5范围内对抗体的吸附影响不大,且在7.0时峰电流最大,说明此pH条件下吸附的抗体量最多,蛋白质稳定。但是pH过大或过小时,电流值均变小,说明抗体在电极表面的吸附量较少,抗体与普通蛋白质一样,在酸性或碱性条件下可能会发生变性[13]。抗体变性后将形成2个半分子,从而影响正常的抗原-抗体免疫结合过程。因此,实验选择用pH=7.0的测试底液。
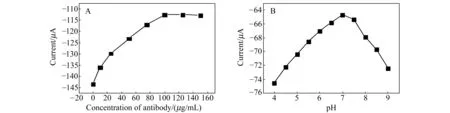
图5 抗体浓度(A)和pH值(B)对电化学免疫传感器性能的影响Fig.5 Effects of the concentration of anti-PAHs(A) and pH(B) on the immunosensor
2.3.2孵育时间和孵育温度对免疫传感器的影响电化学免疫传感器与抗原孵育时间、孵育温度对免疫反应有重要影响。免疫反应时抗原与抗体需要一定结合时间才能形成免疫复合物,在5~25 min范围内示差脉冲伏安(DPV)响应电流的变化随孵育时间的延长而增大,说明免疫反应随着时间的延长在不断进行。当反应时间到达30 min之后,电流曲线趋于平缓,说明免疫反应已基本达到平衡。因此,实验选取30 min为孵育时间。
电化学免疫传感器与抗原孵育的温度也是影响免疫反应的一个重要因素。在温度15~35 ℃温度范围内,响应电流值随温度升高而增大,在35 ℃时响应电流达到最大值。当温度高于35 ℃时,响应电流值反而变小,原因是免疫复合层受到高温破坏,抗原抗体的免疫活性降低,免疫复合物发生解离,影响了免疫传感器的性能[14]。因此实验选取35 ℃为最佳孵育温度。

图6 DPV电流响应与PBA浓度变化的标准曲线Fig.6 Standard curves of amperometric response to the concentrations of PBA cPBA (a-s):0,0.001,0.05,0.5,1.0,3.0,5.0,7.0,8.5,10,30,60,80,110,120,150,160,170,200 ng/mL.
2.4 免疫传感器对1-芘丁酸的DPV检测
将PBA用0.1 mol/L PBS(pH=7.4)配成不同浓度的标准溶液,在0.1 mol/L KCl + 5 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH=7.0)的测试底液中,采用DPV法测定免疫传感器在不同浓度标准溶液中的响应电流值,得到峰电流随浓度的变化情况(图6)。优化条件下,PBA浓度在0.001~10 ng/mL和10~200 ng/mL范围内,峰电流随PBA浓度的增加而减小,且与峰电流值呈良好的线性关系,其回归方程分别是:ip1(μA)= 0.105cPBA(ng/mL)-65.49(相关系数为0.9994);ip2(μA)=2.221cPBA(ng/mL)-87.26(相关系数为0.9900),检出限(S/N=3)为0.001 ng/mL。
对于检测的灵敏度,已报道的PAHs免疫传感器的灵敏度大多集中在μg级,本实验所建立的免疫检测方法的灵敏度明显优于已报道的PAHs生物传感器。韦明元等[15]采用氧化还原标记物标记抗原,竞争法测试苯并芘和PBA,对PBA的检出限为10 ng/mL;杨萍[16]采用纳米金标记法构建阻抗型免疫传感器用于PBA的检测,检测限为0.03 ng/mL;张岩等[17]构建的无标记电流型免疫传感器用于萘的快速检测,检测范围0.5~100 ng/mL,检出限为0.08 ng/mL;也有报道通过玻碳电极表面直接电化学氧化来检测苯并芘,检测范围在0.25~1.25 mmol,检出限为0.027 mmol(6.82 ng/mL)[18]。由此可见,本实验所建立的免疫传感器有较高的灵敏度,对于环境样品中痕量PBA的检测具有潜在的应用价值。
2.5 免疫传感器的特异性、稳定性和重现性
将电化学免疫传感器置于10 ng/mL PBA标准溶液中孵育后,测定DPV响应值。然后在PBA标准溶液中分别加入100 ng/mL芘、荧蒽、苊和菲溶液,相同条件下孵育后,分别测定DPV值。电化学免疫传感器在PBA标准溶液和4种干扰物中的ip值分别为-64.67、-66.33、-65.19、-63.56和-63.07 μA。实验表明,在加入干扰物的条件下电流变化不超过3%,说明该免疫传感器具有良好的选择性。
将电化学免疫传感器置于0.1 mol/L KCl + 5 mmol/L K3[Fe(CN)6]+0.1 mol/L PBS(pH=7.0)测试底液中,连续扫描200圈,电流响应仅下降3.1%。将制备好的电化学免疫传感器置于4 ℃密闭保存,相同条件下每2 d进行DPV扫描,两周后电流值为初始电流值的94.6%,基本无变化,表明该免疫传感器更具稳定性。测试不同批次制备的20支电化学免疫传感器对10g/L PBA的电流响应,所得的PBA浓度为9.78g/L,相对标准偏差(RSD)为2.2%,表明该免疫传感器具有良好的重现性。
2.6 实际样品的测定
取自来水、河水和湖水,经0.45 μm的滤膜过滤后,分别加入PBA标准溶液,配成不同浓度的加标试样,以本实验所制备的免疫传感器,用DPV法检测PBA的含量,相关数据见表1。从表中可知,回收率在90%~104.9%之间,RSD在0.5%~3.8%范围内,表明该免疫传感器准确性良好,具有一定的应用价值。

表1 电化学免疫传感器的回收率Table 1 Recoveries of PBA in spiked sample by the proposed electrochemical immunosensor
3 结论
本文制备了石墨烯-壳聚糖-纳米金修饰的免疫传感器用于1-芘丁酸的检测。石墨烯-壳聚糖复合膜明显提高了免疫传感器的稳定性和导电性;而纳米金的协同作用,进一步提高抗体在电极的固定量,大大提高了免疫传感器的灵敏度和检测性能。该方法所制备的免疫传感器对1-芘丁酸的检测具有较宽的线性范围和较低的检测限,选择性和重现性良好,而且简单快速、制备费用低,对环境中痕量PBA的检测具有潜在应用价值。
