α -Synuclein转基因小鼠内源性儿茶酚异喹啉的 高效液相色谱-串联质谱检测
2017-10-18张镇松郭琳娜邓玉林张庆华
张镇松, 郭琳娜, 邓玉林*, 张庆华*
(1.中国科学院生态环境研究中心,北京 100085;2.北京理工大学生命学院,北京100081)
帕金森病(Parkinson’s Disease,PD)又称震颤麻痹,它是一种仅次于阿尔茨海默病的第二大慢性神经系统退行性疾病,其致病机制目前尚未完全明确。儿茶酚异喹啉类物质(Catecholamine Isoquinolines,CAIQs)是外源性神经毒素MPTP[1]的结构类似物,能通过多巴胺转运体进入多巴胺能神经元,导致神经元特异性死亡,产生帕金森病症状[2]。其中,1-甲基-6,7-二羟基-1,2,3,4-四氢异喹啉(Salsolinol,Sal)及其吡啶环的N位甲基化产物6,7-二羟基-1,2-二甲基-1,2,3,4 -四氢异喹啉(N-methyl-Sal,NMSal)作为脑内自身合成[3]的内源性神经毒素CAIQs,对神经元细胞的毒性作用最显著,与PD的发病密切相关[4]。α-Synuclein蛋白是PD病理特征路易小体(Lewy Bodies,LBs)的主要组成成分。α-Synuclein 编码基因第4号外显子错义突变(G209A,Ala53Thr,简称A53T)被发现与家族遗传性PD有关[5]。研究发现,突变型以及过表达野生型α-Synuclein蛋白可引起蛋白在细胞内聚集,形成毒性更强的不溶性纤维[6],最终导致多巴胺能神经元的变性死亡。在稳定表达α-Synuclein的PC12细胞中检测发现Sal和NMSal的浓度都有升高,分别用Sal、NMSal诱导此稳定转染的细胞发现Sal和NMSal均可引起α-Synuclein蛋白聚集[7]。
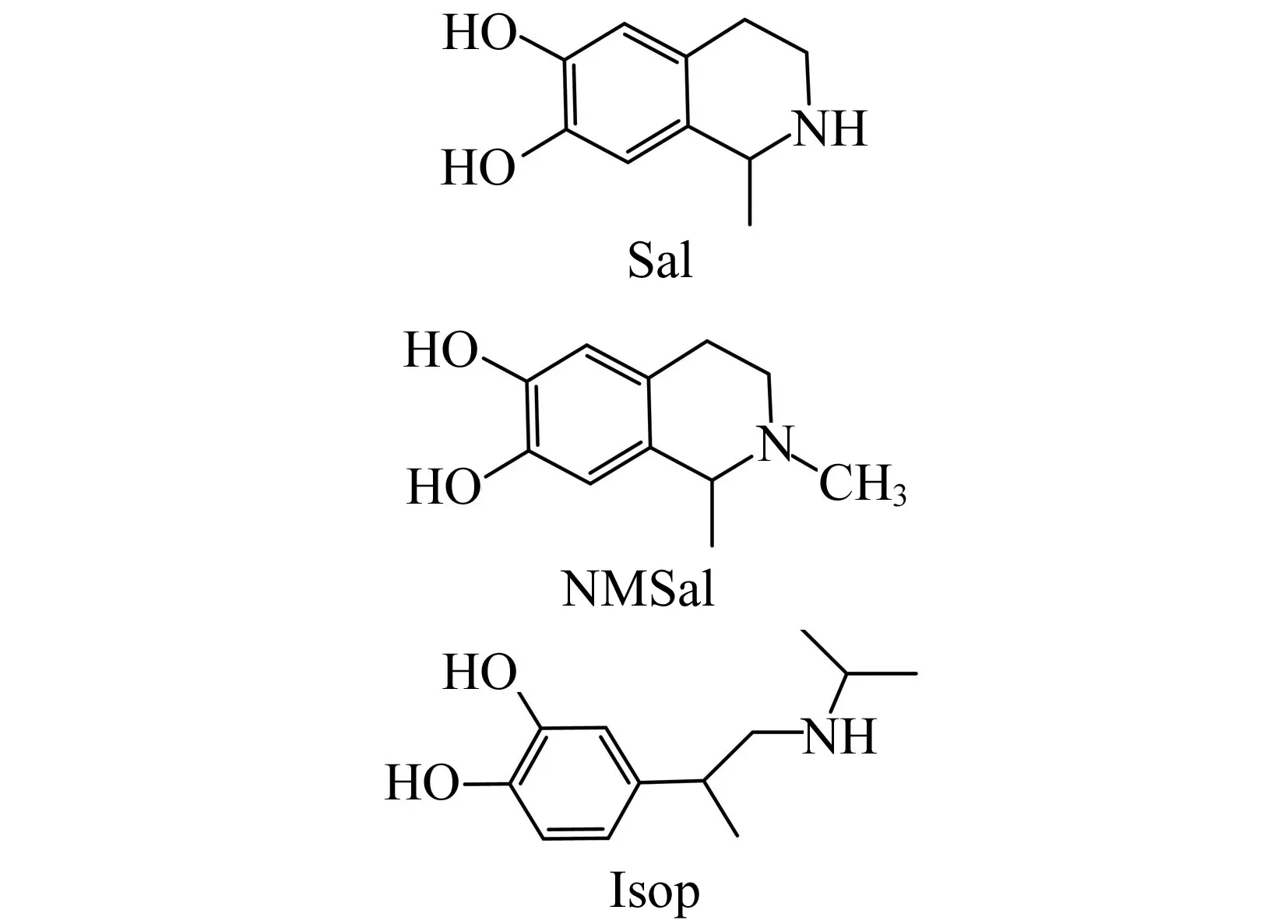
图1 Sal、NMSal和Isop的结构式Fig.1 Chemical structures of Sal,NMSal and Isop
本文建立了Sal和NMSal的高灵敏度、高选择性的高效液相色谱-串联质谱(HPLC-MS/MS)检测方法,该方法采用多反应监测(MRM)技术,以儿茶酚异喹啉结构类似物异丙基肾上腺素(Isoproterenol,Isop)为内标,可提高复杂的生物样品中CAIQs定量结果的可靠性。Sal、NMSal及Isop结构式见图1。能够完成气-质联用法(GC-MS)[8]、高效液相色谱-电化学检测法(HPLC-ECD)[9]或高效液相色谱荧光检测法(HPLC-FLD)[10]等其他常规检测方法难以满足的高灵敏度要求。
为阐明α-Synuclein蛋白过表达对体内Sal、NMSal内源性神经毒素含量的影响,选用过表达人源野生型(WT)及突变型(A53T)α-Synuclein蛋白的转基因小鼠为模型,该模型转入人源α-Synuclein A53T型或WT型基因,促进了小鼠纹状体内α-Synuclein蛋白的聚集,引起神经系统变性[11],使小鼠产生PD病状,以模拟人类PD的发病过程。此模型以血小板源生长因子(Platelet-derived Growth Factor,PDGF)为启动子,可调控α-Synuclein在小鼠的大脑皮层、海马、下丘脑和小脑等神经组织特异性表达,更好地模拟正常生理条件下α-Synuclein在脑内的分布[12 - 13],为研究人源α-Synuclein在活体中过表达对Sal、NMSal水平的影响提供基础。
1 实验部分
1.1 仪器、试剂及实验动物
美国Agilent 1290高效液相色谱仪;美国Agilent 6460三重四级杆质谱仪;意大利HANNA pH酸度计;美国Discovery®HS五氟苯基柱;北京科瑞AR2140电子天平;日本Hitachi CR21G2高速离心机。
Isop和N-Methyl-(R)-salsolinol hydrobromide购于美国Sigma公司;甲酸铵、NaH2PO4和Na2HPO4等均购于北京北化精细化学品有限责任公司;甲醇(色谱纯)购自美国Fisher公司;甲酸(色谱纯)购于北京Dikma公司;Sal由本实验室合成并纯化;其他分析纯化学试剂均购自北京化学试剂公司。超纯水由美国Millipore公司纯水系统制备。
C57BL/6J品系PDGF-h-α-Synuclein-WT、PDGF-h-α-Synuclein-A53T转基因小鼠和正常小鼠购自中国医学科学院实验动物研究所卫生部人类疾病比较医学重点实验室。饲养条件:按小鼠类型、雌雄分笼培养;饲养密度≤5只/笼,温度为18~21 ℃,湿度>40%,自然光照,自由进食、进水。
1.2 空白生物基质标准溶液的配制
取5只正常小鼠鼠脑并称重,然后按10∶1悬浮在组织裂解液(含0.4 mol/L HClO4、0.05%Vc、0.05% Na2EDTA和0.01%氨基脲,下同)中,用组织研磨器在冰浴中研磨破碎组织和细胞。将研磨后的悬浊液在17 000 g、4 ℃条件下离心30 min。弃去沉淀,上清液经0.22 μm水系滤膜过滤,取出15 μL下层滤液进行HPLC-MS/MS检测。其余滤液用6 mol/L NaOH溶液调节pH值至12,并在室温中放置24 h,以除去内源性Sal、NMSal等化合物。然后用甲酸调pH至4.0,以此作为空白生物基质溶液,取出15 μL 进行HPLC-MS/MS检测。取1 mmol/L的Sal、NMSal和Isop标准品混合溶液,用空白生物基质溶液配制成含6.25 nmol/L Sal、100 nmol/L NMSal和10 nmol/L Isop的标准混合工作母液,再用含10 nmol/L Isop的空白生物基质溶液,以体积比1∶1的比例依次往下稀释标准混合工作母液至Sal、NMSal浓度分别为1.53 pmol/L、24.4 pmol/L,共13个不同浓度的标准混合工作溶液,内标物Isop的浓度均为10 nmol/L。
1.3 色谱-质谱条件
色谱条件:Discovery®HS F5五氟苯基色谱柱(100×4.6 mm i.d.,5 μm)。流动相:A相:10 mmol/L甲酸铵缓冲溶液;B相:甲醇。梯度洗脱程序:0~5 min,25%B;5~15 min,25%~90%B;15~19 min,90%B;19~21 min,90%~25%B;21~26 min,25%B;柱温:30 ℃;样品温度:4 ℃;流速:0.5 mL/min;进样量:15 μL。
质谱条件:Agilent Jet Stream电喷雾离子源(ESI),正离子模式;毛细管电压:4 000 V;喷雾嘴电压:0 V;喷雾器压力:0.24 MPa;鞘气温度:325 ℃;鞘气流速:11.0 mL/min;干燥气温度:350 ℃;干燥气流速:10.0 mL/min;碰撞池加速电压:3 V;驻留时间:400 ms。
1.4 样品回收率考察
取5只正常小鼠鼠脑并称重,按10∶1悬浮在组织裂解液中,用组织研磨器在冰浴中按同样的力度研磨15次破碎组织和细胞。将研磨后的悬浊液用6 mol/L NaOH溶液调节pH值至12,并在室温中静置24 h,以除去内源性Sal、NMSal等化合物。然后用甲酸调节pH值至4.0。取70 μL悬浊液分别加入10 μL低、中、高三个浓度(Sal:0.015、0.15、1.50 nmol/L;NMSal:0.4、4.0、40.0 nmol/L)的标准品溶液,20 μL组织裂解液以及10 μL 100 nmol/L Isop。混匀后于17 000 g、4 ℃离心30 min。弃置沉淀,取上清经0.22 μm水系滤膜过滤收集下层滤液。每个浓度平行操作6次,共计18个样品。每个样品取15 μL进行HPLC-MS/MS检测。
1.5 转基因小鼠脑中Sal、NMSal含量的检测
将转基因小鼠培养至12月龄后,用无水乙醚将小鼠深度麻醉,心脏灌流,待血液完全排出后断头取脑。取A53T、WT和正常的小鼠鼠脑各5只,按10∶1悬浮在含10 nmol/L Isop的组织裂解液中,然后用1.5 mL的组织研磨器在冰浴中按同样的力度研磨15次破碎组织和细胞。破碎后的悬浊液在17 000 g、4 ℃ 条件下离心30 min。弃置沉淀,取上清经0.22 μm水系滤膜过滤,滤液进行HPLC-MS/MS检测。
2 结果与讨论
2.1 流动相pH条件优化
液相色谱流动相甲酸铵缓冲液的pH值不仅影响Sal、NMSal和Isop在溶液中的稳定性(在碱性条件下极不稳定),还影响它们在五氟苯基柱中的保留时间和质谱离子化过程中的离子化效率。配制pH值分别为3.0、3.5、4.0、4.5和5.0的10 mmol/L的一系列甲酸铵缓冲溶液,考察甲酸铵缓冲液pH值对NMSal的保留时间、峰面积和各化合物分离情况的影响。从图2可以看出,随着pH值的升高,NMSal峰面积及其与Isop的分离度RS先升高后降低,在pH=4.0时达到最大值,且此时NMSal与Sal、Isop均能达到完全分离(RS>1.5)。因此,确定最佳的pH条件为4.0。
2.2 MRM参数的优化
先后以Q1全扫方式、子离子扫描方式分别对Sal、NMSal和Isop的标准溶液进行一级质谱全扫描,以排除干扰和兼顾高响应值为原则确定Sal、NMSal以及Isop的MRM特征性母离子-子离子分别为180.1→117.1、194.1→145.1和212.1→107.0。先后以选择离子扫描方式和MRM方式,分别对Sal、NMSal和Isop的碎裂电压、碰撞能量参数进行优化,结果如表1所示。通过质谱、色谱条件优化后,Sal、NMSal和内标Isop能达到完全分离,见图3。
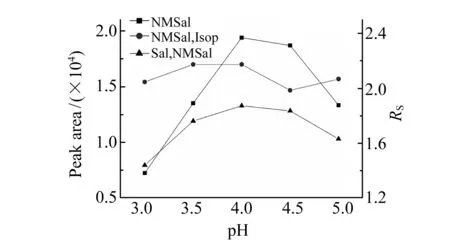
图2 流动相pH值对NMSal的峰面积和分离度的影响Fig.2 Effect of pH of mobile phase on peak area and RS of NMSal
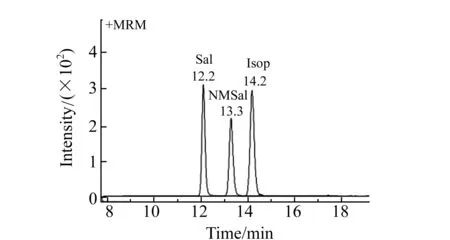
图3 Sal、NMSal和Isop MRM色谱图(叠加后)Fig.3 MRM overlapped chromatograms of Sal, NMSal and Isop 表1 Sal、NMSal和Isop的MRM参数优化Table 1 Summary of MRM parameters for Sal,NMSal and Isop

CompoundsMRM transitions(m/z)Fragmentor(V)Collision energy(eV)SalNMSal180.1→117.1194.1→145.11051152418Isop212.1→107.08530
2.3 内源性Sal、NMSal和Isop去除
按1.2所示方法对鼠脑组织提取液进行强碱处理,处理前后分别通过HPLC-MS/MS检测,考察内源性Sal、NMSal去除效果。由图4(a)可知,NaOH处理前鼠脑组织中含有微量Sal和NMSal,但检测不到Isop的存在。经过NaOH处理后,内源性Sal、NMSal均在检出限以下(图4(b)),说明该方法可以有效排除内源性Sal、NMSal对标准曲线工作液和方法回收率的干扰。
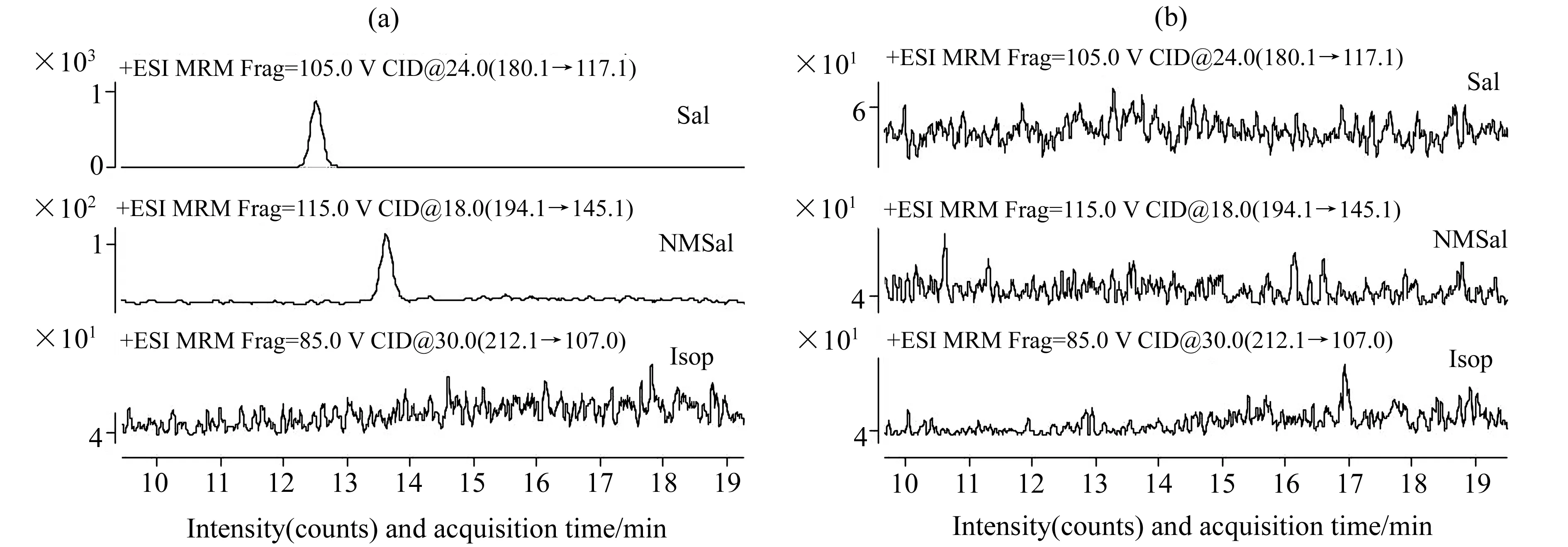
图4 NaOH处理前(a)和处理后(b)鼠脑组织提取液中的Sal、NMSal和Isop的MRM提取色谱图Fig.4 MRM extracted chromatograms of Sal,NMSal and Isop in mice brain tissue extract before (a) and after (b) NaOH treatment
2.4 方法学验证
2.4.1方法的线性范围、检出限和定量限为了尽可能模拟生物样品的实际情况,提高定量结果的可靠性,采用生物背景基质添加内标和目标化合物的标准品配制标准曲线工作液。根据已优化好的色谱、质谱条件,对标准混合工作液进行HPLC-MS/MS检测,检测数据经过Agilent MassHunter Quantitative Analysis 定量分析软件处理,分别以Sal、NMSal的浓度与内标Isop浓度的比值为横坐标(X),Sal、NMSal的峰面积与Isop峰面积的比值为纵坐标(Y),由软件自动拟合线性方程,结果如表2所示。

表2 NMSal和Sal线性方程、相关系数(r)、线性范围、检出限(LODs)及定量限(LQDs)Table 2 The linear equaltions,correlation coefficients(r),linear ranges,LODs and LOQs of NMSal and Sal
2.4.2方法的精密度和准确度分别选择标准曲线中低、中、高三个浓度的质量控制(QC)样品(Sal:0.015、0.15、1.50 nmol/L;NMSal:0.4、4.0、40.0 nmol/L;Isop:均为10 nmol/L)进行方法的准确度和精密度考察。三个浓度QC样品的日内精密度重复5次进样测得,日间精密度连续3 d重复进样6次测得。结果显示(表3),该方法的重复性和准确性均符合定量分析要求。
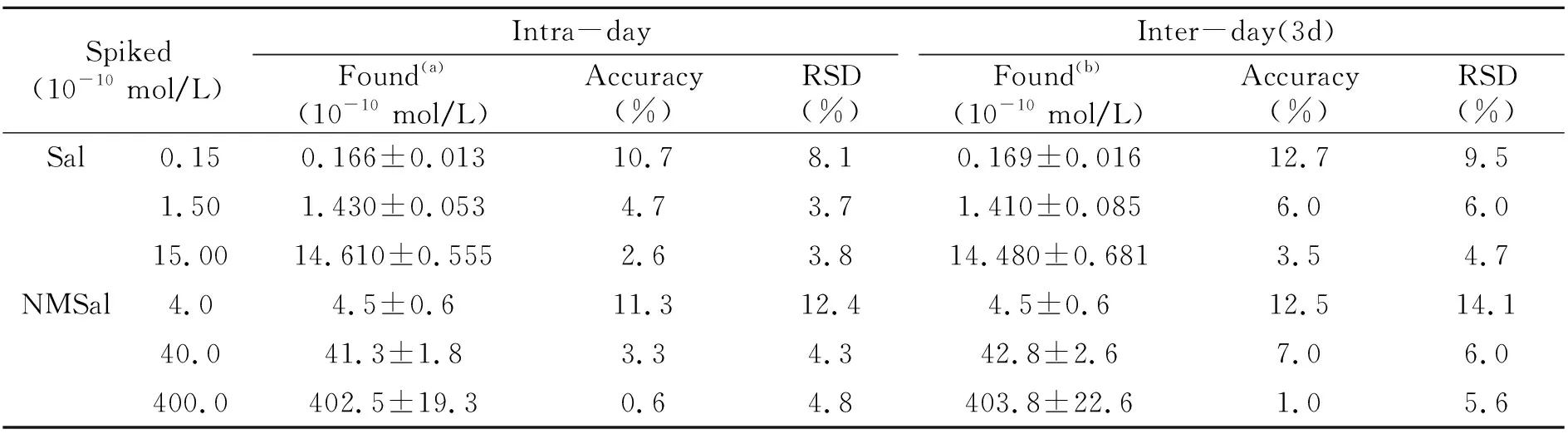
表3 HPLC-MS/MS测定Sal、NMSal的精密度和准确度Table 3 The precision and accuracy of Sal and NMSal by HPLC-MS/MS
(a):mean±SD,n=5;(b):mean±SD,n=6(3 d).
2.4.3方法的回收率对Sal、NMSal在实际样品中的回收率进行考察,结果表明该方法Sal、NMSal回收率分别在86.5%~90.7%和81.0%~91.4%之间,如表4所示。说明前处理方法对样品造成的损失少,重复性较为理想。
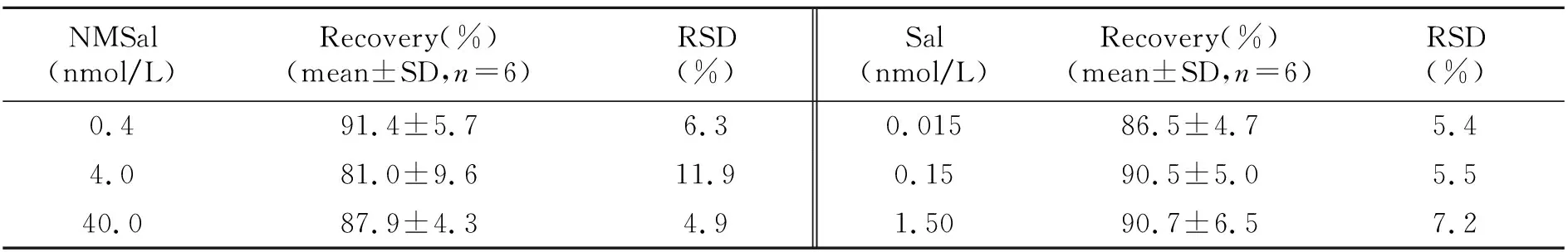
表4 NMSal和Sal样品回收率Table 4 The recovery of NMSal and Sal
2.5 过表达α -Synuclein转基因小鼠脑内Sal、NMSal的含量检测
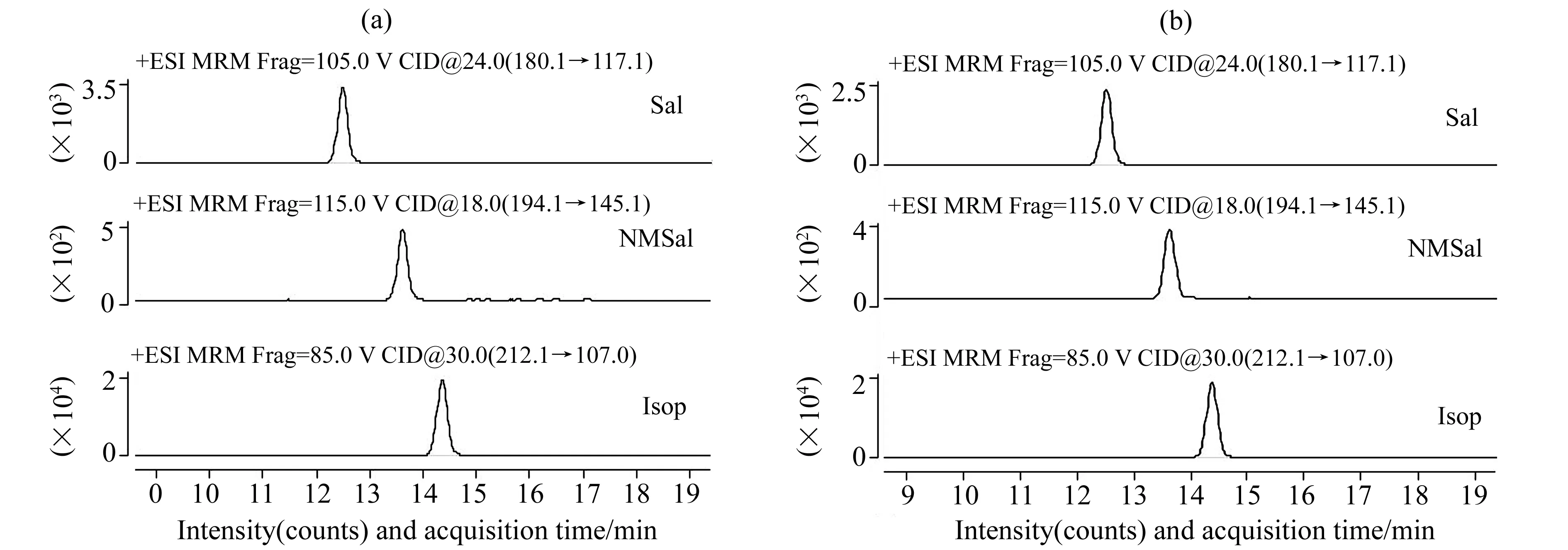
图5 A53T(a)和WT(b)转基因小鼠脑中内源性Sal、NMSal和Isop的MRM提取色谱图Fig.5 MRM extracted chromatograms of Sal,NMSal and Isop in the brain of A53T (a) and WT (b) transgenic mice
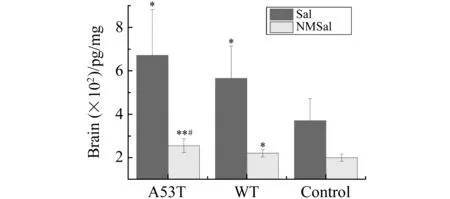
图6 A53T、WT和正常小鼠脑内Sal、NMSal的含量比较Fig.6 Levels of Sal and NMSal in the brain of A53T,WT and control mice *:P<0.05 versus control group;**:P<0.01 versus control group;#:P<0.05 versus WT group;n=5.
按照上述建立的Sal、NMSal的HPLC-MS/MS检测方法,对过表达α-Synuclein转基因小鼠脑中内源性Sal、NMSal的含量进行检测,相关结果见图5、图6。结果显示A53T、WT转基因小鼠脑内Sal的含量与对照组相比均明显升高(P<0.05,n=5);A53T转基因小鼠脑中NMSal浓度与WT转基因小鼠相比显著升高(P<0.05,n=5),与对照组相比具有极显著差异(P<0.01,n=5);WT转基因小鼠脑内NMSal浓度与对照组相比明显升高(P<0.05,n=5)。该结果表明,过表达A53T、WTα-Synuclein会导致生物体内更多内源性神经毒素Sal、NMSal的生成,而A53T突变型α-Synuclein与野生型相比更容易促进寡聚体的形成,从而造成NMSal水平的升高,进一步对神经元细胞产生毒性作用。
3 结论
建立基于多反应监测技术的Sal、NMSal高灵敏度、高选择性、高重复性的HPLC-MS/MS定量检测方法。运用该方法对过表达人源突变型A53T和野生型α-Synuclein的转基因小鼠脑中内源性Sal、NMSal含量进行检测。结果表明,过表达A53T、WTα-Synuclein蛋白会导致内源性神经毒素Sal、NMSal含量显著升高。该结果对研究α-Synuclein的异常聚集与内源性神经毒素之间的关系、阐明帕金森病发病机制具有一定的参考意义。
