Zn掺杂CuO修饰电极的制备及电化学催化检测H2O2
2017-10-18朱南南戴高鹏刘素芹
钱 媛, 朱南南, 王 星, 戴高鹏, 刘素芹
(湖北文理学院化学工程与食品科学学院,低维光电材料与器件湖北省重点实验室,湖北襄阳 441053)
H2O2常作为氧化剂被用于化学和食品工业,同时它也是化学和酶过程的产物,因此其含量的检测显得尤为重要[1]。目前检测H2O2有很多方法,如荧光法[2]、分光光度法[3]、化学发光法[4]和电化学法[5 - 10]等。其中,电化学法装置制备简单、操作方便、检测灵敏而被广泛关注。
过渡金属氧化物具有许多优良特性,如:具有较高的电催化活性,价格较贵金属便宜;耐腐蚀、机械强度高,可于高温、高压下测试;易于微型化,稳定性好,因此是一类理想的电极修饰材料。本文用水热法制备Zn掺杂CuO纳米粒子,并利用该纳米粒子制备了Zn掺杂CuO修饰玻碳电极。利用循环伏安法和计时电流法研究了H2O2在该修饰电极上的电化学行为。研究表明,该修饰电极对H2O2具有明显的电催化还原作用,且具有选择性高、重现性和稳定性好等特点。
1 实验部分
1.1 仪器与试剂
RST5000电化学工作站(苏州瑞思特仪器有限公司),实验采用三电极体系:以修饰电极作为工作电极,饱和甘汞电极作为参比电极,铂电极作为辅助电极;S-4800扫描电子显微镜(SEM)(日本,日立公司)。
不同pH值的0.1 mol/L K2HPO4-KH2PO4缓冲溶液(PBS)通过调控不同K2HPO4-KH2PO4比例配制。实验中所用的其它试剂均为分析纯,实验用水为二次去离子水。
1.2 Zn掺杂CuO纳米粒子的制备
将15 g葡萄糖、4.48 g Zn(NO3)2溶于120 mL水中,在剧烈搅拌下缓慢滴加25%的氨水,调至pH 为6,继续搅拌10 min,转入200 mL 的聚四氟乙烯高压反应釜中,180 ℃下保温24 h,得到黑色沉淀物并进行抽滤,用水和乙醇多次洗涤,真空干燥。将产物分散于100 mL水中,加入1.208 g Cu(NO3)2、0.09 g聚乙二醇(PEG),超声30 min,在搅拌过程中缓慢滴加25%的氨水调至pH 为8,超声30 min,然后在室温下搅拌5 h,将产物进行抽滤,沉淀物用水和乙醇多次洗涤,真空干燥。 置于马弗炉中600 ℃煅烧4 h,即得Zn掺杂CuO,记为Zn-CuO。作为对照,未掺杂CuO纳米粒子的合成直接按照该步骤的后半部分完成。
1.3 修饰电极的制备及实验方法
用粒径为0.3、0.05 μm的Al2O3乳液将玻碳圆盘电极(GCE,直径2 mm)抛光至镜面,每次抛光后用水超声清洗,接着用乙醇超声清洗,之后再用水超声一次,每次5 min。取1.2制备的分散液5 μL滴涂于GCE表面,红外灯下烘干,即得修饰电极Zn-CuO/GCE。
利用循环伏安法、计时电流法测定。将三电极系统插入10 mL 含一定浓度H2O2的0.1 mol/L PBS中进行电化学实验。所有实验均在室温条件下进行。
2 结果与讨论
2.1 Zn掺杂CuO纳米粒子的扫描电镜图
图1(a)、1(b)分别为Zn掺杂CuO纳米粒子的低倍和高倍扫描电镜(SEM)照片。从图中可以看到,Zn掺杂CuO颗粒呈纳米级,其粒径大约在80~100 nm。颗粒分散良好,无明显聚集现象。说明合成了Zn掺杂CuO纳米粒子。

图1 Zn掺杂CuO纳米粒子的低倍和高倍扫描电镜(SEM)图 Fig.1 SEM images of Zn doped CuO nanoparticles (a)lower magnification;(b)higher magnification.
2.2 复合修饰电极Zn-CuO/GCE的电化学行为
研究了不同电极的电化学行为。如图2所示,裸GCE没有明显的电化学反应发生,而CuO/GCE在-0.047 V和-0.188 V处分别出现了氧化峰和还原峰,但峰形对称性不是很好。在Zn-CuO/GCE上,出现一对明显的氧化还原峰,Epa=-0.050 V,Epc=-0.279 V;氧化峰和还原峰的峰电流很大,峰形尖锐且对称,是准可逆的氧化还原反应。
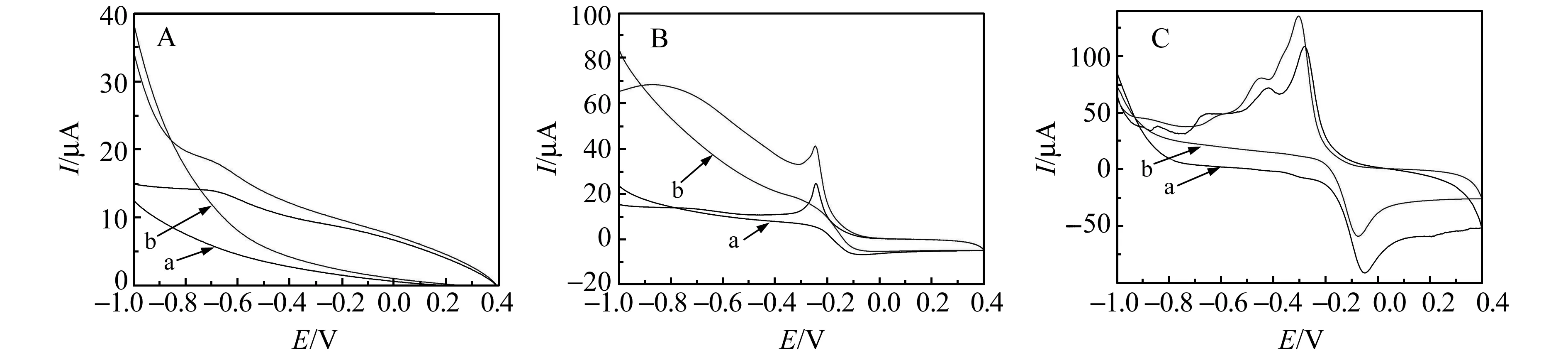
图2 不同电极在未加(a)和加入100 μmol/L H2O2(b)时的循环伏安图Fig.2 Cyclic voltammograms of different electrodes with hydrogen peroxide(a) absent and(b) present 100 μmol/L A:bare GCE;B:CuO/GCE;C:Zn-CuO/GCE;0.1 mol/L PBS(pH=7.0);scan rate:0.10 V/s.
2.3 扫速的影响
采用循环伏安法考察了扫速对Zn掺杂CuO修饰电极的电化学行为的影响。在20~360 mV/s扫描范围内,该修饰电极的氧化峰电流Ipa和还原峰电流Ipc随着扫速v的增大而增大,并且二者呈良好的线性关系。说明此修饰电极的电化学行为受吸附过程控制。当扫速过低时,峰电流较小;而当扫速过高时,峰电位移动较大,峰形变宽,综合考虑选择扫描速率为100 mV/s。
2.4 pH的影响
考察了Zn-CuO/GCE在不同pH值PBS中的循环伏安行为(图略)。结果表明,当pH值分别等于3.0、4.0、5.0、6.0时,均出现明显的氧化峰,峰电流随着pH的增加逐渐增大,峰电位正移,还原峰不明显,这可能与酸性条件下修饰电极不稳定有关系。而在pH等于7.0时,均出现明显的氧化还原峰,且峰形尖锐对称。但当逐渐增加pH 值时,尽管均出现明显的氧化峰,且峰电流逐渐增加,但还原峰并不理想。这可能与在碱性支持电解质中,Zn2+和Cu2+形成了氢氧化物,阻碍了电化学还原的过程。由于在pH=7.0时均出现明显的氧化还原峰,且峰形较好,因此实验选用pH=7.0的PBS作为支持电解质。
2.5 电催化还原检测H2O2
图3为不同浓度H2O2在Zn-CuO/GCE上的循环伏安曲线。比较曲线a和b,当加入100 μmol/L的H2O2时,氧化峰电流明显减小,而还原峰电流明显增加,说明该修饰电极对H2O2产生了电催化还原作用。比较曲线b和c,随着H2O2浓度的增加,还原峰电流逐渐增加,氧化峰电流逐渐减小,催化效果明显。
采用计时电流法(i-t) 对不同浓度的H2O2溶液进行测定,见图4。测定电位控制为-0.26 V。由图可见,随着H2O2的加入,电流以台阶状逐渐增加,符合稳态电流的特征,响应时间小于5 s。在优化条件下,电流与H2O2的浓度在1.0×10-6~ 6.3×10-3mol/L范围内时,其还原峰电流与浓度具有良好的线性关系(内插图),其线性方程为:ipc(μA)=-2.086+0.0694c(μmol/L),相关系数r=0.9964。检出限(S/N=3)低至0.1 μmol/L。从表1可以看出,本文方法检测的线性范围和检出限都具有一定的优越性。

图3 不同浓度H2O2在Zn-CuO/GCE上于扫速0.10 V/s的循环伏安图Fig.3 Cyclic voltammograms of H2O2 Zn-CuO/GCE scan rate of 0.10 V/s 0.1 mol/L PBS(pH=7.0);c(H2O2):a,0 μmol/L;b.100 μmol/L;c,200 μmol/L.
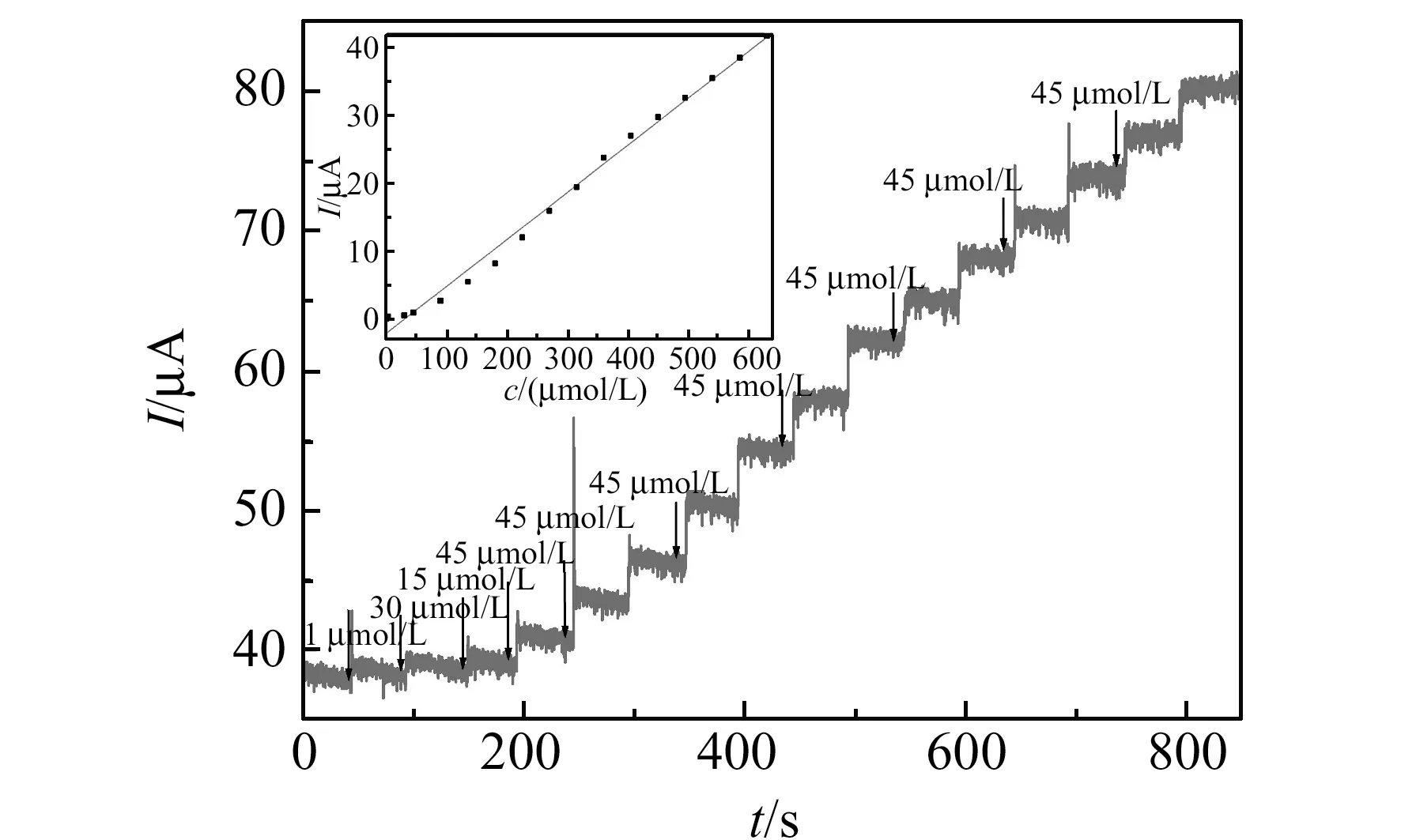
图4 Zn-CuO/GCE检测不同浓度H2O2时的i-t曲线图(内插图为校正曲线)Fig.4 i -t response of different concentration H2O2 at the Zn-CuO/GCE in 0.1 mol/L PBS(pH=7.0)(Inset was the relationship between reduction peak current and H2O2 concentration) 表1 不同过渡金属氧化物电化学修饰电极检测H2O2的比较Table 1 Comparison of the efficiency of some transition metal oxide modified electrodes in the electrochemical determination of H2O2

Modified electrodeLinear range(mol/L)Detection limit(mol/L)Detection potential(V) ReferenceCuO nanosheet1.0×10-5-2.0×10-2-0.26[5]CuO microspheres1.0×10-5-2.0×10-41.25×10-70.7[6]NiO/graphene2.5×10-4-4.75×10-37.664×10-70.5[7]Co doped ZnO nanoparticles5.0×10-3-3.0×10-21.43×10-5-0.30[8]CuO@MnAl NSs6.0×10-6-2.2×10-21.26×10-7[9]Co3O4 nanostructures1.0×10-7-5.0×10-51.45×10-7-0.045[10]Zn doped CuO nanoparticles1.0×10-6-6.3×10-31.0×10-7-0.26This work
2.6 选择性、重现性和稳定性试验
在100倍的浓度范围内抗坏血酸、多巴胺、半胱氨酸、赖氨酸以及葡萄糖都不会对H2O2的测定产生明显影响。通过测试 100 μmol/L H2O2的循环伏安响应电流,考察Zn-CuO/GCE的重现性和稳定性。 采用相同方法制备了6根电极,进行平行测量。实验结果表明,其相对标准偏差(RSD)为3.2%。室温下,将该修饰电极储存 3 d 后,测得的峰电流响应无明显降低,在 14 d和28 d 后,该电极对H2O2的峰电流响应仅降低了3.6%和8.7%。
3 结论
本文采用水热法成功制备了Zn掺杂CuO纳米粒子。采用滴涂法制备了修饰电极Zn-CuO/GCE,并用该修饰电极研究了其对H2O2的电化学行为。结果表明,在0.1 mol/L pH=7.0的PBS支持电解质溶液中,Zn-CuO/GCE 对H2O2有良好的电催化还原作用。该传感器的选择性、重现性和稳定性良好。
