槲皮素对硼氮共掺杂碳点的荧光猝灭作用
2017-10-18杨海芬王亚坤
杨海芬, 王 璇, 王亚坤, 于 青, 卞 伟*
(1.山西医科大学药学院,山西太原 030001; 2.山西医科大学基础医学院,山西太原 030001;)
近年来,荧光碳点作为继碳纳米管和石墨烯之后出现的新型碳纳米材料,受到科研工作者的青睐。碳点与传统量子点相比,具有激发波长与发射波长可调、量子产率高、制备成本低、绿色环保、良好的水溶性和生物相容性等优越特性,且在光催化、生物标记、药物检测、细胞成像、重金属离子的检测等诸多领域得到广泛应用[1 - 4]。研究发现,用其他杂原子掺杂后得到的掺杂碳点具有稳定的光学性质、高的量子产率和显著的催化性能[5 - 6]。如:Hou等[7]用柠檬酸和双氰胺为原料合成了量子产率为73.2%的氮掺杂碳点,以它为 “on-off-on”开关型荧光探针来检测Fe2+和去铁蛋白; Zhang等[8]通过一步水热法制备的荧光性能良好的水溶性氮掺杂碳点检测痕量Hg2+;Jahan等[9]把合成的具有很强荧光的硼和氮掺杂碳点用于光敏剂和苏丹红的检测。
槲皮素(Quercetin)是一种广泛存在于植物界的多羟基黄酮类化合物,它具有多种生物学活性及很高的药用价值,如抗氧化、抗菌抗病毒、抗炎抗过敏、预防心血管疾病、抑制恶性肿瘤生长和转移等[10 - 11]。近年来,槲皮素对于延缓衰老和抗癌防癌的作用成为一个非常热门的课题,然而人体内槲皮素过量时会引起头痛和肾损伤等疾病。因此,探索槲皮素的含量测定方法十分重要。目前槲皮素的测定方法有高效液相色谱法[12]、毛细管电泳法[13]、薄层扫描法[14]、荧光光谱法[15]等。荧光光谱法与其他几种方法相比,具有高灵敏度、高效率、操作简单和成本低等的优点,因而引起了研究人员的更多关注。
本文以硼酸、尿素和柠檬酸为原料,用微波法合成了硼氮共掺杂碳点(BNCDs)。基于槲皮素对该掺杂碳点的荧光猝灭作用,建立了一种检测槲皮素的新方法。同时,初步探讨了槲皮素与该掺杂碳点相互作用的反应机理。
1 实验部分
1.1 仪器与试剂
JEM-1011型透射电子显微镜(日本,JEOL);Paragon 1000型红外光谱仪(美国,Perkin-Elmer公司);TU-1900型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);F-4500型荧光分光光度计(日本,日立公司);FB124型电子分析天平(北京普析通用仪器有限责任公司);pHSJ-3F型酸度计(上海垒固仪器有限公司)。
柠檬酸(上海阿拉丁试剂有限公司);H3BO3( 上海阿拉丁试剂有限公司);尿素(上海阿拉丁试剂有限公司);槲皮素(上海阿拉丁试剂有限公司);NaH2PO4·2H2O、Na2HPO4·2H2O、Na3PO4·12H2O(分析纯,天津博迪化工厂);无水乙醇(分析纯,天津市天新精细化工开发中心);其余试剂均为分析纯。实验用水为去离子水。
1.2 硼氮共掺杂碳点(BNCDs)的制备
取1.0 g H3BO4、1.093 g柠檬酸和1.0 g尿素,溶于20 mL去离子水中,过滤,滤液在微波(700 W)加热4 min得到棕色固体。待固体冷却到室温,加20 mL去离子水溶解并过滤,收集滤液,室温下放置3 d使其蒸干,得深绿色固体。向固体中加入适量乙醇洗涤三次,再加适量去离子水使其溶解。把所得溶液用透析膜(MWCO 500 Da)透析3 d,得到BNCDs溶液,于4 ℃条件贮存,备用。
1.3 检测方法
在5 mL比色管中,依次加入BNCDs储备液、磷酸盐缓冲溶液(PBS,pH=7.0)和不同体积的槲皮素标准溶液,摇匀。室温下反应几分钟后,以360 nm为激发波长,测定体系的荧光强度,F0和F分别表示加入槲皮素前后该BNCDs的荧光强度,计算相对荧光强度ΔF=F0/F。仪器激发和发射狭缝宽度均为10 nm。
2 结果与讨论
2.1 BNCDs的表征
BNCDs的结构通过透射电子显微镜(TEM)、X-射线光电子能谱(XPS)、傅里叶变换红外(FT-IR)光谱进行表征。TEM图表明合成的BNCDs形状近似球形,分散均匀且无聚集现象,粒径约在4.2 nm左右(图1)。图2为BNCDs的红外光谱图,在3 100~3 600 cm-1处的宽峰为N-H和O-H的伸缩振动峰;1 645 cm-1处为C=O的伸缩振动峰;B-O和B-C的伸缩振动峰分别在1 408 cm-1和1 156 cm-1;在1 342 和1 080 cm-1出现的是B-N的特征振动峰;在1 051 cm-1是B-O-C的弯曲振动峰; B-N-B的弯曲振动峰在758 cm-1处可以观察到。

图1 BNCDs的透射电镜(TEM)图Fig.1 TEM image of BNCDs

图2 BNCDs的红外(IR)光谱图Fig.2 IR spectrum of BNCDs
图3为BNCDs的XPS图谱,可以观察到合成的BNCDs主要由C、N、O和B元素组成,比例分别为40.84%、27.93%、27.46%和3.77%。说明成功的将B、N元素掺杂到碳点表面,且XPS结果与IR光谱测定结果相吻合。
2.2 实验条件的优化
2.2.1pH的选择实验考察了体系酸度对BNCDs以及BNCDs-槲皮素体系荧光强度的影响,结果如图4所示。可以看出在不同pH值的PBS中,BNCDs的荧光强度的变化以及槲皮素对BNCDs的荧光强度猝灭作用不同。当pH在5.0~11.0的范围,BNCDs的荧光强度呈现先升后降的趋势,在pH=6.0时,BNCDs的荧光强度达到最大。在加入槲皮素后,ΔF(ΔF=F0-F)在pH=7.0时,槲皮素对BNCDs荧光强度的猝灭作用最强。因此,本实验选择在pH=7.0的PBS中进行。
2.2.2BNCDs浓度的影响在pH=7.0的实验条件下,考察了BNCDs浓度对BNCDs-槲皮素体系荧光强度的影响。实验中得出,当BNCDs的浓度逐渐增大时,BNCDs荧光探针对槲皮素的灵敏度呈升高的趋势,且在BNCDs的浓度为2.0×10-6mg/L时对槲皮素测定的灵敏度达到最高,继续增加BNCDs的浓度,对槲皮素测定的灵敏度反而降低。因此,本实验选择BNCDs的浓度为2.0×10-6mg/L。
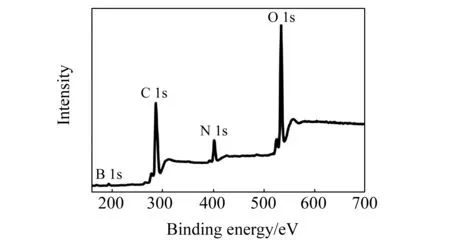
图3 BNCDs的X-射线光电子能谱(XPS)图 Fig.3 XPS of BNCDs
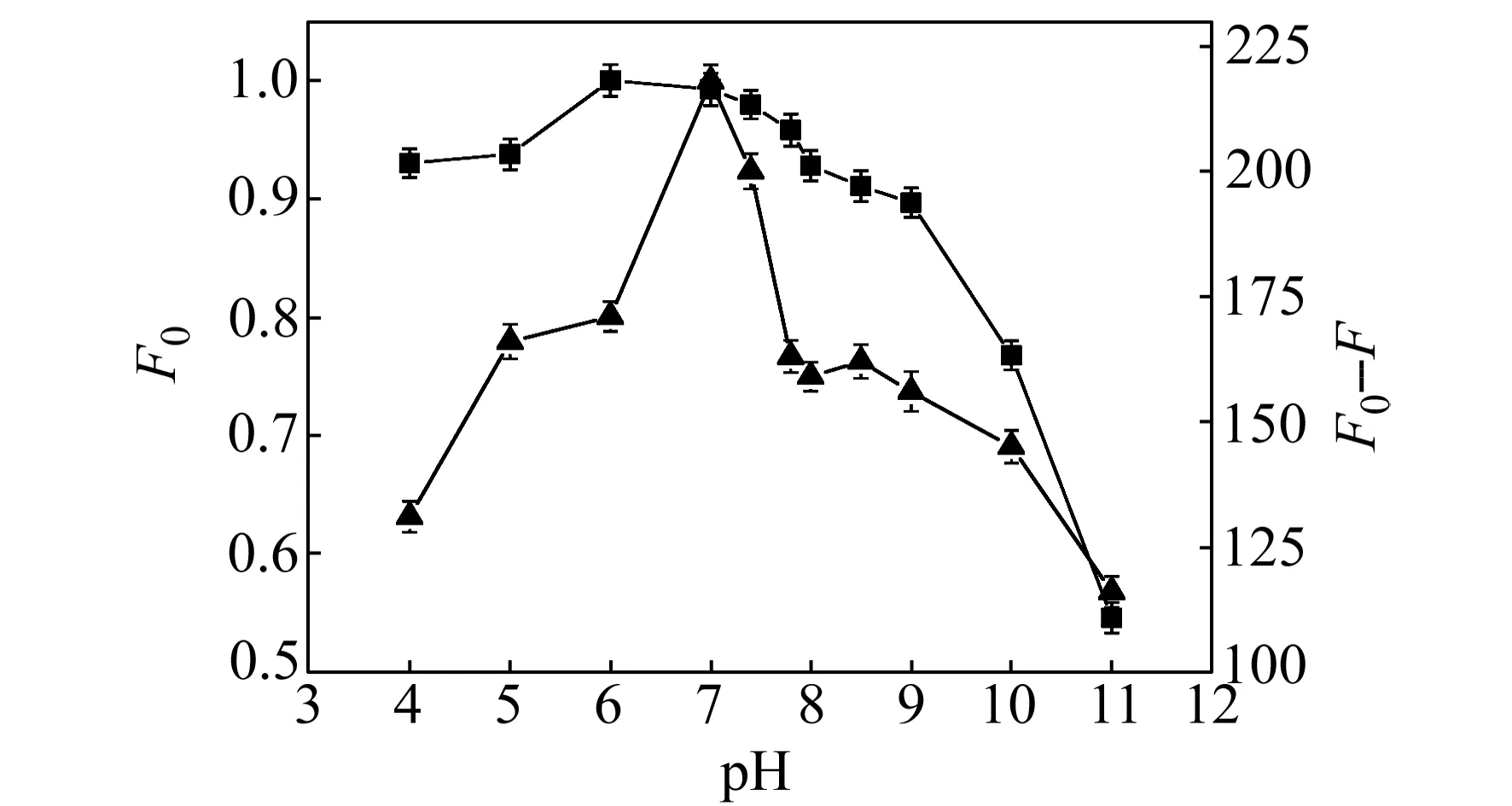
图4 pH对BNCDs以及BNCDs-槲皮素体系荧光强度的影响Fig.4 Effect of pH on fluorescence intensity ) 2.0 μmol/L BNCDs without quercetin;) BNCDs with 10.0 μmol/L quercetin.
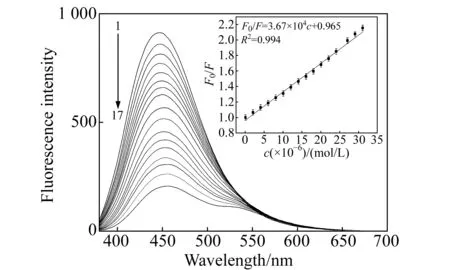
图5 槲皮素浓度对BNCDs荧光强度影响(插图为BNCDs荧光强度变化与槲皮素浓度的线性关系)Fig.5 Effect of quercetin concentration on the fluorescence spectrum of BNCDs(Inset:displays the Lineweaver-Burk plot for the BNCDs and quercetin concentration) top to bottom: concentrations of quercetin:0.0,0.5,1.0,2.0,4.0,6.0,8.0,12.0,14.0,18.0,20.0,24.0,28.0,30.0,32.0,34.0 μmol/L.
2.2.3反应时间的影响本实验研究了在pH=7.0,BNCDs浓度为2.0×10-6mg/L的条件下,探讨了反应时间对荧光强度的影响。我们发现BNCDs的荧光强度在加入槲皮素后的30 s急剧下降,4 min后掺杂碳点的荧光强度趋于稳定,说明反应基本完成,因此实验中反应时间选取为4 min。
2.3 槲皮素对掺杂碳点荧光光谱的影响
在pH=7.0,BNCDs的浓度为2.0×10-6mg/L的实验条件下,不同浓度的槲皮素对BNCDs荧光强度的影响如图5。由图可见,随着槲皮素浓度的逐渐增大,BNCDs的荧光强度逐渐降低。槲皮素浓度在0.0~34.0 μmol/L的范围内与BNCDs的荧光强度变化之间符合Stern-Volmer方程,呈良好的线性关系,图5中的插入图所示的线性方程为:F0/F=3.67×104c+0.965,相关系数(r)为0.994。该方法检出限为47.5 nmol/L。重复测量11次的相对标准偏差为0.324%。
2.4 干扰实验
在最优条件下研究了常见金属阳离子、葡萄糖以及氨基酸对槲皮素测定的干扰,结果见表1。由表中数据可知,常见金属阳离子、葡萄糖以及氨基酸对测定的干扰较小,由此说明该检测方法选择性较好。

表1 共存物质对BNCDs-槲皮素体系的影响Table 1 Effect of coexisting substance on BNCDs and quercetin
(续表1)

InterferentsConcentrationof interferent(μmol/L)Change of fluorescence intensity(%)InterferentsConcentrationof interferent(μmol/L)Change of fluorescence intensity(%)Al3+251.25Serine503.15Co2+25-1.37Histidine50-2.29Cd2+251.03Cysteine503.45Li+251.56Glucose501.43Mn2+251.63Methionine503.17
pH=7.0 PBS;[BNCDs]=2.0×10-6mg/L;[quercetin]=2 μmol/L.
2.5 机理探讨
荧光猝灭过程通常分为静态猝灭和动态猝灭两种。动态猝灭的效率受荧光物质激发态寿命和猝灭剂浓度的影响,不会改变荧光物质的吸收光谱,并且动态猝灭的过程是碰撞过程,与扩散有关,因此温度升高时分子运动加速,使分子的扩散系数增大,猝灭常数增大[16]。静态猝灭是猝灭剂与荧光物质的基态分子发生配合反应,所以荧光物质的吸收光谱会发生变化,且温度升高,配合物的稳定度会下降,猝灭常数减小[17]。因此可以通过吸收光谱和温度对猝灭常数的影响来初步推断荧光猝灭的类型。
实验发现,BNCDs溶液中加入不同浓度的槲皮素(4.0、8.0、12.0、16.0 μmol/L)后,BNCDs的紫外吸收光谱随着槲皮素浓度的增加而升高,初步判断槲皮素与掺杂碳点的基态分子之间形成配合物。图5表明,槲皮素的浓度与该掺杂碳点的荧光强度的变化之间符合Stern-Volmer方程,表2中数据显示掺杂碳点的荧光猝灭常数随着温度的升高而减小。综上所述,我们初步推断槲皮素对掺杂碳点的荧光猝灭主要为静态猝灭。

表2 不同温度下Stern-Volmer方程的参数Table 2 Parameters of Stern-Volmer plots of BNCDs and quercetin
2.6 实际样品分析
尿样取自健康人群。检测前将样品离心分离,测定时取上清液用去离子水稀释1 000倍即可。将所建立的分析方法用于健康人尿液中槲皮素的加标回收实验,结果(表3)表明在人体尿液中槲皮素的回收率在98.7%~101.4%之间。因此该方法可用于实际样品中槲皮素含量的测定。
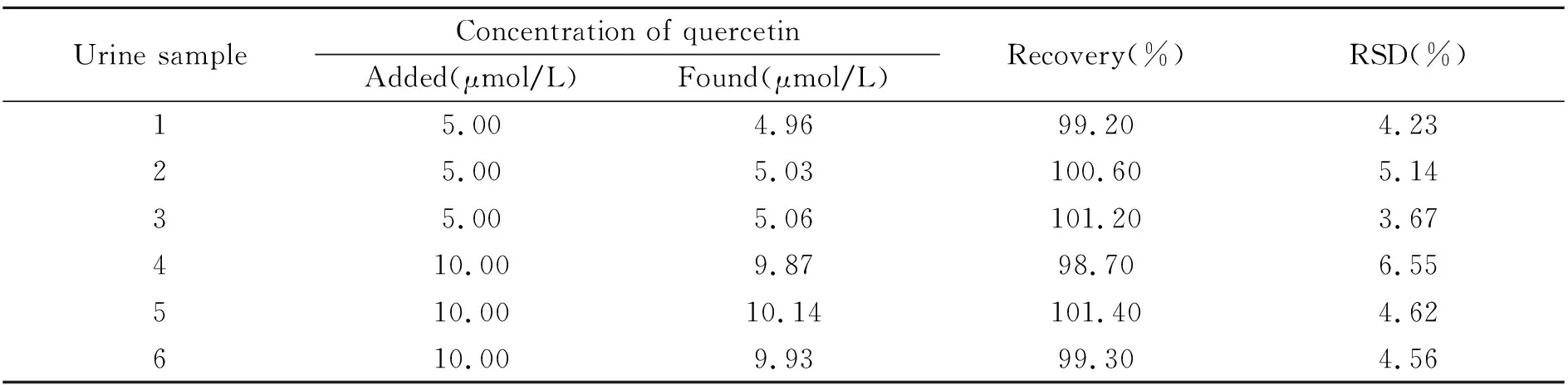
表3 实际样品中槲皮素的测定结果Table 3 Determination results of various real samples
3 结论
本实验成功合成了水溶性的BNCDs,基于槲皮素对该掺杂碳点的荧光猝灭现象建立了一种测定槲皮素含量的荧光分析方法。优化实验条件下槲皮素浓度在0.0~34.0 μmol/L范围与掺杂碳点的荧光强度变化呈良好的线性关系,检出限为47.5 nmol/L。方法操作简单、选择性好,一些常见金属阳离子、葡萄糖以及氨基酸对槲皮素含量测定的干扰很小,回收率实验表明本方法可用于人体尿液中槲皮素含量的测定。
