浅谈纯碱中盐含量分析
2017-10-17
(连云港碱业有限公司,江苏 连云港 222042)
浅谈纯碱中盐含量分析
潘丁文
(连云港碱业有限公司,江苏 连云港 222042)
通过对工业碳酸钠产品盐分检验的几种分析方法(国标与英国标准)进行对比研究,探讨了如何提高检验数据的准确性和代表性,更好地把好出厂产品质量关。
纯碱;氯化钠;汞量法;摩尔法;国标;英国标准;检测
纯碱中盐含量高低对下游用户产品质量影响重大,因此纯碱盐分含量作为纯碱生产过程中的一项主要控制指标。工业碳酸钠产品检验尽管有现成的国家标准分析方法,但由于在实际工作中有些化验员对方法掌握的程度不同,且不少的纯碱用户执行国家标准不严格,或不按国家标准分析,会给检验结果带来一定的偏差,甚至导致检验得到错误的结论,给产品营销系统引起不必要的麻烦。
我国工业碳酸钠国家标准自1963年颁布以来经历了四次修改,现行使用的工业碳酸钠及其试验方法国家标准为GB210.1-2004,是修改采用了英国标准BS3674:1981(1986)《工业碳酸钠》、《工业碳酸钠试验方法》。纯碱的控制指标有:总碱量、氯化钠含量、铁含量、水不溶物、硫酸盐含量等,同时重质纯碱产品指标还有堆积密度和粒度要求。本文针对国家标准方法中一些技术细节,并与相应的国际标准分析方法进行试验对照,现就氯化钠含量的分析检测找出操作的最佳控制条件,结合实际检验工作中遇到的分析技术问题进行了探讨,从而更好地保证纯碱质量检验的准确性和代表性,更好地把好出厂产品质量关。
纯碱中氯化钠含量检测其实就是氯根含量的测定,传统测定方法有摩尔法(银量法)和汞量法,国标采用汞量法和电位滴定法,英国标准也是采用汞量法。
1 国标检验方法(汞量法)
1.1 方法提要
在微酸性的水或乙醇-水溶液中,用强电离的硝酸汞标准滴定溶液将氯离子转化为弱电离的氯化汞,用二苯偶氮碳酰肼指示剂与过量的Hg2+生成紫红色络合物来判断终点。
1.2 试剂
1)硝酸溶液:1+1;
2)硝酸溶液:1+7;
3)氢氧化钠溶液:40 g/L;
4)硝酸汞标准滴定溶液:c[1/2Hg(NO3)2·H2O]约为0.05 mol/L;
5)溴酚蓝指示液:1 g/L;
6)二苯偶氮碳酰肼指示液:5 g/L。
1.3 仪器
滴定管:分度值为0.02 mL或0.05 mL。
1.4 分析步骤
1.4.1 参比溶液的制备
在250 mL锥形瓶中加入40 mL水和2滴溴酚蓝指示液。滴加硝酸溶液(1+7)至溶液由蓝色恰变为黄色,再过量2~3滴。加入1 mL二苯偶氮碳酰肼指示液,用硝酸汞标准滴定溶液滴定至溶液由变为紫红色,记录所用硝酸汞标准滴定溶液的体积。此溶液在使用前制备。
1.4.2 试样的测定
称取约2 g 试样,精确至0.01 g,置于250 mL锥形瓶中。加40 mL水溶解试样,加入2滴溴酚蓝指示液,滴加硝酸溶液(1+1)中和至溶液变黄后,滴加氢氧化钠溶液至试验溶液变蓝,再用硝酸溶液(1+7)调至溶液恰呈黄色再过量2~3滴。加入1 mL二苯偶氮碳酰肼指示液,用硝酸汞标准滴定溶液滴定至溶液由变为与参比溶液(1.4.1)相同的紫红色即为终点。
将滴定后的废液保存起来,按GB/T3051—2000附录的规定进行处理。
1.5 结果计算
氯化物含量以氯化钠(NaCl)的质量分数ω2计,数值以%表示,按下式计算:
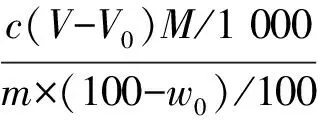
式中:c——硝酸汞标准滴定溶液浓度的准确数值,单位为摩尔每升(mol/L);V——滴定中消耗硝酸汞标准滴定溶液的体积的数值,单位为毫升(mL);V0——参比溶液制备中所消耗硝酸汞标准滴定溶液的体积的数值,单位为毫升(mL);m——试料的质量的数值,单位为克(g);w0——测得的烧失量的质量分数的数值,以%表示;M——氯化钠的摩尔质量的数值(58.44),单位为克每摩尔(g/mol)。
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.02%。
2 国标方法同英国标准方法的对比试验
英国标准也是采用汞量法,和国标的差别主要是样品称取量的不同,英国标准为称取25 g。
2.1 试验过程
样品准备:每天在成品包装口取一个轻灰样品,经用1.18 mm的试验筛除去大颗粒,充分混匀后,置于1 000 mL的干燥广口瓶中,连续10天取10个样(样品编号为1#~10#)。
取以上准备的10个样品,称样量取按2 g、10 g、25 g,按1.4.2的分析步骤操作(溶解时硝酸的量按比增加),分别平行测定四次,取平均值为测定结果。
2.2 测试结果
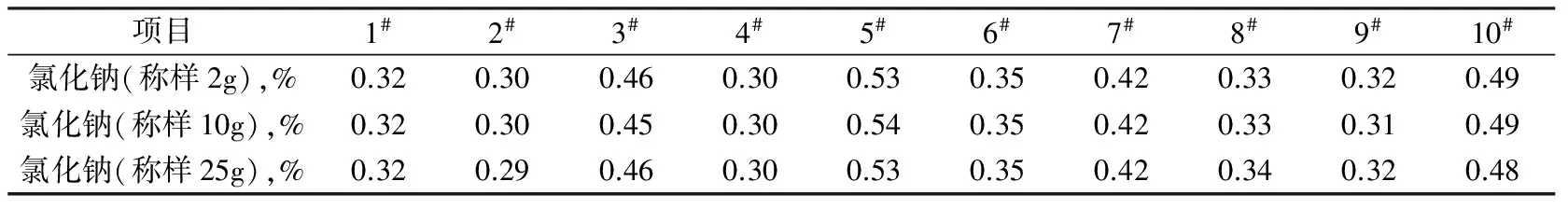
表1 汞量法测试结果
上述每个样品在3种称样量条件下,测得的氯化钠含量的极差≤0.1%,在国标规定的误差范围内。
2.3 试验结论
从以上结果看出,测定纯碱中氯化物含量时,样品的称样量对测定结果没有影响,因为氯化物为可溶性盐,在纯碱中分布较为均匀。因为氯化汞废液有毒,易污染环境,为了尽量减少汞废液的处理量,故一般采用较少的取样量合适。国标中采用取2 g样,英国标准取25 g对分析结果没有影响。
3 摩尔法同汞量法的对比
摩尔法是以铬酸钾为指示剂,采用硝酸银为标准溶液的滴定方法。
3.1 摩尔法的原理
在中性或弱碱性溶液中以铬酸钾为指示剂,用硝酸银标准溶液滴定,反应如下:
Ag++Cl-=AgCl(白色)↓
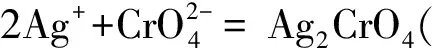
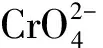
3.2 试验过程
摩尔法测量步骤:称量2.0 g试样,置于250 mL烧杯中,加入少量水溶解,加一滴甲基橙指示剂(1 g/L),缓慢加入硫酸(1+17)至溶液由黄色变为微红色,再加入少许碳酸钙粉末中和至溶液的微红色褪去,加 4滴铬酸钾指示剂(100 g/L),在充分摇动下,用硝酸银标准溶液(0.05 mol/L)滴定至溶液出现微砖红色为终点。
取2.1中准备的10个样品,按上述摩尔法测量,分别平行测定四次,取平均值。
3.3 测定结果
将上述分析结果与相应的汞量法的数据(表1中第一行数据)对比如表2。
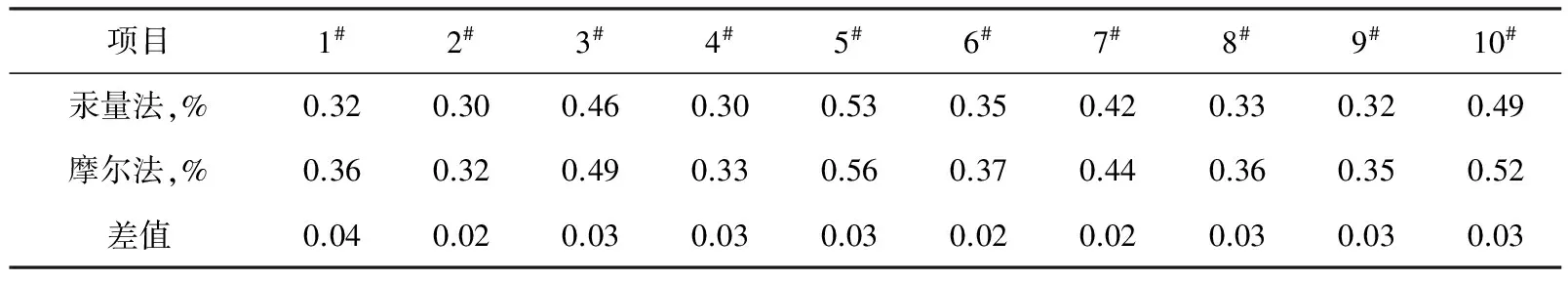
表2 摩尔法与汞量法测试结果比较
3.4 试验结论
从以上数据来看,摩尔法数值偏高0.02%~0.04%,平均偏高0.03%。因此对纯碱质量的出厂检验或仲裁检验应采用汞量法,不能采用摩尔法。
4 在汞量法和摩尔法操作中控制溶液酸度重要性
4.1 摩尔法中酸度的控制
因为H2CrO4的酸性较弱(Ka2=3.2×10-7),Ag2CrO4易溶于酸,即:
所以滴定不能在酸性溶液中进行。但如果溶液的碱性太强,则有Ag2O沉淀析出:
2Ag++2OH-=2AgOH↓ →Ag2O↓+H2O

因此采用摩尔法测定纯碱中的氯化物含量时,溶液的酸度控制非常重要,样品用稀硫酸中和时不能过量,在甲基橙指示剂下刚出现微红色即可,再用少许碳酸钙粉末中和至溶液的微红色褪去;若硫酸过量过多,加入的碳酸钙粉末也要增多,势必影响终点的判断。
4.2 汞量法中酸度的控制
二价汞离子在酸性溶液中与氯离子生成稳定的HgCl2络合物,而二苯偶氮碳酰肼指示剂只有在酸性条件下才与Hg2+生成紫红色的络合物,因此汞量法要求在酸性溶液中进行。
按国标中调节的溶液酸度pH≈3.0,试验中分别在pH=1、2、3、4、5、6条件下,对同一试样的氯化物进行测定,实验发现:在pH=1、2、3、4时,对测定结果没有影响,只是随着酸度的增加(pH=1、2时),试剂空白略为增大;但在pH=5、6时,滴定无法进行,刚开始滴定后就出现深红色,这是因为在pH>5后,二苯偶氮碳酰肼指示剂就由黄色慢慢变为红色,影响溶液颜色,无法滴定。
因此在汞量法中溶液的酸度控制在pH=2~3最佳。
5 汞量法和摩尔法的优劣性比较
从以上分析比较可以看出,汞量法滴定终点变化明显,便于控制,准确度高;缺点其滴定产物是HgCl2有毒,处理比较麻烦,不处理会造成环境污染。而摩尔法滴定终点不敏锐,测定结果略微偏高0.03%,但其滴定产物AgCl可回收利用。因此,一般情况下在出厂检验中应采用汞量法,在生产过程控制中宜采用摩尔法。
[1] 武汉大学.分析化学(2版)[M].北京:高等教育出版社,1978
[2] 李国瑞,陈歆文.纯碱生产分析[M].沈阳:辽宁科学技术出版社,1989
[3] I.M.科尔索夫[美].南京化工学院分析化学校研室译.定量化学分析(中册)[M].北京:高等教育出版社,1987
[4] GB210-2004工业碳酸钠及其试验方法[S]
[5] GB3051-2000无机化工产品中氯化物含量测定的通用方法 汞量法[S]
TQ114.1
A
1005-8370(2017)05-18-03
2017-06-22
潘丁文,男,1965年出生,大学,高工,现从事技术管理工作。
