踝臂指数和无症状颅内动脉狭窄的相关性
2017-10-17张舒凤赵性泉
张舒凤,张 倩,赵性泉
踝臂指数和无症状颅内动脉狭窄的相关性
张舒凤1,张 倩2,赵性泉2
目的研究踝臂指数(ABI)和无症状颅内动脉狭窄(ICAS)的相关性。方法随机抽取5206名研究对象,进行问卷调查、体格检查、实验室检查及经颅多普勒超声(TCD)、ABI检测。颅内动脉狭窄依据经颅多普勒(TCD)诊断;ABI分类依据 2011 ACCF/AHA 指南: 异常ABI(ABI≤0.90), 临界ABI(0.91~0.99),正常ABI(1.00~1.40)。ABI与ICAS的相关性采用多因素 logistic 回归分析。结果临界ABI(0.91~0.99)(OR=1.364,95%CI:1.024~1.818)和异常ABI(ABI≤0.90)(OR=1.890, 95%CI:1.345~2.658)均与无症状颅内动脉狭窄相关。进一步分组研究显示:在男性中, ABI≤0.90与ICAS密切相关(OR=2.143,95%CI:1.419~3.235) ,但在女性中,两者则无明显相关性。在60岁以上人群中,临界ABI(0.91~0.99)及ABI≤0.90均与ICAS的发生密切相关,OR值分别为1.963(95%CI:1.252~3.079)和2.771(95%CI:1.788~4.293),但在60岁以下人群中临界ABI及异常ABI均与ICAS无关。结论在无症状人群中,ABI可以作为颅内动脉狭窄的风险评估指标,但其检测价值因不同性别及年龄而不同。
无症状颅内动脉狭窄;ICAS;踝臂指数;ABI;危险因素
踝臂指数(Ankle Brachial Index,ABI)通过计算踝部动脉与肱动脉收缩压比值获得。早在1950年Winsor[1]对这一指数进行了描述,后来有学者提出ABI可以作为诊断和评估下肢动脉粥样硬化和狭窄程度(外周动脉病,PAD)的一个重要指标[2,3],并被认为是广泛动脉粥样硬化的标志[4-6]。基于一般人群的队列研究报道, ABI可作为心血管事件的独立预测标记,ABI≤0.9与心脑血管事件及全因死亡风险相关[7-9]。2005年ACC/AHA (American College of Cardiology/American Heart Association)指南推荐:在50岁以上合并糖尿病或吸烟、及70岁以上老年人中检测ABI,可以改进心血管疾病的风险评估,并有助于患者获得早期治疗[10]。基于德国getABI队列研究结果,2011年ACC/AHA指南[11]推荐在65岁以上老年人中进行ABI筛查,该研究对6880名65岁以上的老年人随访5年后发现:ABI是心脑血管事件发生的一个很好的预测指标[12]。一项对16个队列研究荟萃分析的结果显示,ABI与弗明翰评分(FRS)联合评价可提高心血管事件预测的准确性[13]。基于上述研究结果,我们设想:ABI作为广泛动脉粥样硬化的重要指标,是否与无症状颅内动脉狭窄有一定的相关性呢? 笔者基于基线资料进行了横断面的分析,从不同性别、不同年龄分组研究踝臂指数与无症状颅内动脉狭窄(ICAS)的相关性,希望为临床工作及下一步流行病学研究提供一定的理论基础和方向。
1 对象与方法
1.1 对象 均来自开滦集团的职工,参考人群共101 510名(包括离退休者,其中男性81 110名, 女性20 400名)。根据国家统计局2010年统计数据中的年龄、性别构成,从参考人群中按照性别、年龄分层(每2岁为一层)随机抽样,参考黄家星教授以往的研究结果,无症状颅内动脉狭窄患病率约为7%,设定抽样条件为α=0.05,精确度0.7%,估计应答率在80%以上,计算得出校正样本量。最后共抽样7000名。2010-06至 2011-06进行抽样,最后共有5852名同意参与,但在基线调查启动前,有36名退出,剩余5816名,进一步排除不符合入选标准的,剩余5440人参与研究,并全部签署知情同意书,剔除了ABI基线资料不完整的及ABI>1.40的部分,剩余5206名研究对象纳入分析。入选标准:(1)年龄40岁以上(包括40岁);(2)通过问卷调查,否认有卒中、短暂性脑缺血发作及冠心病史;(3)经过有经验的神经科医师判断,没有卒中相关的神经功能缺损体征[14,15]。
1.2 方法 调查问卷均由经过统一培训的有经验的医师与研究对象面对面地填写。通过问卷调查收集研究对象的一般人口学资料、行为生活方式、家族史、患病情况及相应疾病的服药情况,同时对每位研究对象进行体格检查、实验室检查及经颅多普勒超声检查(TCD)、踝臂指数(ABI)检测。
1.3 内容及相关定义 调查问卷的内容包括:研究对象基本信息(人口学特征、职业状况、收入状况、联系方式等)、行为因素(吸烟、饮酒、体育活动量及饮食习惯、睡眠情况等)、患病情况与家族史(糖尿病、高血压、高脂血症、心脑血管疾病、恶性肿瘤等)及相应疾病的服药情况。调查问卷中各相关危险因素的定义:(1)吸烟:本文中吸烟定义为在调查日之前30 d内吸过烟。(2)饮酒:指重度饮酒:≥5个标准饮酒量/d;饮酒量的定义:1 个标准饮酒量相当于120 ml(2.5 两)葡萄酒、360 ml(1 听)啤酒或45 ml(1 两左右)白酒。(3)疾病史:询问研究对象既往有无高血压、糖尿病、血脂异常、心脑血管疾病、恶性肿瘤、职业病都应有相关医疗文书所证实,或确定被医师诊断过,或曾经服用相关药物。若既往患者不知患有某病,而调查时被检查出来,此时认为患者既往不患有此病。(4)家族史:询问被调查者一级亲属中下列疾病史:糖尿病家族史,高血压家族史、血脂异常家族史、心脑血管疾病家族史等直系亲属既往疾病史,都应有相关医疗文书所证实,或确定被诊断过,或曾经服用相关药物。
1.4 TCD的检查 由经过天坛医院统一培训并取得认证的四名医师操作。使用便携TCD检查仪(EME Companion, Nicolet, Madison, WI, USA),颅内血管狭窄参考黄家星教授的诊断标准。狭窄动脉依据收缩期峰值流速来定义:大脑中动脉>140 cm/s ,大脑前动脉>120 cm/s,大脑后动脉和椎基底动脉>100 cm /s,颈内动脉虹吸部>120 cm/s。除此以外,还考虑患者年龄、湍流及血管杂音及局限性血流速度增快[16]。
1.5 ABI检测及分类 ABI的测量方法[17]:由熟练的专业技术人员使用多普勒(Doppler)辅助听诊法,在受检者取仰卧位的情况下,分别测量踝部[胫后动脉和(或)足背动脉]和上臂血压,计算出ABI。取同侧足背动脉和胫后动脉血压两者之中高者作为分子,肱动脉血压使用双臂的平均血压,如果双侧血压差别大于10 mmHg,则再次测量高的那一侧,并取最后一次测量值作为分母;每一侧踝部与上臂收缩压的比值为ABI,依此分别计算出左右两侧的ABI值,取左右两侧ABI中较小的值参与ABI的分类。对于单侧检测不到血流信号,而另一侧ABI值在1.0~1.4正常范围之内者,因没有进一步进行其他检查以确诊,作为缺失数据;如果一侧检测不到血流信号,而另一侧ABI值≤0.9,则依据检测到的这一侧进行分类分析。ABI的分类:参考2011年ACCF/AHA(College of Cardiology Foundation/American Heart Association)指南:正常范围1.00~1.40;异常值定义为≤0.90;0.91~0.99为临界范围;>1.40提示动脉严重钙化,管壁僵硬。
1.6 实验室检查 实验室检查包括血常规、血糖、血脂、血尿酸、高敏C-反应蛋白、同型半胱氨酸等。研究对象的血液标本于空腹12 h(至少空腹8 h)后次日上午7:30 到9:00 采自肘前静脉,收集于真空管内,在室温24 ℃下,经过3000×g 离心10 min,取上层血清在4 h内进行测量。在日立7606 型全自动生化仪上进行分析。
1.7 确定诊断依据
1.7.1 高血压 在调查时如果研究对象对以下3 个问题有一个回答“是”,则确定其患高血压:(1)以前被医师确诊为高血压;(2)正在服用降压药物;(3)查体发现收缩压≥140 mmHg,或舒张压≥90 mmHg。
1.7.2 糖尿病 在调查时如果研究对象对以下3个问题有一个回答“是”,则确定其患糖尿病:(1)空腹血糖≥7 mmol/L;(2)以前被医师确诊为糖尿病;(3)正在使用降糖药物或者正在使用胰岛素。
1.7.3 脂代谢异常 (1)以前被医师确诊为高脂血症;(2)正在服用降脂药物;(3)总胆固醇≥200 mg/dl,或者HDL<40 mg/dL, 或者 LDL≥130 mg/dl, 或者三酰甘油≥150 mg/dl。左心室肥厚:根据十二导联心电图结果,采用Sokolow-Lyon(SV1+RV5/6)和Cornell(女RaVL+SV3+0.8 mV;男RaVL+SV3)诊断标准:Sokolow-Lyon voltage>3.5 mV,Cornell voltage>2.8 mV。

2 结 果
2.1 ABI分布情况及基线资料比较 5206名研究对象中,ABI≤0.9所占比例为4.0%,其中女性3.2%(67人),男性4.6%(143人);颅内动脉狭窄组(ICAS)中,ABI≤0.9所占比例为8.3%,无狭窄组中所占比例为3.4%,组间存在统计学差异(P<0.001,表1)。


指标总体(n=5206)ABI≤0.9(n=210)ABI(0.91~1.40)(n=4996)P年龄(岁)55.13±11.7861.40±15.5254.87±11.520.000男性(n;%)3121(60.0)143(68.1)2978(59.6)0.014体重指数(kg/m2)24.94±3.2625.28±3.9724.93±3.230.210C反应蛋白(mg/dL)2.13±4.183.71±9.282.06±3.810.012同型半胱氨酸(μmol/L)15.89±9.5918.67±10.8515.77±9.510.000≥60岁(n;%)1437(27.6)99(47.1)1338(26.8)0.000高血压(n;%)2506(48.1)127(60.5)2379(47.6)0.000糖尿病(n;%)629(12.1)53(25.2)576(11.5)0.000脂代谢异常(n;%)2531(48.6)106(50.5)2425(48.5)0.582吸烟(n;%)1670(32.1)71(33.8)1599(32.0)0.583ICAS(n;%)696(13.4)58(27.6)638(12.8)0.000
2.2 ABI与ICAS相关性分析 多因素logistic回归分析结果显示(表2):年龄≥50岁、高血压、糖尿病、左心室肥厚、高敏C反应蛋白、临界ABI(0.91~0.99) 及ABI≤0.90均与ICAS的发生相关。
2.3 不同性别ABI与ICAS相关性分析 将5206名研究对象按照性别分为两组,结果显示:男性和女性发生ICAS的相关危险因素不同,与踝臂指数的相关程度也因性别而异(表3)。女性中,ABI≤0.90及临界ABI均与ICAS的发生无关。男性中,ABI≤0.90(OR=2.143,95%CI:1.419~3.235)与ICAS密切相关,临界ABI与ICAS的相关性则不显著,OR=1.468(95%CI:0.998~2.161)。
2.4 不同年龄组踝臂指数和ICAS相关性分析(表4) 将5206名研究对象根据年龄(<60岁,≥60 y)进行分组,结果为:<60岁组中,临界ABI(0.91-0.99)和ABI≤0.90与颅内动脉狭窄均没有明显相关性。而在60岁以上人群中,临界ABI和ABI≤0.90发生颅内动脉狭窄的OR值分别为1.963(1.252~3.079),2.771(1.788~4.293)。

表2 ICAS的危险因素分析
注:①调整年龄、体重指数(BMI), 吸烟,高血压、血脂异常、糖尿病、左心室肥厚(LVH)、高敏C反应蛋白(hs-CRP)、血清同型半胱氨酸(HCY)和踝臂指数(ABI);②与对照组相比,P<0.05
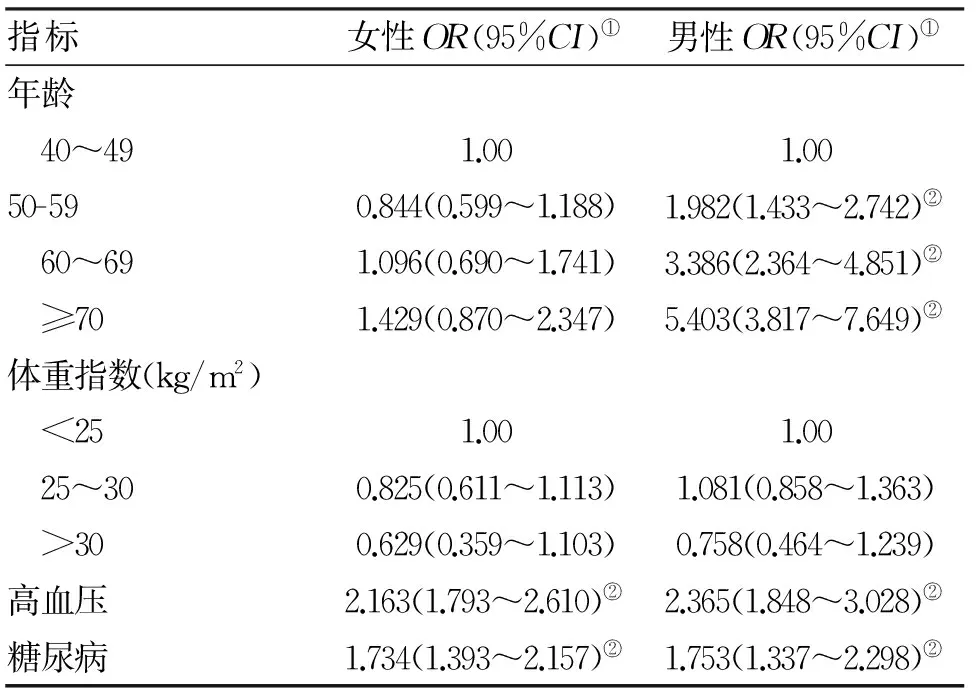
表3 男性和女性颅内动脉狭窄的相关因素分析结果

(续表)
注:①调整年龄、体重指数(BMI), 吸烟,高血压、血脂异常、糖尿病、左心室肥厚(LVH)、高敏C反应蛋白(hs-CRP)、血清同型半胱氨酸(HCY)和踝臂指数(ABI);②与对照组相比,P<0.05

表4 根据年龄分组后颅内动脉狭窄的相关因素分析结果
注:①调整年龄、体重指数(BMI)、吸烟、高血压、血脂异常、糖尿病、左室高电压(LVH)、高敏C反应蛋白(hs-CRP)、血清同型半胱氨酸(HCY)、踝臂指数(ABI);②与对照组相比,P<0.05
3 讨 论
本研究40岁以上人群中,ABI≤0.9发生率为4%,而在颅内动脉狭窄组ABI≤0.9的发生率远远高于一般人群。排除了其他混杂因素之后,异常ABI(≤0.9)与临界ABI(0.91~0.99)都与无症状颅内动脉狭窄独立相关。有研究已证实外周动脉病(PAD)和颈动脉粥样硬化有密切相关性,但与颅内动脉狭窄的关系目前尚无定论。以往的研究发现,ABI<1.0与亚临床的冠状动脉和颈动脉粥样硬化(颈总动脉内中膜厚度)密切相关[4,18]。Barcelona- AsIA 对高加索人群的研究报道, ABI ≤0.90使中-重度的无症状颅外或颅内动脉狭窄的风险增加5倍[19]。大口径的弹力层为主的动脉(如颈动脉)与中口径的肌层为主的动脉(如冠状动脉和颅内动脉)发生动脉粥样硬化机制可能存在不同[20],且颅内动脉狭窄与颅外动脉狭窄在不同种族之间患病率不同,故这两种动脉狭窄与ABI的相关性可能也不相同,应分别进行研究。
虽然针对所有研究对象的分析结果显示ABI≤0.90与临界ABI都与颅内动脉狭窄独立相关,但这种相关性存在明显的性别差异,根据性别进行分组后的研究发现:女性中,ABI≤0.90及临界ABI均与颅内动脉狭窄的发生无相关性,而在男性中,ABI≤0.90与颅内动脉狭窄相关。关于不同性别中ABI与ICAS的相关性差异,目前尚无其他研究支持并很好地解释这一结果。虽然2011年ACCF/AHA指南中并未对男女PAD分别定义,但以往的很多流行病学研究发现:健康人群中,女性ABI值低于男性,差别为0.02。NHANES研究和ARIC研究的结果均显示:用ABI<0.9来定义PAD,在40~59岁年龄组中,女性的患病率是男性的两倍。ARIC研究还发现,ABI<0.8或0.85作为界限定义时,男性的患病率高于女性,而采用ABI<0.9或0.95作为界限定义时,结果却相反[21]。同样,在关于心血管事件及死亡风险预测的队列研究也发现,ABI≤0.9的患者发生风险在男性中的HR值为4.2(95%可信区间3.5~5.4),女性的HR值为3.5(95%可信区间2.4~5.1)[5]。目前尚不能确定不同性别间是否存在一些内在的解剖和生理差别,这种差别部分地影响着ABI的数值。但由此产生了一个问题,不同性别间ABI的这种差别虽然细微,但是有统计学意义的,如果不同性别采用统一定义,可能会对流行病学研究结果产生一定的影响。另外,ABI还受种族的影响,McDermott等[22]的研究结果显示:女性中,ABI与亚临床动脉粥样硬化(颈内动脉内中膜厚度)的这种相关性在中国人中较弱,而在高加索及非裔美国人中相关性较强;而男性无此差别。本研究结果的意义给我们提示,在男性中,ABI≤0.9与颅内动脉狭窄密切相关,可能对颅内动脉狭窄存在一定的预测作用,相对于正常ABI而言,发生ICAS的危险度增加了一倍(OR=2.143),而在女性中,ABI的测量数值需要慎重解读。
研究已证实,年龄是ICAS和PAD的确定的危险因素[23,24],ABI与颅内动脉狭窄的相关性也因年龄而不同。本文研究结果显示:60岁以下人群中ABI与颅内动脉狭窄无关,而在60岁以上老年组中,ABI≤0.9及临界ABI均与颅内动脉狭窄的发生密切相关,且ABI值越小,与颅内动脉狭窄的相关性越强。ABI为0.91-0.99时,发生颅内动脉狭窄的风险增加近1倍(OR=1.963);若ABI≤0.9,则风险增加近2倍(OR=2.771)。ARIC研究也显示:调整FRS后,ABI在65岁以上人群中对心脑血管事件的预测价值要高于45~64岁人群[25-27]。目前关于ABI及PAD的指南源于PARTNERS[28]研究和getABI[12]研究结论,而前者研究对象为70岁以上老年人及50~69岁合并糖尿病或吸烟10年以上者,后者研究对象为65岁以上,均基于老年患者或/合并危险因素者。本研究在60岁以下人群中亦未发现ABI和颅内动脉狭窄的相关性,但我们可以推断,在60岁以上的人群中,ABI的检测可能会更有意义,作为一种简便易行的检测工具,不仅可以对下肢动脉粥样硬化进行评估,还可以对其他亚临床的动脉粥样硬化,包括颅内动脉狭窄进行一定程度的风险评估。
本研究是大样本的基于社区一般人群的关于踝臂指数和颅内动脉狭窄相关性的研究,但也存在一些不足。首先,本研究设计是一个前瞻性的队列研究,但本文只进行了横断面的分析,故得出的结论仍需要以后的研究进一步证实,本研究结果只能为以后的研究提供一定的思路和方向。其次,本研究中男女使用的是同样的ABI界定标准,因为目前公认女性ABI正常值低于男性,这可能会高估了女性外周动脉病的患病率,对实际的结果存在一定的影响。但目前所有的研究包括指南均未对不同性别采取不同的界定标注,这也是以后研究要进一步解决的问题。
[1] Winsor T. Influence of arterial disease on the systolic blood pressure gradients of the extremity [J]. Am J Med Sci,1950,220:117-126.
[2] Yao S T, Hobbs J T, Irvine W T. Ankle systolic pressure measurements in arterial disease affecting the lower extremities[J]. Br J Surg, 1969,56:676-679.
[3] Carter S A. Indirect systolic pressures and pulse waves in arterial occlusive diseases of the lower extremities[J]. Circulation, 1968,37:624-637.
[4] McDermott M M, Guralnik J M, Tian L,etal. Associations of borderline and low normal ankle-brachial index values with functional decline at 5-year follow-up: The walcs (walking and leg circulation study) [J]. J Am Coll Cardiol,2009, 53:1056-1062.
[5] Fowkes F G, Murray G D, Butcher I,etal. Ankle brachial index combined with framingham risk score to predict cardiovascular events and mortality: A meta-analysis [J].JAMA, 2008, 300:197-208.
[6] Criqui M H, Langer R D, Fronek A,etal. Mortality over a period of 10 years in patients with peripheral arterial disease[J]. New Engl J Med, 1992, 326:381-386.
[7] Bouisset F, Bongard V, Ruidavets J-B,etal. Prognostic usefulness of clinical and subclinical peripheral arterial disease in men with stable coronary heart disease [J]. Am J Cardiol, 2012, 110:197-202.
[8] Aboyans V, McClelland R L, Allison M A,etal. Lower extremity peripheral artery disease in the absence of traditional risk factors. The multi-ethnic study of atherosclerosis [J]. Atherosclerosis, 2011, 214:169-173.
[9] Papamichael C M,Lekakis J P,Stamatelopoulos KS,etal. Ankle-brachial index as a predictor of the extent of coronary atherosclerosis and cardiovascular events in patients with coronary artery disease[J]. Am J Cardiol,2000, 86(6):615-618.
[10] Hirsch A T, Haskal Z J, Hertzer N R,etal. ACCF/AHA 2005 practice guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): A collaborative report from the american association for vascular surgery/society for vascular surgery, society for cardiovascular angiography and interventions, society for vascular medicine and biology, society of interventional radiology, and the acc/aha task force on practice guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease): Endorsed by the american association of cardiovascular and pulmonary rehabilitation; national heart, lung, and blood institute; society for vascular nursing; transatlantic inter-society consensus; and vascular disease foundation[J]. Circulation, 2006,113: e463-654.
[11] Rooke T W, Hirsch A T, Misra S,etal. 2011 ACCF/AHA focused update of the guideline for the management of patients with peripheral artery disease (updating the 2005 guideline) [J]. J Am Coll Cardiol, 2011,58:2020-2045.
[12] Diehm C, Allenberg J R, Pittrow D,etal. Mortality and vascular morbidity in older adults with asymptomatic versus symptomatic peripheral artery disease[J]. Circulation, 2009, 120:2053-2061.
[13] Ankle Brachial Index Collaboration. Ankle brachial index combined with framingham risk score to predict cardiovascular events and mortality:a meta-analysis[J]. JAMA, 2008, 300:197-208.
[14] Y Zhou, Y Li, L Xu,etal. Asymptomatic Polyvascular Abnormalities in Community (APAC) Study in China: objectives, design and baseline characteristics[J]. PLOS ONE, 2013, 8(12): e84685.
[15] S Zhang, Y Zhou, Y Zhang,etal. Prevalence and risk factors of asymptomatic intracranial arterial stenosis in a community-based population of Chinese adults[J]. Eur J Neurol, 2013, 20: 1479-1485.
[16] Wong K S, Huang Y N, Yang H B,etal. A door-to-door survey of intracranial atherosclerosis in liangbei county, china [J]. Neurology, 2007, 68: 2031-2034.
[17] Aboyans V,Criqui M H,Abraham P,etal. Measurement and interpretation of the ankle-brachial index: a scientific statement from the American Heart Association[J]. Circulation,2012,126(24):2890-2909.
[18] Razzouk L, Rockman C B, Patel M R,etal. Co-existence of vascular disease in different arterial beds: peripheral artery disease and carotid artery stenosis--Data from Life Line Screening (?)[J].Atherosclerosis, 2015, 241(2):687-691.
[19] Jiménez M, Dorado L, Hernández-Pérez M,etal. Ankle-brachial index in screening for asymptomatic carotid and intracranial atherosclerosis [J]. Atherosclerosis, 2014, 233(1):72-75.
[20] Watanabe M, Kimura K, Iguchi Y,etal. Peripheral arterial atherosclerosis in patients with extracranial, not intracranial, arterial stenosis[J]. Internal Med, 2010,49:1515-1519.
[21] Tsai A W, Folsom A R, Rosamond W D,etal. Ankle-brachial index and 7-year ischemic stroke incidence: The aric study[J]. Stroke, 2001,32:1721-1724.
[22] McDermott M M. Ankle-brachial index and subclinical cardiac and carotid disease: the multi-ethnic study of atherosclerosis[J]. Am J Epidemiol, 2005,162:33-41.
[23] Menke A, Muntner P, Wildman R P,etal. Relation of borderline peripheral arterial disease to cardiovascular disease risk [J]. Am J Cardiol, 2006, 98(9): 1226-1230.
[24] Savji N,Rockman C B,Skolnick A H,etal.Association between advanced age and vascular disease in different arterial territories: a population database of over 3.6 million subjects [J]. J Am Coll Cardiol, 2013, 61(16):1736-1743.
[25] Weatherley B D, Nelson J J, Heiss G,etal. The association of the ankle-brachial index with incident coronary heart disease: the Atherosclerosis Risk In Communities (ARIC) study, 1987-2001[J]. BMC Cardiovasc Diso, 2007, 7:3.
[26] Murphy T P, Dhangana R, Pencina M J,etal. Ankle-brachial index and cardiovascular risk prediction: an analysis of 11,594 individuals with 10-year follow up[J]. Atherosclerosis, 2012, 220(1):160-167.
[27] Tsai A W, Folsom A R, Rosamond W D,etal. Ankle-brachial index and 7-year ischemic stroke incidence: the ARIC study [J]. Stroke, 2001, 32(8):1721-1724.
[28] Hirsch A T,Criqui M H,Treat-Jacobson D,etal. Peripheral arterial disease detection,awareness, and treatment in primary care[J]. JAMA,2001,286(11):1317-1324.
(2017-04-16收稿 2017-06-20修回)
(责任编辑 张 楠)
RelationshipsbetweenanklebrachialindexesandasymptomaticintracranialarterialstenosisinaChinesecommunity-basedpopulation
ZHANG Shufeng1, ZHANG Qian2,and ZHAO Xingquan2.
1.Department of Neurology, General Hospital of Chinese People’s Armed Police Force, Beijing, 100039, China;2.Department of Neurology, Beijing Tiantan Hospital, Capital Medical University, Beijing, 100050,China
ObjectiveTo study the relationships between the low ABI and asymptomatic intracranial artery stenosis (ICAS).MethodsThe current study involved 5206 participants. ICAS was assessed by Transcranial Doppler. ABI was defined and categorized according to the 2011 ACCF/AHA guideline: abnormal ABI(ABI≤0.90), borderline ABI( 0.91-0.99), normal ABI(1.00-1.40). Logistic regression analysis was used to study the association between a low ABI and the risk of ICAS.ResultsAfter adjustment for possible confounders, borderline ABI(OR=1.364, 95%CI:1.024-1.818) and abnormal ABI (OR=1.890,95%CI:1.345-2.658)were both found to be significantly related to asymptomatic ICAS in all the participants. Further subgroup analysis revealed that males with an abnormal ABI were more than twice (OR=2.143, 95%CI:1.419-3.235) as vulnerable to ICAS as those with a normal ABI,but not so in women. In participants aged 60 or above, borderline ABI and abnormal ABI were both associated with ICAS, and OR was 1.963(95%CI:1.252-3.079) and 2.771(95%CI:1.788-4.293) respectively.ConclusionsABI can be considered an index for assessment of risks of ICAS among asymptomatic people, but this association varies with age and gender.
asymptomatic intracranial atherosclerosis; ICAS;ankle brachial index; ABI; risk factors
R743
张舒凤,博士,主治医师。
1.100039 北京,武警总医院神经内科;2.100050 北京,首都医科大学附属天坛医院神经内科
赵性泉,E-mail:zxq@vip.163.com
