硫辛酸对慢性酒精性周围神经病同型半胱氨酸、超敏C反应蛋白及临床症状的作用
2017-10-17王军文温慧军
王军文, 温慧军
治疗
硫辛酸对慢性酒精性周围神经病同型半胱氨酸、超敏C反应蛋白及临床症状的作用
王军文, 温慧军
目的观察硫辛酸对慢性酒精性周围神经病(CAPN) 的同型半胱氨酸(HCY)、超敏C反应蛋白(Hs-CRP)及临床症状的作用。方法将46例CAPN 患者随机分为治疗组和对照组,治疗组给予硫辛酸静脉滴注,0.6 g/d;对照组给予甲钴胺注射液避光静脉滴注500 ug/d,连用14 d,比较两组患者治疗前、治疗后HCY及Hs-CRP及变化,并以神经系统症状评分,以评价其疗效。结果治疗后2组患者HCY及Hs-CRP水平明显降低,与治疗前比较,差异有统计学意(P<0.05),且治疗组Hs-CRP及Hs-CRP水平显著低于对照组,差异有统计学意义(P<0.05);治疗后两组临床症状评分均降低,与治疗前比较,差异有统计学意义(P<0.05),且治疗组临床症状评分显著低于对照组,差异有统计学意义(P<0.05)。治疗期间2组患者均未出现明显不良反应。结论硫辛酸可降低CAPN患者HCY及Hs-CRP水平,显著改善患者临床症状,值得应用及研究。
硫辛酸; 慢性酒精性周围神经病; 同型半胱氨酸; 超敏C反应蛋白
Abstract:ObjectiveTo observe the effect of lipoic acid on homocysteine (HCY),hypersensitive C reactive protein (Hs-CRP) and clinical symptoms of patients with chronic alcoholic peripheral neuropathy (CAPN).Methods46 cases of CAPN patients were randomly divided into treatment group and control group,the treatment group was given intravenous injection of lipoic acid 0.6g/d;the control group was given intravenous infusion of Mecobalamin injection light is 500ug/d. After 14 days treatment,to compare the changes of HCY and Hs-CRP in two groups,to evaluate the scores of nervous system symptoms and efficacy.ResultsAfter treatment,the levels of HCY and Hs-CRP in the two groups were significantly decreased,compared with before treatment,the difference was statistically significant (P<0.05),the levels of HCY and Hs-CRP in the treatment group were significantly lower than those in the control group,the difference was statistically significant(P<0.05). Compared with before treatment,the clinical symptoms of the two groups were reduced,the difference was statistically significant (P<0.05),and the treatment group clinical symptom score was significantly lower than the control group,the difference was statistically significant(P<0.05)ConclusionLipoic acid can reduce the level of HCY and Hs-CRP of CAPN patients,significantly improve the clinical symptoms of patients. It is beneficial to the prognosis,is worthy of large-scale application and research.
Keywords: Lipoic acid; Chronic alcoholic peripheral neuropathy; Homocysteine; Hypersensitive C reactive protein
既往基础及临床研究表明,慢性酒精中毒引起的神经系统损害以周围神经发病率最高,而且饮酒量越大、时间越长,周围神经损害越重[1],酒精引起的神经元死亡与炎症反应及氧化应激反应增加和氧化酶的诱导有关[2]。因此,改善机体氧化应激和炎症因子水平是防治CAPN患者周围神经损害的有效措施之一。国内有研究表明,α-硫辛酸对周围神经病变症状及肢体远端运动有改善作用[3]。有关硫辛酸对CAPN患者HCY、Hs-CRP的临床研究报道很少。本研究探讨硫辛酸对CAPN患者同型半胱氨酸、超敏C反应蛋白及临床症状的作用。
1 资料与方法
1.1 一般资料 选择2015年5月~2017 年3月在本院神经内科就诊的46例CAPN患者,其中男32例,女24例,随机分为治疗组和对照组,每组21例,平均年龄(60.3±3.5)岁。根据Goodwin 等[4]提出的酒精中毒的入选标准:(1)饮酒史,每日饮酒,每次150 g,至少1 y以上,日饮酒量按酒精含量计均超过150 g/d;(2)慢性进行性周围神经受累的症状和体征;(3)排除了其他疾病所致的周围神经损害。两组患者年龄、性别、饮酒年限及病史等一般临床资料无显著性差异(P>0.05),具有可比性。
1.2 治疗方法
1.2.1 给药方法 对照组给予甲钴胺注射液加入100 ml 0.9%氯化钠溶液中避光静脉滴注,500 μg /次,1 次/d;治疗组以注射用硫辛酸加入250 ml 0.9%氯化钠溶液中静脉滴注,每次0.6 g,1 次/d,疗程为14 d,观察两组患者治疗前后HCY及Hs-CRP水平,以及患者临床症状改善情况。
1.2.2 神经系统症状评分标准(NSS评分)[5,6](1)患者下肢麻木、灼痛或刺痛2分;(2)乏力、下肢痉挛或隐痛1分;(3)无上述症状0分;(4)上述症状出现在足部2分,小腿1分,其他部位0分;(5)出现在白天0分,全天1分,夜间2分,若因疼痛或不适从睡眠中惊醒加1 分。轻度:3~4分,中度:5~6分,重度:7~9分。
1.2.3 标本的采集 所有CAPN患者均于住院第2 d及治疗2 w后晨起空腹抽取肘正中静脉血5 ml,其中2 ml血液加肝素抗凝,混匀,立即低温离心后,取血浆置-20 ℃冰箱待测。
1.2.4 血浆HCY、Hs-CRP的测定 用本院德国生产OLYMPUS AU2700全自动生化分析仪,采用胶乳增强免疫透射比浊法测定Hs-CRP水平,循环酶法测定HCY水平。
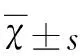
2 结 果
2.1 两组治疗前后NSS评分比较 治疗前,两组患者NSS评分无显著性差异(P>0.05),治疗14 d 后,两组NSS评分均降低,与治疗前比较,差异有统计学意义(P<0.05);且治疗组NSS评分明显低于对照组,差异有统计学意义(P<0.05)(见表1)。
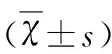
表1 治疗前后两组临床症状比较
与治疗前比较*P<0.05,与对照组比较△P<0.05
2.2 两组患者在用药前后HCY及Hs-CRP水平比较 治疗前两组差异无统计学意义(P>0.05),两组患者在用药后HCY及Hs-CRP水平与治疗前比较,差异有统计学意(P<0.05),且治疗组HCY及Hs-CRP水平明显低于对照组,差异有统计学意义(P<0.05)(见表2)。
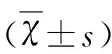
表2 治疗前后两组患者HCY及Hs-CRP水平比较
与治疗前比较*P<0.05,与对照组比较△P<0.05
3 讨 论
研究表明,长期饮酒者发生神经系统病变,常首先累及的是长的周围神经纤维末端,临床症状是由肢体远端向近端发展[7],酒精或其初级代谢物乙醛对轴突运输的干扰及引起的营养代谢障碍、分子及信号转导异常等导致了CAPN 的发生、发展[8]。酒精摄入量和摄入时间与周围神经损害密切相关[9]。酒精将细胞体合成的必需蛋白质和其他细胞成分转运到周围神经轴突末梢的轴突转运系统已被假定为神经毒素的最先攻击处,从而诱发周围神经病[10]。文献报道,临床上本病起病缓慢,症状及体征下肢较上肢重,表现以感觉障碍为主,震动觉敏感性普遍受累,运动神经受累较晚,表现为下肢末端无力,腱反射减弱或消失,跟腱反射改变比膝腱反射早,病变严重者可有肌萎缩[11]。
基础研究表明,α-硫辛酸是具有水溶与脂溶双重特性的一种抗氧化剂,是具有独特的氧化还原双向的氧化应激的强效抑制性,其能抗氧化应激,可以在任何部位清除自由基,增加神经营养血管的血流量等机制来实现其对神经的保护功能[12]。本研究结果表明,经14 d治疗后,两组NSS评分均降低,与治疗前比较,差异有统计学意义(P<0.05),且治疗组NSS评分明显低于对照组,差异有统计学意义(P<0.05)。表明硫辛酸对CAPN有确切疗效,可能与其能抗氧化应激、清除自由基、调节神经功能状态有关,与上述基础研究结果基本一致。
酒精可导致血清中细胞因子的持续改变,使得促炎症细胞因子表达增加[13],氧化应激导致的自由基对神经的损伤是酒精引起周围神经病变的重要因素之一[14]。HCY具有炎症反应性致神经损伤作用,高水平HCY能导致神经内膜血流降低引起神经缺血,神经细胞髓鞘损害和轴索变性,使神经传导速度变慢[15]。Hs-CRP是一类非特异性急性时相反应蛋白,与炎性反应具有良好的一致性和相关性[16],炎症因子氧化应激反应的增加可以促进炎性细胞因子的产生,同样炎性细胞因子的增加可以刺激自由基的产生,加重氧化应激而形成恶性循环[17]。因此,及时阻断氧化应激的发生,控制神经内皮炎症状态对控制周围神经病变的发生和发展具有积极意义。基础研究表明,α-硫辛酸可以通过抑制巯基化合物的氧化应激损伤、减轻线粒体酶的氧电子自由基的传递,并可以通过改善周围神经纤维细胞内的线粒体酶的氧化状态,进而促进神经纤维的修复,改善酒精导致的周围神经的氧化损伤[18]。本研究结果还显示,经14 d治疗后,两组患者用药后HCY及Hs-CRP水平均降低,与治疗前比较,差异有统计学意(P<0.05),且治疗组HCY及Hs-CRP水平明显低于对照组,差异有统计学意义(P<0.05)。间接证明硫辛酸对CAPN有明确疗效,这可能与硫辛酸具有抗氧化应激、有效保护β细胞、清除自由基、增加神经营养血管流量、降低炎症因子水平、改善神经营养等作用有关,与以上研究结果一致。
本临床研究表明,硫辛酸可显著降低CAPN患者HCY及Hs-CRP的水平,且显著改善临床症状,从而减轻炎症和氧化应激反应,提高神经的抗氧化能力,进而抑制CAPN的进展。疗效明显高于传统B族维生素甲钴胺。该研究结果为临床应用硫辛酸治疗CAPN方面提供了依据,值得进一步研究。但由于本实验纳入研究的病例数有限,仍然需大样本、多中心研究进一步证实。
[1]Koike H,Lijima M,Sugiura M,et al. Alcoholic neuropathy is clinicopathologically distinct from thiamine deficiency neuropathy[J]. Ann Neurol,2003,54(1):19-29.
[2]Crews FT,Nixon K. Mechanisms of neurodegeneration and regeneration in alcoholism[J]. Alcohol & Alcoholism,2009,44(2):115-127.
[3]房秋香. 中西医结合治疗慢性酒精中毒性周围神经病变临床观察[J]. 湖北中医杂志,2011,33(7):31-32.
[4]Goodwin DW,Schulsinger F,Knop J,et al. Alcoholism and depression in adopted out daughters of alcoholics [J]. Arch Gen Psychiatry,1977,34(7):751-755.
[5]Harbo T,Andersen H,Overgaard K,et al. Muscle performance relates to physical function and quality of life in long-term chronic inflammatory demyelinating polyradiculoneuropathy[J]. J Peripher Nerv Syst,2008,13(3):208-217.
[6]Ali M,Alireza B,Homayra R. Valid diabetic of Michigan neuropathy screening instrument for diabetic peripheral neuropathy[J]. Clin Neurol Neurosurg,2006,108(5):477-481.
[7]汤晓芙. 神经系统临床电生理学[M]. 北京:人民军医出版社,2002.35-47.
[8]Van Anh Nguyen,Tran Le,Tong M,et al. Experimental alcoholrelated peripheral neuropathy:role of insulin IGF resistance[J]. J Nutrients,2012,4(8):1042-1057.
[9]张 虹,杜 华,李本红,等. 电生理学检查对慢性酒精中毒性周围神经病的诊断价值[J]. 临床神经电生理学杂志,2002,11(4):237-239.
[10]Mclane JA. Decreased axonal transport in rat nerve following acute and chronic ethanol exposure[J]. Alcohol,1987,4(5):385-389.
[11]KoikeH,Mori K,Misu K,et al. Painful alcoholic polyneuropathy with predominant small-fiber loss and normal thiamine status[J]. Neurology,2001,56(12):1727-1732.
[12]Vallianou N,Evangelopoulso A,Koutalas P. Alpha-Lipoic Acidand Diabetic Neuropathy[J]. The Review of Diabetic Studies,2009,6(4):230-236.
[13]Qin L,He J,Hanes RN,et al. Increased systemic and brain cytokine production and neuroinflammation by endotoxin following ethanol treatment[J]. J Neuro Inflammation,2008,8(10):72-73.
[14]Fidanboylu M,Griffiths LA,Flatters SJ. Global inhibition of reactive oxygen species (ROS) inhibits paclitaxel-induced painful peripheral neuropathy[J]. PLoS One,2011,6(9):22-25.
[15]Otto-Buczkowska E,Kazibutowska Z,Sofiyk J,et al. Neuropathy and type 1 diabetes mouitus[J]. Pediair Endocrinol Diabetes Metab,2008,14(3):109-116.
[16]Hotamisligil GS. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J]. Cell,2010,140(2):900-917.
[17]Jeong KH,Lee TW,Ihm CG,et al. Effects of sildenafil on oxidative and inflammatory injuries of the kidney in streptozotocin-induced diabetic rats[J]. AM J Nephrol,2009,29(3):274-282.
[18]Yang W,Guo Z,Yu Y,et al. Pain relief and health-related quality-of-life improvement after microsurgical decompression of entrapped peripheral nerves in patients with painful diabetic peripheral neuropathy[J]. J Foot Ankle Surg,2016,32(5):90-93.
Theeffectsoflipoicacidoninflammatoryfactorsandprognosisofchronicalcoholicperipheralneuropathy
WANGJunwen,WENHuijun.
(DepartmentofNeurology,BaojiCentralHospital,Baoji721008,China)
1003-2754(2017)09-0835-03
2017-05-30;
2017-08-25
(陕西省宝鸡市中心医院,陕西 宝鸡 721008)
温慧军,E-mail:whjsq2008@163.com
R745
A
