3种土壤类型下镉胁迫对红椿生物量分配及其镉富集特性的影响
2017-10-16王岑涅刘柿良李勋王丽萍张健
王岑涅,刘柿良,李勋,王丽萍,张健
3种土壤类型下镉胁迫对红椿生物量分配及其镉富集特性的影响
王岑涅1,2,刘柿良3,李勋1,王丽萍1,张健1,4*
1. 四川农业大学生态林业研究所//四川省林业生态工程重点实验室,四川 成都 611130;2. 成都大学旅游与经济管理学院,四川 成都 610106;3. 四川农业大学风景园林学院,四川 成都 611130;4. 长江上游生态安全协同创新中心,四川 成都 611130
红椿(Toona ciliata Roem.)为中国国家级(Ⅱ)重点保护植物,同时也是(亚)热带珍贵速生用材树种。为了解镉(Cd)胁迫对红椿生长及镉富集特性的影响,采用盆栽控制试验研究了长江上游3种典型土壤(黄壤、酸性紫色土和冲积土)条件下,不同浓度Cd处理[0(对照)、20、40、80和 160 mg∙kg-1]对其幼树生长发育、生物量分配、镉积累与分配及镉富集特性的影响,为深入认识镉污染土壤的有效修复提供理论依据。结果显示,(1)低浓度镉胁迫(<40 mg∙kg-1)可促进红椿幼树生长,而高浓度镉胁迫(≥40 mg∙kg-1)则表现为严重抑制;各器官生物量随镉浓度增加而先升后降,除酸性紫色土壤上茎生物量外。(2)3种土壤条件下,红椿幼树各器官镉含量均随镉处理浓度增大而增大。相同镉浓度处理下主根镉含量表现为:黄壤>酸性紫色土≥冲积土,而冲积土条件下侧根镉含量均低于黄壤或酸性紫色土。同时,3种土壤下各器官镉含量随土壤镉浓度增大而增加,且地下部显著大于地上部。(3)随着镉处理浓度增大,除地上部富集系数(BC)在冲积土条件下无显著差异外,其他土壤条件下地上和地下部均显著增大;而3种土壤条件下转移系数(TF)均逐渐降低。高浓度镉胁迫下,幼树BC和TF虽均大于1,但地上部镉含量低于100 mg∙kg-1。随着镉浓度升高,3种土壤条件下红椿耐性指数(TI)均先增后降,高镉处理下冲积土TI显著大于黄壤和酸性紫色土壤。红椿虽不是典型的镉超富集植物,但其能在较严重镉污染土壤中较好生存,可作为镉污染区域(特别是镉污染冲击土)潜在的土壤修复树种。
镉胁迫;红椿;富集特性;生物量分配;土壤类型
近年来,随着中国经济社会快速发展,工业“三废”与农业活动释放到环境中的重金属量已远大于其自然输入量,目前已造成中国土壤危险重金属总超标率高达 16%(国土资源部,2014)。先前研究表明,在中国重金属污染土壤中,镉(Cd)污染土壤面积已高达1.3×104hm2(茹淑华等,2006;张燕等,2017)。特别地,近年来的“镉米”事件,让大众广泛认识到环境中镉污染已经成为当前最为严重的环境问题之一。通常情况下,镉在土壤中的化学活性较强,不易被微生物分解而易被富集为毒性更大的化合物,被植物(或农作物)吸收后会通过食物链进入人体,从而严重危害土壤的良性循环以及人类的生存环境和健康(Clemens,2006)。因此,开展镉污染土壤的防治以及修复污染土壤具有重要的现实意义。
目前,日益受到关注的植物修复技术(Phytoremediation technology)为解决土壤重金属污染提供了一条全新治理途径(Cuypers et al.,2011)。科学家已发掘的大部分重金属超富集植物(Hyperaccumulators)虽在一定程度上都具较强富集能力,但因其生物量低、生长较缓慢且重金属迁移量小等特点,仅适合作抗性机理理论研究,而不适合应用于大面积重金属污染土壤的修复(刘柿良等,2014;杨容孑等,2016;Liu et al.,2016)。然而,珍贵乡土木本植物与一般木本植物相比,其历经了自然选择和区域演替进化,因而具有极强的抗逆性、适应性和更高的经济价值(陈良华等,2015)。因此,可预见,生长较快的珍贵乡土木本植物既具有一般速生木本植物的修复潜能,也具有良好的市场前景,其开发利用潜力值得重视。
红椿(Toona ciliata Roem.)作为中国国家级(Ⅱ)重点保护植物,也是中国热带和亚热带地区珍贵速生用材树种。已有研究表明,红椿对紫色土和冲积土中重金属铅(Pb)具有较强耐性和积累能力,其富集系数与转移系数都小于0.3,可作为铅污染区域潜在的土壤修复树种(胡方洁等,2012)。紫色土和黄壤是长江上游四川盆地两种典型土壤类型,而冲积土是指河流冲积物发育而来的土壤。研究显示,长江上游典型土壤重金属污染日趋严重,如四川省邛崃市目前土壤镉含量是20年前的两倍(李冰等,2009)。据此,一个重要的科学问题相应提出:红椿对镉污染土壤是否具有修复能力?为解决此问题,本研究以长江上游3种典型土壤(黄壤、酸性紫色土和冲积土)为研究对象,探明镉胁迫对红椿幼树生物量累积及其分配格局、镉吸收以及富集特性的影响,为深入认识镉污染条件下植物的生长适应,以及镉污染土壤的有效修复提供理论依据。
1 材料与方法
1.1 试验地与材料
试验设置在四川农业大学成都校区实验基地温室(30°38′N,103°45′E),海拔 510~600 m,属亚热带湿润气候区,四季分明,日照偏少,雨量充沛,湿度较大。供试红椿(T. ciliata)幼树为楝科(Meliaceae)香椿属(T. Roem.)植物,本研究以一年生红椿种苗(株高约40 cm、地径约8 mm)为供试植物。供试酸性紫色土壤和黄壤采自雅安市四川农业大学读书公园,冲积土采自雅安市水中坝。3种土壤的基本理化性质见表1。
1.2 试验设计
2013年3月,将3种试供土壤风干,研磨,过筛(5 mm),静置,按照每盆10 kg(干土)标准装入带托塑料花盆中(37 cm×25 cm×27 cm),置于大棚中[透光率为 80%,温度为(27±2) ℃,相对湿度为(75±3)%]稳定60 d后待用。2013年6月,选取生长健壮且长势一致的红椿幼树移栽至塑料盆中(每盆1株)。恢复生长后(红椿幼树株高约50 cm、地径约12 mm),于2014年5月10日进行镉胁迫处理试验。本研究根据先前预实验结果,镉浓度水平梯度设置为:对照(0 mg∙kg-1)、T1 [20 mg∙kg-1干土,以 Cd计(下同)]、T2(40 mg∙kg-1干土)、T3(80 mg∙kg-1干土)、T4(160 mg∙kg-1干土),共 75盆,每处理5次重复。土壤中镉添加方法为以氯化镉与蒸馏水配制成约500 mL溶液均匀施入相应塑料盆中(渗出液反复回收浇灌,直到镉离子与土壤均匀混合)。试验期间,精心养护管理,不喷施农药与追施化肥。
1.3 样品分析
2014年9月10日,测量各处理红椿幼树株高和基径(距地面10 cm处),后采用破坏性收获法采集所有植株,采集各处理植株细根(即侧根;直径<2 mm)、粗根(即主根;直径>2 mm)、茎干和叶片(羽状复叶),每株选取鲜叶5片测量小叶叶长和叶面积(YMJ-C叶面积仪测定),计算其平均值。后 105 ℃杀青,75 ℃下烘干至恒重,计算其根、茎、叶及单株生物量。同时,将根、茎、叶粉碎研磨过1 mm筛,待测。样品中镉含量的测定采用湿样消解法(中国标准出版社,2015)消解,再用原子吸收分光光度计(AA320N型)测定,测镉精密度(RSD)为 1.98%。试验选择灰化温度为560 ℃,标准加入法测定镉平均回收率为98.54%。实验中,所有样品均重复测定5次(n=5)。
1.4 数据分析
所有数据均运用SPSS 17.0进行统计分析,单因素方差分析进行差异性检验(One-way ANOVA,Tukey检验)。本研究中,富集特性的计算按照以下公式:
(1)耐性系数(Tolerance Index,TI)=重金属胁迫下生长的植物的生物量/对照处理中植物的生物量(Zacchini et al.,2009);
(2)富集系数(Bioaccumulation Coefficient,BC)=植株体内重金属含量/土壤中重金属含量(Liu et al.,2009);
(3)转移系数(Translocation Factor,TF)=植物地上部分重金属含量/地下部分重金属含量(Liu et al.,2015a)。
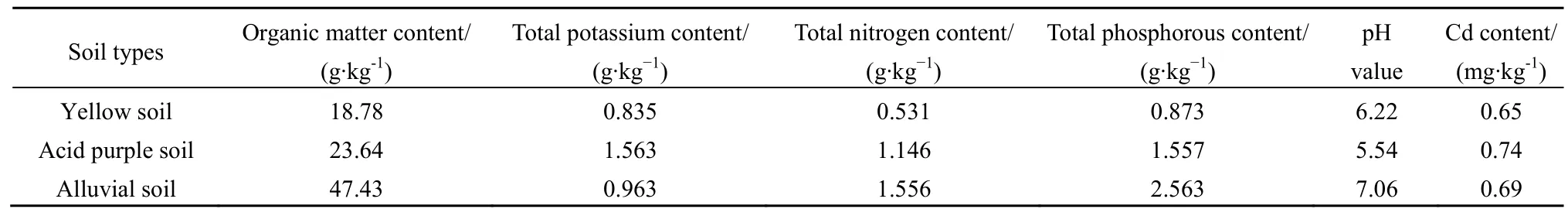
表1 研究中3种土壤(黄壤、酸性紫色土和冲积土)的有机质、全钾、全氮、全磷、pH值及镉(Cd)背景值Table 1 The background values of organic matter, total K, total N, total P, pH and Cd contents in the three studied soils (yellow soil, acid purple soil and alluvial soil)
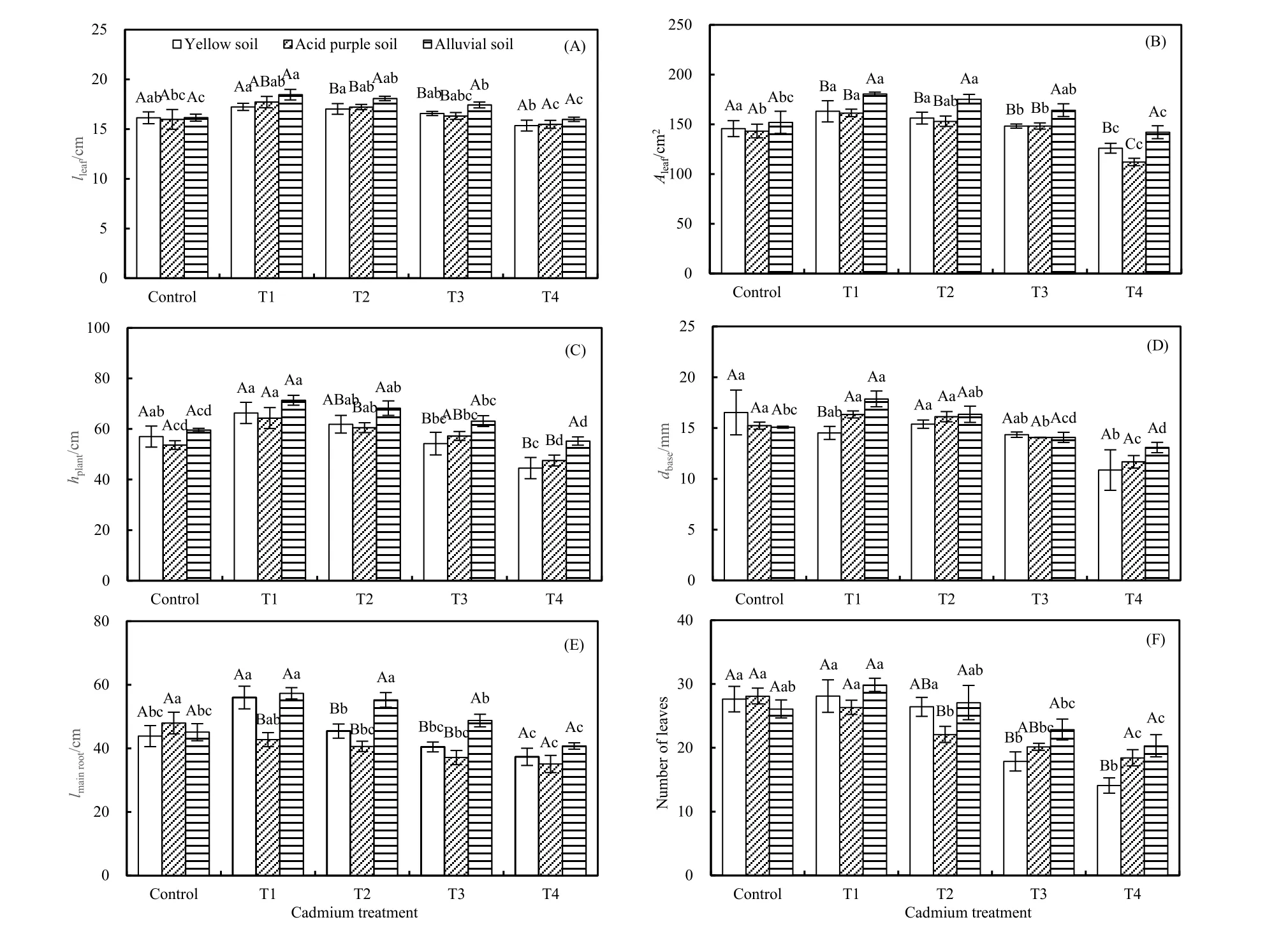
图1 3种土壤类型下不同浓度镉胁迫对红椿幼树生长特性的影响Fig. 1 Impacts of different concentrations of Cd stress on growth characteristics of T. ciliata seedlings in three types of soil不同小写字母表示在相同土壤类型下不同镉处理间差异显著(P<0.05,n=5),不同大写字母表示在相同镉处理下不同土壤类型间差异显著(P<0.05),下图中均同Different lowercase letters indicate the significant differences among different Cd treatments under the same soil type (P<0.05, n=5), while Different lowercase letters indicate the significant differences among different soil types under the same Cd treatment (P<0.05). The same as below
2 结果与分析
2.1 镉胁迫对红椿幼树生长特性的影响
图1显示,随着镉胁迫浓度增大,红椿叶片长度、叶片面积和株高在3种类型土壤中均呈现先升高后降低的趋势,在 T1或 T2处理时最高,而在T4处理时降为最低(叶长在冲积土下除外;图1A)。同时,酸性紫色土下的基径、黄壤和冲积土下的主根长以及冲积土下的叶片数量均表现出“低促高抑”。因此,较低浓度(<40 mg∙kg-1干土)镉胁迫一定程度上促进了红椿幼树的生长(如株高或叶特性),高浓度(>40 mg∙kg-1干土)则显著抑制其生长。相同浓度镉处理下,3种土壤类型对红椿幼树生长特性影响显著。叶片长度、叶片面积和基径在低浓度镉处理(T1)下,均表现为冲积土>酸性土壤或冲积土>黄壤,且叶片面积、株高和叶片数量在高浓度镉处理(T4)下有相似趋势;主根长则在T2和T3处理下表现为冲积土>酸性土壤(或黄壤)。总体来说,相对于黄壤和酸性紫色土,不同浓度镉处理下,红椿幼树在冲积土中的生长较好。
2.2 红椿幼树生物量及其分配对镉胁迫的响应
就 T1处理而言,除黄壤和酸性紫色土中红椿幼树侧根生物量以及酸性紫色土中茎生物量较对照处理差异不显著(P>0.05;图 2B和图 2C)外,幼树主根生物量、叶片生物量和总生物量均表现为T1处理显著高于对照处理(P<0.05)。总体上,3种土壤类型下红椿幼树各器官生物量均随镉处理浓度增加而呈先升高后降低趋势[除黄壤上侧根生物量和根/茎比与酸性紫色土上侧根生物量未见显著改变(P>0.05),以及酸性紫色土壤上茎生物量逐渐降低外(P<0.05)]。相同镉浓度处理下,主根生物量、侧根生物量、茎干生物量与总生物量均呈现为冲积土>酸性土壤(或黄壤);叶片生物量在 T1处理下表现为冲积土(或酸性紫色土)>黄壤,且在T2处理下表现为酸性紫色土>冲积土>黄壤,而T3和T4处理叶片生物量则在3种土壤间无显著差异(P>0.05;图 2D)。
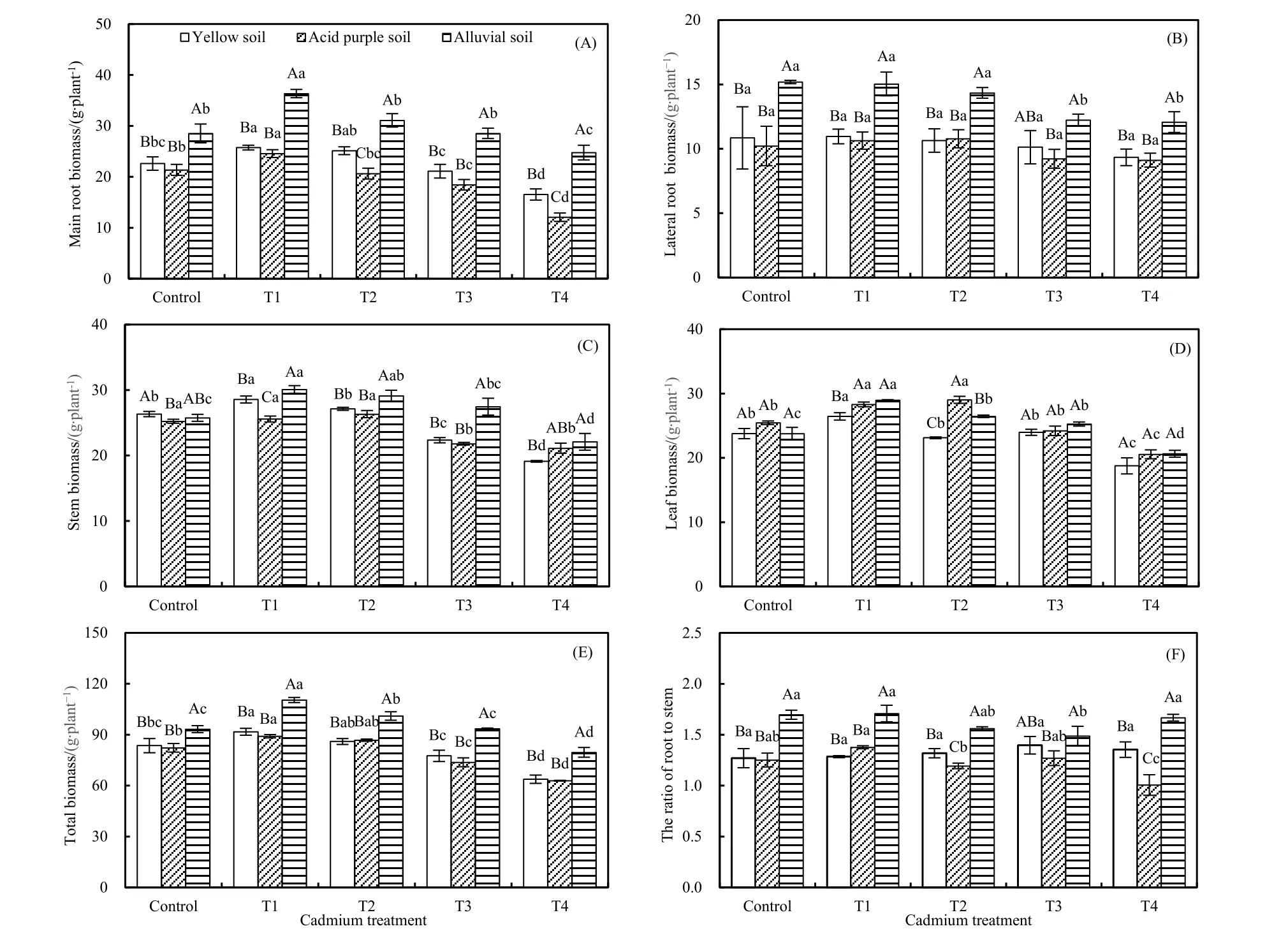
图2 3种土壤类型下不同浓度镉胁迫对红椿幼树生物量分配的影响Fig. 2 Impacts of different concentrations of Cd stress on biomass allocation of T.ciliata seedlings in three types of soil
2.3 镉胁迫对红椿幼树各器官镉含量的影响
3种土壤条件下,红椿各器官镉含量均随镉浓度增大而增大,且各处理与对照间差异显著(P<0.05;图3)。相同浓度镉处理下,主根镉含量呈黄壤>酸性紫色土>冲积土(除T1下酸性紫色土等于冲积土);且侧根与茎干镉含量均表现为冲积土>黄壤或酸性紫色土[除T2处理下3种土壤条件下茎干镉含量无差异外(P>0.05)]。值得注意的是,T1~T3处理叶片镉含量在3种土壤间均无显著差异(P>0.05),但在T4处理下却表现为黄壤(=酸性紫色土)>冲积土。总体来说,侧根镉含量最大,叶片次之,主根和茎干中含量较低。
2.4 镉胁迫对红椿幼树各器官镉积累量的影响
在3种不同土壤条件下,单株红椿幼树镉积累量(即总累积量)随着处理浓度的增加而显著增大(P<0.05;图4E)。对各个器官镉累积量而言,主根、侧根、茎干和叶片均随镉处理浓度的增大而呈不同程度增大(除酸性紫色土壤条件下的叶片镉累积量),但 3种土壤条件下侧根和叶片以及黄壤和冲击土条件下总镉累积量均对T3和T4处理时无显著差异(P>0.05)。总体而言,叶片镉累积量大于根系(主根或侧根),茎干中镉累积量最低。
2.5 红椿镉富集特性对不同浓度镉胁迫的响应
随着镉处理浓度的增大,除红椿幼树地上部BC在冲积土条件下无显著差异外(P>0.05),其他处理地上部和地下部镉富集系数均显著增大(P<0.05),T4处理时均达到最大(图5A、B)。同时,地上部BC在较高镉浓度处理(T3和T4)下表现为冲积土>酸性紫色土(或黄壤)。随着镉处理浓度增加,3种土壤条件下 TF均逐渐降低;且在T3和 T4处理下表现为冲积土>酸性紫色土(或黄壤),T1处理下黄壤>酸性紫色土(或冲积土),及T2处理下无显著差异(P>0.05)。同时,除对照和T1处理下TF大于1外,其余各处理浓度下都小于1,且各处理与对照间差异显著(P<0.05;图 5C)。随着镉处理浓度升高,3种土壤中红椿TI均先增大后降低,在T1处理时达到最大(P<0.05);同时在较高镉浓度处理(T3和T4)下,冲积土TI显著大于黄壤(或酸性紫色土壤;图5D)。
3 讨论
3.1 3种土壤条件下镉胁迫对红椿幼树生长特性及生物量分配格局的影响
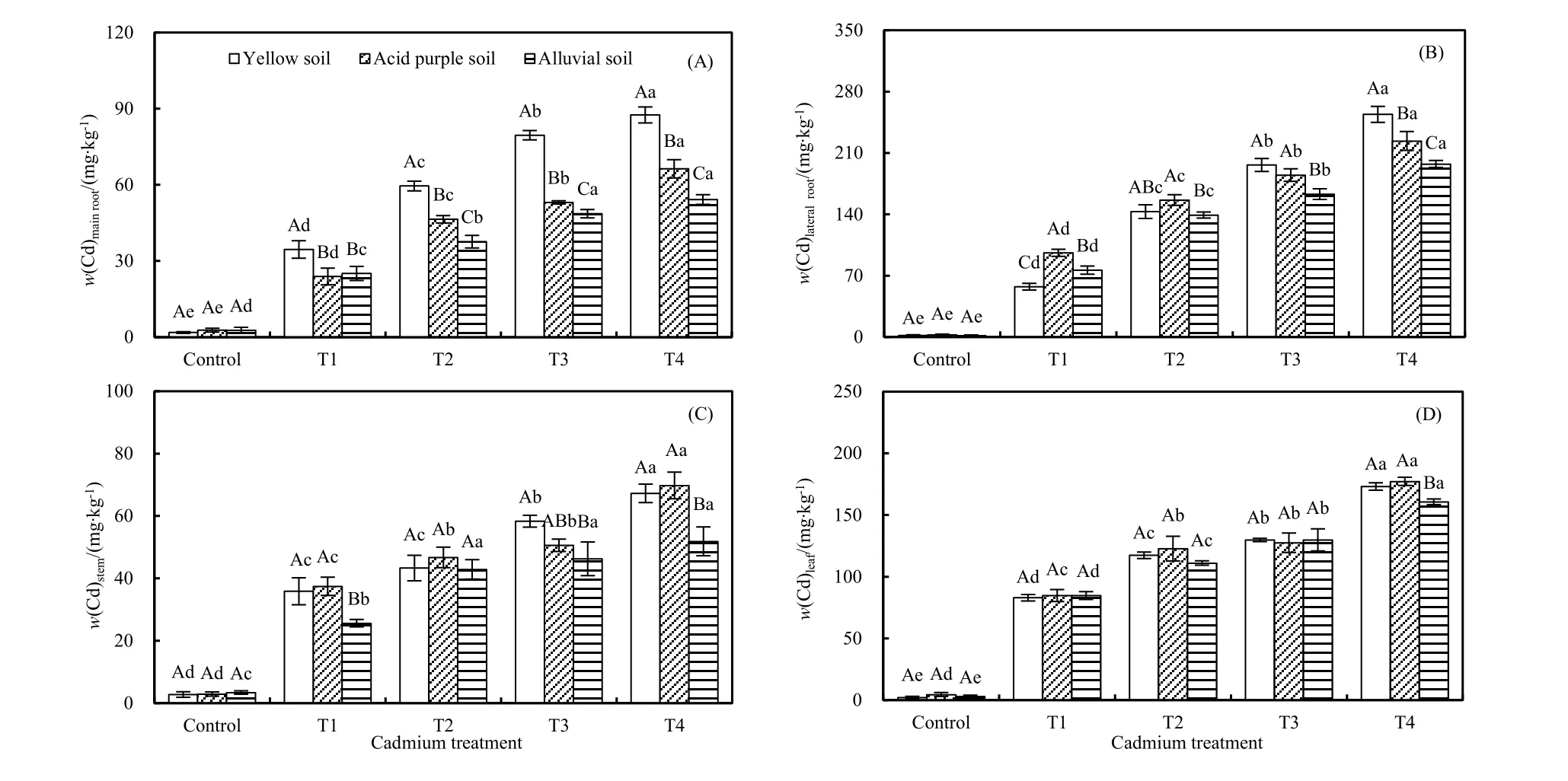
图3 3种土壤类型下不同浓度镉胁迫对红椿幼树各器官镉含量的影响Fig. 3 Impacts of different concentrations of Cd stress on the Cd content of different tissues of T. ciliata seedlings in three types of soil
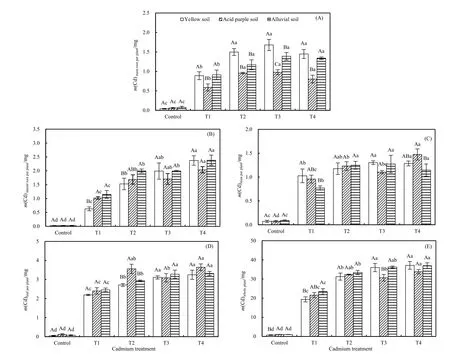
图4 3种土壤类型下不同浓度镉胁迫对红椿幼树各器官镉累积量的影响Fig. 4 Impacts of different concentrations of Cd stress on the Cd accumulation of different tissues of T. ciliata seedlings in three types of soil
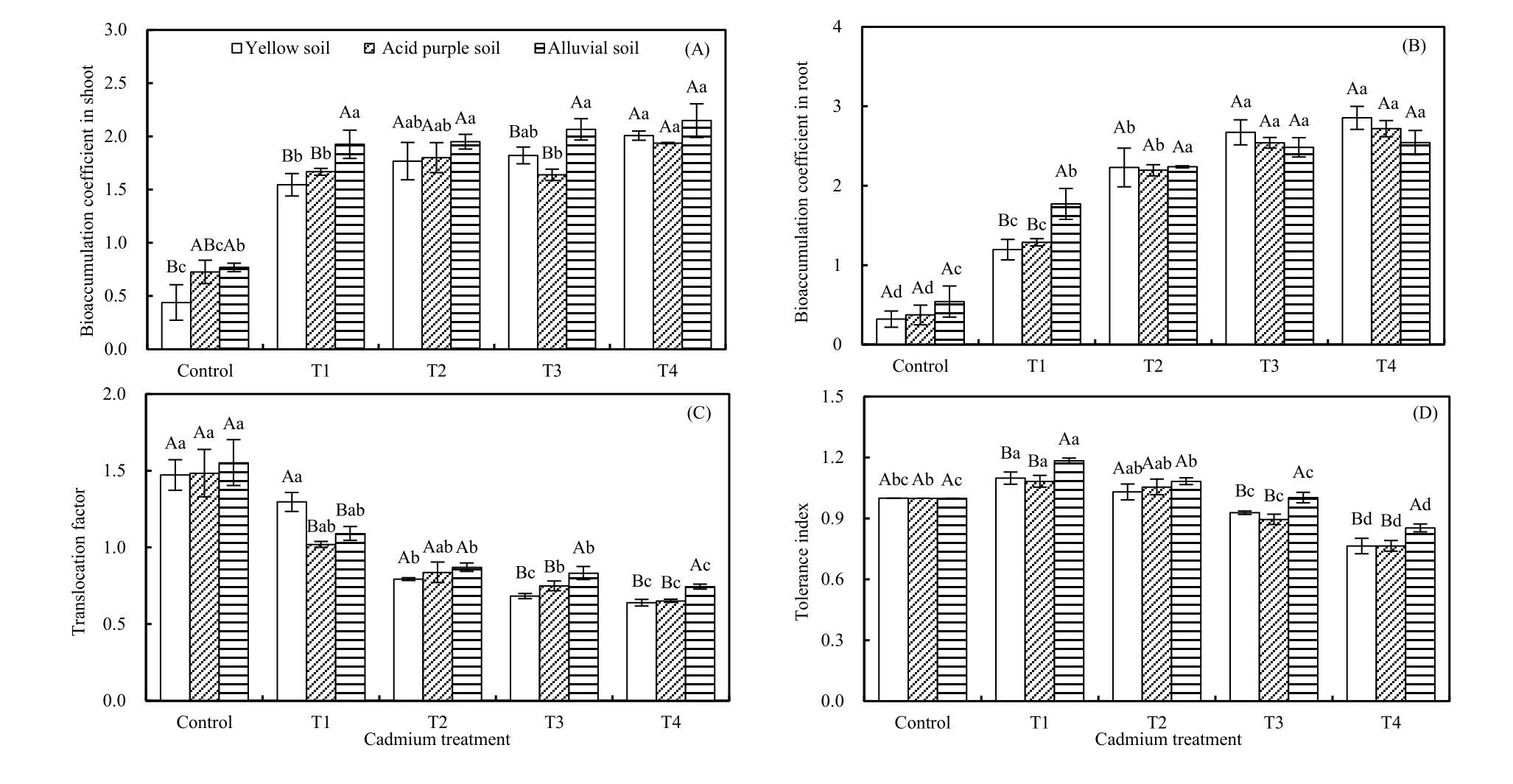
图5 3种土壤类型下镉胁迫对红椿幼树地上部富集系数(A)、地下部富集系数(B)、转移系数(C)和耐性系数(D)的影响Fig. 5 Impacts of Cd stress on shoot bioaccumulation coefficient (A), root bioaccumulation coefficient (B), translocation factor (C) and tolerance index (D) of T. ciliata seedlings in three types of soil
植物形态上的改变通常是其适应逆境的基本响应机制。本研究中,3种类型土壤中低浓度镉处理(<40 mg∙kg-1)在一定程度上能够促进红椿幼树的生长发育,而高浓度镉处理(≥40 mg∙kg-1)则抑制其生长特性,主要表现为叶面积缩小、植株矮化,同时生物量下降(图1和2),这种“低促高抑”现象与先前众多研究结果相类似(徐学华等,2009;Liu et al.,2015a,2015b;张燕等,2017)。究其原因,可能是因为在低浓度重金属的胁迫下,植物叶绿素含量有所增加,抗氧化系统被激活并参与活性氧清除,从而增加了植物对逆境的适应能力(Ghnaya et al.,2005;Cuypers et al.,2011;史静等,2013;Liu et al.,2015b)。而在高浓度重金属胁迫时,镉能与植物生长中的关键酶、含氮和硫基团及蛋白中心巯基结合,导致硫代巴比妥酸反应物过量堆积及生物大分子损伤而抑制生长发育(刘柿良等,2013)。同时,高镉也可能破坏了叶绿素酸酯还原酶活性,影响氨基-r-酮戊酸合成,导致叶绿素含量降低而影响光合作用(Hu et al.,2014)。同时,酸性紫色土下的基径、黄壤和冲积土下的主根长以及冲积土下的叶片数量均表现出“低促高抑”的现象(图 1)。相同浓度镉处理下,3种土壤类型对红椿幼树生长特性的影响均达到显著水平。值得注意的是,叶片长度、叶片面积和基径在低浓度镉(T1)处理时,表现为冲积土>酸性土壤或冲积土>黄壤,且叶片面积、株高和叶片数量在高浓度镉处理(T4)时趋势相似;而主根长则在T2和T3处理下表现为冲积土>酸性土壤(或黄壤)。相对黄壤和酸性紫色土,不同浓度镉处理红椿幼树在冲积土中的生长较好,表明红椿在冲积土壤生长条件下对土壤镉的耐性较高。已有研究显示,土壤中重金属生物有效性与其酸碱性有关(Xian et al.,1989;Yanai et al.,2006)。本研究中,酸性土和冲积土最大差异就是pH值不同。与碱性条件相比,酸性条件下的重金属具有较高的活性和生物有效性,因而酸性条件下镉的毒性大于碱性条件(图1和表1)。
逆境中植物常常通过改变其生物量分配与利用方式,将有限资源分配到不同结构和器官上,以更好地适应环境(Gonzaga et al.,2008;刘柿良等,2015;杨容孑等,2016)。研究表明,镉能有效限制土壤中养分的有效性和可利用性,因而加大植物各器官对环境资源的竞争,进而表现出器官生物量及其分配格局的改变(Feng et al.,2009;吴福忠等,2010;史静等,2013)。本研究中,3种土壤条件下,较高浓度镉胁迫均降低了红椿幼树的生物量积累,改变了其生物量分配格局的结论就佐证了该观点;而低浓度镉对红椿幼树的生物量及其分配格局的改变却不明显(图2),这也表明其对土壤镉污染具有一定抗性。相同浓度镉处理条件下,主根、侧根以及茎干生物量与总生物量均表现为冲积土>酸性土壤(或黄壤),也证实冲积土在镉胁迫条件下对植株生长的抑制作用显著低于其他两种类型土壤。然而,叶片生物量在T1处理下表现为冲积土(酸性紫色土)>黄壤,且在T2处理下表现为酸性紫色土>冲积土>黄壤,而T3和T4处理叶片生物量则在3种土壤类型间无显著差异(图2)。
3.2 3种土壤条件下镉胁迫对红椿幼树镉累积量及其富集特性的影响
研究已表明,多数带正电重金属离子易与组织中带负电的化合物结合,而被限制运输至茎、叶,使其累积在根系(刘柿良等,2013)。本研究中,红椿幼树各器官镉含量均随胁迫强度增大而升高,这不仅与镉施加剂量有关,还与土壤中含碳酸盐和有机质含量有关(吴福忠等,2010;Ruttens et al.,2010)。研究表明,碳酸盐能有效降低土壤中的交换态镉,而有机质中羧基、氨基和羟基等能与镉螯合配位(Ruttens et al.,2010),从而降低镉生物有效性;而镉浓度增加则提高土壤有效态镉量,进而增加植株吸收量。研究表明,植物有2种适应策略应对重金属胁迫,即排斥和积累(Baker et al.,1989)。本研究中,3种土壤类型条件下的红椿幼树地上部重金属含量均低于地下部,表明红椿在镉胁迫下选择了排斥策略。究其原因,主要是因为植株根系对重金属离子具有截留作用,借助质子泵产生的能量“主动”将根细胞中的生物大分子与镉离子结合形成稳定螯合物(吴福忠等,2010;Babula et al.,2015;Liu et al.,2016),这也被认为是植物应对逆境的生存策略。同时,本研究中侧根镉含量最大,叶片次之,主根和茎干中含量较低;且叶片镉累积量大于根系(主根或侧根),茎干中镉累积量最低(图3和图4),这些结果都证实了该观点。
通常情况下,BC、TF和TI是用来定义超富集植物的 3 个必要指数(Baker,1981;刘柿良等,2015)。目前认定超富集植物的标准包括:(1)地上部积累重金属质量分数应超过正常植物累积的100倍以上,一般镉质量分数要达到100 mg∙kg-1;(2)富集系数大于 1;(3)转移系数大于 1(韦朝阳等,2001;Liu et al.,2009)。本研究中,随着镉处理浓度的增大,除幼树地上部BC在冲积土条件下无显著差异外(P>0.05),其他土壤条件下地上部和地下部镉富集系数均随镉处理浓度增加而显著增大;而3种土壤条件下TF均逐渐降低(图5)。高镉胁迫下,虽然红椿BC和TF均大于1,但是地上部镉含量低于100 mg∙kg-1,因此红椿不是标准的“超富集植物”。同时,随着镉浓度升高,3种土壤中红椿耐性指数均先增大后降低,在高镉处理下(T3和T4)冲积土 TI显著大于黄壤和酸性紫色土,表明红椿在冲积土条件下具有相对较高的修复能力。
4 结论
低镉胁迫促进红椿幼树生长,而高镉胁迫则严重抑制其生长(如生长特性与生物量)。3种不同土壤条件下,红椿幼树各器官镉含量均随镉浓度增大而增大,大小顺序为:侧根>叶片>主根(或茎干)。相同浓度镉处理下,主根镉含量在3种土壤类型下表现为:黄壤>酸性紫色土≥冲积土;而侧根镉含量均表现为冲积土<黄壤或酸性紫色土壤。同时,在3种土壤中生长的红椿各器官镉含量随土壤镉浓度增大而显著增加,且地下部镉含量显著大于地上部。总体而言,冲积土生长下的红椿相对于其他两种土壤具有较高的富集系数和耐性系数,表明红椿在冲积土壤上对镉污染具有较好的修复效果。
BABULA P, KLEJDUS B, KOVÁČIK J, et al. 2015. Lanthanum rather than cadmium induces oxidative stress and metabolite changes in Hypericum perforatum [J]. Journal of Hazardous Materials, 286: 334-342.
BAKER A J M, BROOKS R R. 1989. Terrestrial higher plants which accumulate metallic elements: a review of their distribution, ecology and Phytochemistry [J]. Biorecovery, 1: 81-126.
BAKER A J M. 1981. Accumulators and excluder’s-strategies in the response of plants to heavy metals [J]. Journal of Plant Nutrition, 3: 643-654.
CLEMENS S. 2006. Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants [J]. Biochimie, 88: 1707-1719.
CUYPERS A, SMEETS K, RUYTINX J, et al. 2011. The cellular redox state as a modulator in cadmium and copper responses in Arabidopsis thaliana seedlings [J]. Journal of Plant Physiology, 168(4): 309-316.
FENG L, ZHANG JG, ZHANG ZS, et al. 2009. Growth and biomass allocation dynamics of Artemisia ordosica in sand fixing vegetation of the Tengger desert of China [J]. Chinese Journal of Plant Ecology, 33,1132-1139.
GHNAYA T, NOUAIRI I, SLAMA I, et al. 2005. Cadmium effects on growth and mineral nutrition of two halophytes: Sesuvium portulacastrum and Mesembryanthemum crystallinum [J]. Journal of Plant Physiology, 162(10): 1133-1140.
GONZAGA M I, SANTOS J A, MA L Q. 2008. Phytoextraction by arsenic hyperaccumulator Pterisvittata L. from six arsenic-contaminated soils:Repeated harvests and arsenic redistribution [J]. Environmental Pollution, 154(2): 212-218.
HU H, WANG L, WANG Q, et al. 2014. Photosynthesis, chlorophyll fluorescence characteristics, and chlorophyll content of soybean seedlings under combined stress of bisphenol A and cadmium [J].Environmental Toxicology and Chemistry, 33(11): 2455-2462.
LIU S L, YANG R J, MA M D, et al. 2015a. Effects of exogenous NO on the growth, mineral nutrient content, antioxidant system, and ATPase activities of Trifolium repens L. plants under cadmium stress [J]. Acta Physiologiae Plantarum, Doi: 10.1007/s11738-014-1721-7.
LIU S L, YANG R J, PAN Y Z, et al. 2015b. Nitric oxide contributes to minerals absorption, proton pumps and hormone equilibrium under cadmium excess in Trifolium repens L. plants [J]. Ecotoxicology and Environmental Safety, 119: 35-46.
LIU S L, YANG R J, PAN Y Z, et al. 2016. Beneficial behavior of nitric oxide in copper-treated medicinal plants [J]. Journal of Hazardous Materials, 314: 140-154.
LIU Z L, HE X Y, CHEN W, et al. 2009. Accumulation and tolerance characteristics of cadmium in a potential hyperaccumulator-Lonicera japonica Thunb [J]. Journal of Hazardous Materials, 169(1-3): 170-175.
RUTTENS A, ADRIAENSEN K, MEERS E, et al. 2010. Long-term sustainability of metal immobilization by soil amendments: cyclonic ashes versus lime addition [J]. Environment Pollution, 158(5): 1428-1434.
XIAN X,SHOKOHIFARD G I. 1989. Effect of pH on chemical forms and plant availability of cadmium, zinc and lead on polluted soils [J].Water, Air, & Soil Pollution, 45(3-4): 265-273.
YANAI J, ZHAO F J, MCGRATH S P, et al. 2006. Effect of soil characteristics on Cd uptake by the hyperaccumulator Thlaspi caerulescens [J]. Environ Pollution, 139(1): 167-175.
ZACCHINI M, PIETRINI F, MUGNOZZA GS, et al. 2009. Metal tolerance,accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics [J]. Water, Air & Soil Pollution,197(1-4): 23-34.
陈良华, 徐睿, 杨万勤, 等. 2015. 镉污染条件下香樟和油樟对镉的吸收能力和耐性差异[J]. 生态环境学报, 24(2): 316-322.
国土资源部. 2014. 环境保护部和国土资源部发布全国土壤污染状况调查公报[A]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm[2014-4-17]
胡方洁, 张健, 杨万勤, 等. 2012. Pb胁迫对红椿 (Toonaciliata Roem) 生长发育及Pb富集特性的影响[J]. 农业环境科学学报, 31(2): 284-291.
李冰, 王昌全, 谭婷, 等. 2009. 成都平原土壤重金属区域分布特征及其污染评价[J]. 核农学报, 23(2): 308-315.
刘柿良, 潘远智, 杨容孑, 等. 2014. 外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响[J]. 植物营养与肥料学报, 20(2): 445-458.
刘柿良, 杨容孑, 马明东, 等. 2015. 土壤镉胁迫对龙葵 (Solanum nigrum L.) 幼树生长及生理特性的影响[J]. 农业环境科学学报,34(2): 240-247.
刘柿良, 杨容孑, 潘远智, 等. 2013. 镉胁迫对长春花质膜过氧化、ATP酶及5'–核苷酸酶活性的影响[J]. 农业环境科学学报, 32(5): 916-924.
茹淑华, 苏德纯, 王激清. 2006. 土壤镉污染特征及污染土壤的植物修复技术机理[J]. 中国生态农业学报, 14(4): 29-33.
史静, 潘根兴, 夏运生, 等. 2013. 镉胁迫对两品种水稻生长及抗氧化酶系统的影响[J]. 生态环境学报, 22(5): 832-837.
韦朝阳, 陈同斌. 2001. 重金属超富集植物及植物修复技术研究进展[J].生态学报, 21(7): 1196-1203.
吴福忠, 杨万勤, 张健, 等. 2010. 镉胁迫对桂花生长和养分积累、分配与利用的影响[J]. 植物生态学报, 34(10): 1220-1226.
徐学华,黄大庄, 王连芳, 等. 2009. 土壤铅、镉胁迫对红瑞木生长及生理生化特性的影响[J]. 水土保持学报, 23(1): 213-216.
杨容孑, 刘柿良, 宋会兴, 等. 2016. 不同氮形态对龙葵镉积累、抗氧化系统和氮同化的影响[J]. 生态环境学报, 25(4): 715-723.
张燕, 铁柏清, 刘孝利, 等. 2017. 玉米秸秆生物炭对水稻不同生育期吸收积累 As、Cd的影响[J]. 生态环境学报, 26(3): 500-505.
中国标准出版社. 2012. 中华人民共和国国家标准: 食品卫生检验方法·理化部分(1)[S]. 北京: 中国标准出版社.
Abstract: Toona ciliata Roem. is a vital and precious fast-growing species in tropical and subtropical regions due to the national class Ⅱ key protected plants. The presented work investigated the effects of different cadmium (Cd) stress on the growth and Cd accumulation characteristics of T. ciliata seedlings under three types of soil (yellow soil, acid purple soil and alluvial soil) in the middle and lower reaches of the Yangtze River, which will provide a theoretical basis for the effective restoration of Cd contaminated soil. A controlled pot-experiment was arranged with different treatments of five Cd dosages [0 (control), 20, 40, 80 and 160 mg·kg-1] to investigate the growth characteristics, accumulation and distribution of biomass and Cd, and Cd enrichment in the T.ciliata seedlings. The results indicated that: (1) low concentration of Cd stress (<40 mg·kg-1) promoted the growth of T. ciliata seedlings, while the high concentration of Cd stress (≥40 mg·kg-1) seriously inhibited its growth. In addition, the biomass of each organ was increased first and then decreased with the increase of Cd concentration, but for the decrease of stem biomass in acid purple soil. (2) Under three different soil conditions, the contents of Cd in the organs of the seedlings were increased with the increase of Cd concentration. In detail, the content of Cd in lateral root was the highest, followed by leaf, and the content of main root and stem was the lowest. Under the same dose of Cd treatment, the main root Cd content was yellow soil>acid purple soil≥alluvial soil, while the contents of root Cd were lower in alluvial soil than that in yellow soil or acidic purple soil. The Cd content of the organs in the three soils increased significantly with the increase of the soil Cd concentration, and the root Cd content was significantly higher than that of the shoots. (3) With the increase of Cd dose applied, there was no significant difference in the bioaccumulation Coefficient (BC) under alluvial soil conditions, while the BC of shoot and root increased significantly. However, the translocation factor (TF) decreased gradually with the increase of Cd dose applied under three soil conditions. Moreover, under the high dose of Cd stress, the BC and TF were higher than 1, but the Cd content in the shoot was less than 100 mg·kg-1. Additionally,with the increase of Cd dose, the tolerance index (TI) was increased firstly and then decreased under the three soil conditions, and the TI in the alluvial soil was significantly higher than that in the yellow soil and/or the acidic purple soil under higher Cd treatments.These results indicate that T. ciliate could have a good growth in the soils with severe Cd pollution even through it is not a typical cadmium hyperaccumulator plants, which could be a potential tree species for Cd phytoremediation in Cd contaminated areas,especially in alluvial soil with Cd pollution.
Key words: cadmium stress; Toona ciliata Roem.; accumulation characteristics; biomass allocation; soil types
Impacts of Cadmium Stress on Biomass Distribution Pattern and Cadmium Accumulation Characteristics of Toona ciliata Roem. in Three Types of Soil
WANG Cennie1,2, LIU Shiliang3, LI Xun1, WANG Liping1, ZHANG Jian1,4*
1. Key Laboratory of Ecological Forestry Engineering of Sichuan Province, Institute of Ecology & Forest, Sichuan Agricultural University,Chengdu 611130, China;2. College of Tourism and Economic Management, Chengdu University, Chengdu 610106, China;3. College of Landscape Architecture, Sichuan Agricultural University, Chengdu 611130, China;4. Collaborative Innovation Center of Ecological Security in the Upper Reaches of Yangtze River, Chengdu 611130, China
10.16258/j.cnki.1674-5906.2017.09.019
X171.5
A
1674-5906(2017)09-1591-08
王岑涅, 刘柿良, 李勋, 王丽萍, 张健. 2017. 3种土壤类型下镉胁迫对红椿生物量分配及其镉富集特性的影响[J].生态环境学报, 26(9): 1591-1598.
WANG Cennie, LIU Shiliang, LI Xun, WANG Liping, ZHANG Jian. 2017. Impacts of cadmium stress on biomass distribution pattern and cadmium accumulation characteristics of Toona ciliata Roem. in Three types of soil [J]. Ecology and Environmental Sciences, 26(9): 1591-1598.
国家自然科学基金项目(31370628);国家科技支撑计划项目(2011BAC09B05)
王岑涅(1985年生),男,讲师,博士研究生,主要从事土壤污染及其修复研究。E-mail: wangcn100@163.com*通信作者。张健,E-mail: sicauzhangjian@163.com
2017-07-05
