核桃壳中酚酸的提取及含量测定
2017-10-16刘丽金周萍
刘丽金,周萍
(大理大学药学与化学学院,云南大理671000)
核桃壳中酚酸的提取及含量测定
刘丽金,周萍*
(大理大学药学与化学学院,云南大理671000)
采用单因素试验和正交设计对回流提取核桃壳中酚酸的工艺进行优化,以酚酸提取率为参考指标,考察乙醇浓度、提取温度、提取时间、料液比对酚酸提取率的影响并采用普鲁士兰法测定不同产地核桃壳样品中酚酸含量。结果表明,核桃壳中酚酸的最佳提取工艺条件为:30%乙醇,提取温度80℃,提取时间60min,料液比为1∶21(g/mL);不同产地核桃壳样品中酚酸含量存在差异,核桃壳样品中酚酸平均含量为0.679%。
核桃壳;酚酸;提取;含量测定
Abstract:To optimize the extraction process of phenolic acids from Walnut shell,ethanol concentration,extracting temperature,extracting time,solid-liquid ratio were determinated by the single-factor experiment and orthogonal design,using the extracte rate of phenolic acids as index.Results showed that he optimum conditions were ethanol concentration 30%,extraction temperature 80℃,extraction time 60 min,solid-liquid ratio 1∶21(g/mL).The contents of phenolic acids in Walnut shell.from different sources were different.And the average content of phenolic acids was 0.679%.
Key words:Walnut shell;phenolic acid;extraction;content determination
核桃(JugLans regia L.)又名胡桃,素有“长寿之果”、“健脑之果”、“美容之果”的美称[1]。核桃壳是核桃取仁后的外壳,民间可用于治疗口腔溃疡[2]、胃溃疡[3]。现代研究发现核桃壳中含有酚酸类[4]、黄酮类[5]、苷类等多种活性物质,具有抗氧化[6-7]、抗菌[8]、降脂、抗肿瘤[9-10]等药理活性。目前关于核桃壳研究的报道,主要涉及核桃壳中的化学成分研究[11-13]、糖类的含量测定[14-15]、黄酮提取[16-17]、棕色素研究[18-19]和活性炭制备[20]等方面,有关核桃壳中酚酸类物质的研究报道较少。酚酸类物质具有抗氧化、抗肿瘤、抑菌、减肥、护肝、提高免疫力、改善情绪、抗炎、抗病毒和保护心血管等多种生物活性[21],具有较高的研究价值。本试验采用加热回流提取的方法,优化核桃壳中酚酸的提取工艺,测定并比较不同产地核桃壳中酚酸含量,以期为核桃废弃资源的合理开发利用提供理论依据。
1 材料与方法
1.1 仪器与材料
核桃壳:采自云南省大理州,核桃取仁后自然风干,经鉴定为胡桃科核桃属植物核桃(JugLans regia L.)的壳,粉碎过60目筛,根据来源不同依次编号为1#~16#。
没食子酸对照品(批号MUST-13040103,纯度>98%):成都曼思特生物科技有限公司;无水乙醇、浓盐酸、十二烷基硫酸钠、三氯化铁、铁氰化钾等均为分析纯。
TU-1901双光束紫外分光光度计:北京普析通用仪器有限责任公司;UV-5500紫外可见分光光度计:上海元析仪器有限公司;FA2004N电子天平:上海精密科学仪器有限公司;DZKW-4双孔电子恒温水浴锅:上海科析实验仪器厂;SB-25-12DT超声波清洗机:宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 溶液的配制
没食子酸对照品溶液:精密称取干燥至恒重的没食子酸对照品适量,加蒸馏水溶解制成浓度为2.56 mg/mL的没食子酸对照品储备液。取1 mL没食子酸对照品储备液至100 mL容量瓶中,加蒸馏水定容至刻度,即得浓度为0.025 6 mg/mL的没食子酸对照品溶液。
样品溶液:精密称取样品约0.5 g,按料液比为1∶21(g/mL)加入 30%乙醇,80℃回流提取 60 min,过滤,滤液转移至100 mL容量瓶中,用蒸馏水定容至刻度,即得。
1.2.2 最大吸收波长的选择
精密移取酚酸样品溶液1.0 mL和没食子酸对照品溶液1.0 mL,分别置于25 mL容量瓶中,加无水乙醇5.0 mL;0.3%十二烷基硫酸钠溶液2.0 mL,0.6%FeCl3-0.9%K3[Fe(CN)4]溶液 1.0 mL,暗处放置 20 min 后用0.1 mol/L的盐酸溶液定容至刻度。以相应显色剂为空白,于500 nm~900 nm波长范围内扫描,结果显示,没食子酸对照品溶液和酚酸样品溶液均在729 nm波长处有最大吸收,所以选择729 nm为测定波长。
1.2.3 最佳显色条件的确定
1.2.3.1 无水乙醇用量的考察
精密移取没食子酸对照品溶液0.5 mL于25 mL容量瓶中,平行7份,分别加入无水乙醇1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL后,依次加入0.3%十二烷基硫酸钠溶液 2.0 mL,0.6%FeCl3-0.9%K3[Fe(CN)4]溶液1.0 mL,暗处放置20 min后用0.1 mol/L的盐酸溶液定容至刻度,以相应显色剂为空白,于729 nm波长处测吸光度。
1.2.3.2 0.3%十二烷基硫酸钠溶液用量的考察
精密移取没食子酸对照品溶液0.5 mL于25 mL容量瓶中,平行6份,加入无水乙醇5.0 mL后,分别加入 0.3%十二烷基硫酸钠溶液 0.5、1.0、1.5、2.0、2.5、3.0 mL,0.6%FeCl3-0.9%K3[Fe(CN)4]溶液 1.0 mL,暗处放置20 min后用0.1 mol/L的盐酸溶液定容至刻度,以相应显色剂为空白,于729 nm波长处测吸光度。
1.2.3.3 0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液用量的考察
精密移取没食子酸对照品溶液0.5 mL于25 mL容量瓶中,平行6份,加入无水乙醇5.0 mL,0.3%十二烷基硫酸钠溶液1.5 mL后,分别加入0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液 0.5、1.0、1.5、2.0、2.5、3.0 mL,暗处放置20 min后用0.1 mol/L的盐酸溶液定容至刻度,以相应显色剂为空白,于729 nm波长处测吸光度。
1.2.3.4 暗处放置时间考察
精密移取没食子酸对照品溶液0.5 mL于25 mL容量瓶中,平行7份,加入无水乙醇5.0 mL,0.3%十二烷基硫酸钠溶液 1.5 mL,0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液 2.0 mL,分别在暗处放置 0、10、20、30、40、50、60 min,用0.1 mol/L的盐酸溶液定容至刻度,以相应显色剂为空白,于729 nm波长处测吸光度。
1.2.4 酚酸提取单因素试验
1.2.4.1 乙醇浓度对酚酸提取率的影响
精密称取1#样品6份,每份约0.5 g,分别加入20%、30%、40%、50%、60%、70%的乙醇溶液30.0 mL,70℃加热回流40 min,过滤,滤液用蒸馏水定容至100 mL,每份精密移取0.3 mL按“1.2.3”确定的最佳显色条件显色,于729 nm波长处测吸光度,计算酚酸提取率。
1.2.4.2 提取温度对酚酸提取率的影响
精密称取1#样品6份,每份约0.5 g,加入40%乙醇 30.0 mL,分别于 40、50、60、70、80、90 ℃加热回流40 min,过滤,滤液用蒸馏水定容至100 mL,每份精密移取0.3 mL按“1.2.3”确定的最佳显色条件显色,于729 nm波长测定吸光度,计算酚酸提取率。
1.2.4.3 提取时间对酚酸提取率的影响
精密称取1#样品6份,每份约0.5 g,加入40%乙醇 30.0 mL,分别于 80 ℃加热回流 30、40、50、60、70 min后过滤,滤液用蒸馏水定容至100 mL,每份精密移取0.3 mL按“1.2.3”确定的最佳显色条件显色,于729 nm波长测定吸光度,计算酚酸提取率。
1.2.4.4 料液比对酚酸提取率的影响
精密称取1#样品8份,每份约0.5 g,分别按照料液比为 1∶3、1∶6、1∶9、1∶12、1∶15、1∶18、1∶21、1∶24(g/mL)加入 40%乙醇,80℃加热回流 50 min后过滤,滤液用蒸馏水定容至100 mL,每份精密移取0.3 mL按“1.2.3”确定的最佳显色条件显色,于729 nm波长测定吸光度,计算酚酸提取率。
1.2.5 酚酸提取正交试验
结合单因素试验结果,以乙醇浓度、提取时间、提取温度、料液比为影响因素,分别选3个水平进行正交试验,以酚酸提取率为指标,确定酚酸提取的最佳工艺条件。
1.2.6 方法学考察
1.2.6.1 标准曲线的绘制
精密移取没食子酸对照品溶液 0.2、0.4、0.6、0.8、1.0 mL置25 mL容量瓶中,按“1.2.3”确定的最佳显色条件显色,于729 nm波长下测吸光度,以吸光度(Y)为纵坐标,质量浓度(C)为横坐标,进行线性回归分析。
1.2.6.2 仪器精密度试验
精密移取没食子酸对照品溶液0.5 mL,按“1.2.3”确定的最佳显色条件显色,于729 nm波长处测定吸光度,连续测6次,计算RSD值。
1.2.6.3 重复性试验
精密称取1#样品6份,每份约0.5 g,按“1.2.1”项下方法制备样品溶液,按“1.2.3”确定的最佳显色条件显色,在729 nm波长下测定吸光度,计算样品中酚酸含量,计算RSD值。
1.2.6.4 加样回收率试验
精密称取已知酚酸含量(1.328%)的1#样品9份,每份约0.5 g,分别按照对照品加入量与所取供试品中被测物质含量之比约为 0.5∶1、1∶1、1.5∶1加入适量没食子酸对照品,按“1.2.1”项下方法制备样品溶液,按“1.2.3”确定的最佳显色条件显色,于729 nm处测定吸光度,计算回收率。
1.2.7 不同核桃壳样品中酚酸含量比较
精密称取1#~16#核桃壳粉末各3份,每份约0.5g,按“1.2.1”项下方法制备样品溶液,按“1.2.3”确定的最佳显色条件显色,于729 nm波长下测定吸光度,计算酚酸含量。
2 结果与分析
2.1 最佳显色条件结果与分析
2.1.1 无水乙醇的用量的考察
无水乙醇用量考察结果见表1。

表1 无水乙醇用量考察结果Table 1 Investigation results of anhydrous alcohol dosage
由表1可知,无水乙醇加入量为5.0 mL时吸光度最大,确定无水乙醇的用量为5.0 mL。
2.1.2 0.3%十二烷基硫酸钠溶液用量的考察
0.3%十二烷基硫酸钠溶液用量结果见表2。
由表2可知,0.3%十二烷基硫酸钠溶液加入量为1.5 mL时吸光度最大,确定0.3%十二烷基硫酸钠溶液的用量为1.5 mL。
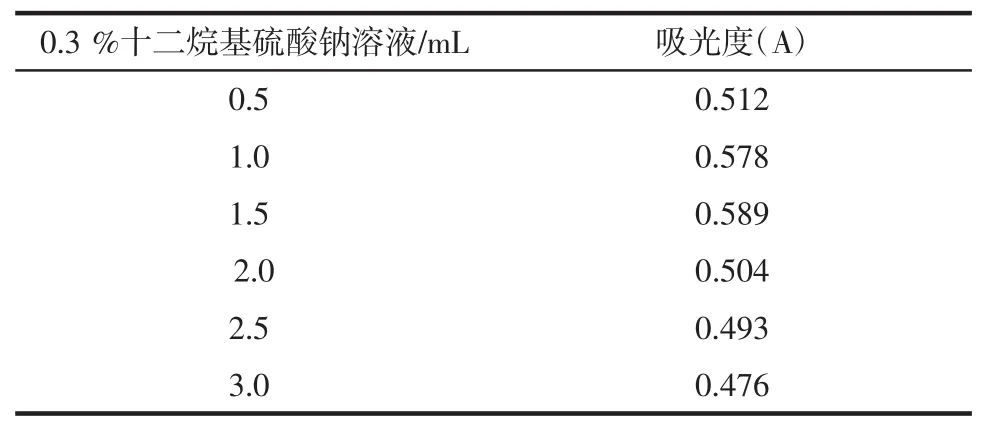
表2 0.3%十二烷基硫酸钠溶液用量的考察结果Table 2 Investigation results of the dosage of 0.3%dodecyl sodium dodecyl sulfate
2.1.3 0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液用量的考察
0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液用量结果见表3。

表3 0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液用量的考察结果Table 3 Investigation results of the dosage of 0.6%FeCl3-0.9%K3[Fe(CN)4]mixed solution
由表3可知,混合溶液用量为2.0 mL时吸光度最大。确定0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液用量为2.0 mL。
2.1.4 暗处放置时间考察
暗处放置时间考察结果见表4。

表4 暗处放置时间考察结果Table 4 Investigation results of the dark time
由表4可知,放置时间为50 min时吸光度最大,确定暗处放置时间为50 min。
综上得最佳显色条件为:无水乙醇5.0 mL,0.3%十二烷基硫酸钠溶液1.5mL,0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液2.0 mL,暗处放置时间50 min。
2.2 酚酸提取单因素试验结果与分析
2.2.1 乙醇浓度对酚酸提取率的影响
乙醇浓度对酚酸提取率的影响见图1。

图1 乙醇浓度对酚酸提取率的影响Fig.1 Effection of ethanol concentration on the extraction of phenolic acids
结果表明,酚酸提取率随着乙醇浓度的提高呈现先增后降的趋势,乙醇浓度为40%时提取率最大。
2.2.2 提取温度对酚酸提取率的影响
提取温度对酚酸提取率的影响见图2。

图2 提取温度对酚酸提取率的影响Fig.2 Effection of extraction temperature on the extraction of phenolic acids
结果表明,温度为80℃时酚酸的提取率最大。
2.2.3 提取时间对酚酸提取率的影响
提取时间对酚酸提取率的影响见图3。
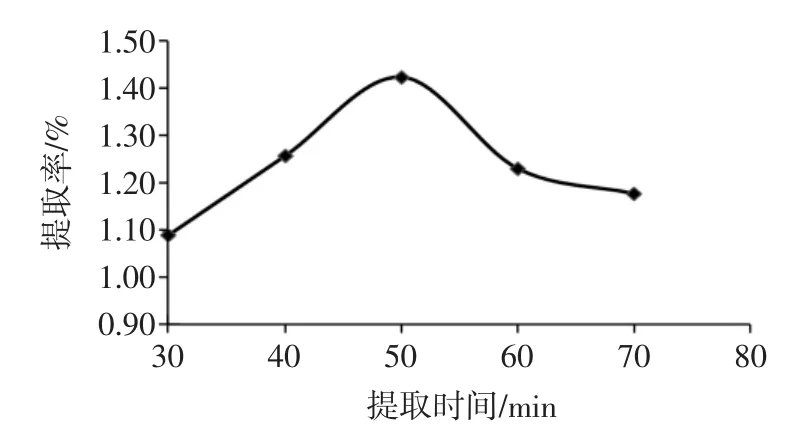
图3 提取时间对酚酸提取率的影响Fig.3 Effection of extraction time on the extraction of phenolic acids
结果表明,酚酸提取率随提取时间的增加呈现先增加后降低的趋势,提取时间为50 min时,酚酸的提取率最大。
2.2.4 料液比对酚酸提取率的影响
料液比对酚酸提取率的影响见图4。
结果表明,料液比为1∶18(g/mL)时,酚酸提取率最高。

图4 料液比对酚酸提取率的影响Fig.4 Effection of solid-liquid ratio on the extraction of phenolic acids
2.3 酚酸提取正交试验结果与分析
2.3.1 正交试验因素及水平
在单因素试验的基础上,选择提取温度(A)、乙醇浓度(B)、提取时间(C)、料液比(D)为研究对象,采用四因素三水平正交试验研究酚酸在不同条件下的提取率。正交试验设计的因素和水平见表5。

表5 正交试验因素水平Table 5 Orthogonal experiment factor levels
2.3.2 正交试验结果与分析
对提取温度(A)、乙醇浓度(B)、提取时间(C)、料液比(D)进行正交试验,结果见表6。

表6 正交试验结果及分析Table 6 Results and analysis of orthogonal test
结果表明所选4个因素对酚酸提取率大小影响顺序为:提取温度(A)>乙醇浓度(B)>料液比(D)>提取时间(C)。核桃壳中酚酸的最佳提取工艺为A2B1C3D3;即提取温度为80℃,乙醇浓度为30%,提取时间为60 min,料液比为 1∶21(g/mL)。本试验采用加热回流提取的方法,该法操作简单,有良好的稳定性和重复性。
2.3.3 最佳工艺条件的验证
按照上述优选工艺条件即提取温度为80℃,乙醇浓度为30%,提取时间为60 min,料液比为1∶21(g/mL)对1#样品分别进行3次验证,结果显示:在最佳提取条件下,酚酸提取率平均值为1.327%,RSD值为1.23%,酚酸提取率均高于正交试验数据,说明正交试验结果可靠,优选出的工艺可行,该方法的重现性好。
2.4 方法学考察结果与分析
2.4.1 标准曲线的绘制
以吸光度(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,得回归方程为Y=1.102X+0.002,相关系数r=0.999 3;没食子酸溶液在0.204 8 μg/mL~1.024 μg/mL范围内呈现良好的线性关系。
2.4.2 仪器精密度试验
仪器精密度的RSD值为0.22%,表明仪器精密度良好。
2.4.3 重复性试验
测得核桃壳中酚酸平均含量为1.328%,RSD为2.8%,表明该方法的重复性良好。
2.4.4 加样回收率试验
加样回收率试验结果见表7。

表7 加样回收率试验结果Table 7 Test results of sample recovery
2.5 不同产地核桃壳样品中酚酸含量
不同核桃壳样品中酚酸含量见表8。
由表8中试验结果可知,不同产地核桃壳样品中酚酸含量不同,其中漾濞县苍山西镇沙河村含量最高,下关镇太邑彝族乡江西桥最低;样品中酚酸平均含量为0.679%。
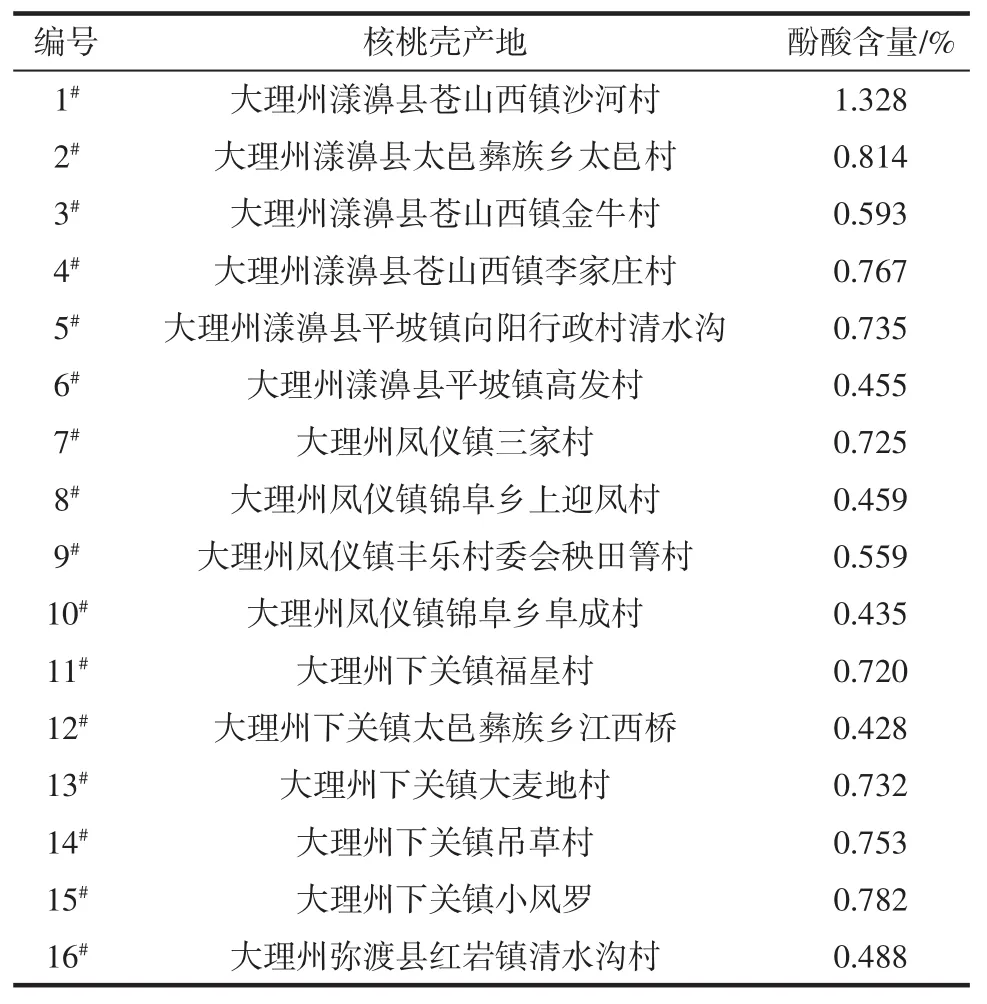
表8 不同产地核桃壳样品中酚酸含量Table 8 Content of phenolic acids in walnut shell samples from different habitats
3 结论与讨论
本试验采用加热回流提取法提取核桃壳中酚酸,经单因素及正交试验设计得出核桃壳中酚酸的最佳提取工艺为:提取温度为80℃,乙醇浓度为30%,提取时间为 60 min,料液比为 1∶21(g/mL)。
不同来源的核桃壳样品中酚酸平均含量为0.679%,其中漾濞县沙河村的含量较高,为1.328%。不同产地核桃壳中酚酸含量不同,可能受核桃品种、海拔、气候、土壤等因素的影响,具体原因有待进一步考察研究。
预试验分别考察冷浸、超声、回流不同提取方法对酚酸提取率的影响,结果显示采用回流提取时酚酸提取率最大,故将提取方法确定为回流提取。此外,根据酚酸的溶解性和极性,可选择不同溶剂进行提取,本试验前期分别以水、50%乙醇和50%甲醇为溶剂考察了溶剂对酚酸提取的影响,结果显示以50%乙醇为溶剂时酚酸提取率较大,故确定乙醇为提取溶剂,并考察不同乙醇浓度对酚酸提取率的影响。
酚酸含量测定常用的方法有Folin-酚法[22]和普鲁士兰法[23]。其中普鲁士兰法为较经典的显色方法,该法采用十二烷基硫酸钠-FeCl3-K3[Fe(CN)4]-HCl系统进行显色,具有操作简便、快速、经济、重现性好等优点;且该法加入试剂后立即形成深浅不同的颜色,容易辨别[24],故本试验选用普鲁士兰法显色。不同文献报道普鲁士兰法显色剂用量不同,故试验前期先优化显色条件,确定显色剂用量;试验确定最佳显色条件为:无水乙醇5.0 mL,0.3%十二烷基硫酸钠溶液1.5 mL,0.6%FeCl3-0.9%K3[Fe(CN)4]混合溶液 2.0 mL,暗处放置时间50 min。测定核桃壳中酚酸的含量时,显色剂配制后,放置时间和显色时间对吸光度影响较大。故应严格控制反应条件,显色试剂应现配现用,各样品测定时平行操作。
[1]陈鹏,张仕林.云南核桃资源现状及其加工利用前景分析[J].安徽农学通报,2009,15(1):59-61
[2]戴立新,司爱丽.核桃壳治疗复发性口腔溃疡22例[J].中国民间疗法,1997(4):50
[3]潘春华.核桃壳治疗胃溃疡[J].家庭医学,2011(6):56
[4]张旭,梁杏,陈朝银,等.核桃壳的化学成分及其功能活性研究进展[J].食品研究与开发,2015,36(14):143-147
[5]宋倩,赵声兰,刘彬球,等.响应面法优化核桃壳总黄酮提取工艺的研究[J].食品工业科技,2013,34(11):214-216
[6]胡博路,杭瑚.核桃壳抗氧化作用的研究[J].中国油脂,2002,27(2):22-23
[7]郭瑜,郝慧娟,王晓闻,等.核桃壳提取物体外抗氧化活性研究[J].山西农业大学学报(自然科学版),2014,34(3):262-265
[8]张海珠,马媛,周萍.泡核桃壳提取物体外抗菌实验的初步研究[J].大理学院学报,2012,11(9):38-40
[9]于冬梅,刘熙,李冬梅,等.漾濞泡核桃壳醇沉物对人肺癌、肝癌对人细胞增殖的影响[J].中成药,2015,37(10):2299-2302
[10]刘成娇,夏盟恺,李杨,等.泡核桃壳提取物的体外抗肿瘤作用研究[J].大理学院学报,2015,14(8):15-17
[11]郑志峰,邹春菊,花勃,等.核桃壳化学组分的研究[J].西南林学院学报,2006,26(4):33-36
[12]彭友伦,李冬梅,刘光明.泡核桃壳的化学成分研究[J].中草药,2013,44(12):1534-1538
[13]苑雅萍,赵洪云,刘晓丹,等.山核桃壳化学成分的研究[J].黑龙江医药,2006,19(1):33-34
[14]周萍,罗延梦,马媛,等.核桃壳多糖的含量测定[J].安徽农业科学,2012,40(25):12654-12655
[15]张海珠,周萍,邓水来,等.泡核桃壳多糖中单糖的组成及测定[J].中成药,2012,34(12):2372-2376
[16]宋倩.核桃壳黄酮类化合物的制备工艺、结构分析及降脂活性研究[D].昆明:昆明理工大学,2012
[17]宋倩,赵声兰,刘芳,等.大孔吸附树脂分离纯化核桃壳总黄酮[J].食品与发酵工业,2012,38(12):180-184
[18]战峰,邵婧,韩泳平.回归正交设计优化核桃壳棕色素的提取工艺[J].食品科学,2011,32(16):196-200
[19]周萍,许兴景,王敏,等.泡核桃壳棕色素的提取和稳定性研究[J].安徽农业科学,2011,39(7):3912-3983
[20]李盛龙,谢学忠,邱彩英,等.核桃壳活性炭的制备及其对烟酸缓释性能的研究[J].化学与生物工程,2014,31(9):49-58
[21]乔丽萍,傅瑜,叶兴乾,等.酚酸生物活性研究进展[J].中国食品学报,2013,13(10):144-151
[22]赵小燕,李波,杨正明,等.坚杆火绒草中总酚酸的提取及含量测定[J].中国实验方剂学杂志,2015,21(9):19-21
[23]王文祥,周巧霞,顾明,等.不同对照品对芎芍胶囊总酚酸含量测定的影响[J].中成药,2001,23(7):536-537
[24]胡桂娟,金锡凤,张玉英,等.果实中单宁的测定[J].落叶果树,1982(4):45-49
Extraction and Content Determination of Phenolic Acids from Walnut Shell
LIU Li-jin,ZHOU Ping*
(Department of Pharmacy and Chemistry,Dali University,Dali 671000,Yunnan,China)
2017-02-20
10.3969/j.issn.1005-6521.2017.20.011
刘丽金(1992—),女(汉),硕士研究生,研究方向:药物分析。
*通信作者:周萍(1972—),女(汉),教授,硕士生导师
