流动注射荧光法测定植物油中脂肪醛
2017-10-16,,,,,*,,,
,, ,, ,*, ,,
(1.新疆维吾尔自治区产品质量监督检验研究院,新疆乌鲁木齐 830001;2.济宁医学院药学院,山东日照 276800;3.中国科学院兰州化学物理研究所,甘肃兰州 730000)
流动注射荧光法测定植物油中脂肪醛
龙泽荣1,王利涛2,刘莉1,赵建勇1,鹿毅1,*,赵亮3,董树清3,李辉3
(1.新疆维吾尔自治区产品质量监督检验研究院,新疆乌鲁木齐830001;2.济宁医学院药学院,山东日照276800;3.中国科学院兰州化学物理研究所,甘肃兰州730000)
建立了流动注射荧光法测定食用植物油中脂肪醛化合物的方法。利用2-萘肼和脂肪醛化合物在酸催化作用下生成在400 nm波长处有强荧光发射的2-萘腙化合物的原理,在自制的流动注射分析仪中,以混合醛(甲醛、乙醛、正丙醛、正丁醛、正戊醛、正己醛、正庚醛、正辛醛、正壬醛)为标准物质,对催化剂、温度、时间、溶剂、2-萘肼的浓度和载流流速进行了条件优化,确定了最佳的流动注射荧光法检测食用植物油中脂肪醛化合物的方法。在该优化条件下,脂肪醛化合物测定的线性工作曲线为y=26.8x+42,相关系数0.997;该方法的相对标准偏差(RSD)在1.18%~1.89%之间,回收率在92%~113%之间,最低检出限为0.02 mmol/L(S/N=3)。因此,流动注射化学发光法具有方法简单、检测快速、数据准确等特点,可用于实际食用油样品中醛类物质的在线快速检测。
流动注射分析,荧光法,食用植物油,脂肪醛化合物
Abstract:A flow injection spectrophotometry method for the determination of aldehydes content in vegetable oil was built. The standard substance was adopted by mixed equal-molar nine aldehydes(formaldehyde,acetaldehyde,n-propanal,n-butanal,n-pentanal,n-hexaldehyde,n-heptaldehyde,n-octanal and n-nonanal). The optimal condition for aldehydes determination was obtained by adjusting catalysts,temperature,time,solvents,flow rate,and dosage of reagent,which was suitable to the reaction of aldehydes and 2-naphthylhydrazine to produce the 2-naphthalene hydrazone derivatives under the acid action by self-made flow injection equipment with strong fluorescence-emission at 400 nm. As a result,the linear equation of aliphatic aldehydes was y=26.8x+42(r=0.997),with 1.18%~1.89% of relative standard deviation(RSD)and 92%~113% of recovery rate. The limit of detection(LOD)for this method was 0.02 mmol/L(S/N=3). The method can be applied successfully to the determination of aliphatic aldehydes in plant oils with much simple way,high speed and accuracy.
Keywords:flow injection analysis;fluorescence method;edible plant oils;aliphatic aldehydes
食用油在高温烹饪或者地沟油精炼过程中脂肪酸酯会发生不同程度的降解,其主要降解产物有脂肪醛或酮等多种极性化合物[1-3]。现有的检测技术如高效液相色谱法[4-5]、荧光光谱法[6]、原子吸收光谱法[7]、离子色谱法[8]以及固相萃取结合GC-MS法[9]等均可用于食用油中脂肪醛的检测。赵亮等[4-5]提出了脂肪醛或酮可作为鉴别伪劣食用油的特征指标,通过高效液相色谱成功实现了合格食用油和精炼地沟油的鉴别。肖莹等[10]通过柱前衍生化-高效液相色谱法发现精制地沟油中的甲醛和乙醛的含量均显著增加。迄今报道的检测食用油中脂肪醛的方法均需要借助于昂贵的仪器与复杂的前处理过程,导致检测耗时长、检测成本高以及不能实现现场检测等诸多缺点。流动注射分析技术是一种自动快速的化学分析技术,具有操作简便、快速、灵敏以及可实现在线监测等诸多优点[11-12],被广泛应用于大气、土壤和食品中的痕量金属离子[13]、阴离子[14-15]、生物分子[16]和致癌物质的检测[17]。赵小青[18]采用5,5′-二甲基-1,3-环己二酮与甲醛可生成强荧光衍生物,流动注射分析食品和饮料样品中的甲醛,但这一技术对油脂中单一或混合脂肪醛的检测研究几乎还是空白。
本文利用2-萘肼与脂肪醛类化合物在酸作用下发生高度特异性化学反应生成具有强烈荧光萘腙衍生物的原理,建立流动注射荧光法检测食用植物油中脂肪醛化合物的分析方法,在实际食用油样品中进行测试。将化学发光分析与流动注射分析技术相结合,与现有的检测方法相比,该法具有操作简便、检测快速和准确的特点,在食用油油品质量控制方面具有极高的实用价值。
1 材料与方法
1.1 材料与仪器
甲醛、乙醛、正丙醛、正丁醛、正戊醛、正己醛、正庚醛、正辛醛、正壬醛、乙醇、硫酸、盐酸、冰醋酸、三氯乙酸、三氟乙酸 均为分析纯,购自国药集团化学试剂有限公司;2-萘肼盐酸盐 购自百灵威科技试剂公司;乙腈 色谱纯,购自山东禹王实业有限公司;食用植物油样品:金利胡麻油、金龙鱼一级菜籽油、金龙鱼三级菜籽油、金龙鱼一级大豆油和金龙鱼调和油 超市购买;精炼地沟油样品 实验室制备。
自组装流动分析仪如图1所示;蠕动泵 中国雷弗流体科技有限公司;7725i手动进样阀 美国罗丹尼公司;Waters-474荧光检测器 美国沃特斯,其附件包括:20 μL定量环和反应管(φ=0.7 mm,长度为0.5 m,材质为聚四氟乙烯管);恒温水浴槽 郑州市亚荣仪器有限公司;电子分析天平 德国赛多利斯公司。
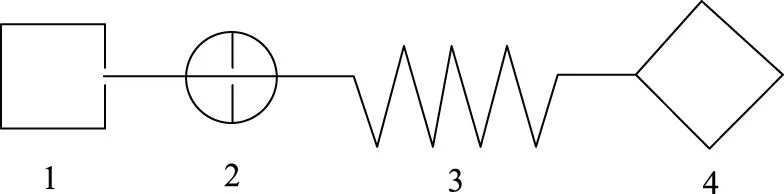
图1 流动注射化学发光分析测定醛类化合物工作流程示意图Fig.1 Schematic diagram of flow injection chemiluminiscence to measure aldehydes注:1.蠕动泵,控制流速,以mL/min计;2.进样阀;3.反应管,0.5 m;4.荧光检测器。
1.2 实验方法
1.2.1 配制标准溶液 取0.1 mmol三氯乙酸于10 mL容量瓶中,乙腈定容配成10 mmol/L三氯乙酸标准溶液;取0.1 mmol 2-萘肼盐酸盐溶于10 mL乙腈,再取1 mL溶液于10 mL容量瓶中,乙腈定容配成2 mmol/L萘肼标准溶液;分别取0.1 mmol的甲醛、乙醛、正丙醛、正丁醛、正戊醛、正己醛、正庚醛、正辛醛和正壬醛溶于5 mL乙腈,再取1 mL溶液于10 mL容量瓶中,乙腈定容配成2 mmol/L混合醛标准溶液;取2 mmol/L混合醛标准溶液,分别配制成0.05、0.10、0.15、0.20、0.30 mmol/L标准溶液,4 ℃冰箱中储存。
1.2.2 供试样品的制备 取5 mL乙腈于试管中,再加入5 mL食用油,摇匀,静置5 min分层,由于乙腈与食用油不互溶,上层清液即为食用油的乙腈萃取液;取0.25 mL萃取液于试管中,再加入0.5 mL三氯乙酸溶液(10 mmol/L),加入0.5 mL 2-萘肼溶液(2 mmol/L),再加入0.75 mL乙腈使总体积为2 mL,摇匀,即为反应前供试样品的待测溶液;在水浴槽中60 ℃加热10 min,反应完成后,冷却10 min,即为反应后供试样品的待测溶液。
1.2.3 样品测定条件的单因素实验 初步确定了测定条件,分别以单个因素作为变量,考察反应前后电压峰值的变化,从而得出最佳的流动注射测定条件。流动相为乙腈,蠕动泵的流速为1 mL/min,激发波长为350 nm,发射波长为400 nm,进样量20 μL,恒温水浴的温度为60 ℃。同样在保持萘肼浓度为0.5 mmol/L,三氯乙酸的浓度为0.5 mmol/L,混合醛浓度为0.2 mmol/L,反应时间为10 min。在蠕动泵的作用下,分别将反应前和反应后供试样品的待测溶液,通过进样针注入进样阀,通过荧光检测器,测得萘肼反应前和反应后荧光强度的变化(反应前后荧光的变化即为实际参与反应的醛化合物与萘肼生成萘腙的荧光增强),通过标准工作曲线,即可测得脂肪醛类化合物的含量。其单因素考察的条件如下:
1.2.3.1 酸催化剂的选择 分别以硫酸、盐酸、醋酸、三氯乙酸、三氟乙酸为反应催化剂,浓度均为0.5 mmol/L,其它条件保持不变,考察反应前后峰值的变化。
1.2.3.2 反应温度的选择 分别以10 ℃为间隔,在40、50、60、70和80 ℃,其它条件保持不变,考察反应前后峰值的变化。
1.2.3.3 反应时间的选择 反应时间分别为3、6、10、15、20 min,其它条件保持不变,考察反应前后峰值的变化。
1.2.3.4 反应溶剂的选择 分别在甲醇、乙醇、异丙醇和乙腈中,其它条件保持不变,考察反应前后峰值的变化。
1.2.3.5 萘肼浓度的选择 萘肼的浓度分别为0.12、0.25、0.35、0.50、1.0 mmol/L,其它条件保持不变,考察反应产物前后峰值的变化。
1.2.3.6 三氯乙酸浓度的选择 三氯乙酸的浓度分别为0.05、0.25、0.50、1.5、5.0 mmol/L,其它条件保持不变,考察反应前后峰值的变化。
1.2.3.7 流速的选择 流速分别为0.50、0.75、1.0、1.25、1.5 mL/min,其它条件保持不变,考察反应前后峰值的变化。
1.2.4 体系方法评价
1.2.4.1 线性范围及检出限 按1.2.3确定的条件,利用流动注射方法获得了测定混合醛标准工作曲线的线性方程。
1.2.4.2 方法精密度 取混合醛溶液的浓度分别为0.15、0.3 和0.5 mmol/L,按1.2.3确定的条件,分别测定8次,计算混合醛的平均相对标准偏差。
1.2.4.3 方法准确度 采用1.2.2的方法,将2份金龙鱼一级大豆油的待测样品用乙腈稀释10倍,混合醛的加标浓度分别为0.10、0.15和0.20 mmol/L。以建立的流动注射荧光法进行测定,计算混合醛的平均加标回收率。
1.3 数据处理
本实验所有样品除特别注明外,均重复3次测试,实验结果为三次测定结果的平均值。仪器信噪比(S/N)的3倍确定为脂肪醛物质的最低检出限。
2 结果与分析
2.1 流动注射条件的选择
食用植物油中可能含有甲醛、乙醛、正丙醛、正丁醛、正戊醛、正己醛等多种脂肪醛,其食用油质量的好与坏,与这些小分子脂肪醛的含量密切相关[4]。本文通过单因素实验,得到了流动注射化学发光法检测脂肪醛类化合物的方法。
2.1.1 酸性催化剂的选择 考察萘肼与混合醛反应过程中酸的催化效率。如图2所示,三氯乙酸得到的产物峰值最大,与其他酸比较,三氯乙酸的加入,有利于促进萘肼和脂肪醛化合物的化学反应。
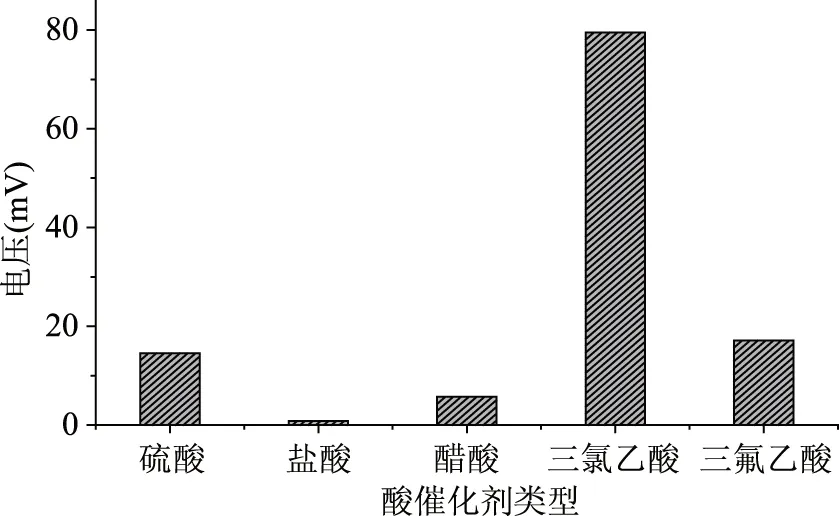
图2 流动注射酸性催化剂的选择Fig.2 The conversion of aliphatic aldehydes under different acidic catalysts by using flow injection
2.1.2 反应温度的选择 萘肼与脂肪醛类化合物反应是吸热反应,为提高该反应速度,本实验通过升高温度来促进萘肼与脂肪醛的反应速度。反应后产物峰值变化如图3所示:从40 ℃升至50 ℃时,峰值没有提升;从50 ℃升高到60 ℃时,峰值迅速提高,60 ℃达到峰值;继续升高温度,反应的产率迅速降低,表明在高温条件下生成的产物可能又发生了分解。综合以上因素,确定本实验最佳反应温度为60 ℃。

图3 流动注射反应温度的选择Fig.3 The conversion of aliphatic aldehydes under different reaction temperature by using flow injection
2.1.3 反应时间的选择 萘肼与脂肪醛化合物需要在一定温度和时间内完成化学反应,反应时间也是影响醛类物质与萘肼之间反应主要因素之一。本文分别考察了不同反应时间对反应过程的影响。如图4所示,在3~10 min时间段内,随着反应时间的延长,反应产物峰值达到了最高;而延长反应时间,其产物峰值又快速的下降。推测可能是由于反应时间的延长,发生了一些副反应,导致了峰值的降低。综合以上因素,本实验选择确定了最佳反应时间为10 min。
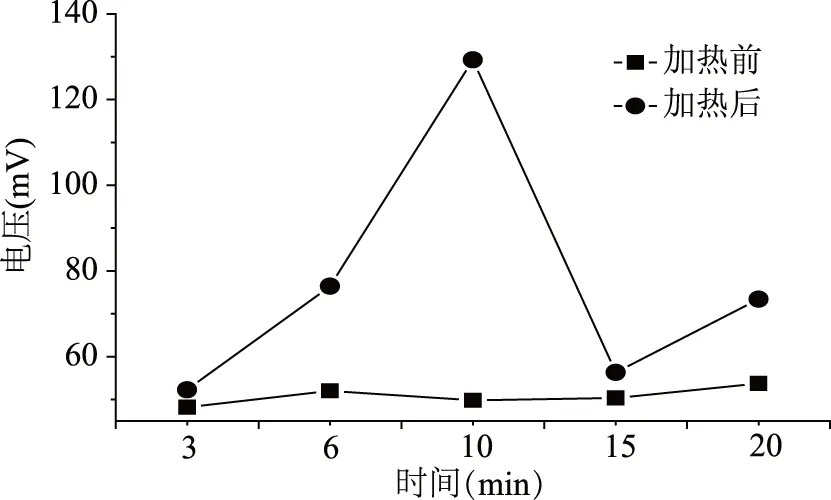
图4 流动注射反应时间的选择Fig.4 The conversion of aliphatic aldehydes at different reaction time by using flow injection
2.1.4 反应溶剂的选择 萘肼与脂肪醛化合物反应,除了受到温度和反应时间的影响之外,其发生反应所需要的溶剂也是影响反应主要因素之一。在保持上述条件下,本实验分别考察了不同反应溶剂对反应过程的影响。如图5所示,在甲醇、乙醇和异丙醇中该反应峰值的变化很小,表明质子性溶剂的溶剂化效应抑制了萘肼与醛的反应;而在乙腈溶剂中,反应前后的峰值变化最大,可能是由于非质子性的乙腈溶剂促进了萘肼与醛的缩合反应,本实验选用的载流试剂为乙腈。
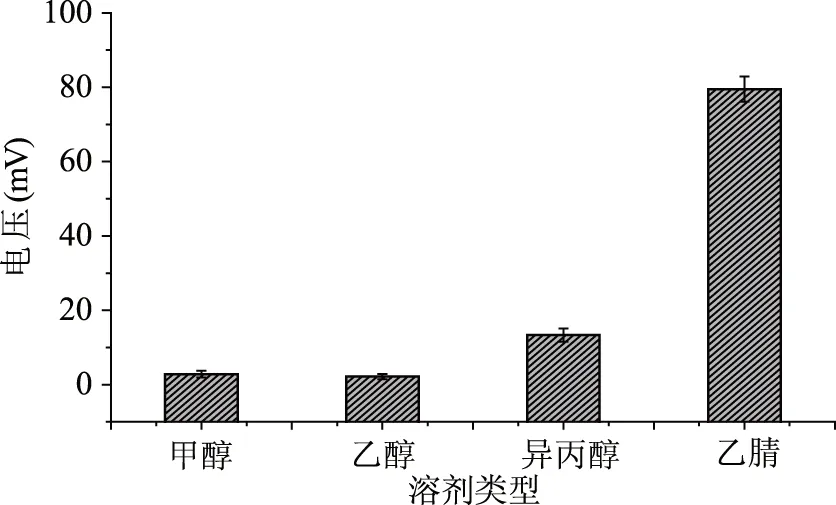
图5 流动注射条件下反应溶剂的选择Fig.5 The conversion of aliphatic aldehydes under different reaction solvents by using flow injection
2.1.5 萘肼浓度、三氯乙酸浓度和流速的选择 通过以上反应条件的优化,确定了萘肼与脂肪醛化合物反应所用的催化剂、反应温度和反应时间。但是所用萘肼、脂肪醛化合物和三氯乙酸试剂的量和流动注射的流速,需要进一步的实验。本文分别将萘肼、三氯乙酸和流速作为单因素考察的对象,实验结果如图6和图7所示。当萘肼和三氯乙酸的浓度分别为0.50 mmol/L时,达到了最大的峰值变化(如图6),这也证实了萘肼和三氯乙酸是按照1∶1的摩尔比进行化学反应的;此外,流速的考察实验结果如图7所示,当载流试剂流速为1 mL/min,检测得到的产物浓度信号最强,以此确定了最佳的流速。
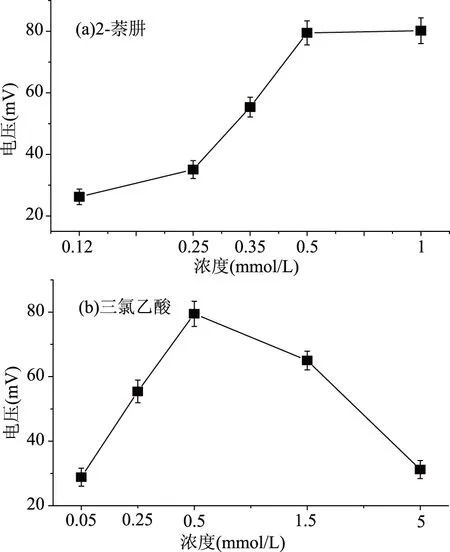
图6 流动注射试剂浓度的选择Fig.6 The conversion of aliphatic aldehydes by using different reagent dose under flow injection

图7 流动注射流速的选择Fig.7 The conversion of aliphatic aldehydes under different flow rate by using flow injection
2.2 体系方法评价
2.2.1 线性范围及检出限 在最优化的条件下,利用流动注射方法获得了测定混合醛标准工作曲线的线性方程为y=26.8x+ 42(式中y为峰高,x为混合醛摩尔浓度,mmol/L),相关系数0.997,得出最低检出限为0.02 mmol/L(S/N=3)。
2.2.2 方法精密度 取混合醛溶液的浓度分别为0.15、0.3和0.5 mmol/L,分别测定8次,其平均相对标准偏差分别为1.41%、1.18%和1.89%,表明该流动注射化学发光仪器检测脂肪醛化合物的精密度方法良好。
2.2.3 方法准确度 采用1.2.3的方法,将2份金龙鱼一级大豆油的待测样品用乙腈稀释10倍,混合醛的加标浓度分别为0.10、0.15和0.20 mmol/L。以建立的流动注射荧光法进行测定,其平均加标回收率分别为92%、113%和103%,表明实验方法的准确度很好,符合食用油中脂肪醛化合物的检测要求。
2.3 实际样品测定
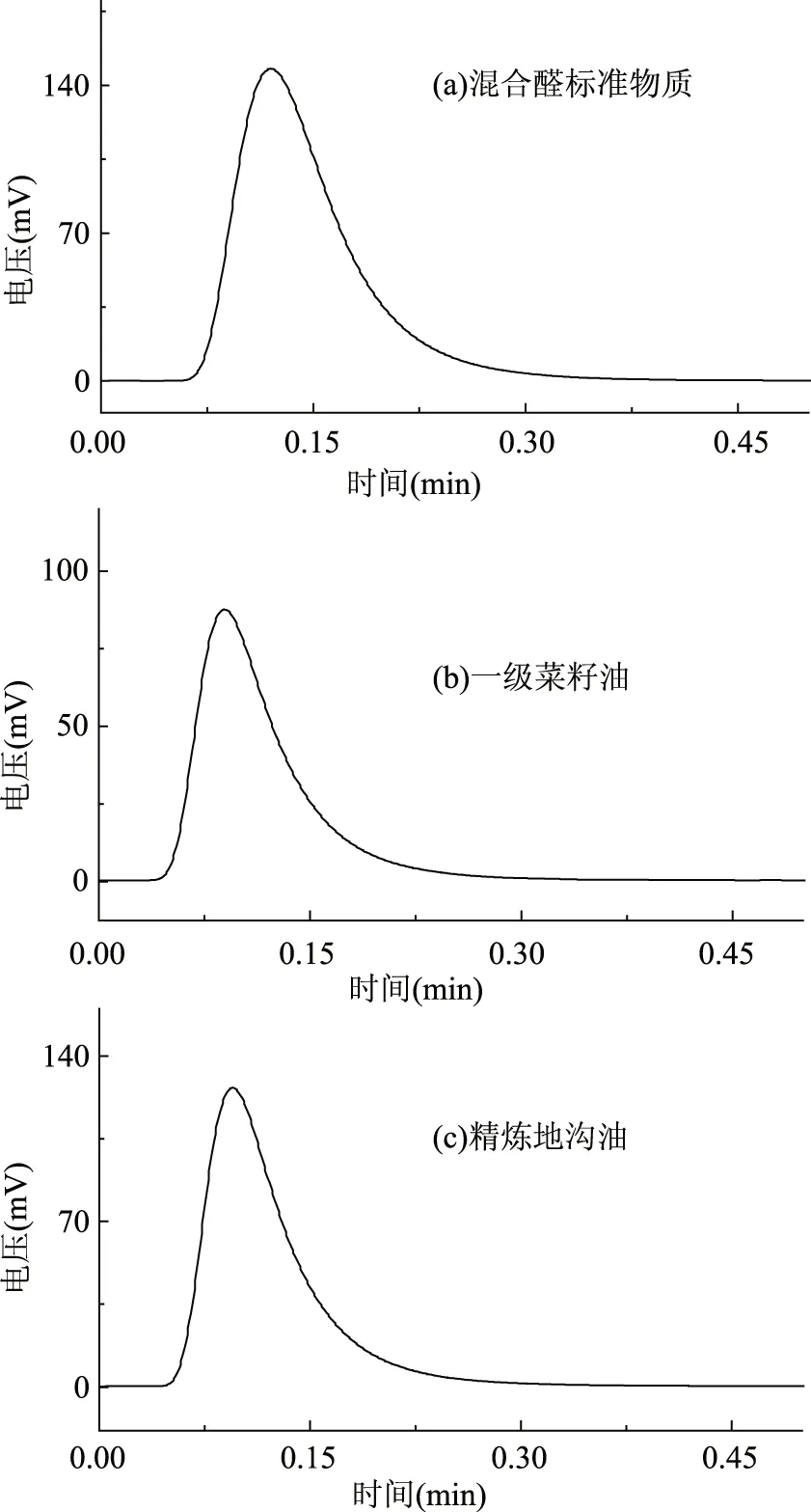
图8 流动注射荧光法测定脂肪醛化合物Fig.8 The determination of aliphatic aldehydes in different edible oil samples by using flow injection
采用前方建立方法对混合醛标准物质、市购的菜籽油和自制的精炼地沟油分别进行了脂肪醛化合物含量的分析测定,结果如图8所示。结果表明各样品均显示了极好的响应信号,并且所有样品在0.2 min内就完成了脂肪醛含量测定,充分发挥了流动注射化学发光法快速检测的特点。接着采用本文建立的测试方法,分别对市购的5种植物油样品进行测定,结果见表1。与其他植物油相比,调和油中的脂肪醛含量较高,达到4.41 mmol/L;胡麻油中脂肪醛化合物的含量最低为0.94 mmol/L;一级大豆油和一级菜籽油中脂肪醛的含量相对较低,含量分别为1.92、1.84 mmol/L,而三级菜籽油的含量达到了3.93 mmol/L;由此可以看出,食用植物油品的质量越高,脂肪醛的含量相对较低。总体来看,食用油中醛的含量在0.94~4.41 mmol/L之间,而精炼地沟油中的脂肪醛化合物的含量最高,达到了27.85 mmol/L,其相对偏差为0.43%~1.21%。表明市场上流通的各种食用油中脂肪醛化合物的含量是远远低于精炼地沟油脂肪的含量,地沟油中脂肪醛的含量约为合格食用油样品的6~30倍,通过油中脂肪醛的含量比较,可以明显鉴别出地沟油。正常食用油中的脂肪醛化合物主要来自一些不饱和脂肪酸的脂质过氧化反应,因此食用油在制备、贮存过程中也会进行缓慢的脂质过氧化反应,产生少量的脂肪醛,因而也能够被少量检测到。而地沟油在精炼过程中,经过高温加热、酸洗会产生大量的脂肪醛物质,而后续脱色、脱臭等处理过程不能有效除去脂肪醛物质,因此地沟油中含有较大量的脂肪醛物质。本方法测定的合格食用植物油样品的脂肪醛含量与文献报道的结果基本一致[4,10]。

表1 不同油样品中醛类物质的测定结果Table 1 Analysis results of aldehydes in edible oil samples
3 结论
食用油的成分非常复杂,其中的脂肪醛类物质难以快速的准确定量测定,本研究优化了流动注射的检测条件,建立了食用植物油中脂肪醛化合物的流动注射快速测定方法。在优化条件下,流动注射荧光法测定脂肪醛化合物的标准工作曲线方程为y=26.8x+42,相关系数0.997,最低检出限为0.02 mmol/L(S/N=3),相对偏差为1.18%~1.89%,回收率为92%~113%。本文建立的流动注射荧光法可用于在线快速检测食用植物油中的脂肪醛化合物,操作简便,灵敏度高,重复性好,为监管部门提供脂肪醛的检测依据,有一定的推广应用价值。
[1]邓云,杨铭铎,李健,等. 煎炸油脂中极性成分的色谱分析[J]. 食品与发酵工业,2006,32(5):127-130.
[2]申南竹.食用油类中的羰基化合物[J]. 化学工程师,1991,21(3):56.
[3]邓云,杨铭铎,李健,等. 油炸中油脂极性成分的产生对食品品质的影响[J]. 华南理工大学学报(自然科学版),2004,32(6):49-54.
[4]董树清,杨孟铭,王利涛,等. 高效液相色谱法测定油脂中的脂肪醛[J]. 分析实验室,2013,32(11):67-71.
[5]董树清,王利涛,张霞,等. 高效液相色谱法测定地沟油中脂肪醛类物质[J]. 食品工业科技,2013,34(11):313-316.
[6]耿红蕊,曹文明,江明. 荧光光谱结合模式识别技术鉴别地沟油[J]. 食品科技,2015,40(12):275-279.
[7]李凯凯,张会明,姚海波. 原子吸收光谱法鉴别地沟油的方法探讨[J]. 广州化工,2014,42(16):93-94.
[8]陈轲,颜毅坚,马军,等. 离子迁移谱法对地沟油的检测研究[J]. 中国油脂,2015,40(12):66-69.
[9]王晓乐,王凯,贾金平,等. 基于固相微萃取技术的GC-MS法快速检测地沟油[J]. 分析实验室,2014,33(2):153-157.
[10]沈卫阳,王洁琼,王婉,等. 柱前衍生化-高效液相色谱法测定地沟油中的脂肪醛[J]. 食品科学,2016,37(14):160-164.
[11]陈冠林,邓晓婷,黄莹偲,等. 流动注射化学发光法在食物及药物分析中的应用[J]. 食品工业科技,2012,33(11):395-399.
[12]赵增兵,阎娥. 流动注射化学发光法研究进展[J]. 河南师范大学学报(自然科学版),2012,40(5):110-114.
[13]申东方,周方钦,王珍. 磁芯-硫脲壳聚糖微柱在线流动注射-原子吸收光谱法测定大米中痕量镉[J]. 分析科学学报,2015,31(1):28-32.
[14]赵珍义. 双光束流动注射光度法测定生活用水中氯离子[J]. 分析测试学报,1997,16(5):34-36.
[15]孙涛,周冬香,毛芳,等. 流动注射化学发光法对超氧阴离子自由基和羟基自由基的检测[J]. 食品工业科技,2006,27(11):182-184.
[16]梁琴琴,李永生. 流动注射分光光度法快速测定乳制品中的蛋白质含量[J]. 分析化学,2011,39(9):1412-1417.
[17]马强,朱定波,杨杏芳,等. 鲁米诺-铁氰化钾流动注射化学发光体系测定饮用水中棒曲霉素[J]. 食品工业科技,2013,34(15):306-308.
[18]赵小青. 流动注射荧光法测定食品和饮料中的甲醛[J]. 化学研究,2007,18(3):80-82.
Determinationofaliphaticaldehydesinplantoils
byflowinjectionfluorescencemethod
LONGZe-rong1,WANGLi-tao2,LIULi1,ZHAOJian-yong1,LUYi1,*,ZHAOLiang3,DONGShu-qing3,LIHui3
(1.Xinjiang Uugur Autonomous Region Product Quality Supervision and Inspection Institute,Urumqi 830001,China;2.College of Pharmacy,Jining Medical University,Rizhao 276800,China;3.Lanzhou Institute of Chemical Physics of the Chinese Academy of Sciences,Lanzhou 730000,China)
TS227
A
1002-0306(2017)18-0275-05
2017-02-07
龙泽荣(1974-),女, 博士,提高待遇高级工程师, 研究方向:食品质量与安全,E-mail:long8326rong@163.com。
*通讯作者:鹿毅(1966-),男,大学本科,提高待遇高级工程师,研究方向:食品分析和精细化学,E-mail:luyi_xjzjy@163.com。
乌鲁木齐市科技局重点项目(Y141320007)。
10.13386/j.issn1002-0306.2017.18.052
