固相萃取-超高效液相色谱法测定土壤中氯吡苯脲的残留
2017-10-16,,,,,,
, , ,,,,
(涪陵出入境检验检疫局,重庆 408000)
固相萃取-超高效液相色谱法测定土壤中氯吡苯脲的残留
郑洋,吴杰,唐璜,王安良,杨文友,徐亚琴,郭禹良
(涪陵出入境检验检疫局,重庆408000)
采用固相萃取-超高效液相色谱法(SPE-UPLC)快速测定土壤中的氯吡苯脲残留量,对比确定了合适的前处理方法,并系统优化了测定方法中的提取和净化条件。实验结果表明:当采用乙腈提取,超声时间为30 min,离心转速为5000 r/min,PSA柱净化,色谱流动相为:V乙睛∶V水=65∶35时土壤中氯吡苯脲的提取效果最佳。氯吡苯脲在0.05~5.0 μg/mL质量浓度范围内与峰面积呈良好的线性关系(r=0.9999),定量限为0.025 mg/kg,氯吡苯脲的添加回收率为78.34%~102.4%,相对标准偏差为3.24%~6.65%。该方法测定速度快,准确度和精密度符合农药残留分析,能够满足对土壤中氯吡苯脲残留的快速测定要求。
氯吡苯脲,土壤,固相萃取,超高效液相色谱法
Abstract:The forchlorfenuron residues in soil were determined quickly by solid-phase extraction and ultra performance liquid chromatography(SPE-UPLC)in this paper. And this paper compared to determine the appropriate pre-treatment methods,optimized the extraction method and purification conditions. The optimal conditions were obtained that the sample was extracted with acetonitrile for 30 min by ultrasonic method, centrifuged in 5000 r/min and cleaned up with the PSA column. Forchlorfenuron was determined by ultra performance liquid chromatography using acetonitrile-water(65∶35) as mobile phase. The developed method showed a good linear relationship in the range of 0.05~5.0 μg/mL for forchlorfenuron,with correlation coefficient of 0.9999. The limit of quantitation for forchlorfenuron was 0.025 mg/kg.The average recovery rates were 78.34%~102.4%,with relative standard deviation(RSD)ranging from 3.24% to 6.65%. The method is fast,highly sensitivity,repeatable and suitable for the determination of forchlorfenuron residues in soil.
Keywords:forchlorfenuron;soil;solid-phase extraction;ultra performance liquid chromatography
氯吡苯脲又称氯吡脲,是一种具有细胞分裂素活性的植物生长调节剂,广泛用于农业中,如果树种植和园艺,具有促进果实肥大、影响细胞分裂、防止花和果实的脱落等作用[1]。中国作为人口大国,科技兴农的需求大,氯吡苯脲的应用规模与范围预计还会不断增加。但是氯吡苯脲摄入过多可能危害人体健康,美国环保署在《农药毒性确认和管理》第5版13章指出,长期接触氯吡苯脲会导致体内蛋白质代谢的紊乱、形体消瘦和轻度的肺气肿[2]。
由于氯吡苯脲具有一定的毒性,国内外学者对常见的蔬菜瓜果中氯吡苯脲残留进行了大量的研究[3-5],但是针对土壤中氯吡苯脲残留的研究较少。目前,由土壤污染引发的农产品质量安全问题逐年增多,成为影响大众身体健康和社会稳定的重要因素。有机农药作为常见的土壤污染物,能够间接被人体吸收,达到危害人体健康的程度[6]。因此开展土壤中氯吡苯脲残留的检测方法研究具有重要意义,不仅可以为土壤安全性评价提供理论依据,也为蔬菜瓜果的食用安全性提出参考意见。
目前,氯吡苯脲残留的测定方法很多,主要有气相色谱法[7-8]、液相色谱法[9-11]以及液相色谱-串联质谱法[12-15]等。近年来兴起的超高效液相色谱法能够提高样品分离度,相对于液相色谱-质谱联用法成本更低、分析速度更快、发展前景广阔。同时,农残分析前处理技术从最初的液液萃取,到固相小柱萃取和分散固相萃取发展,其中固相小柱萃取和QuEChERS(quick,easy,cheap,effective,rugged,safe)提取净化方法[16-17]已成为主流。在土壤中氯吡苯脲残留分析方法的研究上,李佳等[18]研究了氯吡苯脲在土壤和黄瓜中残留的液相色谱分析方法,但其方法有机溶剂消耗量较大,步骤繁琐。本文比较了固相萃取-超高效液相色谱法(SPE-UPLC)和QuEChERS法快速测定土壤中的氯吡苯脲残留量,并以此为基础对样品前处理条件进行了优化,以期建立土壤中氯吡苯脲残留的快速分析方法。
1 材料与方法
1.1 材料与仪器
甲醇、乙腈、二氯甲烷、乙酸乙酯、甲苯 均为色谱纯,TEDLA公司;超纯水 由密理博纯水仪制得;氯化钠 经120 ℃烘烤6 h后放置于干燥器中备用,分析纯,上海化学试剂公司;无水硫酸钠 经650 ℃烘烤6 h后放置于干燥器中备用,分析纯,上海化学试剂公司;无水硫酸镁 经140 ℃烘烤6 h后放置于干燥器中备用,分析纯,上海化学试剂公司;固相萃取小柱:丙基乙二胺(PSA)柱、氨基(NH2)柱、C18柱、碱性氧化铝(Al-N)柱、中性氧化铝柱、弗罗里硅土(Florisil)柱 Agela Technologies;分散固相吸附剂:丙基乙二胺(PSA)吸附剂 Agela Technologies;氯吡苯脲标准品 CAS号68157-60-8,纯度99.5%,Dr. Ehrenstorfer GmbH公司;新鲜土壤样品 于2016年11月,采自重庆市涪陵区清溪镇菜地。
安捷伦1290超高效液相色谱仪(配二极管阵列检测器)、色谱柱:AgiLent Zorbax XDB-C18柱(3.0 mm×150 mm,1.8 μm) Agilent Technologies;SCQ-8201A超声波清洗机 上海声彦超声波仪器有限公司;JPPM正压固相萃取仪 美国J2公司;DEG-200氮气发生器 淄博宏润工贸有限公司;N-EVAP TM112氮吹仪 Organomation Associates,Inc.;XW-80A旋涡振荡器 上海青浦沪西仪器厂。
1.2 实验方法
1.2.1 标准曲线的绘制 准确称取1.0 mg氯吡苯脲标准物质,置于10 mL容量瓶中,用甲醇溶解并定容至刻度,所配制的标准储备液置于冰箱保存备用。氯吡苯脲标准储备液用甲醇分别稀释成浓度为0.05、0.1、0.5、1.0、2.0、5.0 μg/mL系列标液,超高效液相色谱仪测定,以保留时间定性,峰面积定量,绘制标准工作曲线。
1.2.2 色谱条件 色谱柱:AgiLent Zorbax XDB-C18柱(3.0 mm×150 mm,1.8 μm);流动相:V乙睛∶V水=65∶35;柱温:25 ℃;检测器:二极管阵列检测器;波长:260 nm;流速:0.3 mL/min;进样量:10 μL。
1.2.3 两种前处理方法对土壤中氯吡苯脲提取的影响
1.2.3.1 固相萃取法提取土壤中的氯吡苯脲 准确称取新鲜土壤样品5.00 g置于50 mL具塞离心管中,添加0.2 mg/kg氯吡苯脲标准品,加入5.0 mL乙腈,涡旋振荡2 min混匀,超声30 min,取出后加入0.5 g氯化钠,2 g无水硫酸钠,涡旋振荡2 min,在5000 r/min的条件下离心10 min,待净化。将丙基乙二胺PSA分散固相萃取小柱置于正压固相萃取仪上,用4.0 mL淋洗剂乙腈∶甲苯=3∶1 (v/v)预淋洗活化,取离心后上清液2 mL上柱,再用10 mL淋洗剂洗脱,洗脱液用15 mL离心管收集。将收集液置于氮吹仪,于40 ℃水浴,氮吹近干,用甲醇∶水=1∶1 (v/v)溶解残留物定容至1 mL,过0.22 μm有机滤膜,待上机检测。
1.2.3.2 QuEChERS法提取土壤中的氯吡苯脲 准确称取新鲜土壤样品5.00 g置于50 mL具塞离心管中,添加0.2 mg/kg氯吡苯脲标准品,加入5.0 mL乙腈,涡旋振荡2 min混匀,超声30 min,取出后加入0.5 g氯化钠,2 g无水硫酸钠,涡旋振荡2 min,在5000 r/min的条件下离心10 min,待净化。准确吸取离心后的提取液2 mL于15 mL离心管中加入100 mg丙基乙二胺(PSA)吸附剂,涡旋2 min,以5000 r/min离心3 min,取上清液过0.22 μm有机滤膜,待上机检测。
1.2.4 固相萃取法前处理方法和流动相优化
1.2.4.1 液相色谱流动相的选择 准确称取4份新鲜土壤样品5.00 g置于50 mL具塞离心管中,添加0.2 mg/kg氯吡苯脲标准品,后续处理步骤同实验方法1.2.3.1。处理后待测样分别在流动相为乙腈-水、乙腈-0.1%甲酸水溶液、乙腈-0.1%乙酸水溶液、乙腈-0.1%乙酸铵水溶液,其他色谱条件同1.2.2进行检测。
1.2.4.2 提取溶剂的选择 准确称取5份新鲜土壤样品5.00 g置于50 mL具塞离心管中,添加0.2 mg/kg氯吡苯脲标准品,分别向5支离心管加入5.0 mL提取剂乙腈、乙腈(含1%乙酸)、二氯甲烷、甲醇、乙酸乙酯。后续处理步骤同1.2.3.1,每个处理重复2次。
1.2.4.3 超声时间和离心转速的优化 准确称取7份新鲜土壤样品5.00 g置于50 mL具塞离心管中,添加0.2 mg/kg氯吡苯脲标准品,加入5.0 mL乙腈,涡旋振荡2 min混匀,其中4份样品分别超声10、20、30、40 min,其余操作同实验方法1.2.3.1,每个处理重复3次。由于受仪器设备条件限制,另外3份样品的离心转速分别设定为4000、5000、6000 r/min,其余操作同实验方法1.2.3.1,每个处理重复2次。
1.2.4.4 固相萃取小柱的选择 准确称取6份新鲜土壤样品5.00 g置于50 mL具塞离心管中,添加0.2 mg/kg氯吡苯脲标准品按实验方法1.2.3.1进行提取处理。提取后6份样品分别采用PSA柱、Florisil柱、氨基柱、C18柱、碱性氧化铝和中性氧化铝进行净化,净化步骤同实验方法1.2.3.1,每个处理重复2次。
1.2.5 方法的定量限、准确度和精密度实验 通过对固相萃取前处理方法的优化,得到最佳测定条件。在此基础上向空白土壤样品中分别添加一系列不同水平的氯吡苯脲,得到氯吡苯脲定量限。然后选取4个不同水平(0.025、0.05、0.25、2 mg/kg)的氯吡苯脲,测定氯吡苯脲含量,并计算回收率。在相同条件下,每个添加水平重复6次,计算相对标准偏差(RSD)。
2 结果与讨论
2.1 两种前处理方法对土壤中氯吡苯脲提取效果比较
两种前处理方法对土壤加标样品的提取净化效果如图1和图2所示。
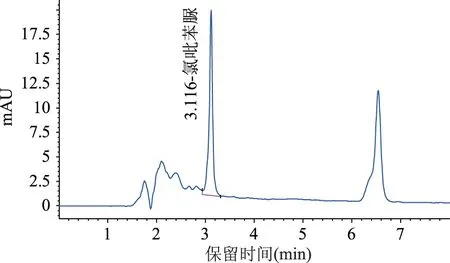
图1 固相萃取法处理土壤加标样品的液相色谱图Fig.1 Chromatography of spiked soil sample extracted by SPE method

图2 QuEChERS法处理土壤加标样品的液相色谱图Fig.2 Chromatography of spiked soil sample extracted by QuEChERS method
从图1和图2可以发现,两种前处理方法均能从土壤中提取出氯吡苯脲,目标峰峰形尖锐呈高斯分布,周围杂峰较少,有利于氯吡苯脲的定性定量检测,都适合土壤中氯吡苯脲的提取。进一步对比两种方法处理土壤样品得到的色谱图,在保留时间为1.4~3.0 min的区域内,QuEChERS法所得的色谱图基线更高,说明其极性干扰物质的含量较多。同时,采用固相萃取法得到的上机溶液为无色透明溶液,QuEChERS法得到的上机溶液为浅绿色样品溶液。说明固相萃取法处理后净化液中色素含量较少。两种前处理方法下氯吡苯脲的回收率如表1所示。结果表明,QuEChERS法平均回收率为54.68%,提取效果不佳,超出残留检测要求范围。而固相萃取法平均回收率为91.64%,能够有效提取土壤中的氯吡苯脲,相对标准偏差为2.43%,重现性较好,能够满足残留检测的要求。因为固相萃取法在净化过程中,提取液靠重力以较低流速通过固相萃取柱,这使提取液与吸附剂接触充分,从而有效去除掉色素、有机酸等杂质[19]。因此,本文选取固相萃取法作为土壤中氯吡苯脲的提取分析方法,并进一步优化。

表1 两种前处理方法下氯吡苯脲的回收率Table 1 Forchlorfenuron recoveries in two pretreatment methods
2.2 固相萃取法前处理方法和流动相优化
2.2.1 液相色谱条件中流动相的选择 本文首先在实验室前期工作[20]的基础上选择了V乙睛∶V水=65∶35,流速:0.3 mL/min作为流动相条件。实验发现,在此流动相条件下,待测物峰形及灵敏度都较好,目标峰附近无杂峰。查阅文献发现徐永等[12]在流动相中加入少量酸可改变不同组分的保留时间,使目标物和杂质有更好的分离。因此,在乙腈-水流动相中分别加入了0.1%的甲酸、乙酸和乙酸铵进行实验。实验结果表明,流动相加甲酸、乙酸或者乙酸铵对峰形无明显改善,且会增加流动相配制的步骤和成本,综合考虑选择乙睛-水作为流动相。
2.2.2 不同提取剂的提取效果比较 由于氯吡苯脲易溶于有机溶剂,且乙腈、二氯甲烷、甲醇、乙酸乙酯都是常用的农残提取溶剂。同时,有学者采用酸性乙腈(1%乙酸)提取氯吡苯脲,获得了较为理想的结果[21]。因此选取了乙腈、二氯甲烷、甲醇、乙酸乙酯、乙腈(1%乙酸)等作为氯吡苯脲的提取溶剂。实验结果如表2所示。

表2 不同提取溶剂的提取效果比较Table 2 Extraction effects by several extraction solvents
结果发现,采用乙酸乙酯作为提取溶剂得到的氯吡苯脲峰形不好,无法准确定量,故未选择。其他提取溶剂中,二氯甲烷的提取效果不佳,且对人体的毒性较大。采用甲醇作为提取溶剂时,会溶解出更多的色素和杂质,导致氯吡苯脲回收率下降[3]。而乙腈的提取效果优于其他溶剂。因为乙腈为极性溶剂,其对脂肪、糖、蛋白质的溶解度较小,且降低了基体杂质的溶出。同时,乙腈的低挥发性也能够减少对人体健康和生态环境的危害[22]。因此,本实验选择乙腈作为土壤中氯吡苯脲的提取溶剂。
2.2.3 超声时间和离心转速对氯吡苯脲提取效果的影响 本文进一步研究不同超声时间对土壤中氯吡苯脲提取效果的影响。从图3可以看出,超声时间从10 min变化至30 min时,氯吡苯脲回收率从84.53%增加到91.63%,说明氯吡苯脲提取效果随超声时间增加而明显提高。超声时间超过30 min,氯吡苯脲回收率趋向平稳,说明超声30 min即可将土壤中氯吡苯脲提取完全。故本实验选择超声时间为30 min。由于受仪器设备条件限制,分别考察了离心转速为4000、5000、6000 r/min时土壤中氯吡苯脲的提取效果。从图4可以看出,三个离心转速条件下氯吡苯脲回收率均能达到84%以上,离心转速从4000 r/min变化至6000 r/min时,氯吡苯脲回收率在84.95%和91.98%之间变化,差异不明显。其中离心转速为5000 r/min时氯吡苯脲回收率最高,相对标准偏差为1.10%,土壤中氯吡苯脲的提取效果最佳。因此本实验选择离心转速为5000 r/min。

图3 不同超声时间的提取效果比较Fig.3 Extraction effects by different ultrasound time
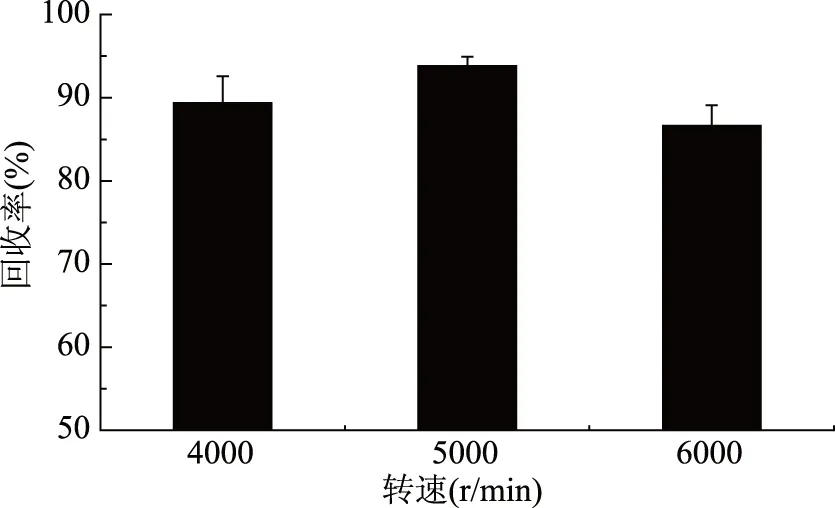
图4 不同离心转速的提取效果比较Fig.4 Extraction effects by different centrifugal speed
2.2.4 固相萃取小柱的净化效果比较 由于土壤成分复杂,为了增强净化效果,本实验通过查阅文献[23-24]后筛选了6种固相萃取小柱,分别为PSA柱、Florisil柱、氨基柱、C18柱、碱性氧化铝柱和中性氧化铝柱。研究了不同固相萃取小柱对土壤加标样品的净化处理效果,得到氯吡苯脲回收率如表3所示。

表3 采用不同固相萃取柱获得的回收率比较Table 3 Forchlorfenuron recoveries of the different kinds of solid phase extraction column
结果表明,不同固相萃取小柱都具有一定的净化除杂效果。在氯吡苯脲添加水平为0.20 mg/kg时,PSA柱对土壤样品的净化效果最佳,回收率达到93.55%,且样品测定时无干扰。Florisil柱、氨基柱和C18柱对土壤样品的净化效果较好,回收率均能达到85%以上。但碱性氧化铝和中性氧化铝对土壤样品的净化效果不佳,回收率较低。林涛等[22]比较了氨基柱、Florisil柱、碱性氧化铝柱的净化富集效果,发现氨基柱、Florisil柱、碱性氧化铝柱的净化效果,与本实验结果一致。可能是由于PSA柱和氨基柱所含有的氨基基团更有利于氯吡苯脲的净化。因此综合文献结果和实验数据本实验选择PSA柱。
2.3 方法的线性关系
在选定的色谱条件下,分别对一系列浓度的氯吡苯脲标液进行测定,以氯吡苯脲标样的峰面积为纵坐标(Y),进样浓度(μg/mL)为横坐标(X)做标准曲线,得到线性回归方程为Y=272.3732X-1.9836。结果表明,在0.05~5.0 μg/mL范围内,线性关系良好,r=0.9999。
2.4 方法的定量限、准确度和精密度
通过不同水平的土壤样品加标实验,结合取样量和稀释倍数,得到氯吡苯脲的定量限为0.025 mg/kg。方法的准确度和精密度可通过添加回收率实验来考察。按上述优化后的实验方法,对氯吡苯脲加标样品进行了含量测定并计算回收率和相对标准偏差(RSD),结果见表4。由表4可知,本实验方法在从低至高四个水平下,平均回收率在78.34%~102.4%之间,相对标准偏差在3.24%~6.65%之间。实验结果表明,本方法的准确度和精密度较好。采用此方法检测土壤中氯吡苯脲的残留量,准确可靠,符合农药残留的检测要求。
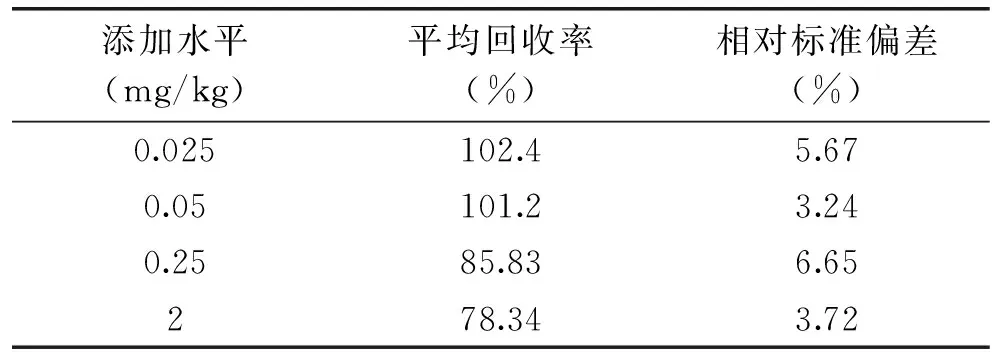
表4 氯吡苯脲的土壤加标回收率及相对标准偏差Table 4 The recovery and relative standard deviation of forchlorfenuron in soil
2.5 实际样品的测定
采用建立的方法对涪陵区清溪镇菜地采集的10个土壤样品进行氯吡苯脲残留测定,测定结果为10个土壤样品均未检测出氯吡苯脲。
3 结论
本文研究了土壤中的氯吡苯脲残留量的检测方法。实验结果表明固相萃取法可有效提取土壤中的氯吡苯脲,较好地去除土壤中的杂质对检测的影响。进一步优化了固相萃取法,当采用乙腈提取,超声时间为30 min,离心转速为5000 r/min,PSA柱净化,色谱流动相为:V乙睛∶V水=65∶35,流速0.3 mL/min时土壤中氯吡苯脲的提取效果最佳。氯吡苯脲在0.05~5.0 μg/mL质量浓度范围内与峰面积呈良好的线性关系(r=0.9999),定量限为0.025 mg/kg,氯吡苯脲的添加回收率为78.34%~102.4%,相对标准偏差为3.24%~6.65%。同时,该方法每次进样分析时间仅为8 min,测定速度快。说明所建方法具有灵敏度高、快捷简便等特点,准确度和精密度符合农药残留分析,能够满足对土壤中氯吡苯脲残留的快速测定要求。
[1]张卫炜,杨永珍. 氯吡脲的研究及应用进展[J]. 农药科学与管理,2006(5):36-40.
[2]林利美,黄大伟,郭娇娇,等. 氯吡脲对小鼠的毒性实验研究[J]. 食品工业科技,2012,33(14):360-362.
[3]张燕,舒平,徐幸,等. Florisil分散固相萃取-HPLC-MS/MS联用法测定果蔬中氯吡脲的残留[J]. 食品科学,2016,37(6):216-219.
[4]Chen W J,Jiao B N,Su X S,et al. Dissipation and residue of forchlorfenuron in citrus fruits[J]. Bulletin of Environmental Contamination and Toxicology,2013,90(6):756-760.
[5]Liu Q,Gong D X,Peng X C,et al. Determination of forchlorfenuron dissipation and residue in cucumbers and red soil[J]. Journal of Northeast Agricultural University(English Edition),2010,17(1):27-31.
[6]叶雪均,赵倩,郭子武,等. 土壤微生物与有机农药互作关系及其应用[J]. 林业科技开发,2008,22(6):9-12.
[7]赵莉,马青,马琳,等. 蔬菜瓜果中氯吡脲残留检测方法研究[D]. 武汉:华中农业大学,2007.
[8]张卫炜. 氯吡脲的残留分析方法及残留动态研究[J]. 分析科学学报,2013,29(4):583-586.
[9]胡江涛,盛毅,方智,等. 分散固相萃取_高效液相色谱法快速检测猕猴桃中的氯吡脲[J]. 色谱,2007,25(3):441-442.
[10]罗伟强,肖小华,杜卓,等. 整体柱固相萃取-高效液相色谱法在线分析水果中的氯吡脲[J]. 色谱,2014(4):407-412.
[11]杨春平,李钊君,宁红,等. HPLC检测枇杷中氯吡脲含量的前处理方法[J]. 浙江大学学报(农业与生命科学版),2016,42(3):350-357.
[12]徐永,寿林飞,虞淼,等. 超高效液相色谱-串联四级杆质谱联用法测定水果中多效唑、氯吡脲和咪鲜胺的残留[J]. 农药学学报,2012,14(1):61-66.
[13]Valverde A,Aguilera A,Ferrer C,et al. Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the buffered QuEChERS method[J]. Journal of Agricultural & Food Chemistry,2010,58(5):2818-2823.
[14]白冰,赵莉,宋卫国,等. 西瓜中氯吡脲残留的LC-MS/MS检测方法研究[J]. 上海农业学报,2016(3):60-62.
[15]Ma L Y,Zhang H Y,Xu W T,et al. Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Analytical Methods,2013,6(3):941-951.
[16]王楠,胡坪,国欣,等. QuEChERS-HPLC法快速检测猕猴桃中氯吡脲残留[J]. 食品工业,2014(5):234-237.
[17]Shi X M,Jin F,Huang Y T,et al. Simultaneous determination of five plant growth regulators in fruits by modified quick,easy,cheap,effective,rugged,and safe(QuEChERS)extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural & Food Chemistry,2015,60(1):60-65.
[18]李佳,龚道新. 氯吡脲在土壤和黄瓜中的残留分析[J]. 湖南农业科学,2010(5):84-87.
[19]王慧君,薛亚薇,康健,等. SPE和QuEChERS前处理方法结合LC-Q-TOF/MS检测苹果和番茄中282种农药残留对比研究[J]. 分析实验室,2015,34(4):383-387.
[20]吴杰,杨文友,王晓欢,等. 固相萃取-超高效液相色谱法检测榨菜中氯吡苯脲的研究[J]. 食品工业科技,2017(3):286-289.
[21]孙大利,郑尊涛,叶火春,等. 氯吡脲在葡萄中的残留分析方法及消解动态[J]. 农药,2011,50(10):751-753.
[22]吴莉莉,吕媛媛,沈兵,等. 高效液相色谱-串联质谱法快速测定水果中氯吡脲残留量[J]. 理化检验-化学分册,2014,50(2):206-209.
[23]林涛,陈兴连,李彦刚,等. 超高效液相色谱-串联质谱法测定葡萄中氯吡脲的残留[J]. 食品与机械,2013,29(6):93-98.
[24]侯玉茹,杨媛,石磊,等. 固相萃取-高效液相色谱法检测葡萄中氯吡脲的研究[J]. 食品科技,2011,36(1):255-258.
Residuedeterminationofforchlorfenuroninsoilbysolid-phase
extractionandultraperformanceliquidchromatography
ZHENGYang,WUJie,TANGHuang,WANGAn-liang,YANGWen-you,XUYa-qin,GUOYu-liang
(Fuling Entry-exit Inspection Quarantine Bureau,Chongqing 408000,China)
TS207.5
A
1002-0306(2017)18-0264-05
2017-02-23
郑洋(1989-),男,硕士研究生,工程师,主要从事食品安全检测分析方面的研究,E-mail:651192869@qq.com。
涪陵区科技计划项目(FLKJ,2016ABB1052)。
10.13386/j.issn1002-0306.2017.18.050
