不同干燥方法对金针菇多糖抗氧化活性的影响
2017-10-16,,,,,,
,,, ,,,
(常熟理工学院生物与食品工程学院,江苏常熟 215500)
不同干燥方法对金针菇多糖抗氧化活性的影响
陈义勇,李家祺,赵圆圆,陈慧,顾冰飞,李一天,赵培
(常熟理工学院生物与食品工程学院,江苏常熟215500)
以金针菇为原料,利用传统水提法提取金针菇多糖(polysaccharides fromFlammulinavelutipes,FVP),分别对传统热风干燥多糖(FVP-H)、真空干燥多糖(FVP-V)和冷冻干燥多糖(FVP-F)的成分和抗氧化活性进行研究。结果表明,FVP为酸性多糖,不同干燥方法对其单糖种类没有影响,但会改变单糖的构成比例和糖醛酸含量,FVP-H、FVP-V和FVP-F相对分子质量变化不明显,分别为2342309、2375843和2358437 Da。FVP-H、FVP-V 和FVP-F具有较强的清除DPPH自由基、羟基自由基、超氧阴离子自由基的能力和还原力,在一定浓度范围内,多糖与抗氧化活性及还原能力之间呈正相关关系,干燥方法对FVP抗氧化活性具有不同的影响,其中FVP-F抗氧化活性最强,其次是FVP-V和FVP-H,冷冻干燥是制备FVP适宜的干燥方法。
金针菇多糖,干燥方法,抗氧化活性
Abstract:Flammulinavelutipeswas used as raw materials. Polysaccharides fromFlammulinavelutipes(FVP)were extracted using conventional water extraction. FVP-H,FVP-V and FVP-F were obtained with hot-air drying,vacuum drying and freeze drying,respectively. Component and antioxidant activities of FVP-H,FVP-V and FVP-F were investigated. The results showed that FVP were acidic polysaccharides. Different drying methods had no effect on the monosaccharide species. However,it could change the monosaccharide composition and uronic acid content. The relative molecular weight of FVP-H,FVP-V and FVP-F were not obvious,which were 2342309,2375843 and 2358437 Da,respectively. FVP-H,FVP-V and FVP-F had a stronger scavenging ability of DPPH radical,hydroxyl radical,superoxide anion free radical and reducing power. In a certain concentration range,FVP were positively correlated with the antioxidant activity and reducing capacity. Different drying methods had different effects on the antioxidant activity of FVP. FVP-F had highest antioxidant activities,followed by FVP-V and FVP-H.Freeze-drying was the best drying method for preparation of FVP.
Keywords:polysaccharides fromFlammulinavelutipes;drying methods;antioxidant activity
金针菇(Flammulinavelutipes)又名朴菇、冬菇,隶属口磨科金钱菌属,已发展成为世界第三大食用菌[1]。现代研究表明,金针菇多糖(Polysaccharides fromFlammulinavelutipes,FVP)具有增强免疫力[2]、护肝[3]、抗肿瘤[4]、改善记忆[5]等功效。
不同干燥方法由于传热、受热及失水等因素可能会改变多糖的结构进而影响多糖生物活性[6]。吴振等[7]研究了不同干燥方式对银耳多糖理化特性及抗氧化活性的影响,Fan等[8]研究了不同干燥方法对灵芝多糖抗氧化活性的影响,结果表明干燥方式对多糖的生物活性有显著的影响。干燥方法对金针菇多糖抗氧化活性的影响研究报道较少,本文考察热风干燥、真空干燥和冷冻干燥等三种干燥方法对FVP的化学组成及抗氧化活性的影响,筛选出一种最适合FVP的干燥方法,旨在为FVP工业制备提供技术支撑。
1 材料与方法
1.1 材料与仪器
金针菇 张家港市常兴菌业有限公司;对氨基苯磺酸、盐酸奈己二胺 国药集团化学试剂有限公司;铁氰化钾 上海强顺化学试剂有限公司;1,1-二苯基-2-苦苯肼(DPPH) 上海楷洋生物技术有限公司;邻苯三酚、双氧水、三羟甲基氨基甲烷(Tris)、盐酸、无水乙醇、甲醇、丙酮、苯酚、硫酸亚铁、水杨酸、维生素C、三氯乙酸、亚硝酸钠、正丁醇、氯仿、石油醚等试剂 均为分析纯。
Alpha 1-2 LD冷冻干燥机 德国CHRIST公司;722分光光度计 上海菁华科技仪器有限公司;HK-20B密封式粉碎机 广州市旭朗机械设备有限公司;CR22GⅡ高速冷冻离心机 日本HITACHI公司;DHG-9030A电热恒温鼓风干燥箱 上海三发科学仪器有限公司;SHB-B95循环水式多用真空泵 郑州长城科工贸有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器有限公司;GC-14A气相色谱仪 日本Shimadzu公司;HH-2智能数显恒温水浴锅 金坛市杰瑞尔电器有限公司;Waters600高压液相色谱仪 美国Waters公司。
1.2 实验方法
1.2.1 FVP的提取 用蒸馏水清洗新鲜金针菇,将水沥干后在60 ℃条件下真空干燥12 h,然后机械粉碎,过100目筛,用石油醚将金针菇粉在70 ℃条件下脱脂回流2次,每次3 h,然后用体积分数为95%乙醇洗涤2次,以除去一些色素、单糖、低聚糖和其他一些小分子物质,抽滤除去溶剂后,60 ℃条件下真空干燥24 h得到金针菇粉末样品备用。称取100 g样品粉末于磨口锥形瓶中,加入3000 mL蒸馏水,在恒温水浴80 ℃下提取6 h,提取液在4000 r/min条件下离心20 min,上清液经过旋转蒸发浓缩(加热温度50 ℃,旋转速度50 r/min,真空度1.5 MPa,浓缩时间8 h)。浓缩液采用Sevage法去蛋白(6次),将浓缩液采用聚酰胺吸附柱层析法进一步纯化,用蒸馏水洗脱,得到洗脱液,洗脱液透析24 h,浓缩透析袋中多糖提取物,加入4 倍体积95%乙醇,4 ℃过夜后离心(4000 r/min),沉淀即为精制FVP。
1.2.2 FVP的干燥 采用热风干燥、真空干燥和冷冻干燥分别得到热风干燥多糖(Hot-air drying FVP,FVP-H)、真空干燥多糖(Vacuuming drying FVP,FVP-V)和冷冻干燥多糖(Freezing drying FVP,FVP-F)。热风干燥干燥条件:温度70 ℃,风速 2.0 m/s,干燥时间16 h。真空干燥干燥条件:温度50 ℃,真空度0.07 MPa,干燥时间12 h。冷冻干燥条件:温度-50 ℃,压力0.06 MPa,干燥时间48 h,经过三种方式干燥后的FVP为棕黄色粉未,水分含量≤5%。
1.2.3 FVP成分分析 中性糖含量测定以葡萄糖为对照品,采用苯酚-硫酸法[9],蛋白质含量的测定以牛血清白蛋白为标准品,采用福林-酚法[10],糖醛酸含量测定以半乳糖醛酸为对照品,采用间羟联苯法[11]。
1.2.3.1 FVP单糖组成 取多糖样品10 mg于具塞管中,加入2 mol/L的三氟乙酸(TFA)溶液2 mL真空封管后于121 ℃水解1 h,水解液除尽过量的TFA后,真空干燥。采用糖腈乙酸酯衍生化法,加10 mg盐酸羟胺、适量肌醇(内标)和0.5 mL吡啶,90 ℃加热30 min后,取出冷却至室温,加入0.5 mL醋酸酐,90 ℃下继续反应30 min进行乙酰化,反应产物直接进行气相色谱分析。
色谱条件:采用OV1701弹性石英毛细管柱(Φ0.32 mm×30 m),载气为N2,流速1.5 mL/min,FID氢焰检测器,气化室温度260 ℃,检测器温度250 ℃,采用程序升温:起始温度150 ℃,停留l min,以10 ℃/min升温至190 ℃,停留l min,以3 ℃/min升温至240 ℃,停留20 min。
1.2.3.2 FVP相对分子质量测定 将相对分子质量为6100、26290、84000、158000和291000的标准Dextran相继进样,采用高效液相色谱(HPLC)记录保留时间TR,以TR为横坐标,lgM为纵坐标绘制标准曲线,求得回归方程lgM=13.0-0.467 TR。将FVP-H、FVP-V和FVP-F多糖溶液(2 mg/mL)进样20 μL,根据所得TR,通过回归方程计算不同干燥多糖的相对分子质量。色谱柱:Waters UllrallydrogelTM Linear(Φ7.8 mm×300 mm),检测器:Waters2410示差折光检测器,以0.l mol/L的NaNO3为流动相,流速0.9 mL/min,柱温45 ℃。
1.2.4 抗氧化活性测定
1.2.4.1 清除羟基自由基的测定 根据Wang等[12]方法并稍作改进,研究FVP对羟基自由基的清除作用。取不同浓度的多糖样液(0.5、1.0、2.0、3.0、4.0 mg/mL)各1.0 mL,分别加入硫酸亚铁(9.0 mmol/L)和1.0 mL水杨酸-乙醇(9.0 mmol/L),对照组以1.0 mL去离子水代替多糖样液,最后加1.0 mL过氧化氢溶液启动反应。将反应溶液在37 ℃恒温水浴30 min,在510 nm波长处测定吸光度,记为A1;以去离子水代替多糖样液来重复以上操作,在510 nm波长处测得吸光度,记为A0;以去离子水代替过氧化氢溶液重复上述操作,在510 nm波长处测其吸光度,记为A2。三种样品分别测定,VC作为阳性对照,代替多糖样品液同样进行测定,样品平行测定3次取平均值,按下式计算·OH的清除率:
·OH清除率(%)=[1-(A1-A2)/A0]×100
式中:A1表示加多糖样品的吸光度;A2表示不加多糖样品的空白组的吸光度;A0表示不加过氧化氢的对照组的吸光度。
1.2.4.2 清除DPPH自由基的测定 根据Liu等[13]方法研究FVP对DPPH自由基的清除作用。分别取2 mL不同质量浓度的多糖样品液(0.5、1.0、2.0、3.0、4.0 mg/mL),加入2 mL的0.1 mmol/L的DPPH-乙醇溶液(现用现配),混匀后避光室温放置30 min,在517 nm波长处测定吸光度,记为A1;以蒸馏水代替多糖样液重复上述操作,在517 nm波长处测其吸光度,记为A0;以蒸馏水代替DPPH-乙醇溶液重复以上操作,作为对照管,在517 nm波长处测得吸光度,记为A2。VC作为阳性对照,代替多糖样品液同样进行测定,样品平行测定3次并且取平均值,按下式计算DPPH自由基的清除率:
DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100
式中:A1表示加多糖样品的吸光度;A0表示不加多糖样品的空白组的吸光度;A2表示不加DPPH的对照组的吸光度。

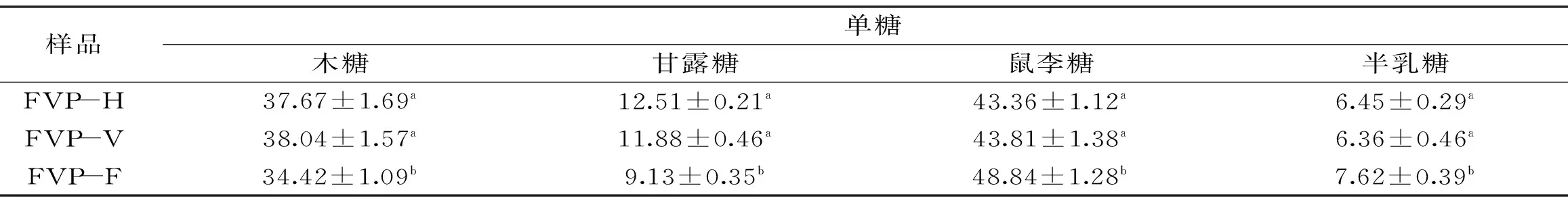
表2 不同干燥方法的FVP单糖组成(%)Table 2 Monosaccharide composition of FVP dried by different methods(%)

式中:A0表示不加多糖样品空白组的吸光度;Ai表示加多糖样品的吸光度。
1.2.4.4 还原力的测定 根据Wu等[15]方法研究FVP的还原力。在具塞比色管中分别加入2 mL磷酸缓冲液(0.2 mol/L、pH6.6)、0.2 mL不同质量浓度的FVP多糖样品溶液(0.5、1.0、2.0、3.0、4.0 mg/mL)和质量分数为1%的铁氰化钾溶液2.5 mL,混合均匀,50 ℃恒温水浴20 min后,加入质量分数为10%的三氯乙酸2.5 mL终止反应。取反应溶液2.5 mL,加入2.5 mL蒸馏水和0.5 mL FeCl3,混合均匀静置10 min,4500 r/min离心10 min,在700 nm波长处测吸光度,VC作为阳性对照,样品平行测3次取平均值。
1.3 数据统计分析
数据以平均数和标准偏差(x±SD)表示,采用SAS软件AVOVA程序进行显著性分析,Duncan程序进行多重比较。
2 结果与讨论
2.1 FVP化学组分
不同干燥方法得到的FVP化学组成见表1,从表1中可以看出,FVP-H、FVP-V和FVP-F均含有中性糖、蛋白质及糖醛酸。一般把含有酸性基团的多糖都称为酸性多糖,从化学结构上分析,酸性多糖链除了含酸性基团(主要是糖醛酸和硫酸根)外,可能还含有中性单糖[16],因此推断这三种多糖是酸性多糖,三种多糖中中性糖和蛋白含量(即百分含量)差异不明显。FVP-H的糖醛酸含量低于FVP-V和FVP-F,差异显著(p<0.05),这可能是由于FVP-H在干燥过程中氧气的存在及高温对糖醛酸的破坏[17]。
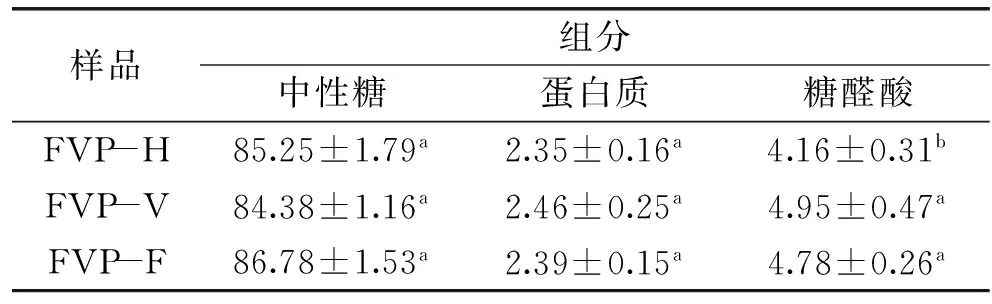
表1 不同干燥方法的FVP化学组成(%,W/W)Table 1 Chemical composition of FVP dried by different methods(%,W/W)
注:该表内数据为平均值±标准偏差(n=3),同行不同字母表示差异显著(p<0.05);表2同。
2.2 FVP单糖组成
标准单糖经乙酰化后的气相色谱图见图1,给出了不同出峰时间所代表的单糖。不同干燥方法得到的FVP-H、FVP-V 和FVP-F的单糖气相色谱图分别见图2~图4,单糖组成(质量分数)见表2,从图2~图4和表2可以看出,三种FVP主要由木糖、甘露糖、鼠李糖和半乳糖四种单糖组成,其中FVP-H和FVP-V单糖组成差异不明显,FVP-F单糖组成与FVP-H和FVP-V差异显著(p<0.05),表明干燥方法对多糖的单糖种类没有影响,但会改变单糖的构成比例。
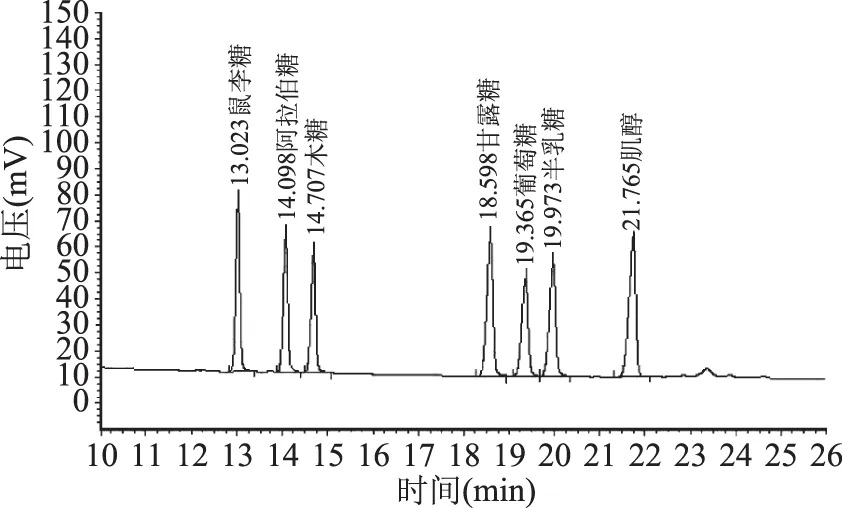
图1 标准单糖经乙酰化后的气相色谱图Fig.1 Gas chromatogram of standardmonosaccharides with acetylation
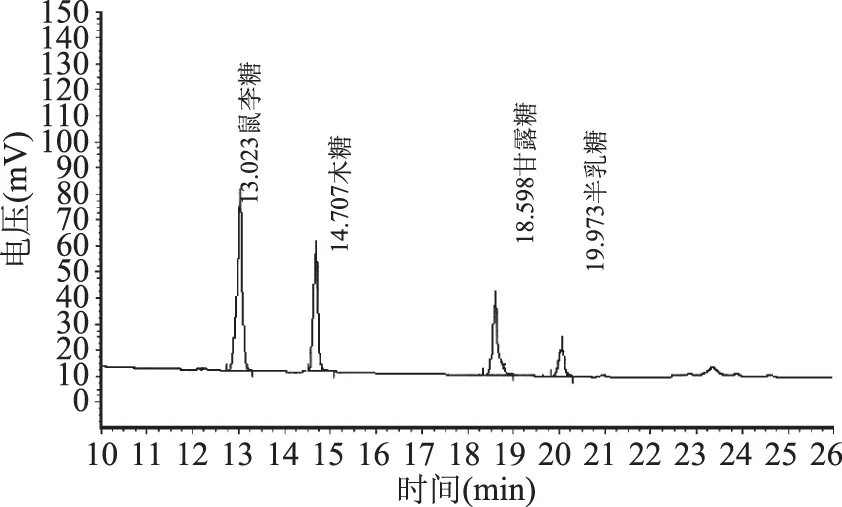
图2 FVP-H单糖的气相色谱Fig.2 Gas chromatogram of the monosaccharides of FVP-H
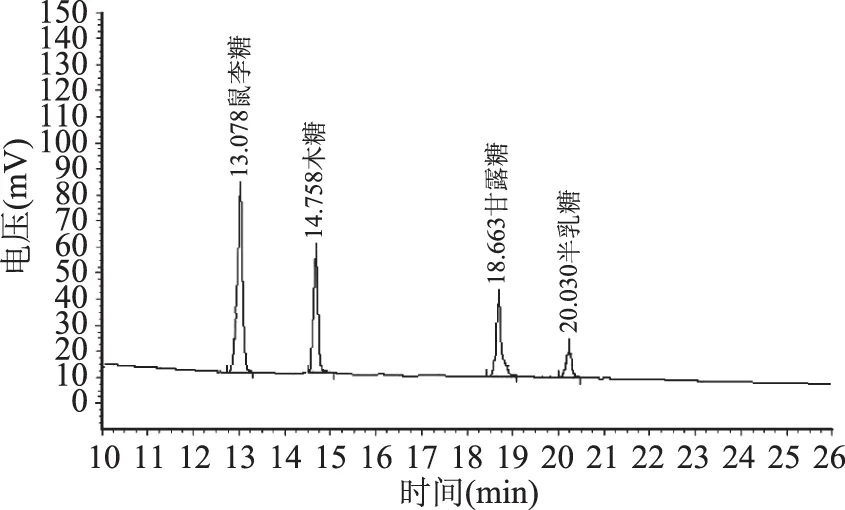
图3 FVP-V单糖的气相色谱Fig.3 Gas chromatogram of the monosaccharides of FVP-V
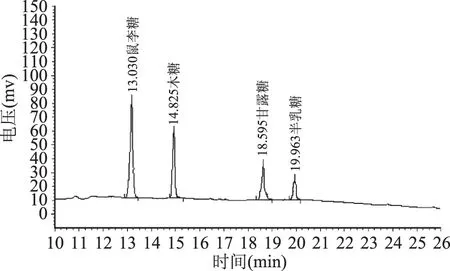
图4 FVP-F单糖的气相色谱Fig.4 Gas chromatogram of the monosaccharides of FVP-F
2.3 FVP相对分子质量
采用高效液相色谱方法分析了FVP-H、FVP-V和FVP-F的相对分子质量,结果分别见图5~图7,从图5~图7可以看出,FVP-H、FVP-V和FVP-F相对分子质量分别为2342309、2375843、2358437 Da,不同干燥方法得到的多糖相对分子质量变化不明显。
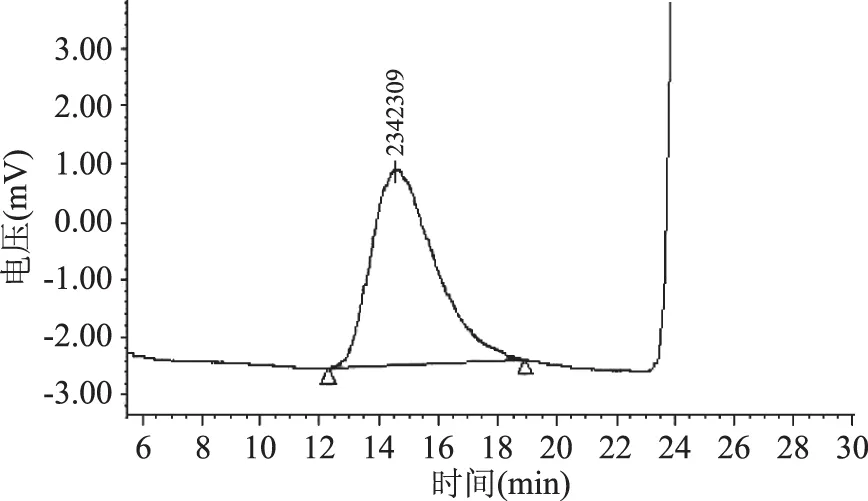
图5 FVP-H相对分子质量Fig.5 Relative molecular weight of FVP-H
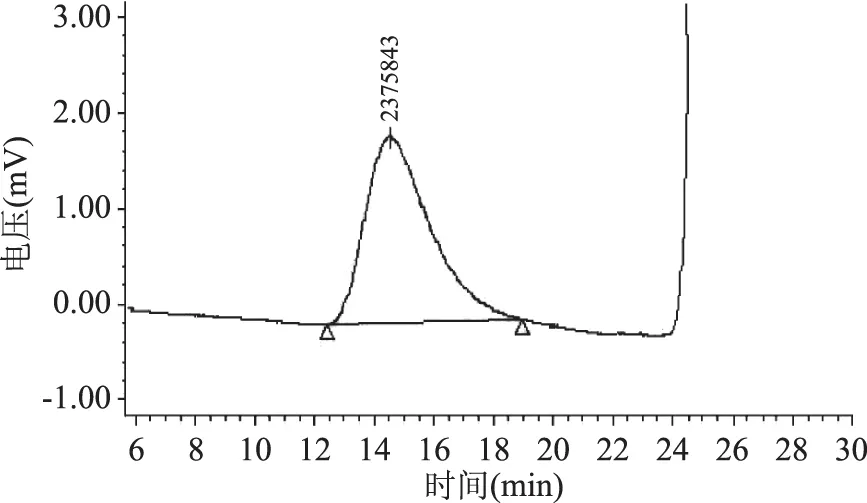
图6 FVP-V相对分子质量Fig.6 Relative molecular weight of FVP-V
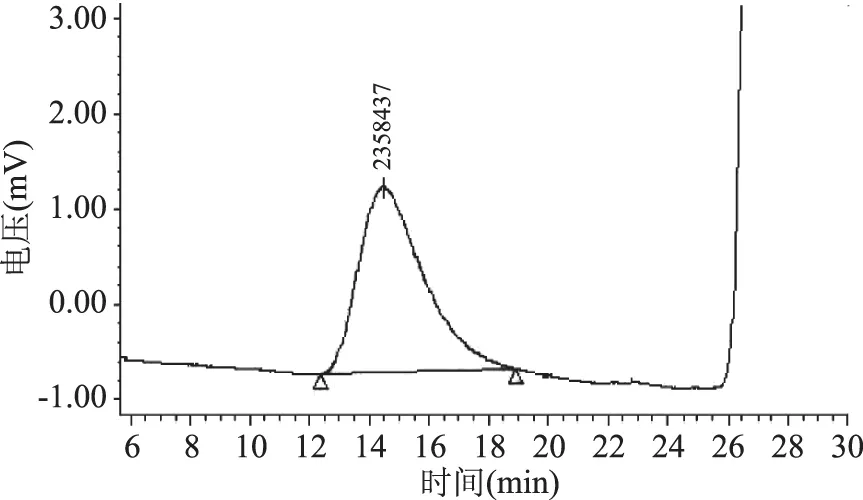
图7 FVP-F相对分子质量Fig.7 Relative molecular weight of FVP-F
2.4 干燥方法对FVP抗氧化活性的影响
2.4.1 干燥方法对FVP羟基自由基清除的影响 干燥方法对FVP清除羟基自由基的影响结果见图8。在一定的质量浓度范围内,随着FVP-F、FVP-V和FVP-H质量浓度的增加,对羟基自由基的清除作用增加,清除作用与浓度呈正相关关系,其中FVP-F对羟基自由基的清除作用最强,其次是FVP-V和FVP-H,在质量浓度为4.0 mg/mL时,FVP-F、FVP-V和FVP-H的清除率分别为90.3%、73.4%和59.8%,但弱于VC。
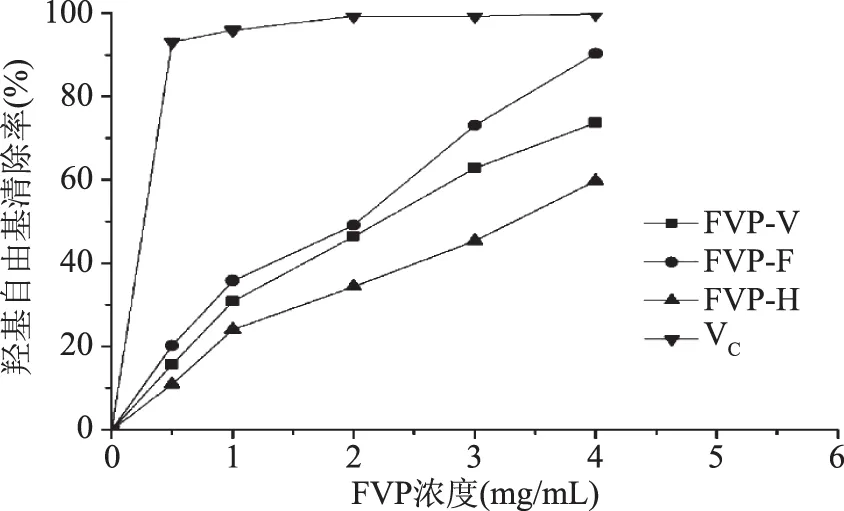
图8 干燥方法对FVP清除羟基自由基的影响Fig.8 Scavenging effect of FVP dried by different methods on hydroxyl free radical
2.4.2 干燥方法对FVP清除DPPH自由基的影响 干燥方法对FVP清除DPPH自由基的影响结果如图9所示。从图9可以看出,三种干燥方法得到的多糖均具有一定的DPPH自由基清除作用,在一定的质量浓度范围内,随着FVP-F、FVP-V和FVP-H质量浓度的增加,其对DPPH自由基的清除作用增加,清除作用与浓度呈正相关关系,其中FVP-F对DPPH自由基的清除作用最强,其次是FVP-V和FVP-H,在质量浓度为4.0 mg/mL时,FVP-F、FVP-V和FVP-H对DPPH自由基清除率分别为48.7%、40.8%和36.9%,但弱于VC。
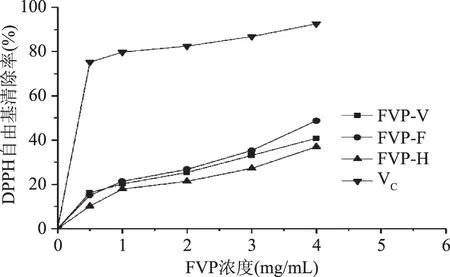
图9 干燥方法对FVP清除DPPH自由基的影响Fig.9 Scavenging effect of FVP dried by different methods on the DPPH radical
2.4.3 干燥方法对FVP清除超氧阴离子自由基的影响 干燥方法对FVP清除超氧阴离子自由基的影响结果见图10,三种干燥方法得到的多糖均具有一定的超氧阴离子自由基清除作用,在一定的质量浓度范围内,随着FVP-F、FVP-V和FVP-H质量浓度的增加,对超氧阴离子自由基的清除作用增加,清除作用与浓度呈正相关关系,其中FVP-F对超氧阴离子自由基的清除作用最强,其次是FVP-V和FVP-H,在质量浓度为4.0 mg/mL时,FVP-F、FVP-V和FVP-H对超氧阴离子自由基清除率分别为77.8%、66.6%和56.2%,但弱于VC。
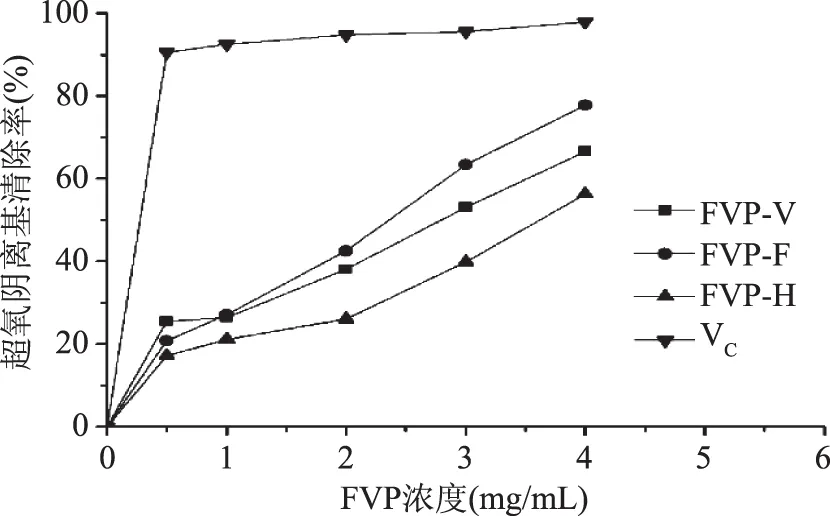
图10 干燥方法对FVP清除超氧阴离子的影响Fig.10 Scavenging effect of FVP dried by different methods on hydroxyl free radical
2.4.4 干燥方法对FVP还原力的影响 干燥方法对FVP还原力的影响结果见图11,三种干燥方法得到的多糖均具有一定的还原力,在一定的质量浓度范围内,随着FVP-F、FVP-V和 FVP-H质量浓度的增加,还原力增加,还原力与浓度呈正相关关系,其中FVP-F的还原力最强,其次是FVP-V和FVP-H,在质量浓度为4.0 mg/mL时,FVP-F、FVP-V和FVP-H的还原力分别为0.94、0.894和0.789,但弱于VC。
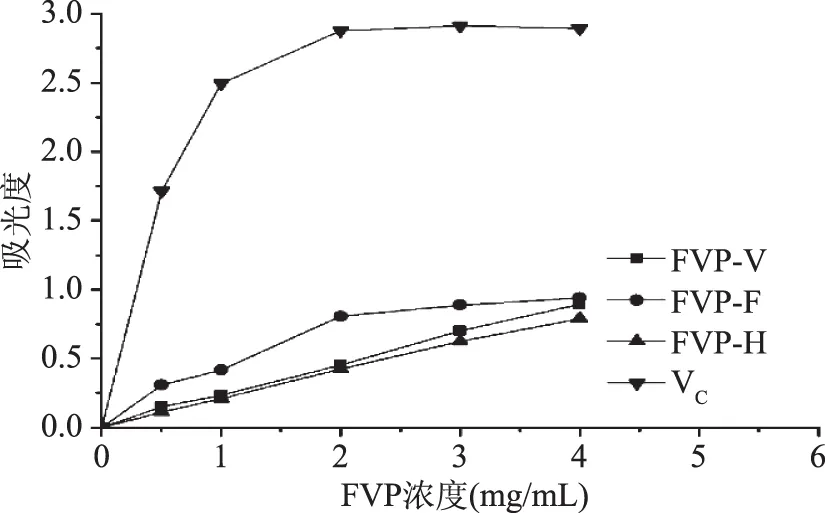
图11 干燥方法对FVP还原力的影响Fig.11 Effect of FVP dried by different methods on reducing power scavenging
3 结论
以金针菇为原料,利用传统水提法提取金针菇多糖,分别采用热风干燥、真空干燥和冷冻干燥三种干燥方法对金针菇多糖进行干燥,得到传统热风干燥多糖(FVP-H)、真空干燥多糖(FVP-V)和冷冻干燥多糖(FVP-F),对其组分和抗氧化活性进行研究,得到如下结论:不同干燥方法对其单糖种类没有影响,但会改变单糖的构成比例和糖醛酸含量,FVP-H、FVP-V和FVP-F相对分子质量变化不明显,分别为2342309、2375843和2358437Da。FVP-H,FVP-V 和FVP-F具有较强的清除DPPH自由基、羟基自由基、超氧阴离子自由基的能力和还原力,在一定浓度范围内,多糖与抗氧化活性及还原能力之间呈正相关关系,干燥方法对FVP抗氧化活性具有不同的影响,其中FVP-F抗氧化活性最强,其次是FVP-V 和FVP-H;冷冻干燥是制备FVP适宜的干燥方法。
[1]郑义,李超,王乃馨.金针菇多糖的研究进展[J].食品科学,2010,31(17):425-428.
[2]常花蕾,雷林生,余传林,等. 金针菇多糖对小鼠免疫细胞产生细胞因子及对荷瘤小鼠血清细胞因子含量的影响[J].中药材,2009,32(4):561-563.
[3]Pang XB,Yao WB,Yang XB. Purification,characterization and biological activity on hepatocytes of a polysaccharide from Flammulina velutipes mycelium[J].Carbohydrate Polymers,2007,70(3):291-297.
[4] 陈芝芸,严茂祥,项柏康. 金针菇多糖对Lewis肺癌荷瘤小鼠的抑瘤作用及免疫功能的影响[J].中国中医药科技,2003,10(4):226-227.
[5]潘鸿辉,宇雄涛,黄纪国,等. 金针菇多糖改善小鼠学习记忆功能[J].中国食用菌,2014,35(5):40-42.
[6]徐洲,刘静,冯士令,等.不同干燥方法对淫羊藿多糖化学性质和抗氧化活性的影响[J].食品工业科技,2015,36(19):116-119,123.
[7]吴振,李红,罗杨,等.不同干燥方式对银耳多糖理化特性及抗氧化活性的影响[J].食品科学,2014,35(13):93-97.
[8]Fan LP,Li JW,Deng KQ,et al. Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J]. Carbohydrate Polymers,2012,87(2):1849-1854.
[9] 张惟杰主编.糖复合物生化研究技术[M].杭州:浙江大学出版社,2003:52-54.
[10]Lowry OH,Rosebrough NJ,Farr A,et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry,1951,193:265-275.
[11]Blumenkrantz N,Gasboe H. New method for quantitative determination of uronic acid[J].Aanalytical Biochemistry,1973,54:484-489.
[12]Wang HY,Jiang XL,Mu HJ,et al. Structure and protective effect of exopolysaccharide from P. Agglomerans strain KFS-9 against UV radiation[J]. Microbiological Research,2007,162(2):124-129.
[13]Liu LX,Sun Y,Laura T,et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J. Tseng[J]. Food Chemistry,2009,112(1):35-41.
[14]Jiang B,Zhang HY,Liu CJ,et al. Extraction of watersoluble polysaccharide and the antioxidant activity from Ginkgo biloba leaves[J]. Medicinal Chemistry Research,2010,19(3):262-270.
[15]Wu HC,Chen HM,Shiau CY. Free amino acids and peptides as related to antioxidant properties in protein ydrolysates of mackerel(Scomberaustriasicus)[J]. Food Research International,2003,36(9/10):949-957.
[16]熊双丽,李安林. 酸性多糖的最新研究进展[J].食品科技,2010,35(5):80-83.
[17]Ma LS,Chen HX,Zhu WC,et al. Effect of different drying methods on physicochemical properties and antioxidant activities of polysaccharides extracted from mushroom Inonotus obliquus[J].Food Research International,2013,50(2):633-640.
EffectofdifferentdryingmethodsonantioxidantactivitiesofpolysaccharidesextractedfromFlammulinavelutipes
CHENYi-yong,LIJia-qi,ZHAOYuan-yuan,CHENHui,GUBing-fei,LIYi-tian,ZHAOPei
(School of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China)
TS255.1
A
1002-0306(2017)18-0040-06
2017-02-07
陈义勇(1974-),男,博士,副教授,研究方向:食品科学与天然活性成分,E-mail:chenyyxp@126.com。
国家星火计划项目(2014GA690011);张家港市科技支撑计划(农业)项目(ZKN1304)。
10.13386/j.issn1002-0306.2017.18.008
