油酸对C57/BL6J小鼠脂肪干细胞体外成脂分化的影响
2017-10-16张靖伟,姚英俊,梁媛,王晗,王际辉
张 靖 伟, 姚 英 俊, 梁 媛, 王 晗, 王 际 辉
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 生物工程学院, 辽宁 大连 116034 )
油酸对C57/BL6J小鼠脂肪干细胞体外成脂分化的影响
张 靖 伟1, 姚 英 俊2, 梁 媛1, 王 晗2, 王 际 辉2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 生物工程学院, 辽宁 大连 116034 )
对C57/BL6J小鼠脂肪干细胞进行原代培养,通过流式细胞术鉴定细胞表面抗原标志物。体外培养条件下,在成脂诱导分化培养基中加入不同浓度的油酸处理小鼠ADSCs 3 d,倒置显微镜下观察ADSCs的形态变化,油红O染色观察胞质中脂滴的聚集,并测定细胞中甘油三酯总量。结果表明,诱导3 d后,油酸处理组细胞胞体显著增大,形态由梭形变为圆形,胞质内脂滴显著增多;油红O染色细胞中可见大量红色的脂滴染色。各浓度油酸处理组细胞胞浆内甘油三酯总量增多,显著高于对照组,并呈剂量效应关系。说明油酸可促进小鼠ADSCs体外成脂分化。
油酸;脂肪干细胞;成脂分化
Abstract: Adipose-derived stem cells (ADSCs) from C57/BL6J mice were primary cultured and cell surface antigen markers were identificated by flow cytometry. ADSCs were treated with different concentration of oleic acid for 3 d. The morphological changes of ADSCs were observed and the differentiation level was assayed by oil red O staining and cellular triglyceride content was detected to confirm the degree of adipogenic differentiation. The cells increased in volume and lipid droplets in cytoplasm became round after stimulating for 3 d at different oleic acid concentrations. The cellular TG content was significant higher in oleic acid-treated cells than that in control group. The cells treated with oleic acid augmented cellular TG content in a dose dependent manner. The results suggested that oleic acid could promote adipogenic differentiation of C57/BL6J mice adipose-derived stem cellsinvitro.
Keywords: oleic acid; adipose-derived stem cells; adipogenic differentiation
0 引 言
日常膳食中的脂肪酸是一种重要的营养物质。脂肪酸在摄入人体后可以形成甘油三酯储存起来,为人体提供能量。脂肪酸在体内还能以磷脂的形式参与细胞膜系统的组成[1]。此外,部分脂肪酸及其代谢产物具有重要的生物活性,可以参与形成类固醇激素等信号分子来发挥重要的生理调控作用[2],如调节代谢、抗肿瘤以及与肥胖的发生密切相关。
肥胖是由多种因素引起的一种慢性代谢疾病[3]。对于儿童和青少年来说,肥胖的发生往往伴随着脂肪细胞数目的增多和体积的增大[4]。脂肪细胞的数目增多是脂肪前体细胞成脂分化的结果,成脂分化在肥胖的发生过程中扮演着重要角色。脂肪干细胞(Adipose-derived stem cells,ADSCs)是一类存在于脂肪组织中的干细胞,Zuk等[5]于2001年首次在人脂肪组织抽提物中发现。脂肪干细胞具有容易获取、增殖迅速和多向分化潜能等明显优势,因而被广泛应用于成脂分化研究中[6]。
在组成人体的脂肪酸中,十八碳烯酸是一类含量丰富的脂肪酸。在十八碳烯酸中,油酸(顺9-十八碳一烯酸)是一种主要的脂肪酸。此外,油酸也同样广泛存在于动植物来源的食用油中,是食用油主要的组成成分[7]。目前一些研究结果表明,油酸可以有效保护心脑血管系统[8-9]。动物实验表明,与鱼油相比,长期摄入油酸丰富的橄榄油会引起实验动物的肥胖[10]。但是,油酸引起肥胖的作用机制尚未见报道。
本实验应用C57/BL6J小鼠脂肪干细胞,以不同浓度的油酸干预脂肪干细胞成脂分化,探究了油酸对脂肪干细胞成脂分化的影响。
1 材料与方法
1.1 材料与试剂
8周龄雄性C57/BL6J小鼠,大连医科大学SPF级实验动物中心。
油酸、硬脂酸,美国Cayman化学公司;DMEM/F12细胞培养液,美国Thermo Fisher公司;胎牛血清(FBS),天津灏洋生物制品有限公司;MTT、牛胰岛素,上海源叶生物科技有限公司;油红O,美国Sigma公司;地塞米松,北京索莱宝科技有限公司;吲哚美辛,上海阿拉丁试剂;3-异丁基-1-甲基黄嘌呤(IBMX),百灵威科技有限公司。
1.2 仪器与设备
酶标仪,Multiskan GO,美国Thermo Fisher公司;倒置显微镜,IX81,日本奥林巴斯公司;流式细胞仪,FACSAria Ⅲ,美国BD。
1.3 方 法
1.3.1 脂肪干细胞原代培养
脂肪干细胞的分离操作参考Zuk等[11]的方法并稍加改动。取8周龄雄性C57/BL6J小鼠,断颈法处死,将鼠体浸入75%酒精消毒,无菌操作下取腹股沟脂肪垫,放在含有2%青链霉素的PBS中清洗多次,剔除肉眼可见的筋膜和血管,将组织尽量剪碎,将等体积的0.1%的Ⅰ型胶原酶加入组织块中,37 ℃下恒温消化40 min,每隔10 min用胶头滴管吹打组织块若干次,最后加入等体积的细胞培养基终止消化。400g离心5 min,弃去上层的脂肪细胞,沉淀物用PBS洗2次,最后用含10%胎牛血清重悬,70 μm细胞过滤网过滤,接种细胞于T-25细胞培养瓶中。将细胞培养瓶置于37 ℃、5%二氧化碳培养箱中,每隔3 d更换培养基。
1.3.2 脂肪干细胞的鉴定
采用流式细胞术鉴定细胞的表面抗原标志。待细胞传至第三代,用0.25%胰蛋白酶消化收集细胞,用含有2% CD29和CD34一抗的PBS在4 ℃ 下孵育细胞30 min。孵育结束后,用PBS洗细胞2次,调整细胞量至1×106个/mL,将细胞用0.2 mL 的PBS重悬,最后用70 μm尼龙滤网过滤后上机分析。
1.3.3 油酸的浓度筛选
收集三代以后的细胞,在96孔板以1×105个/孔的密度接种细胞。待细胞融合至90%,将细胞培养基换成含1 μmol/L地塞米松、10 μg/mL胰岛素、100 μmol/L吲哚美辛、0.5 μmol/L IBMX、10% FBS的DMEM/F12的成脂诱导分化培养基,分别用20、40、60、80 μmol/L油酸作用细胞3 d,以同样浓度的硬脂酸为对照。诱导3 d 后,每孔加入5 mg/mL的MTT,于37 ℃、5%二氧化碳培养箱中孵育4 h后吸弃液体,每孔加入150 μL DMSO,静置10 min后,在酶标板中于570 nm下测量吸光度。
1.3.4 油酸对脂肪干细胞的干预处理
将细胞接种于96孔板中,待细胞融合至90%,更换培养基为成脂诱导培养基,以终浓度为0、20、40、60 μmol/L的油酸干预脂肪干细胞分化3 d,每个浓度设3个重复。
1.3.5 脂滴油红O染色
取出终止诱导的细胞,在每孔中加入适量10%中性甲醛,室温下固定细胞30 min。向每孔中加入适量的2%油红O,室温下染色15 min。再将各孔加入0.3%的苏木精染液,室温下复染15 min。再向各孔中加入1%碳酸氢钠返蓝5 min。返蓝结束后,吸弃各孔碳酸氢钠溶液,用PBS清洗各孔后,在镜下观察细胞油红O染色程度。
1.3.6 胞质甘油三酯含量的测定
按照“1.3.4”的方法,用脂肪酸干预细胞成脂分化3 d,每孔中加入100 μL的SDS细胞裂解液,收集细胞,在冰上进行超声裂解(38 W,2 s/次,2 min)。按照甘油三酯测定试剂盒说明书的操作,37 ℃下孵育5 min,546 nm波长下测定吸光度。用甘油标准品作标准曲线,根据所测样品的吸光度,计算样品甘油三酯的实际浓度。
1.3.7 细胞总蛋白测定
按照BCA法测定总蛋白试剂盒说明书的方法,将各试剂和样品混合,37 ℃下孵育30 min,在562 nm波长下测量吸光度。作标准曲线,根据所测样品的吸光度,计算样品蛋白的实际浓度。
1.3.8 统计学分析
数据采用(平均数±标准差)表示,应用SPSS 22.0对多组均数进行单因素方差分析,P<0.05具有统计学意义。
2 结果与讨论
2.1 细胞鉴定
2.1.1 形态学观察
如图1所示,从脂肪组织分离接种的细胞3 d后贴壁呈纤维细胞样,培养7 d后细胞达到80%以上融合。经过若干次传代后细胞仍为梭形,增殖迅速,生长排列呈漩涡状,部分细胞集落出现层叠交错生长,未出现接触抑制现象。形态学观察结果表明,分离出的细胞符合脂肪干细胞形态学特征。
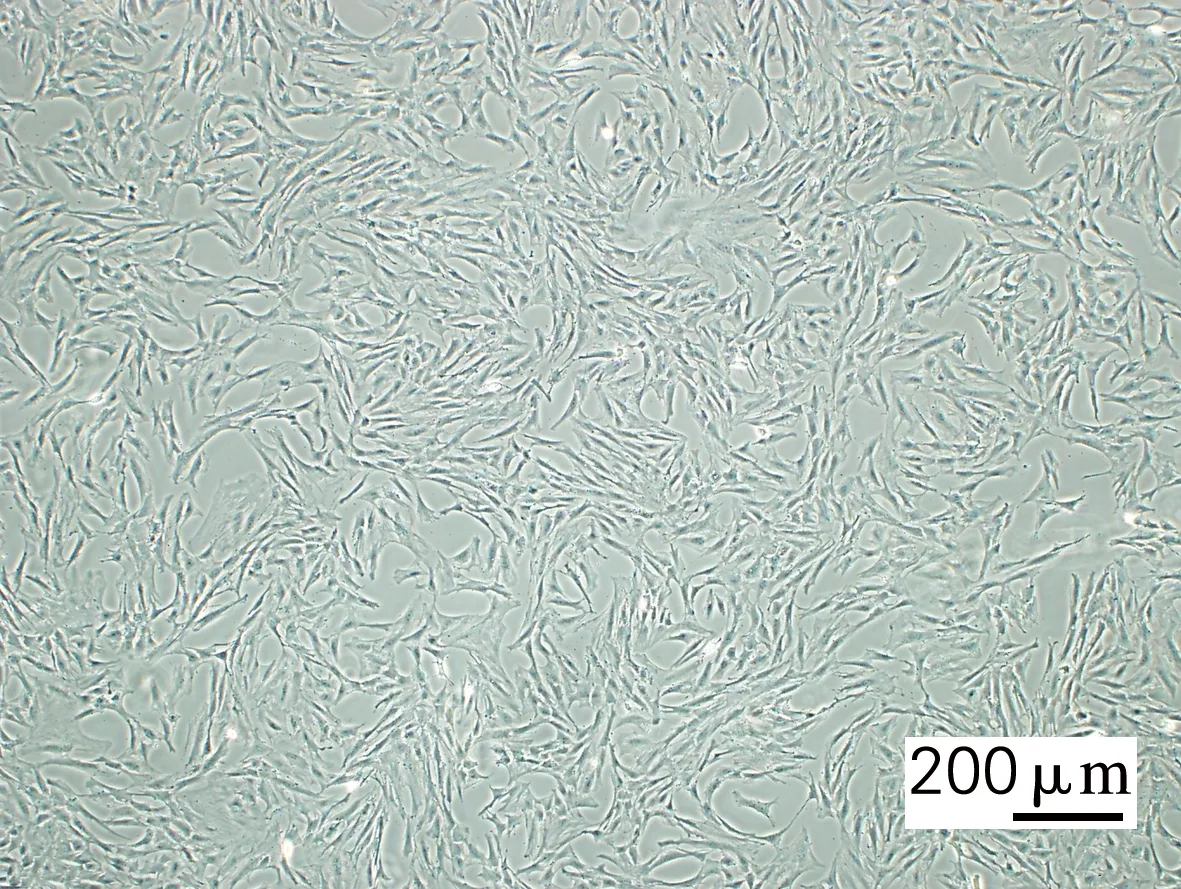
图1 C57/BL6J小鼠脂肪干细胞Fig.1 Adipose-derived stem cells of C57/BL6J mice
2.1.2 细胞表面抗原标志鉴定
流式细胞术检测结果如图2所示。由图2可以看出,分离出的细胞高表达CD29,未表达CD34。说明分离出的细胞表面抗原标志符合脂肪干细胞的表面标志特征。

(a) CD29直方图

(b) CD34直方图
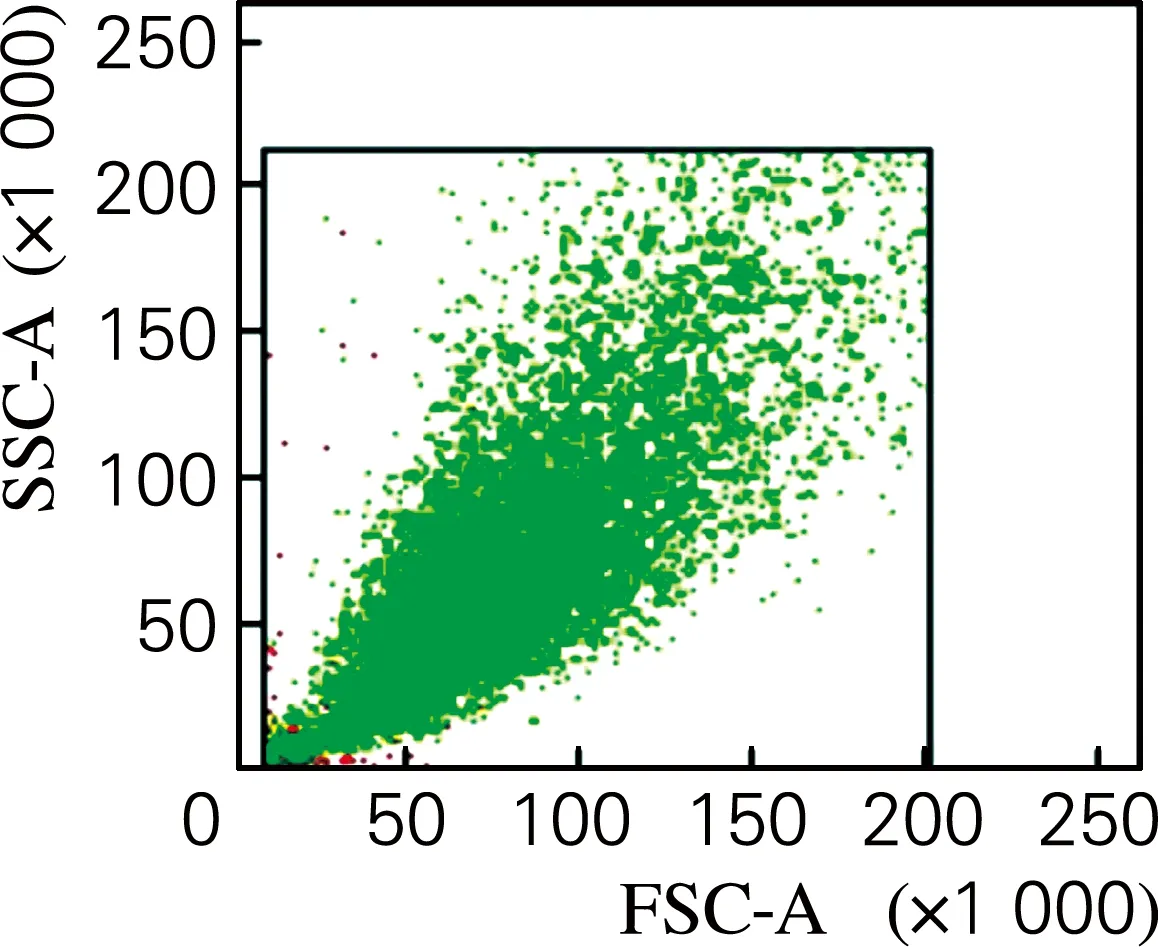
(c) CD29散点图
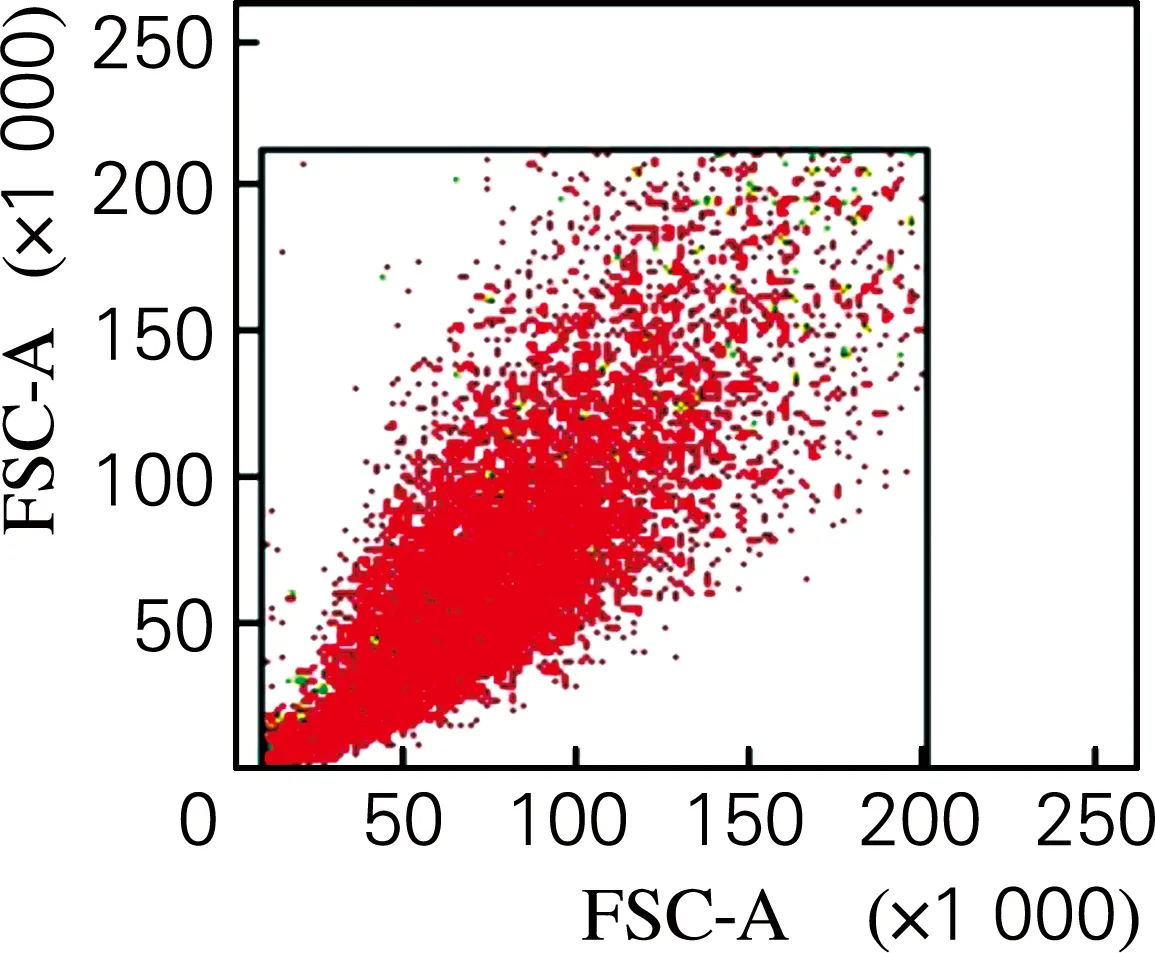
(d) CD34散点图
图2 细胞表面抗原标志鉴定
Fig.2 Identification of cell surface marker
2.2 脂肪酸浓度的筛选
应用MTT法确定合适的脂肪酸作用浓度,结果如图3所示,在20、40、60 μmol/L的油酸浓度作用下,各浓度组间吸光度没有显著差异(P>0.05),但在80 μmol/L,吸光度有显著下降(P<0.01);在相同浓度的硬脂酸作用下,各浓度组间吸光度有显著差异(P<0.01)。实验结果表明,油酸在20、40、60 μmol/L下,对分化期间的细胞没有毒性作用;相同浓度的硬脂酸对分化细胞的有毒性作用,并且呈现剂量效应关系。
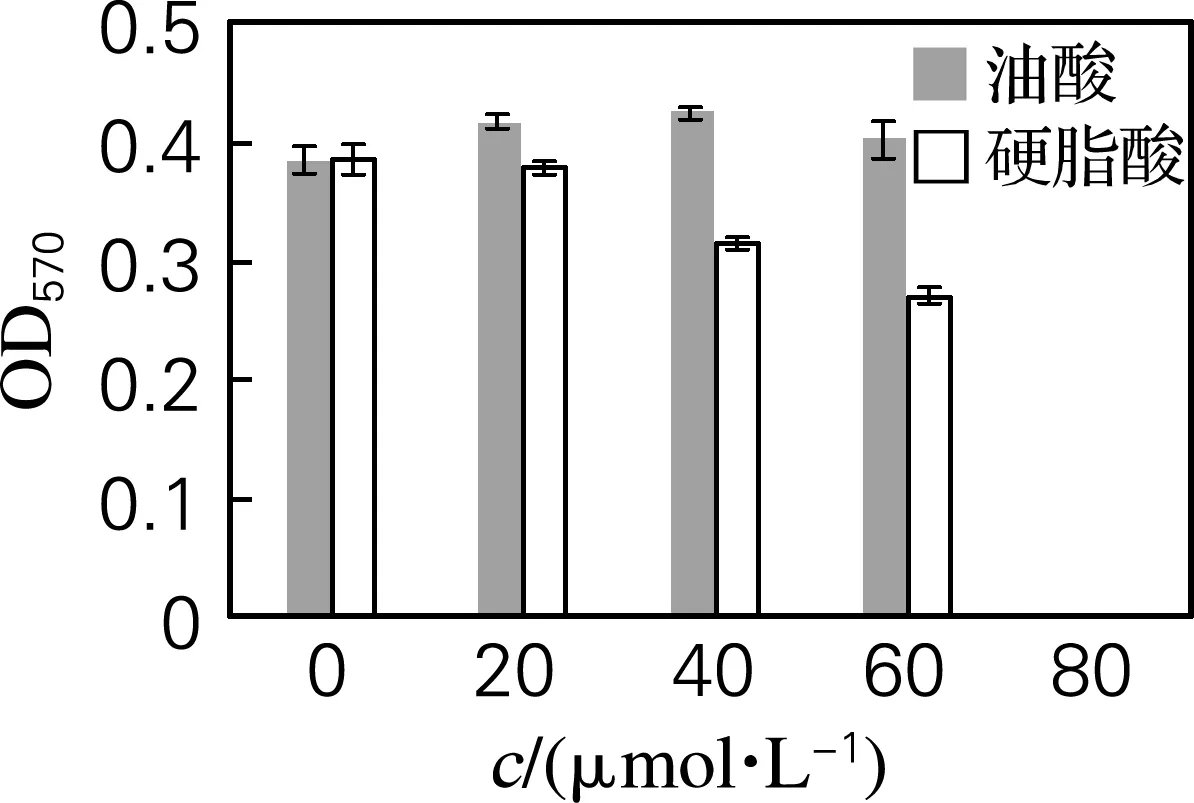
图3 油酸和硬脂酸对细胞活力的影响Fig.3 Effects of oleic acid and stearic acid on cell viabilities
2.3 油酸浓度对脂肪干细胞成脂分化的影响
在细胞分化的过程中,用不同浓度(20、40、60 μmol/L) 的油酸分别作用细胞3 d,应用油红O染色观察细胞的成脂分化情况,结果如图4所示。与未分化的细胞相比,处于分化阶段的细胞胞体变大,开始变圆,胞质中开始出现明显的脂滴。经过油酸处理后,胞质中的脂滴显著多于未经油酸处理的细胞。随着油酸浓度的增加,胞质中脂滴的含量也随之增加。油红O染色结果表明,油酸能够显著促进细胞胞浆中脂质的积累,促进细胞成脂分化。
2.4 油酸对胞质内甘油三酯质量分数的影响
以甘油三酯占细胞总蛋白的质量摩尔浓度对细胞成脂分化程度进行定量。如图5所示,与油红O染色的结果相似,经过油酸处理后的细胞胞质内甘油三酯含量显著提高,并呈现剂量效应。与未处理组相比,油酸处理3 d后,20、40、60 μmol/L 浓度下的细胞胞浆内甘油三酯质量分数分别提高了95.9%、294.7%和341.2%。实验结果进一步表明,油酸能够显著促进脂肪干细胞体外成脂分化,并呈现剂量效应关系。
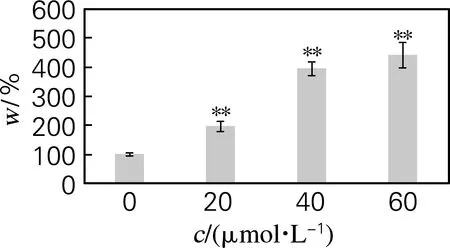
图5 油酸浓度对细胞中甘油三酯质量分数的影响
Fig.5 Effect of oleic acid concentration on TG accumulation during cell differentiation
3 结 论
本实验通过原代培养,获得了可以稳定传代的脂肪干细胞,并在成脂分化期间用不同浓度的油酸处理脂肪干细胞,通过油红O染色和胞内甘油三酯测定法分析发现油酸可以在体外显著地促进脂肪干细胞成脂分化,并且呈现剂量效应关系,提示大量摄入油酸可能与肥胖有关。
脂肪细胞分化是一个由众多转录因子参与的过程[14-17]。其中过氧化物酶体增殖激活受体γ(PPARγ) 是一种重要的转录因子,具有很强的脂肪细胞专一性,若被激活,则会发生强烈的成脂分化作用[18]。有文献证实,棕榈油酸可以以通过激活PPARγ来促进3T3-L1前脂肪细胞成脂分化[19]。此外,一些脂肪酸可以作为信号分子对Wnt/β-catenin[20]和Notch[21]等与成脂分化相关的细胞信号通路进行调控来发挥相应的作用。因此,油酸是否能够通过激活PPARγ和调控上述相关信号通路来促进脂肪干细胞成脂分化有待进一步研究。
[1] 王镜岩,朱胜庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[2] ORTEGA L, GARCIA-ANGUITA A, RIESTRA P, et al. Plasma non-esterified fatty acid levels in children and their relationship with sex steroids[J]. Steroids, 2014, 88: 15-18.
[3] 曲伸,陆灏.肥胖分类的重新思考与基于代谢的个体化诊断[J].中华内分泌代谢杂志,2015(8):655-658.
[4] KNITTLE J L, TIMMERS K, GINSBERG-FELLNER F, et al. The growth of adipose tissue in children and adolescents. Cross-sectional and longitudinal studies of adipose cell number and size[J]. Journal of Clinical Investigation, 1979, 63(2): 239-246.
[5] ZUK P A, ZHU M, MIZUNO H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J]. Tissue Engineering, 2001, 7(2): 211-228.
[6] ZUK P A. The adipose-derived stem cell: looking back and looking ahead[J]. Molecular Biology of the Cell, 2010, 21(11): 1783-1787.
[7] 魏永生,郑敏燕,耿薇,等.常用动、植物食用油中脂肪酸组成的分析[J].食品科学,2012(16):188-193.
[8] TERES S, BARCELO-COBLIJN G, BENET M, et al. Oleic acid content is responsible for the reduction in blood pressure induced by olive oil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(37): 13811-13816.
[9] COVAS M. Olive oil and the cardiovascular system[J]. Pharmacological Research, 2007, 55(3): 175-186.
[10] BUETTNER R, PARHOFER K G, WOENCKHAUS M, et al. Defining high-fat-diet rat models: metabolic and molecular effects of different fat types[J]. Journal of Molecular Endocrinology, 2006, 36(3): 485-501.
[11] ZUK P A, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Molecular Biology of the Cell, 2002, 13(12): 4279-4295.
[12] LI G, YAO W, JIANG H. Short-chain fatty acids enhance adipocyte differentiation in the stromal vascular fraction of porcine adipose tissue[J]. Journal of Nutrition, 2014, 144(12): 1887-1895.
[13] BROWN J M, HALVORSEN Y D, LEA-CURRIE Y R, et al. Trans-10, cis-12, but not cis-9, trans-11, conjugated linoleic acid attenuates lipogenesis in primary cultures of stromal vascular cells from human adipose tissue[J]. Journal of Nutrition, 2001, 131(9): 2316-2321.
[14] PRINS J B, O'RAHILLY S. Regulation of adipose cell number in man[J]. Clinical Science, 1997, 92(1): 3-11.
[15] UMEK R M, FRIEDMAN A D, MCKNIGHT S L. CCAAT-enhancer binding protein: a component of a differentiation switch[J]. Science, 1991, 251(4991): 288-292.
[16] AILHAUD G. Early adipocyte differentiation[J]. Biochemical Society Transactions, 1996, 24(2): 400-402.
[17] BRUN R P, KIM J B, HU E, et al. Adipocyte differentiation: a transcriptional regulatory cascade[J]. Current Opinion in Cell Biology, 1996, 8(6): 826-832.
[18] HALLENBORG P, PETERSEN R K, FEDDERSEN S, et al. PPARγ ligand production is tightly linked to clonal expansion during initiation of adipocyte differentiation[J]. Journal of Lipid Research, 2014, 55(12): 2491-2500.
[19] BOLSONI-LOPES A, FESTUCCIA W T, FARIAS T S M, et al. Palmitoleic acid (n-7) increases white adipocyte lipolysis and lipase content in a PPAR -dependent manner[J]. AJP: Endocrinology and Metabolism, 2013, 305(9): E1093-E1102.
[20] CHRISTODOULIDES C, LAGATHU C, SETHI J K, et al. Adipogenesis and WNT signalling[J]. Trends in Endocrinology and Metabolism, 2009, 20(1): 16-24.
[21] BI P, SHAN T, LIU W, et al. Inhibition of notch signaling promotes browning of white adipose tissue and ameliorates obesity[J]. Nature Medicine, 2014, 20(8): 911-918.
EffectofoleicacidonadipogenicdifferentiationofC57/BL6Jmiceadipose-derivedstemcellsinvitro
ZHANG Jingwei1, YAO Yingjun2, LIANG Yuan1, WANG Han2, WANG Jihui2
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2.School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
TS201.4
A
1674-1404(2017)05-0333-05
2016-03-21.
国家自然科学基金项目(31371764, 31370554);辽宁省自然科学基金项目(2014026016).
张靖伟(1989-),男,硕士研究生;通信作者:王 晗(1972-),女,副教授.
张靖伟,姚英俊,梁媛,王晗,王际辉.油酸对C57/BL6J小鼠脂肪干细胞体外成脂分化的影响[J]. 大连工业大学学报,2017,36(5):333-337.
ZHANG Jingwei, YAO Yingjun, LIANG Yuan, WANG Han, WANG Jihui. Effect of oleic acid on adipogenic differentiation of C57/BL6J mice adipose-derived stem cellsinvitro[J]. Journal of Dalian Polytechnic University, 2017, 36(5): 333-337.
