不同pH下瘤胃液中纤维素降解产氢菌群的性能
2017-10-16张璐,邢德峰,蒋青青,孙睿,任南琪
张 璐, 邢 德 峰, 蒋 青 青, 孙 睿, 任 南 琪
( 哈尔滨工业大学 市政环境工程学院, 黑龙江 哈尔滨 150090 )
不同pH下瘤胃液中纤维素降解产氢菌群的性能
张 璐, 邢 德 峰, 蒋 青 青, 孙 睿, 任 南 琪
( 哈尔滨工业大学 市政环境工程学院, 黑龙江 哈尔滨 150090 )
为了提高纤维素类有机质的降解率并了解牛瘤胃内微生物的种类及功能,从瘤胃液中以不同初始pH为基础定向培育稳定高效的降解群落,利用PCR-DGGE技术对菌落结构及菌种功能进行分析。结果表明,该菌群对以5 g/L微晶纤维素为碳源的发酵液的利用率最高,达到83%;在pH 6.5时获得了较高的产氢量(178.2 mL/L),此降解效率及产氢量均高于已报道的纤维素降解菌群。对群落结构分析发现,传代驯化4次后群落结构基本稳定,此群落中含有的菌种主要包括:具有纤维素降解功能的瘤胃菌(Ruminococcaceae),具有产氢能力细杆菌(Anaerofilum)以及降解纤维素并产生氢气的肠球菌(Enterococcus)、梭菌类(Clostridium)和肠杆菌(Enterobactercloacae)。
纤维素降解;瘤胃液;产氢菌群
Abstract: A stable and efficient degradation community was developed based on different initial pH to improve the degradation rate of cellulose and study types and function of bovine rumen microorganisms. The structure and function of bacteria were analyzed by PCR-DGGE. The result showed that the utilization rate of fermentation broth with 5 g/L microcrystalline cellulose as carbon source could reach to the maximum of 81.3%. The hydrogen production at pH 6.5 could reach to 178.2 mL/L. Its degradation rate and hydrogen production were higher than those reported in cellulose degrading bacteria. The community structure analysis showed that it was basically stable after 4 times of domestication. The community is consist of cellulolytic bacteria such asRuminococcaceae, hydrogen producers such asAnaerofilum,Enterococcus,ClostridiumandEnterobactercloacaeproducing H2from cellulose.
Keywords: cellulose degradation; rumen fluid; hydrogen-producing bacteria flora
0 引 言
生物制氢是一种利用微生物代谢产生氢气的可持续能源技术[1],其中一种方式是使用廉价的可再生原料以降低产氢的成本。纤维素是地球上分布最广、含量最丰富的碳水化合物,降解纤维素生产可再生能源已成为近年来生物质研究方向的热点[2]。纤维素的晶体结构极其复杂有序,使得其很难溶解和降解。与物理和化学方法相比,生物的方法具有减少环境污染和降低成本的优点。瘤胃微生物具有较高的纤维素分解活性且废弃物可转化为挥发性脂肪酸(VFA)或气体的优点,因此,构建稳定高效的瘤胃纤维素降解菌具有重要的研究意义。
目前,对于产氢细菌的筛选主要借助传统的微生物筛选方法,即采用特定的底物对菌源进行富集,再利用厌氧技术逐步纯化分离获得纯种。厌氧菌分解纤维素体系复杂,需要多种酶的协同作用。许多菌株产生的酶活性较低,且不能产生所有种类的纤维素酶,因此单纯通过微生物培养难以完全降解纤维素原材料。另一方面,代谢过程中,促进降解的协同作用不仅包括不同的纤维素降解菌之间纤维素酶的协同,还包含了纤维素降解菌和其他非纤维素降解菌之间的共同协作[3]。本研究利用富集培养对不同初始pH下的瘤胃液进行传代驯化,并对其过程中的发酵效能及群落结构进行了分析研究,以期为获得稳定高效的纤维素降解菌群提供理论支撑。
1 材料与方法
1.1 材 料
菌种采自哈尔滨郊区某屠宰场新鲜宰杀的水牛胃取出装入无菌瓶中,4 ℃厌氧保存,快速运往实验室。
富集培养基:NH4Cl,1 g/L;NaCl,1 g/L;K2HPO4,1 g/L;KH2PO4,1 g/L;半胱氨酸,0.5 g/L;MgCl2·6H2O,0.5 g/L;KCl,0.2 g/L;微晶纤维素,5 g/L;酵母粉,2 g/L;蛋白胨,2 g/L;微量金属元素贮液,1 mL/L;维生素贮液,1 mL/L;0.1%刃天青,1 mL/L;磷酸缓冲液,50 mmol/L。微量金属元素贮液及维生素贮液成分参考文献[4]。
1.2 方 法
1.2.1 纤维素降解产氢菌的富集
将4.0~6.0 g菌源样品放入装有玻璃珠的灭菌血清瓶中,以140 r/min在37 ℃恒温摇床中培养6~8 h。取10 mL悬浊液至葡萄糖为碳源的液体培养基中培养4~6 d。以结晶纤维素为底物,在不同初始pH下对混合溶液进行厌氧富集培养,富集培养2 d后转接至50 mL新鲜培养基中继续培养,选择纤维素降解效果较好的富集菌液转接几次以获取高效稳定的纤维素降解菌群。
1.2.2 DNA提取
取对数生长期中层液体2 mL,离心收集菌体进行基因组DNA提取,用0.8%的琼脂糖凝胶电泳检测。
1.2.3 变性梯度凝胶电泳
1.2.3.1 PCR扩增16S rRNA基因
按文献[5]的方法进行变形梯度凝胶电泳(PCR-DGGE)扩增。取PCR样品6 μL和10×loading buffer混合均匀缓慢加入上样孔。加样后在电压75 V下60 ℃ 运行12 h。染色后的凝胶样品经UMAX PowerLook 1000透射扫描仪成像,并在凝胶成像图上按顺序标注优势条带。
1.2.3.2 目的基因的克隆和测序
采用小量胶回收试剂盒回收凝胶中标记的DNA优势条带,将胶回收的DNA用pMD19-T Vector试剂盒连接。对连接转化后菌落进行蓝白斑筛选,挑取4个白色单菌落,利用通用引物M13(-47)和M13(-48)对样品进行PCR反应[9]。产物采用0.8%的琼脂糖进行凝胶电泳,含有目的基因的阳性转化子送至上海生工生物工程有限公司采用ABI 3730测序仪进行测序。
1.2.4 产物的测定方法
1.2.4.1 微晶纤维素质量分数的测定
将不同时期的混合溶液在3 000 r/min下离心,冲洗多次去除菌体后离心,烘干后测定剩余纤维素质量分数。
1.2.4.2 氢气体积分数的测定
利用GC-122型气相色谱仪对气体成分进行测定。色谱柱为2 m不锈钢柱,内部是分子筛填料(Alltech Molesieve 5A 60/80),采用热导池作为检测器。以氮气作为载气测定氢气的体积分数,气体体积流量在测定过程中为70 mL/min。柱温、进样器和检测器温度分别为110、205和300 ℃。样品进样量为200 μL,氢气体积分数根据外标法进行计算。
1.2.4.3 液相末端产物的测定
液相末端产物中主要含有各种挥发酸及乙醇等。将发酵液样品在10 000 r/min下离心10 min,取上清液,用0.22 μm滤膜过滤,取1 mL样品加入色谱瓶中后,加入30 μL甲酸酸化,混合均匀后取2 μL样品采用安捷伦GC-7890气相色谱测定液相末端产物成分及含量,以氮气作为载气,体积流量为60 mL/min,控制氢火焰检测器、汽化室、色谱柱室温度分别为185、220和185 ℃。1.2.4.4 可溶性还原糖含量的测定
还原糖含量采用3,5-二硝基水杨酸比色法进行测定[6],绘制标准曲线。取波长540 nm在分光光度计上进行比色。所测标准曲线公式为y=0.739x+0.331 2,R2=0.999 4。
2 结果与讨论
2.1 初始pH对富集产氢菌群结构的影响
采用磷酸盐缓冲液稳定发酵液中的pH,将发酵液维持在比较适于微生物菌体生长的溶液酸碱度内,此方法能有效减弱样品在发酵过程中由于溶液pH的不稳定而对产氢菌群造成不必要的影响。
2.1.1 纤维素降解产氢菌的传代
采用每隔48 h传代一次的方式进行传代。研究表明,纤维素降解开始的标志是气体的产生以及黄色素的生成[7]。从图1中可以看出,在发酵代谢过程中,微晶纤维素逐渐变为黄色,这主要是由于有一些生黄瘤胃细菌R.flavefaciens的出现[8]。随着发酵的进行,发酵液逐渐浑浊,白色的微晶纤维素几乎全部代谢完全。
2.1.2 基于PCR-DGGE的产氢菌群结构
瘤胃内的微生物群落具有很复杂的结构,利用变性梯度凝胶电泳对微生物群落结构在传代转接过程中的变化进行动态解析。如图2所示,富集菌群传代到第4次时,每种发酵液中的微生物群落都已基本达到相对稳定。在不同初始pH的发酵体系中,微生物的群落结构之间存在很大的差异。

图1 初始溶液pH 6.5时混合发酵0~48 h 的菌群
Fig.1 Fermentation of mixed bacteria from 0 to 48 h at initial pH of 6.5
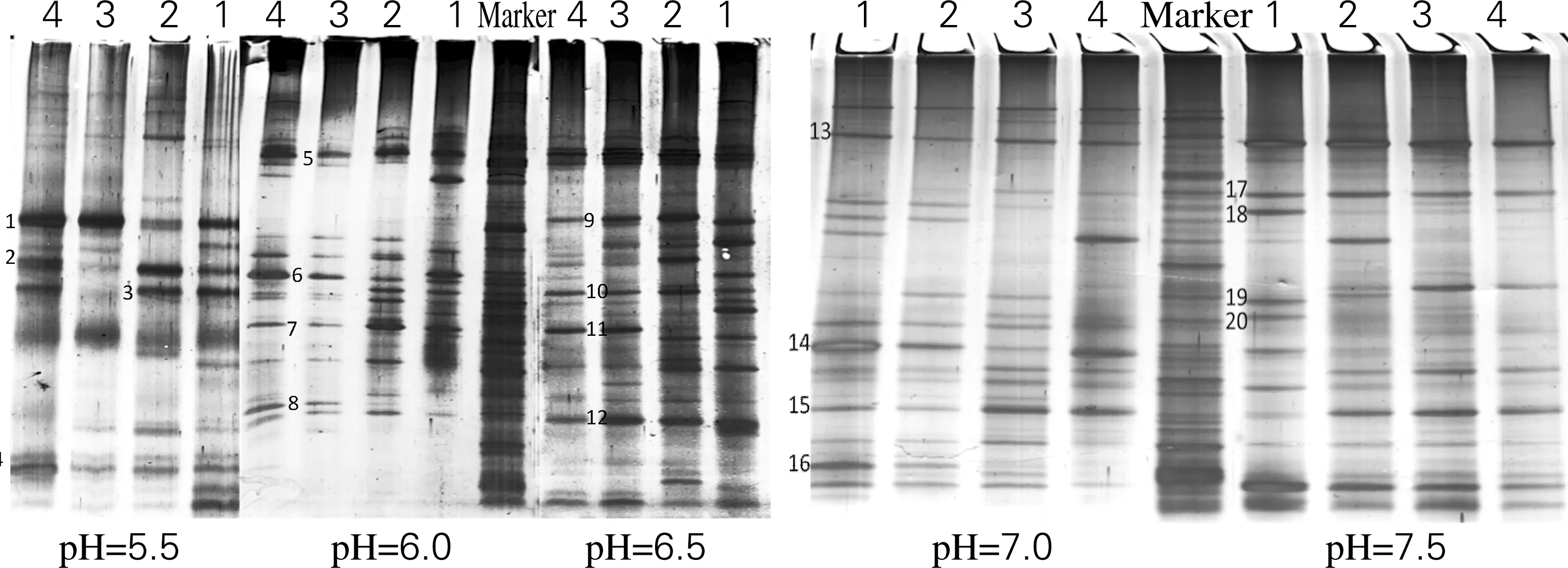
图2 不同初始pH下富集培养纤维素产氢菌群落16S rRNA的DGGE图谱Fig.2 DGGE profiles of 16S rRNA in the microbial communities at different initial pH
2.1.3 PCR-DGGE条带信息比对及功能分析
将所得条带的克隆测序结果利用Blast软件进行基因序列比对分析,获得了各条带最相近的微生物种属信息,结果如表1所示。条带1、9、13所指代的种群始终存在于各个不同的群落体系中,与之最相近的是拟杆菌(Bacteroidesgraminisolvens)[9]的部分基因,该菌属是从处理牛粪的产甲烷反应器中分离出来的,它是能够利用包括木聚糖、木糖、纤维二糖在内的多种有机质的厌氧菌。与条带3、10相近的细杆菌(Anaerofilum)是依赖氢化酶中的铁氢化酶为主要产氢功能酶的厚壁厌氧菌[10]。pH为5.5时,较明显的条带4为真杆菌(Eubacterium)[11],是一种可以广泛利用碳源进行严格厌氧发酵并产氢产乙酸的异养菌。pH为6.0中的明显优势条带5、6是肠球菌(Enterococcus),该菌种不但可以发酵产氢,还能够降解纤维素[12]。同时具有利用纤维素为底物降解,并且产氢气的还有条带8、14、19、20所代表的梭菌类(Clostridium)[13],以及能够利用多种有机底物产氢的肠杆菌(Enterobactercloacae)[14](条带11)。图谱中还有一些具有单一功能的菌种,例如利用糖蜜发酵产氢的乳杆菌(Lactobacillales)[15](条带16)以及富含β-1,4木聚糖内切酶和纤维素酶[16],能够降解纤维素的瘤胃菌(Ruminococcaceae)(条带12)。
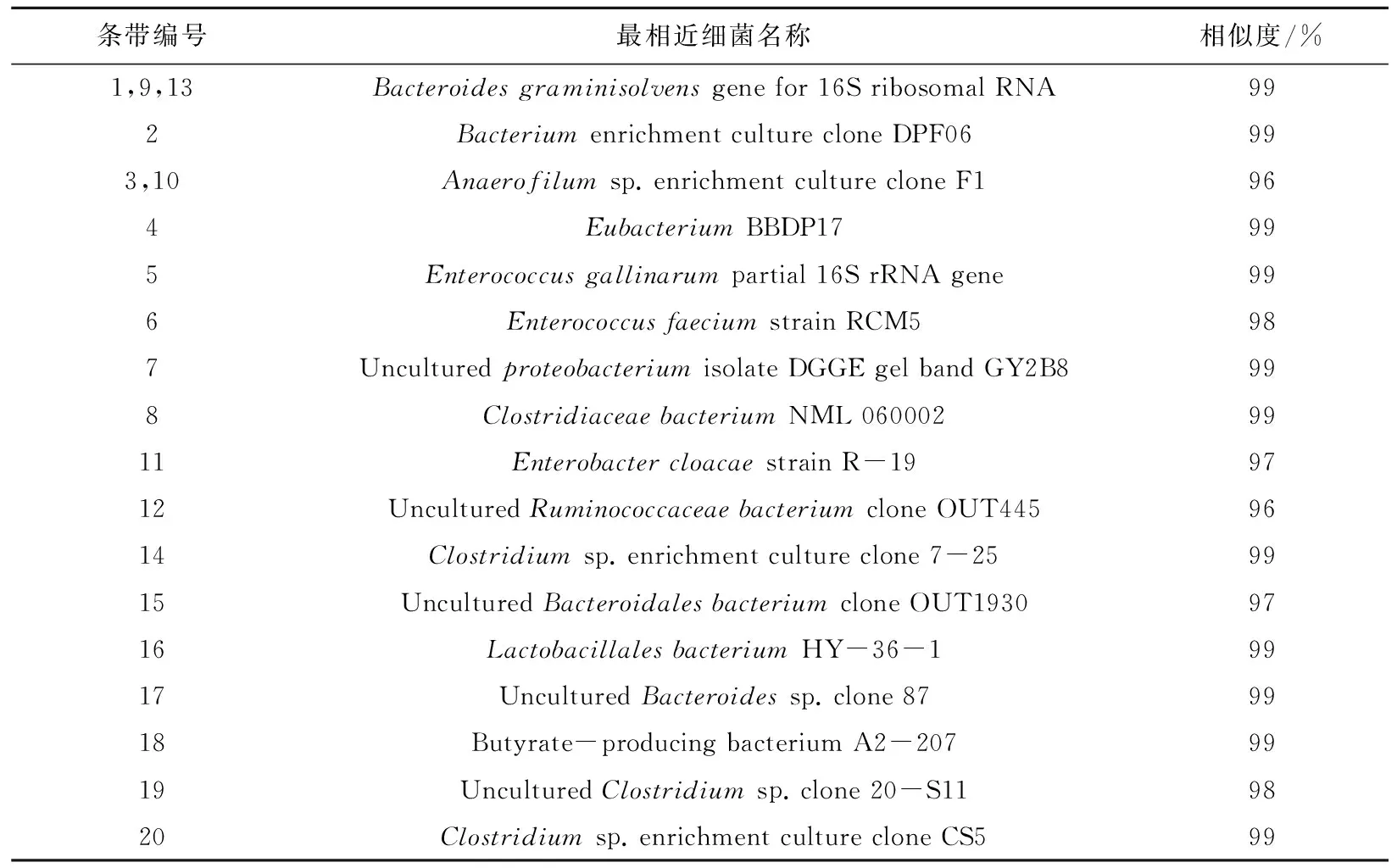
表1 与优势条带序列的DGGE条带具有最大相似性的种属Tab.1 Most closely related bacterial species and strains with DGGE bands in predominant bands
2.2 不同初始pH下的富集产氢菌群发酵效能
以微晶纤维素为唯一碳源富集的微生物经多次转接驯化,并测定各初始pH转接过程中的微生物的代谢特性。
2.2.1 不同初始pH下连续富集纤维素降解产氢群落的末端pH
从表2可以看出,缓冲液的加入使溶液的pH变化得到了有效控制,其pH基本稳定在弱酸环境,非常适宜瘤胃中的功能菌群,可以降低由于发酵产物如挥发酸的产生导致pH大幅变化,给微生物带来代谢抑制作用。
表2 不同初始pH条件下连续富集产氢群落的末端pH
Tab.2 Terminal pH of hydrogen-producing microbial communities enriched continuously at different initial pH

传代次数初始pH5.56.06.57.07.5Ⅰ6.516.626.486.747.21Ⅱ6.406.546.516.587.34Ⅲ6.356.426.446.627.29Ⅳ6.316.446.456.427.14
2.2.2 不同初始pH下连续富集纤维素降解产氢群落的产糖量及产氢量
由于初始酸碱度的不同,不同群落的优势菌群差别各异产生了差异性较大的代谢方式。由于在较高的pH下出现了如Ruminococcaceaebacterium一类降解纤维素的瘤胃菌,因此出现了糖类的累积。而对于pH较低情况下出现的一些产氢菌如Enterococcus、Enterobacter,还原糖得到了很好的利用,因此剩余量较少。
表3 不同初始pH条件下连续富集产氢群落的产糖量及产氢量
Tab.3 Production of reducing sugar and hydrogen of microbial communities at different initial pH
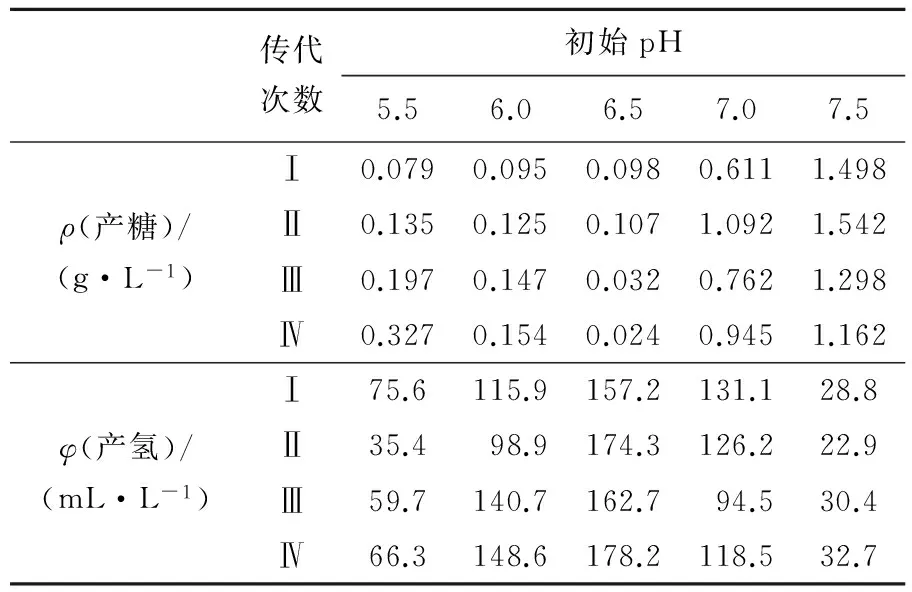
传代次数初始pH5.56.06.57.07.5ρ(产糖)/(g·L-1)Ⅰ0.0790.0950.0980.6111.498Ⅱ0.1350.1250.1071.0921.542Ⅲ0.1970.1470.0320.7621.298Ⅳ0.3270.1540.0240.9451.162φ(产氢)/(mL·L-1)Ⅰ75.6115.9157.2131.128.8Ⅱ35.498.9174.3126.222.9Ⅲ59.7140.7162.794.530.4Ⅳ66.3148.6178.2118.532.7
2.3 稳定菌群的底物发酵利用比较
如图3所示,微生物群落在初始pH为6.5时,具有最好的纤维素降解率81.3%。经过传代培养,菌群已具备稳定高效的降解功能,在发酵液pH 6.0~7.0检测到如Enterococcus、Enterobacter、Ruminococcaceae等具有纤维素降解功能的菌种,因此降解效率较高。
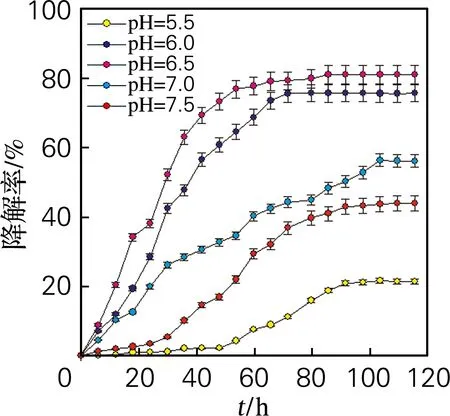
图3 不同初始pH下的纤维素降解率Fig.3 Cellulose degradation rate at different initial pH
3 结 论
本实验对不同初始pH下的瘤胃液进行定向培养,在富集培养4次后微生物群落结构基本稳定,但不同群落中的优势菌群差异很大。在初始pH为6.5时,产氢量和纤维素降解率均较高,氢气产量可达到178.2 mL/L培养基,降解率为81.3%;pH为7.5时获得了较高产糖量(1.162 g/L)。结果表明,富集的群落中含有多种功能菌属,包括降解纤维素的拟杆菌、瘤胃菌;发酵产氢的细杆菌、乳杆菌以及降解纤维素同时产生氢气的肠球菌、梭菌和肠杆菌。
[1] ZHANG L, CHUNG J S, REN N Q, et al. Effects of the ecological factors on hydrogen production and [Fe-Fe]-hydrogenase activity inEthanoligenensharbinenseYUAN-3[J]. International Journal of Hydrogen Energy, 2015, 40(21): 6792-6797.
[2] WYMAN C E, SPINDLER D D, GROHMANN K. Simultaneous saccharification and fermentation of several lignocellulosic feedstocks to fuel ethanol[J]. Biomass and Bioenergy, 1992, 3(5): 301-307.
[3] LEWIS S M, MONTGOMERY L, GARLEB K A, et al. Effects of alkaline hydrogenperoxide treatment on in vitro degradation of cellulosic substrates by mixed ruminal microorganisms andBacteroidessuccinogenesS85[J]. Applied and Environmental Microbiology, 1988, 54(5): 1163-1169.
[4] 孙云章,毛胜勇,姚文,等.瘤胃厌氧真菌和细菌对木质素含量不同底物的发酵特性[J].福建农林大学学报(自然版),2007,36(4):392-395.
[5] 许继飞.同步代谢秸秆木糖和葡萄糖的产氢新菌种及其产氢特性[D].哈尔滨:哈尔滨工业大学,2010.
[6] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428.
[7] 陈晓倩,殷浩文.微生物群落多样性分析方法的进展[J].上海环境科学,2003,22(3):213-217.
[8] 曹广丽.高效利用玉米秸秆的产氢菌种及其产氢性能研究[D].哈尔滨:哈尔滨工业大学,2010.
[9] NISHIYAMA T, UEKI A, KAKU N, et al.Bacteroidesgraminisolvenssp. nov., a xylanolytic anaerobe isolated from a methanogenic reactor treating cattle waste[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(8): 1901-1907.
[10] MOHAN S V, AGARWAL L, MOHANAKRISHNA G, et al. Firmicutes with iron dependent hydrogenase drive hydrogen production in anaerobic bioreactor using distillery wastewater[J]. International Journal of Hydrogen Energy, 2011, 36(14): 8234-8242.
[11] NGUYEN T A D, HAN S J, KIM J P, et al. Hydrogen production by the hyperthermophilic eubacterium,Thermotoganeapolitana, using cellulose pretreated by ionic liquid[J]. International Journal of Hydrogen Energy, 2008, 33(19): 5161-5168.
[12] PÉREZ C C, REYE C J, CELIS L B, et al. Inoculum pretreatment promotes differences in hydrogen production performance in EGSB reactors[J]. International Journal of Hydrogen Energy, 2015, 40(19): 6329-6339.
[13] ZHANG J N, LI Y H, ZHENG H Q, et al. Direct degradation of cellulosic biomass to bio-hydrogen from a newly isolated strainClostridiumsartagoformeFZ11[J]. Bioresource Technology, 2015, 192: 60-67.
[14] KUMAR N, DAS D. Enhancement of hydrogen production byEnterobactercloacaeIIT-BT 08[J]. Process Biochemistry, 2000, 35(6): 589-593.
[15] 张蕊,李永峰,包红旭,等.甜菜废蜜生物制氢的微生物学基础[J].中国甜菜糖业,2004(1):8-11.
[16] BIDDLE A, STEWART L, BLANCHARD J, et al. Untangling the genetic basis of fibrolytic specialization byLachnospiraceaeandRuminococcaceaein diverse gut communities[J]. Diversity, 2013, 5(3): 627-640.
Propertiesofcellulose-degradingandhydrogen-producingbacteriaflorainrumenfluidatdifferentpH
ZHANG Lu, XING Defeng, JIANG Qingqing, SUN Rui, REN Nanqi
( School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China )
Q815;X172
A
1674-1404(2017)05-0328-05
2017-07-06.
国家自然科学基金项目(31470233).
张 璐(1984-),女,博士研究生;通信作者:任南琪(1959-),男,教授.
张璐,邢德峰,蒋青青,孙睿,任南琪.不同pH下瘤胃液中纤维素降解产氢菌群的性能[J].大连工业大学学报,2017,36(5):328-332
ZHANG Lu, XING Defeng, JIANG Qingqing, SUN Rui, REN Nanqi. Properties of cellulose degrading hydrogen producing bacteria flora in rumen fluid at different pH[J]. Journal of Dalian Polytechnic University, 2017, 36(5): 328-332.
