解磷菌剂对香蕉幼苗生长及土壤理化因子的影响
2017-10-16柯春亮李淑娟段雅婕
柯春亮,李淑娟,段雅婕
(1.广东石油化工学院,广东 茂名 525000;2.茂名市第十七中学,广东 茂名 525000;3. 中国热带农业科学院南亚热带作物研究所,广东 湛江 524091)
解磷菌剂对香蕉幼苗生长及土壤理化因子的影响
柯春亮1,李淑娟2,段雅婕3
(1.广东石油化工学院,广东 茂名 525000;2.茂名市第十七中学,广东 茂名 525000;3. 中国热带农业科学院南亚热带作物研究所,广东 湛江 524091)
为了研究解磷菌剂对香蕉幼苗的促生效果,本研究将解磷菌株M-3-01制成菌剂,并以磷矿粉作为对照,通过盆栽试验研究了磷菌剂对香蕉植株生物量、生理生化指标及土壤因子的影响.研究表明:M-3-01菌剂对香蕉幼苗的生长有明显的影响.
解磷菌; 盆栽; 促生效应
微生物菌肥产业在肥料类型、工艺设备、质量体系与标准体系等方面有了长足的发展[1].目前,解磷菌剂的应用发展迅速,它作为微生物肥料重要的成员,已经成为我国农业肥料生产中的最重要的一部分[2].解磷菌剂通过自身的新陈代谢,可溶解植物根际土壤的难溶性磷素、分泌植物激素物质、抑制病原菌的生长,并且还能促进植株生长.为此,本研究利用实验室筛选所获得的溶磷效果较好的细菌菌株M-3-01(Serratianematodiphila),将其制成菌剂,并通过盆栽试验,设计了不同的试验条件,探究了解磷菌剂对香蕉幼苗生长及土壤理化因子的影响,以期为微生物菌肥的运用提供一定的理论支持.
1 材料与方法
1.1实验材料
1.1.1 供试菌株及植物从香蕉根际土壤中筛选到对磷矿粉具有良好溶解效果的细菌菌株M-3-01;
健康巴西蕉杯苗由中国热带农业科学院品质资源研究所(儋州)提供.
1.1.2 盆栽土壤海口红壤土,其基本特性为:全氮(N)1 031.6 mg·kg-1,速效磷(P)124.56 mg·kg-1,速效钾(K)630.65 mg·kg-1,pH 6.78.
1.2实验材料
1.2.1 实验设计盆栽试验是在海口市龙华区中国热带农业科学院生物技术研究所的实验大棚(110°19′ 24″E,19°59′8″N )内完成,每个处理设15株盆栽实验,试验共设4组处理,具体如下:
CK:无机磷基础培养基B(除磷矿粉外)
处理1:M-3-01解磷菌剂;
处理2:化学磷矿粉;
处理3:M-3-01解磷菌剂+化学磷矿粉.
1.2.2 盆栽试验本试验采用完全随机区组设计 菌株M-3-01菌液的制备:挑取少许代表细菌M-3-01,将其接种到细菌基础液体培养液中,转速为150 r·min-1,恒温摇床培育1 d;用无菌水稀释菌液至活菌密度为109cfu·mL-1量级,备用.
盆栽试验操作:按照m磷矿肥∶m土壤=1 ∶100 000的比例,提前1周,将磷矿肥与土壤混匀,备用.将处理好的香蕉杯苗移栽到营养钵中,每个处理15盆,并按V解磷菌液∶V无菌水=1 ∶50的稀释比例,从移栽后第1 天开始,按照试验设计浇灌相应的处理液,对于CK和T2也同样施入等量的灭菌无机磷,每次每株浇灌50 mL,每隔5 天浇灌1次,在整个盆栽期间,各组处理的其他管理措施均一致.
1.2.3 香蕉植株的生理生化指标的测定移栽当天记作第0天,移栽后第0,10,20,30,40 天,取香蕉第二片新叶来测定其生理指标,测定重复3次,并以其平均值作为实验结果.
(1)初提酶液的制备 将提取所用的所有试验工具清洗之后,于120 ℃灭菌20min,冷却后备用.用清水清洗叶片之后,再用φ=75%的酒精擦洗叶片的表面,然后在靠近主脉的部位取香蕉叶片0.5g,剪碎并置于预冷的研钵中,加入5mL50mmol·mL-1和pH=7.8的磷酸缓冲液以及少量石英砂与PVPP,于冰浴条件下研磨成匀浆,完毕后将其转入到离心管内,接着再用5mLPBS缓冲液清洗研钵及磨杵,并将清洗液转入到离心管中,最后于4 ℃,以12 000r·min-1离心20min,然后收集上清液,以其作为试验初提酶液,并于4 ℃保存,备用.
(2)生理生化指标的测定
在移栽后第0,10,20,30,40 天,分别取香蕉的第二片新叶来测定其以下指标:丙二醛(MDA)[3]、相对电导率(RC)[4]、可溶性糖、可溶性蛋白[5];叶绿素含量则采用丙酮(乙醇)提取法来提取.
1.2.4 土壤理化因子的测定土壤有效磷、有效钾、全氮含量及pH值测定按文献《土壤农化分析》进行.
1.2.5 数据处理用SAS6.12软件对试验数据进行方差分析和多重比较分析,并采用MicrosoftExcel2010软件作图.
2 结果与分析
2.1解磷菌M-3-01对香蕉幼苗生长及其理化因子的影响
2.1.1 M-3-01解磷菌对香蕉植株生长的影响如图1所示,不同处理组的香蕉苗生长状况与对照相比均表现出一定的差异性,香蕉苗的生长情况为:处理3>处理1>处理2>CK.从图1可以看出,T处理组的香蕉苗较CK组生长健壮.T处理组中,T1、T3组的生长势最为显著;CK组则表现出植株矮小,叶片偏黄而狭小;其中T3组是所有处理组中效果最好的.

图1 接种45 天后香蕉苗的生长情况
2.1.2 M-3-01解磷菌对香蕉叶片叶绿素含量的影响磷素是植物合成叶绿素的主要元素之一,因此植物磷素含量大小可直接反映出其叶绿素的含量.由图2可知,随着生长时间的延长,处理T1和T3组的叶绿素含量整体均有显著提高,而CK组的叶绿素含量则反而降低,T2组叶绿素含量的变化则不明显.香蕉植株生长到第40d时,CK组的叶绿素含量为0.57mg·g-1,T处理组的叶绿素含量分别是CK组叶绿素含量的2.81、2.19和4.19倍.加入M-3-01解磷菌液的处理T1、T3组,其叶绿素含量比无菌液处理组T2的叶绿素含量要高,这表明在低磷环境下M-3-01解磷菌有利于提高香蕉叶片的叶绿素含量.
2.1.3 M-3-01解磷菌对香蕉叶片可溶性糖含量的影响磷在植物体内有着重要的生理作用, 它可参与碳水化合物的代谢作用,因此,磷含量越高,香蕉叶片的可溶性糖含量也会上升.
如图3所示,随着栽培时间的延长,在10d内,各处理香蕉叶片的可溶性糖含量增长较快.T1、T2、T3处理组香蕉叶片的可溶性糖含量显著高于CK组香蕉叶片的可溶性糖含量,T3处理的可溶性糖含量最高,达33.3mg·g-1;香蕉幼苗在栽培10d以后,T2、T3处理组的可溶性糖含量开始明显下降,T1、CK组的可溶性糖含量却持续增长,并且T1处理组的增长量明显高于CK组的增长量;在第20d时,T2的可溶性糖含量开始比CK的可溶性糖含量低,而T3组仍还高于CK对照组.在对T处理组的数据变化做比较时发现,磷矿粉不利于香蕉叶片可溶性糖的积累,而施用M-3-01解磷菌剂后,其能持续有效地促使土壤释放出可溶性磷素,从而满足了香蕉的生长,因此解磷菌剂对于香蕉生成可溶性糖具有促进作用.
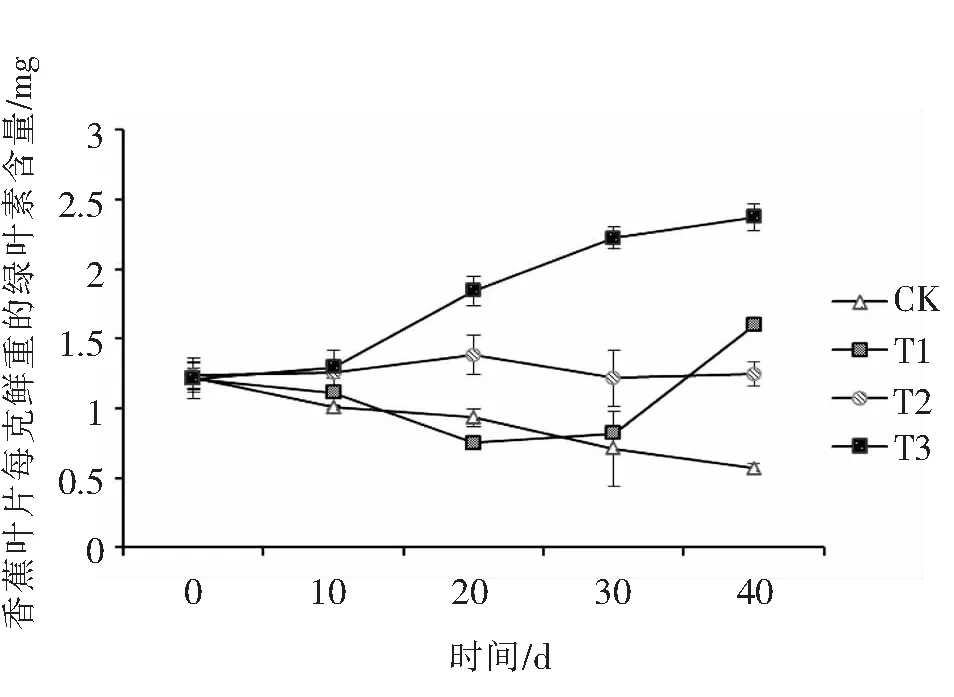
图2 M-3-01 对香蕉叶片叶绿素含量的影响

图3 M-3-01 对香蕉叶片可溶性糖含量的影响
2.1.4 M-3-01解磷菌对香蕉叶片可溶性蛋白含量的影响作为植物体内的一种重要的渗透调节物质,蛋白质是植物体重要的结构物质和功能物质.植物体内积累一定量的可溶性蛋白,这有助于植物细胞维持渗透势,增强其抵抗逆境胁迫的能力.由图4显示,香蕉栽培一段时间后,各处理香蕉叶片的可溶性蛋白含量开始大量积累.接菌第10 天之后,加入M-3-01解磷菌的T1和T3处理的香蕉叶片的可溶性蛋白含量增长比较快,处理T1增长最大,可溶性蛋白含量达3.13μg·g-1,均显著高于处理CK.接菌第30 天时,各处理的可溶性蛋白含量相差甚微.随后,CK和T2处理的可溶性蛋白含量的增长速度开始放缓,而T1和T3处理却维持较快的增长速度,显著高于其他处理.

图4 M-3-01 对香蕉叶片可溶性蛋白含量的影响

图5 M-3-01 对香蕉叶片MDA 含量的影响
2.1.5 M-3-01解磷菌对香蕉叶片MDA含量的影响丙二醛(MDA)是质膜过氧化最终分解的产物,其含量的高低能够反映出植物遭受伤害的程度[3,6].如图5所示,在不同处理的环境下,香蕉叶片中的MDA含量随着培养时间的推移呈现出缓慢增长的趋势.在第10 天,未加入M-3-01解磷菌的CK和T2处理,其香蕉叶片的MDA含量均低于处理T1和T3的MDA含量差异显著.随着培养时间的延长,CK和T2处理的香蕉叶片的MDA含量开始迅速增长,而T1和T3处理的MDA含量却维持在较低水平;于30d后,在CK处理的植物体内MDA的含量出现了跃升,丙二醛含量高达1.21μmol·L-1,显著高于其他处理组,T2的MDA含量也略高于接M-3-01解磷菌的处理组.由此说明,未接M-3-01解磷菌的CK和T2处理组在前期其质膜过氧化程度较低,但于培养后期,其质膜过氧化程度急剧加剧;而接M-3-01解磷菌的处理组却能够缓解香蕉叶片的质膜过氧化程度,而且还能有效缓解植物体内MDA含量升高的速率及幅度,表现出了较好的抗逆效果.
2.1.6 M-3-01解磷菌对香蕉叶片相对电导率的影响植物细胞质膜对维持细胞的微环境和正常的代谢起着重要作用.在正常的情况下,细胞质膜对物质具有选择透过能力,当植物受到环境因子胁迫时,往往会造成细胞质膜的透性增大,致使植物细胞内可渗透物质外渗,从而引起组织浸泡液的电导率增大.因此,根据叶片泡液的相对电导率可以判断出质膜受损的程度.由图6可知,在移栽10d内,各处理香蕉幼苗叶片的相对电导率没有显著变化,并且CK、T2、T3处理的叶片相对电导率值略微下降,且处于一个较低水平;栽培时间在10 ~20d之间时,CK组的相对电导率仍维持下降趋势,T1、T2、T3处理的相对电导率始终比CK的要高,而且接菌处理的T3的相对电导率一直处于较低水平;第30 天后,CK组的相对电导率出现了急剧升高,相对电导率值为55.79%,显著高于其他处理,未接M-3-01解磷菌的T2也略高于接菌处理组T1和T3.由此可以说明,各处理的香蕉幼苗在栽培一段时间后,其相对电导率仍维持低水平增长,处理T1始终处于最高,但是,随着栽培时间的推移,幼苗栽培土壤的环境发生了变化,对香蕉叶片的细胞质膜产生了损害,尤其是对CK处理组,这是由于植物根际土壤理化因子的较大变化导致了香蕉幼苗叶片相对电导率的急剧升高的缘故,但是,其他处理组却能缓解叶片受损的程度,并显著降低其相对电导率,其中T1处理的效果最好.

图6 M-3-01 对香蕉叶片相对电导率的影响

图7 香蕉根际土壤pH
2.2M-3-01解磷菌对土壤理化因子的影响
2.2.1 解磷菌对土壤 pH 的影响图7为不同处理对植物根际土壤pH值的影响.香蕉幼苗移栽后, 各处理土壤的pH值平稳升高,维持在中性范围.解磷菌的解磷机制主要是分泌有机酸、释放H+离子,并将土壤中难溶磷的磷酸根置换出来,从而改变土壤的pH.由图7可以看出,加入M-3-01解磷菌后,香蕉根际土壤的pH值较对照组和未加菌的T2处理的土壤pH值均有所提高,但升幅较低,更趋向于中性,这表明M-3-01解磷菌的解磷机制与释放有机酸有关.
2.2.2 解磷菌对土壤有效磷的影响解磷菌能将土壤中的难溶性磷素分解出来,以供给植物生长的需要.图8显示的是香蕉根际土壤中有效磷含量在不同处理组的变化情况.从图8可以看出,香蕉幼苗移栽7d后,T处理组植株根际土壤的有效磷含量与CK比较有明显提高,加入M-3-01解磷菌的T1和T3处理尤为显著.T1和T3处理的根际土壤平均有效磷含量分别是CK处理的3.18和3.15倍,CK处理与各接菌处理间的差异达到显著水平.杨慧等[7]在进行土壤培养实验时接种了菌株P21,与CK相比,其土壤中有效磷的含量达22mg·kg-1.随着栽培时间的延长,植物吸收和利用了土壤养分,从而使土壤中的养分逐渐消耗,致使各处理组土壤有效磷的含量均有所降低,但接M-3-01解磷菌的处理,其土壤有效磷含量始终高于不接菌的处理,且保持高位水平.这表明M-3-01解磷菌对土壤中难溶磷的活化能力较强,其能提高根际土壤周围的磷浓度.
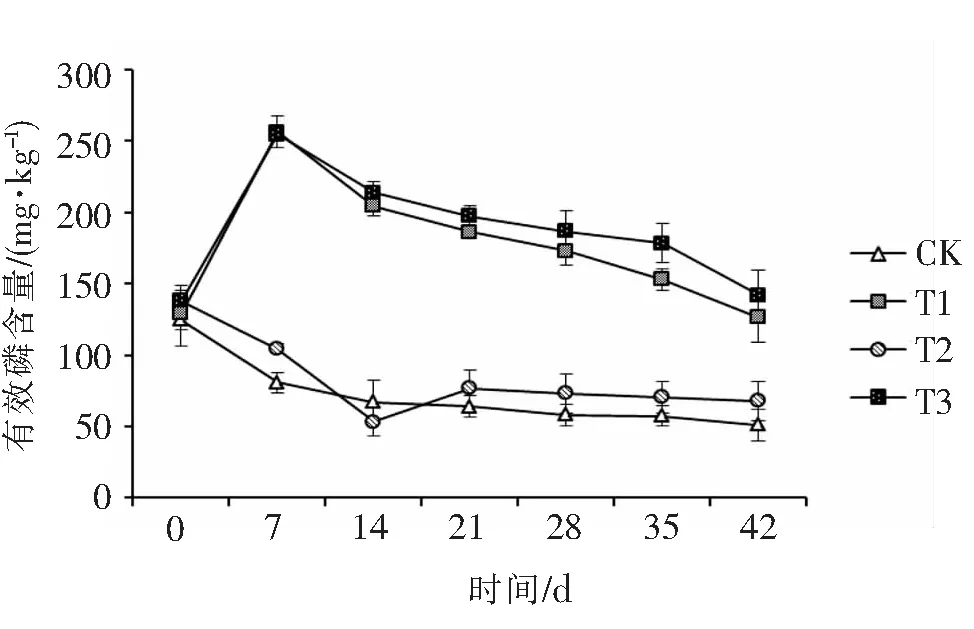
图8 香蕉根际土壤的有效磷含量
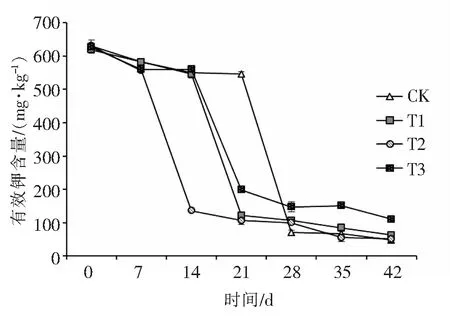
图9 香蕉根际土壤的有效钾含量
2.2.3 解磷菌对土壤有效钾的影响图9中显示的是不同处理对香蕉根际土壤中有效钾含量的影响.由图9可以看出,随着栽培时间的延长,各处理根际土壤有效钾的含量普遍下降,各处理组与CK处理组相比较,其有效钾含量下降较早, 这是因为接M-3-01解磷菌后,虽然增强了土壤的供磷能力,但同时也提高了其生物有效性,促进了植物对土壤中有效钾元素的吸收和利用效率.第21天后,接M-3-01解磷菌的T1和T3处理组的土壤有效钾含量均比未加菌株处理组的有效钾含量要高,这可能是由于M-3-01解磷菌具有活化土壤中无效钾的能力, 在植物根系接种解磷菌剂之后,其在溶解土壤难溶性磷的同时,还可以溶解土壤中难溶性钾的缘故.
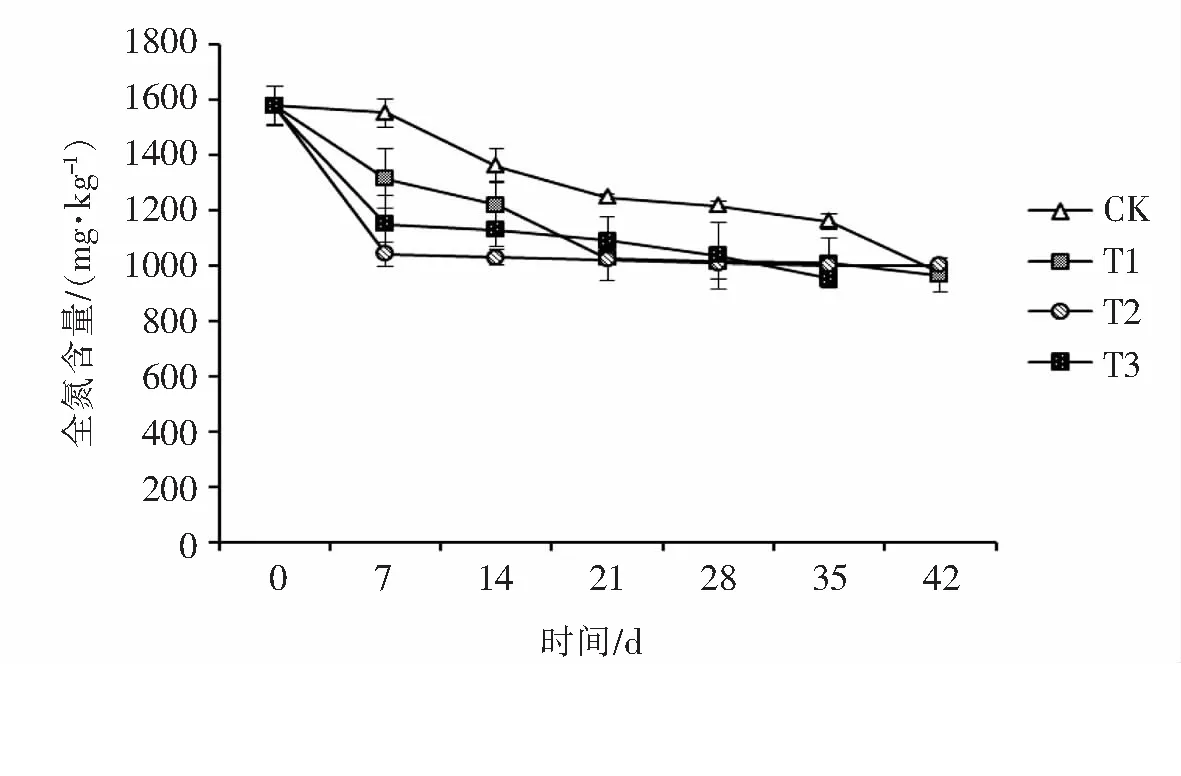
图10 香蕉根际土壤的全氮含量
2.2.4 解磷菌对土壤全氮的影响氮素是植物体内的蛋白质、核酸、叶绿素以及部分关键有机分子的基本组成元素,植物体需要氮素来维持生长,因此提高氮素的利用率,可以在短期之内提高生物量,图10所示的是不同处理对香蕉根际土壤中全氮的影响,在此生长期内土壤的全氮含量呈现不同程度的下降趋势.由图10可以看出,T处理组比CK组的土壤全氮含量低,差异显著.这说明T处理组的香蕉植株对土壤氮的吸收量明显比CK组的要高.T2处理组的全氮含量下降最快,这主要是由于化学磷肥促进了植物的吸收和利用,从而也促进了植物对有效氮素的利用.但在整个栽培过程中,接M-3-01解磷菌的植株对氮素的吸收能力仅比未接菌的植株对菌素的吸收能力略强.
3 结论与讨论
磷素对植物生长及生理生化特性具有很大影响.Dey等[8]发现,解磷菌能够促进花生生长、提高花生产量;Selvaraj等[9]发现,接种解磷菌可增加白菜的根长和生物量;闫小妹[10]、徐文思[11]、Yu[12]等施用解磷菌于花生植株,不仅增加了其株高、干重和鲜重,同时也显著提高了花生植物对N、P、K的吸收.本实验在对T处理组与CK组进行比较时发现,香蕉苗在株高、鲜重、茎围以及叶绿素、可溶性蛋白、可溶性糖的含量等方面均有增长,是否可提高植株对N、P、K的吸收,这尚有待研究.MDA活性和相对电导率均比CK组的低,这表明解磷菌株M-3-01的施加缓解了香蕉植株的低磷胁迫效应.此外,可溶性蛋白和叶绿素含量及效果均显著高于其他几个处理,这与余旋[13]和郝晶[14]的研究结果一致.
在解磷菌株M-3-01对香蕉苗土壤理化性质的影响方面,本研究发现,同CK组相比,T处理组的香蕉苗根际土壤的速效磷含量明显增加,T1和T3处理组的根际土壤有效磷含量分别是CK处理组的 3.18和3.15倍,而有效钾和全氮含量则显著减少.史发超[15]在以磷矿粉为磷源的条件下,接种了P38菌株于处理,其土壤有效磷含量与CK组的土壤有效磷含量达到了显著性差异水平.方华舟[16]等发现,用复合菌剂处理稻田土壤后其有效磷量可增加 32.94%;同样,毕银丽[17]等在研究微生物对大豆生长及其根际土壤影响时也得出一致的验证,即接菌根际的土壤其有效磷含量普遍较高,土壤氮、钾含量的下降相对较快.根据生物量促生效果作出一推测:解磷微生物对植物的促生作用不仅是增加植物根际的有效磷含量,而且它会释放出生长素(IAA)、细胞分裂素(CK)等物质来促进植物生长[18].T1和T3组的土壤pH值与CK组的土壤pH值相比,升幅较低,更趋向于中性[19],这是由于M-3-01解磷菌能够产生有机酸而导致土壤pH值下降,从而有利于难溶性磷溶解的缘故,前人的研究也证明了解磷菌对植物有很好的促生作用[20-21].本研究为解磷菌在生产上的应用提供了一些理论性支持.
[1] 葛诚. 微生物肥料生产及其产业化[M]. 北京: 化学工业出版社,2007.
[2] 李俊, 姜昕, 李力, 等. 微生物肥料的发展与土壤生物肥力的维持[J]. 中国土壤与肥料, 2006,43(4):1-5.
[3] 赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[M]. 植物生理学通讯,1991, 30(3): 207-210.
[4] 白宝璋, 史安国, 赵景阳, 等. 植物生理学[M]. 北京:中国农业科技出版社, 2001.
[5] 王学奎. 植物生理生化实验原理和技术[M].第2版.北京:高等教育出版社, 2006.
[6] 王爱国, 邵从本, 罗广华.内一醛作为植物脂质过氧化标准的探讨[J].植物生理学通讯, 1986,36(2):55-57.
[7] 杨慧. 溶磷高效菌株筛选鉴定及其溶磷作用研究[D].北京:中国农业科学院,2007.
[8]DeyR,PalKK,BhattDM,etal.Growthpromotionandyieldenhancementofpeanut(Arachis hypogaeaL.)byapplicationofplantgrowthpromotingrhizobacteria[J].MicrobilogicalResearch,2004, 159(10):371-394.
[9]SelvarajP,MadhaiyanM,SaT.IsolationandidentificationofphosphatesolubilizingbacteriafromChinesecabbageandtheireffectongrowthandphosphorusutilizationofplants[J].MicrobiolBiotechnol, 2008,18(3):773-777.
[10] 闫小梅,虞 丽,叶成龙,等.一株灰潮土解磷菌的解磷特性及其对花生的促生作用[J].中国农学通报,2015,31(26):150-155.
[11] 徐文思,姜瑛,李引,等.一株植物促生菌的筛选、鉴定及其对花生的促生效应研究[J].土壤,2014,46(1):119-125.
[12]YuX,LiuX,ZhuTH,etal.Isolationandcharacterizationofphosphatesolubilizingbacteriafromwalnutandtheireffectongrowthandphosphorusmobilization[J].BiologyFertilityandSoils, 2011,47:437-446.
[13] 余旋. 四川核桃主产区根际解磷细菌研究[D]. 雅安:四川农业大学, 2011.
[14] 郝晶,洪坚平,刘冰,等.不同解磷菌群对豌豆生长和产量影响的研究[J].作物杂志,2006,27(1):73-76.
[15] 史发超,一株溶磷真菌筛选鉴定及其溶磷促生效果[J].微生物学报,2014,54(11):1 333-1 342.
[16] 方华舟,左雪枝.稻田固氮解磷解钾菌筛选及其复合菌剂对土壤培肥作用[J].中国土壤与肥料,2014,51(2):82-87.
[17] 毕银丽,陈书琳,孔维平,等.接种微生物对大豆生长及其根际土壤的影响[J].生态科学,2014,33(1): 121-126.
[18]KuceyRMN.Phosphate-solubilizingbacteriaandfungiinvariouscultivatedandvirginalbertasoils[J].CanadianJournalofSoilScience,1983,63(5):671-678.
[19] 毕银丽, 于淼, 曹楠,等. 解磷细菌对难溶磷肥的解磷效率比较[J].科学导报, 2011, 29(19):19-23.
[20] 毕银丽, 陈书琳, 孔维平, 等. 接种微生物对大豆生长及其根际土壤的影响[J]. 生态科学, 2014, 33(1):121-126.
[21] 史发超, 殷中伟, 江红梅,等. 一株溶磷真菌筛选鉴定及其溶磷促生效果[J]. 微生物学报,2014,54(11): 1 333-1 343.
Abstract:In the report, M-3-01(Serratianematodiphila)was used to prepare biological fertilizer, and its effects on the growth of the young banana trees were determined by analyzing the impacts of M-3-01 on the number of young trees, the bio-standards, and the soil. The results indicated that the M-3-01(S.nematodiphila)bioprepate has an obvious effects on the promotion of banana seedlings. The growth speed was as follows:Treatment 3>Treatment 1>Treatment 2>CK, and the level of membrane lipid peroxidation and the content of membrane permeability substances of the third experiment group were significantly higher than that of the other several groups. Among the physical and chemical factors of rhizosphere soil of banana plant, the content of available phosphorus of the experiment gruops were higher than that of CK. Available phosphorus content of the first experiment group and the third experiment group was 3.18 and 3.15 times as high as that of CK, respectively, however, the content of available K and total nitrogen of the first experiment group and the third experiment group was lower than that of CK. Our findings suggested that M-3-01(S.nematodiphila)can promote the growth of seedlings, and which provide a theoretical support for the use of (S.nematodiphila.)
Keywords:phosphorus-dissolving bacteria; potting; growth promoting effect
EffectsofPhosphate-SolubilizingBacteriaontheGrowthofBananaSeedlingsandPhysicalandChemicalFactors
Ke Chunliang1, Li Shujuan2, Duan Yajie3
(1. Guangdong University of Petrochemical Technology, Maoming 525000, China;2. Maoming NO:17 Middle School, Maoming 525000, China;3. South Subtropical Crops Research Institute, Chinese Academy of Tropical Agricultural Sciences, Zhanjiang 524091, China)
Q5
A DOl:10.15886/j.cnki.hdxbzkb.2017.0040
2017-03-17
海南省自然科学基金项目(20163110);中央级公益性科研院所基本科研业务费(1630062015010)
柯春亮(1988-),男,广东茂名人,助教,硕士,研究方向:植物生物防控,E-mail:kecliang@163.com
1004-1729(2017)03-0253-07
