锂硫电池复合硫正极中客体材料与多硫化物的相互作用
2017-10-14唐晓楠孙振华杨慧聪禚淑萍
唐晓楠,孙振华,陈 克,杨慧聪,禚淑萍,李 峰
锂硫电池复合硫正极中客体材料与多硫化物的相互作用
唐晓楠1,2,孙振华1,陈 克1,杨慧聪1,禚淑萍2,李 峰1
(1中国科学院金属研究所,辽宁沈阳 110016;2山东理工大学化学工程学院,山东淄博 255091)
随着人类社会对高效电化学储能器件需求的不断增加,具有高理论能量密度和低成本的锂硫电池成为下一代最具潜力的锂二次电池之一。然而,锂硫电池的实际应用仍然存在很多问题,如循环寿命短、库仑效率差、自放电等。产生这些问题的主要原因是发生在电池放电过程中的多硫穿梭效应。为了解决这些问题,国内外学者进行了大量研究,特别是在利用复合正极材料中客体碳基材料的结构设计及电极材料的功能修饰来改善电化学性能方面,取得了很大进展。本文回顾了近年来应用于锂硫电池的各种纳米结构正极材料的基础研究及技术发展,包括其制备、结构、形貌及电池性能等。根据复合硫正极中客体材料与多硫化物的相互作用,将复合硫正极材料分为物理吸附材料和化学吸附材料两大类,深入分析了作用机理及性能提高的作用规律,并在此基础上,展望了锂硫电池正极材料将来可能的发展方向。
锂硫电池;物理吸附;化学吸附;复合硫正极
随着移动电子设备、电动汽车以及智能电网等领域的不断发展,电能存储系统在实现电力的供求平衡中扮演着越来越重要的角色。经过近二十年的优化后,锂离子电池的能量密度已经达到265 W·h/kg,是Sony公司在1991年商业化的锂离子电池的3倍多[1],然而其仍然不能满足市场需求。同时锂离子电池的成本高,约为400 $/kW·h,也是制约其发展的一个重要因素,根据美国先进电池联盟的建议,商业化的最低目标需要缩减为小于150 $/kW·h[2]。所以,高能量密度和低成本的电化学能量存储系统成为当前的研究热点。
在众多的电化学能源存储体系中,锂硫电池是目前最具发展潜力的电化学储能体系之一。与锂离子电池中Li+嵌入和脱出反应机理不同,锂硫电池的能量储存是基于硫正极的多步电化学反应(S8+16Li—→8Li2S)。基于锂(Li)与硫(S)完全反应生成硫化锂(Li2S),单质硫作为正极材料具有高的理论比容量(1675 mA·h/g)和高的理论能量密度(全放电,2600 W·h/kg或2800W·h/L),远高于当前商业化锂离子电池[3-5]。另外,硫来源广泛、价格低廉、环境友好,在自然界中分布较广(地壳质量含量为0.048%),使得锂硫电池的材料成本远低于锂离子电池[6]。
尽管锂硫电池具有较高的理论容量和能量密度,但是依然存在很多问题,如电池的容量衰减快、库仑效率低等,这些问题限制了其商业化的实现。产生这些问题的主要原因包括:①硫及放电产物硫化锂的电子和离子导电性差[7-8];②放电过程中硫正极高达80%的体积膨胀,会引起较大的内应力,造成正极粉化,导致电极材料与集流体接触不良[9];③在充放电过程中,产生的中间产物多硫化锂可溶于电解液,循环过程中多硫化物在硫正极与锂负极之间穿梭,在两极生成不溶的绝缘性沉淀硫化锂(Li2S2或Li2S)。在上述问题中,对于正极而言,最关键的是解决穿梭效应,因为多硫化物的溶解、扩散及沉淀生成会引起活性物质的损失,造成容量衰减、循环稳定性差等问题。为了解决穿梭效应,近年来研究人员进行了大量研究工作,获得了各种形式的硫复合正极材料,如硫-碳、硫-导电聚合物、硫-金属化合物以及多重复合材料等[10-15]。正极材料的电化学性能提高是通过材料的设计实现的:①设计合适的孔隙度,与硫产生强的物理相互作用,适应在充放电过程中硫的体积变化及吸附多硫化物;②选择合适的添加剂或表面功能化,如表面具有一定的官能团,吸附多硫化物来抑制穿梭效应。如图1所示,将硫封装在多孔碳基体[图1(a)][16],防止中间产物多硫化物从正极溶解到电解液,称为物理吸附;通过碳材料表面极性基团(共价键)、金属氧化物来吸附多硫化物,使得多硫化物滞留在正极区域[图1(b)][17],称为化学吸附。本文综述了近年来国内外复合硫正极材料的研究进展,分别从物理吸附及化学吸附两个方面,简述了这两类材料特点,并探讨了吸附过程对电化学性能的影响。
(a)
(b)
图1 吸附过程示意图(a)物理吸附[16];(b)化学吸附[17]
Fig.1 Schematic representation of physical(a)and chemical[16];(b)adsorption on sulfur host materials[17]
1 硫复合正极
硫导电性差及多硫化物的穿梭效应一直是阻碍锂硫电池发展的主要问题,碳材料一直在其中发挥着非常重要的作用。十多年前,导电的碳材料就被添加到硫正极中形成硫-碳复合材料,以增强导电性和提高活性物质硫的利用率,如WANG等[18]提出硫与多孔活性碳形成复合材料,活性碳增加正极导电性并起到存储活性物质的作用,使复合硫正极表现出更好的循环性能。随后JI等[7]以硫-介孔碳复合物作为正极材料,通过将活性物质硫限制在有序的介孔内,抑制多硫化物的自由迁移,使物理吸附方法抑制多硫化物穿梭成为研究热点,物理吸附多硫的各种多孔碳基电极材料得到迅速发展。另外,考虑到非极性的碳材料与多硫化物作用较弱,近年来利用功能化的碳材料化学吸附可溶性多硫化物得到广泛关注[19]并取得了很好的效果。
1.1 物理吸附
对于物理吸附的研究主要集中在提高吸附材料的比表面积、调控孔及材料整体的结构来实现抑制多硫化物穿梭的目标。目前,在锂硫电池中使用的碳材料有很多,不同类型的碳材料与多硫化物的作用也不相同,因此本文将按照碳材料的形貌分别讨论结构与性能之间的关系。
1.1.1 硫-一维碳复合材料
一维碳材料主要有纳米线、纳米棒、纳米管等形式,利用其孔或空腔来限制硫或多硫化物。按照限制硫或多硫化物的方式,可将硫-一维碳材料复合物分为两类,一类是硫存储在管腔内,一类是硫存储于管壁的孔隙内。ZHENG等[20]采用表面覆盖碳膜的阳极氧化铝作为模板,合成中空碳纳米纤维阵列,将硫浸渍到碳纳米管的管腔内[图2(a)],减少了硫在碳纳米纤维外表面的沉积,电化学测试表明其具有高的初始容量,约为1400 mA·h/g,循环性能也有明显改善,经过150次充放电后容量约为730 mA·h/g。GUO等[21]将硫浸渍到无序碳纳米管中作为锂硫电池正极材料[图2(b)],从透射电镜照片中可看出,硫全部浸渍到碳纳米管管腔中,展示了较好的循环性能和高的库仑效率。硫储存在碳纳米管的管腔内,可减少硫与电解液的直接接触,从而避免多硫化物在电解液中的溶解和扩散,使得电化学性能得到了显著提高。MA等[22]利用氢氧化钾活化多壁纳米碳管[图2(c)],活化后多壁纳米碳管的比表面积大大提高,可实现碳管对硫的毛细吸附作用。化学活化多壁碳纳米管过程中产生的大量孔隙结构有利于Li+的传输、电解液的渗透以及多硫化物的吸附,因此复合材料表现出良好的循环稳定性和倍率性能。JI等[23]通过静电纺丝、碳化和化学反应沉积过程,将硫封装进多孔纳米碳纤维中[图2(d)],使纳米碳纤维和硫紧密接触。且硫可均匀分散,固定在高比表面积的碳纤维多孔结构中,能有效缓解多硫化物穿梭,从而表现出良好的电化学性能,在电流密度为83.75 mA/g时放电容量约1439 mA·h/g。将硫存储在碳纳米管的管壁孔隙内,一方面可使硫均匀分散在碳材料表面,另一方面通过硫和碳管之间的毛细作用,吸附硫及中间产物多硫化物,但由于碳纳米管等一维材料的孔容和比表面的限制,复合硫正极的硫含量一般较低。
1.1.2 硫-二维碳复合材料
石墨烯作为典型的二维碳材料,具有高导电性、高机械强度和良好的柔韧性等优点,大量研究结果表明,使用硫-石墨烯复合正极可提高锂硫电池的电化学性能,因此石墨烯在锂硫电池正极的应用中也备受关注[24-25]。同样,根据复合硫的方式可将复合正极材料分为两类(图3),一类是开放式结构,将硫存储在石墨烯的层间,另一类是封闭式结构,石墨烯将硫包裹在里面[26]。ZHAO等[27]以介孔层状双金属氢氧化物纳米片为模板,通过模板导向化学气相沉积方法制备了非堆叠双层石墨烯[图4(a)],其中石墨烯层沉积在介孔模板上,碳原子沉积在介孔中形成结团聚,这种团聚不仅能防止石墨烯堆叠且可增加石墨烯的比表面积,提高了硫和石墨烯之间的有效接触,材料中的介孔可以吸附多硫化物,抑制穿梭效应。该复合材料在电流密度1675 mA/g和8375 mA/g时的容量分别是1034 mA·h/g和734 mA·h/g,1000次循环后,分别为530 mA·h/g和380 mA·h/g。LI等[28]采用简单的电化学组装方法得到了垂直对齐的硫-石墨烯纳米墙复合物[图4(b)],有序的石墨烯阵列垂直地排列在基底上,在每层硫-石墨烯纳米墙中,硫纳米颗粒均匀锚定在石墨烯层间,这种独特的结构有利于Li+和电子的快速扩散。该复合材料具有较高的初始容量1261 mA·h/g,120次循环后仍然可达1210 mA·h/g。DUAN等[29]采用超声分散方法制得的超薄石墨片作为导电剂,在没有使用表面活性剂情况下,硫颗粒能够被超薄石墨片包覆起来,可有效改善硫颗粒和超薄石墨片之间的接触,降低了接触内阻和电子转移电阻[图4(c)]。因此,在电流密度1675 mA/g或更高的电流密度下,硫-超薄石墨片比硫-纳米炭黑表现出更好的性能。XU等[30]合成了具有核壳结构的石墨烯包覆硫复合材料[图4(d)],展示了优异的倍率性能、高的可逆比容量和良好的循环性能,这是因为该材料含有高导电的石墨烯、合适粒径的硫颗粒和能够促进电子传输及缓解多硫穿梭的核壳结构。
1.1.3 硫-多孔碳复合材料
多孔碳材料孔隙结构的多样性使得它在锂硫电池正极材料中应用广泛。通常根据孔径()的大小,可将多孔碳分为微孔碳(<2 nm)、介孔碳(2 nm<<50 nm)和大孔碳(>50 nm)。孔是通过碳化(微/中孔)、化学或物理活化(微孔)或使用软/硬模板(微/介/大孔)形成的[33]。多孔碳材料作为锂硫电池正极中复合硫的导电碳基体,不仅能够存储硫,而且可以通过不同的孔结构限制多硫化物的穿梭[34]。其中微孔[图5(a)]、介孔[图5(b)]及层次孔碳[图5(c)]在锂硫电池中的研究最为广泛[35]。
当碳基体的孔径大小在微孔尺寸,尤其是小于(或等于)0.5 nm时,硫的存在形态会发生改变,由常温常压下稳定存在的S8八元环转变为亚稳态的小分子硫S2-4,因此在反应过程中不生成多硫化物,避免了穿梭效应。XIN等[36]计算机模拟得到了S2-8分子的大小,如图6(a)所示,并根据计算结果把硫(S2-4)封装在微孔碳涂层碳纳米管(CNT@MPC)材料的微孔中,该材料的微孔为0.5 nm,这种复合结构的设计可避免充放电过程中S8到中间产物的形成,解决了多硫化合物溶解的问题。因此硫-微孔碳涂层碳纳米管(S/CNT@MPC)复合正极表现出了高的电化学性能(初始容量1670 mA·h/g,200次循环后保持在1149 mA·h/g,电流密度为8375 mA/g时,仍有800 mA·h/g)。LI等[37]分别将S2-4和S8/S2-4封装在高度有序的微孔碳中,通过比较S2-4与S2-4/S8电极的电化学性能,并结合理论计算,发现碳材料的微观结构对电化学性能起着至关重要的作用。
关于硫-介孔碳复合正极材料的早期工作由WANG等[18]提出,作者采用平均孔径大小为2.5 nm的活性炭作为负载硫的材料,硫与介孔碳在200 ℃加热6 h,使硫熔融扩散到介孔中,再提高温度至300 ℃保持3 h,蒸发碳材料表面多余的硫,获得了硫-介孔碳复合材料。由于硫在介孔中均匀分布和多孔结构对多硫化物的物理吸附,解决了活性物质利用率低及循环稳定性差等问题。JI等[7]将硫储存在介孔碳骨架中的孔道中,保证了硫与碳材料的有效接触,碳骨架不仅可以作为活性材料的电子导体,还可以作为电化学微反应室,因此可以确保更完整的氧化还原过程的发生,提高硫的利用率。
近年来,大量研究表明层次孔碳材料可以综合利用微孔及介孔的优势提高锂硫电池的性能。这是由于微孔具有更强物理吸附作用可限制多硫的溶解,介孔可加快离子传输、提高硫负载量。WANG等[38]将层次孔概念引入到硫碳正极中,利用熔融方法将硫填充到层次孔碳材料当中(CS-Ad),再用 CS2将介孔中的硫除去(CS-Ex),实现了多数硫填充到微孔结构中[图6(b)]。材料中微孔限域和介孔骨架对于获得良好电化学性能至关重要,微孔作为锂化过程的反应器,介孔提供离子传输通道,其协同作用实现了高循环性能。SCHUSTER等[39]合成了纳米级球形有序介孔碳(OMCs),具有6 nm和3.1 nm的双峰多孔结构、比表面积2445 m2/g及孔容2.32 cm3/g。与大多数多孔碳材料不同,随着正极硫含量的增加,这种硫-有序介孔碳球电极材料没有出现显著的容量衰减,而是表现出较高的可逆容量(1200 mA·h/g)和良好的循环稳定性,这主要归因于其大的比表面积及孔容使硫在该纳米结构中均匀分布。LIANG等[40]研究了硫-层次孔碳复合材料作为正极的电化学性能。作者通过软模板方法合成孔径为7.3 nm的介孔,并使用氢氧化钾进一步活化,在保持有序介孔的前提下,形成了大量<2 nm的微孔,将溶解在二硫化碳中的硫渗入微孔中,形成具有高表面积和大孔隙率的硫-层次结构碳复合材料[图6(c)],电化学测试结果表明,循环稳定性和硫利用率都显著提高。其归因于微孔与介孔的协同作用:微孔提供了高比表面积及吸附多硫化物使其在正极区域;介孔为Li+的传输提供了通道,从而提高了正极材料的离子电导率。
综上所述,在锂硫电池中使用层次孔碳材料作为硫的载体,一方面可以通过材料的微孔把多硫或硫化锂(Li2S2/Li2S)限制在正极区域,从而抑制穿梭效应,另一方面可以通过介孔加快离子传输,通过协同作用改善电极的性能。
然而对于多孔碳材料而言,虽然微孔有利于吸附,但是过多的微孔会降低孔容,从而降低载硫量,影响电池的能量密度,表1阐明了多孔碳材料孔容与载硫量的关系。因此通过合理的设计孔结构实现优异综合性能(高载硫量、高循环稳定性及倍率性能)的锂硫电池,是多孔碳材料应用在锂硫电池中的核心问题。
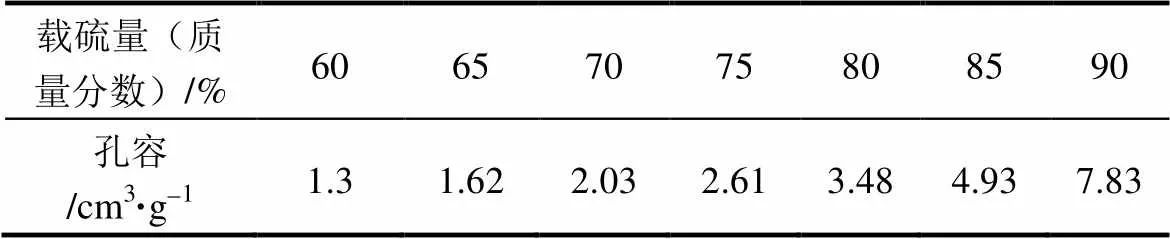
表1 多孔碳材料孔容与载硫量的关系
1.1.4 硫-三维碳复合材料
硫-三维碳复合材料是指多种碳材料杂化后复合硫的三维结构,或一体化电极的复合硫材料,通过三维结构或一体化设计可使硫和导电网络的接触更有效,并提高硫负载量。另外,硫-三维碳复合材料可使电解液更充分的浸润,有效防止多硫化物向负极扩散,抑制穿梭效应。CHEN等[41]通过两步过程制备了一种三明治型复合结构,首先制备了硫-多壁碳纳米管核壳结构,然后将其嵌入石墨烯层间[图7(a)]。多壁碳纳米管骨架提供了机械支撑,阻止石墨烯片堆叠并提高硫正极结构稳定性,同时三明治夹层结构作为开放通道又能促进电解液的浸润。该复合正极材料,在电流密度为335 mA/g时,表现出高的初始容量(1396 mA·h/g),并改善了循环稳定性和库仑效率。PU等[42]采用碳纳米管海绵作为存储多硫的“超级水库”[图7(b)],利用碳纳米管的柔韧性及高比表面积,可吸附高于本身数百倍重量的有机溶剂,从而表现出高的倍率性能,电流密度为8375 mA/g时,仍然有80%的容量保持率。ZHOU等[43]设计了纯硫夹在两层石墨烯薄膜中间的三明治结构,一层石墨烯薄膜被用作集流体,利用粗糙的表面和高导电性可吸附硫和降低电池的极化;另外一层石墨烯薄膜涂在隔膜上可成为抑制多硫穿梭的屏障,并通过电荷转移绑定和转化多硫。FANG等[44]采用空心碳纤维泡沫作为三维集流体,在空心碳纤维泡沫形成的导电骨架内填充大量的硫、多壁碳纳米管和炭黑,从而获得超高硫负载量的正极材料[图7(c)]。在电极材料中,硫粒子均匀分散在导电网络中,保证了有效的电子传递,同时该材料具有很强的吸液性,可使得多硫离子被有效限制在正极区域,从而抑制穿梭效应。
基于上述分析,总结物理吸附特点如表2所示。提高锂硫电池正极材料的物理吸附作用,需要考虑以下关键因素:首先,孔结构的调节,碳材料表面孔隙或空腔都可物理吸附多硫,同时还需要考虑孔径分布、比表面积及孔容;其次,不同的碳材料各有优势,二元或多元碳材料结合能够获得性能更高的正极材料。

表2 不同结构的碳材料的物理吸附特点的比较
1.2 化学吸附
虽然大量研究表明设计最优孔隙度和高比表面积的碳基体材料可有效吸附多硫,但是物理吸附的作用力较弱,只是减缓了多硫化物扩散至电解液中,不能保证多硫化物与碳基体的长期稳固结合。经过多次充放电后,极性的多硫化物易从非极性的碳材料的表面和孔隙中脱出。因此,改善碳纳米材料表面的功能性,增加复合硫正极材料中碳基体与多硫化物的化学作用,对于有效限制多硫化物的穿梭效应更加重要。近年来,研究人员利用官能团或添加的吸附剂来吸附多硫,可改善循环性能和库仑效 率[45-47]。这类材料具有表面极性,对极性的多硫化锂有很强的亲和力[48],可实现对多硫化物的化学吸附,这类材料主要包括表面功能化碳材料或金属基化合物负载碳材料等[49-50]。
1.2.1 硫-表面功能化碳复合材料
通过在电中性的碳表面上引入具有正或负电荷位点,多硫化物可与碳表面形成化学键。其中掺杂不同电负性的杂原子,如O、B、N、S等,或在碳材料表面引入官能团[51-53],都可以改变碳材料的表面状态,来改善复合材料的电化学性能,如氧化石墨烯及碳化的导电聚合物等都是很好的掺杂碳 基体。
氧化石墨烯具有独特层状结构与大比表面积,并且表面含有大量环氧、羟基和羰基等官能团,是锂硫电池中常用的表面功能化的碳材料。硫-氧化石墨烯复合材料制备方法简单,且表现出强吸附能力,可有效缓解循环过程中多硫化物的穿梭问题。如ZU等[54]发现羟基化的石墨烯表面含有均匀分布的羟基,可有效吸附多硫化物,具有更好的循环稳定性和倍率性能。FEI等[17]采用H2S还原氧化石墨烯,通过氧化还原反应形成化学结合(C—S键),获得的硫-石墨烯材料具有高的电子导电率,表现出了优异的电化学性能,电流密度为335mA/g时,初始容量达1200 mA·h/g,在837.5 mA/g电流密度下,70次循环后容量仍有700 mA·h/g。XU等[55]采用球磨法获得了含氧官能团石墨烯与硫复合的正极材料,在电流密度为167.5 mA/g时,首次可逆容量达1265.3 mA·h/g,在电流密度为3350 mA/g时,500次循环后容量高达966.1 mA·h/g。
氮掺杂材料也常被用在锂硫电池的正极材料中,特别是含氮导电聚合物碳化后含有大量的含氮官能团,有利于吸附多硫化物。常用的导电聚合物有聚苯胺、聚噻吩、聚吡咯、聚丙烯腈等[56-59]。YIN等[58]通过原位聚合获得了硫-聚丙烯腈/石墨烯复合材料,通过扫描和透射电镜观察到聚丙烯腈颗粒< 100 nm并且均匀分散在石墨烯片层上,这种独特的结构有利于吸附多硫,电化学性能测试结果表明,石墨烯含量为4%(质量分数)的硫-聚丙烯腈/石墨烯复合材料初始容量高达1500 mA·h/g。XIAO等[60]合成了自组装聚苯胺纳米管,并在280 ℃与硫单质复合,部分硫与聚合物反应生成三维、交联、结构稳定的硫-聚苯胺聚合物骨架,该聚合物骨架上的胺基可吸附单质硫和多硫化物,从而减少活性物质的损失[图8(a)],表现出优异的循环稳定性和倍率性能。ZHOU等[61]制备了石墨烯包覆聚多巴胺双层中空碳球,能够形成电荷快速转移的反应位点,更好地化学吸附多硫化物[图8(b)],当电流密度为335 mA/g时,初始放电容量高达1360 mA·h/g,当电流密度为3350 mA/g时,依然有600 mA·h/g放电容量,200次循环后,库仑效率接近100%。
另外,将氨气或含氮化合物引入到材料的碳化过程中,也可以获得氮掺杂的碳材料[62-64]。LI等[65]利用氨气还原氧化石墨烯,获得的氮掺杂石墨烯对多硫化锂具有很强的约束力,可提高电化学稳定性和加快电化学反应动力学过程。
与氮掺杂类似,硼掺杂也可提高碳材料导电性,能够实现对多硫化物的化学吸附。YANG等[66]制备了硼掺杂多孔碳材料,其导电性高于未掺杂的多孔碳,通过XPS证明硼掺杂导致碳基体材料表面形成了C—B极性键,硼原子周围积聚了正电荷,能够吸附硫及多硫化物。与未掺杂的多孔碳正极相比,硼掺杂多孔碳/硫作为正极,显示了更高的初始容量(1300 mA·h/g、418 mA/g)以及更好的循环稳定性和倍率性能。另外,两种或多种元素共掺杂也可起到良好吸附作用,协同改善电化学性能[67-69],如ZHOU等[70]采用氮硫共掺杂石墨烯,不仅提高了材料的导电性,同时增强对多硫的吸附作用,表现出良好的循环稳定性,500次循环容量衰减率为0.078%。
在碳材料表面掺杂O、N、S等电负性原子,其作用机理是在碳材料表面引入带负电的位点,可吸附Li2S中Li+,进而吸附离子。以氮掺杂为例,QIU等[71]制备了氮掺杂石墨烯,通过计算结合能发现,氮掺杂石墨烯与Li2S间的结合能要高于纯石墨烯与Li2S的结合能,这是由于氮和Li+之间存在强离子相互作用[图9(a)]。另外,氮原子的孤对电子与多硫形成SLi…N键后,Li—S键长度仅从2.4×10-10略增加到2.6×10-10,表明多硫化锂作为整个分子被吸附。SONG等[72]制备了碳管贯穿在氮掺杂介孔碳球中的复合材料,其中氮官能团可有效捕获多硫化物,从而大大改善了电化学性能(循环200次后,仍然保持1200 mA·h/g)。为了更好地理解Li2S在氮掺杂的碳材料上的吸附机制,采用密度泛函计算Li+吸附在无氮和氮掺杂碳材料模型,如图9(b)所示,结果发现氮掺杂碳材料吸附Li+的键能比无掺杂的碳材料大得多,因此表面氮掺杂可提高Li+的吸附。YIN等[73]通过密度泛函计算系统考察了不同氮掺杂石墨烯与多硫离子间的相互作用,发现相比于其它掺杂形式,吡啶氮掺杂引起石墨烯表面的局域极化最强,其周围的正电荷环境最弱;同时还发现,孤立的氮掺杂与多硫离子间的作用类似于点电荷与点电荷之间的作用,而当多个吡啶氮以团簇化形式出现时,其与多硫离子间的作用则类似于单个点电荷与多个点电荷或者电偶极矩与电偶极矩间的作用,所引起的作用强度(≥1.2 eV)显著高于电解液分子与多硫离子间的作用强度(约0.9 eV)。HOU等[74]通过第一原理计算,推断氮掺杂石墨烯带对多硫化物具有更强的相互作用,指出吸附过程中,电子迁移可用路易斯酸碱理论来解释。吡啶氮有额外的一对电子被认为是一个电子供体,作为路易斯碱位点,与(多)硫化物中的锂原子路易斯酸中心有强的交互作用[图9(c)]。
虽然通过掺杂实现了碳材料对多硫化物的化学吸附,大大提高了碳材料对穿梭效应的抑制作用,显著提高了电化学性能,但是表面功能化碳材料的稳定性不佳,从而限制了对多硫化物的吸附效果,影响了电极材料的长循环性能。此外,由于掺杂方法的限制,很难在实验上控制掺杂的种类和数量。
1.2.2 金属基化合物复合碳材料
除了功能化的碳基体可以化学吸附多硫化物外,研究人员还发现金属氧化物,如TiO2[75-77]、Al2O3[78]、Nb2O5[79]及V2O5[80]等,也可有效吸附多硫化物,来抑制穿梭效应。如YU等[81]制备了氮掺杂石墨烯复合硫的正极材料,然后采用原子层沉积的方法将TiO2沉积在该电极上,利用TiO2与多硫化物之间强的化学吸附作用显著抑制了穿梭效应,结果显示这种修饰电极表面的方法有利于电化学性能的提高,在电流密度为1675 mA/g时,初始放电容量为1069.5 mA·h/g,500次循环后,仍然保持在918.3 mA·h/g。LIANG等[82]制备了二氧化锰纳米片/硫复合材料,作者提出通过一个化学反应过程吸附多硫,即在二氧化锰纳米片表面形成硫代硫酸盐,其能够绑定高阶多硫化合物,并通过歧化反应将它们转换为硫化锂。硫含量75%时表现出优异的电化学性能1300 mA·h/g,2000次循环后的容量衰减率0.036%/次。PANG等[83]研究了极性、高比表面积的金属氧化物Ti4O7在复合硫正极中的应用。作者指出在传统的碳材料基体上硫还原成多硫,并溶解于电解液中,Ti4O7具有固有的金属导电性(2×103S/cm),表面的O—Ti—O能化学吸附多硫,抑制多硫化物穿梭[图10(a)]。如图10(b)所示,多硫链上的硫与Ti4O7表面具有强的化学键作用,Ti4O7的高导电属性还能够促进吸附在其表面的多硫化物的进一步转化。此外,其它金属化合物,如金属硫化物[84-85]、金属氮化物[86-87]、金属氢氧化物[88-89]及金属有机框架[90-94]等,也能化学吸附多硫化物,有效改善电化学性能。最近,基于金属氮化物的高导电性和强吸附性能,SUN等[87]采用一步水热法将氮化钒纳米带负载在三维石墨烯基体上,这种复合的正极结构既充分利用了石墨烯三维骨架和孔结构,又结合了高导电的极性氮化钒对多硫化物的化学吸附和转化促进作用,有效解决了由“穿梭效应”带来的容量衰减及库仑效率低等问题,从而获得了优异的电化学性能。
在碳材料中加入金属基化合物作为添加剂,其作用机理是利用金属路易斯酸中心来吸附多硫化物路易斯碱性中心。如ZHENG等[93]利用金属有机框架(Ni-MOF),Ni6(BTB)4(BP)3(BTB =苯-1,3,5-三苯酸和BP = 4,4′-联吡啶)的物理和化学作用来锚定多硫化物,提高锂硫电池性能。首先,复合正极材料中Ni-MOF交织形成的中孔(约2.8 nm)和微孔(约1.4 nm)产生协同效应,提供了理想的结构来限制多硫化物。另外,路易斯酸Ni(II)中心和多硫碱性中心之间的强相互作用,大大降低了可溶性多硫化物的迁移,而使Ni-MOF/S复合材料具有良好的循环性能。采用密度泛函理论计算金属有机框架和多硫化合物间的相互作用Li2S(2≤≤8),发现只有多硫化物终点硫与Ni-MOF结合[图10(c)],不同长度的多硫在Ni-MOF孔中都是稳定的,且随着多硫链的增长其之间的相互作用增强。
通过在碳材料中添加金属基化合物作为活性位点对多硫化物进行化学吸附,可以抑制穿梭效应,并显著提高了电化学性能。从发表过的工作中可以发现锂硫电池采用的吸附添加剂均为元素周期比较靠前且密度较低的金属元素及其化合物,因为如果其密度较大,会降低复合硫电极中活性物质硫的比例,从而导致电池的能量密度降低。另外,在化学吸附过程中起到吸附作用的仅仅是材料表面的活性位点,因此当掺杂物质的颗粒过大时会降低吸附 效果。
综上所述,锂硫电池复合硫正极中客体材料所起到的物理或者化学吸附作用都可有效提高电化学性能,表3是文中提到的典型的物理吸附、化学吸附材料在可逆容量、倍率、循环性等方面的总结。

表3 文中提到的典型的锂硫电池数据
2 硫复合正极常用表征技术
锂硫电池的早期研究集中在将硫和多孔碳复合成正极材料,很少有人研究其基本电化学原理及其动力学过程。近几年来,各种先进表征技术使得对锂硫电池体系的理解更为深刻,尤其是现场原位技术,如 X射线衍射(XRD)、拉曼光谱、傅里叶变换红外光谱(FTIR)、核磁共振(NMR)、紫外-可见光谱(UV-vis)、X射线光电子能谱(XPS)、透射电子显微镜(TEM)和高效液相色谱(HPLC)等,其分析结果可用于指导电池设计从而提高电化学性能。众所周知,锂硫电池中起到物理吸附作用的客体材料主要通过碳材料孔隙与硫复合。为了得到更直观的结构表征,典型的表征手段有3D X射线显微技术(XRM)[44]及扫描、透射电子显微镜的元素分布图等。另一方面,尽管利用功能化的碳材料与硫化学成键获得了良好的电化学性能,然而,这些吸附现象的基本理解,如如何以及为什么这些官能团能与硫相互作用仍缺乏更深刻的解释,尤其是在分子的水平。研究化学吸附机理除了常用密度泛函理论进行模拟计算,还需要很多表征技术如常用到的FTIR 及XPS等,来说明起到吸附作用的化学键。另外,X射线近边吸收光谱(XANES)常用作研究化学吸附的机理,因其对特定元素附近的局部配位结构非常敏感[95]。尽管现在锂硫电池的表征技术已得到很大发展,但是对于锂硫电池的机理研究还需要更进一步的理解。
3 结语及展望
综上所述,多硫化物的穿梭效应,可采用物理或化学吸附来抑制。对于物理吸附,可将多硫限制在碳材料的多孔结构中,大比表面积、大孔容及小孔径有利于多硫化物的吸附,但物理吸附只能缓解穿梭效应并不能完全抑制。化学吸附,如掺杂碳材料或金属基化合物复合碳材料等,可与多硫化物成键,而表现出了良好的吸附作用,其中含有额外电子的路易斯碱中心(如氮掺杂)更容易与多硫终端的Li+形成强烈的相互作用,而含有金属离子路易斯酸中心,更容易吸附多硫碱性中心。引入化学键可有效吸附多硫化物,但由于这些具有化学吸附能力的添加剂的密度一般较大,或者合成的粒子较大,导致电池的能量密度降低,或降低吸附效果使得抑制穿梭效应结果不明显。
为了更好的解决穿梭效应的问题,复合硫正极材料需结合物理吸附及化学吸附作用。首先,碳材料的导电性及物理储硫功能在锂硫电池的应用中都是不可或缺的。可调的孔结构对多硫的物理吸附作用,已被证实可有效地抑制穿梭效应。为了更好利用物理吸附作用,需进一步探索不同孔径分布及整个正极材料的结构设计,从而提高物理吸附作用。另一方面,充分利用化学吸附来更好抑制穿梭效应,锂硫电池中吸附多硫的吸附剂的选择应该从以下几方面考虑:吸附能力强、吸附材料密度小以及复合材料合成过程中掺杂的吸附剂的颗粒尺寸小,从而获得更高性能的锂硫电池。
[1] 吴娇杨, 胡勇胜, 李泓. 锂离子电池和金属锂离子电池的能量密度计算[J]. 储能科学与技术, 2016, 5(4): 443-453.
WU Jiaoyang, HU Yongsheng, LI Hong. Calculation on energy densities of lithium ion batteries and metallic lithium ion batteries[J]. Energy Storage Science and Technology, 2016, 5(4): 443-453.
[2] POPE M A, AKSAY I A. Structural design of cathodes for Li-S batteries[J]. Adv. Energy Mater., 2015, 5(16): 1500124.
[3] ZHANG S, UENO K, DOKKO K, et al. Recent advances in electrolytes for lithium-sulfur batteries[J]. Adv. Energy Mater., 2015, 5(16): 1500117.
[4] LIANG J, SUN Z H, LI F, et al. Carbon materials for Li-S batteries: Functional evolution and performance improvement[J]. Energy Storage Materials, 2015, 2: 76-106.
[5] 周兰, 余爱水. 锂硫电池硫碳复合正极材料研究现状及展望[J]. 电化学, 2015, 21(3): 211-220.
ZHOU Lan, YU Aishui. Current status and prospect of cathode materials for lithium sulfur batteries[J]. Journal of Electrochemistry, 2015, 21(3): 211-220.
[6] BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O2and Li-S batteries with high energy storage[J]. Nat. Mater., 2012, 11(1): 19-29.
[7] JI X, LEE K T, NAZAR L F. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nat. Mater., 2009, 8(6): 500-506.
[8] 张强, 程新兵, 黄佳琦, 等. 碳质材料在锂硫电池中的应用研究进展[J]. 新型炭材料, 2014, 29(4): 241-264.
ZHANG Qiang, CHENG Xinbing, HUANG Jiaqi, et al. Review of carbon materials for advanced lithium sulfur batteries[J]. New Carbon Materials, 2014, 29(4): 241-264.
[9] CHEN L, SHAW L L. Recent advances in lithium-sulfur batteries[J]. J. Power Sources, 2014, 267(1): 770-783.
[10] SONG M K, CAIRNS E J, ZHANG Y. Lithium/sulfur batteries with high specific energy: Old challenges and new opportunities[J]. Nanoscale, 2013, 5(6): 2186-2204.
[11] YIN Y X, XIN S, GUO Y G, et al. Lithium-sulfur batteries: Electrochemistry, materials, and prospects[J]. Angew. Chem. Int. Ed., 2013, 52(50): 13186-13200.
[12] FANG X, PENG H. A revolution in electrodes: Recent progress in rechargeable lithium-sulfur batteries[J]. Small, 2015, 11(13): 1488-1511.
[13] 胡菁菁, 李国然, 高学平. 锂/硫电池的研究现状、问题及挑战[J]. 无机材料学报, 2013, 28(11): 1181-1186.
HU Jingjing, LI Guoran, GAO Xueping. Current status, problems and challenges in lithium-sulfur batteries[J]. Journal of Inorganic Materials, 2013, 28(11): 1181-1186.
[14] 杨蓉, 邓坤发, 刘晓艳, 等. 锂硫电池正极复合材料研究现状[J]. 化工进展, 2015, 34(5): 1340-1344.
YANG Rong,DENG Kunfa,LIU Xiaoyan, et al. Recent progress of sulfur composites as cathode materials for lithium sulfur batteries[J]. Chemical Industry and Engineering Progress, 2015, 34(5): 1340-1344.
[15] 梁骥, 闻雷, 成会明, 等. 碳材料在电化学储能中的应用[J]. 电化学, 2015, 21(6): 505-517.
LIANG Ji, WEN Lei, CHENG Huiminig, et al. Applications of carbon materials in electrochemical energy storage[J]. Journal of Electrochemistry, 2015, 21(6): 505-517.
[16] ROSENMAN A, MARKEVICH E, SALITRA G, et al. Review on Li-sulfur battery systems: An integral perspective[J]. Adv. Energy Mater., 2015, 5(16): 212-233.
[17] FEI L, LI X, BI W, et al. Graphene/sulfur hybrid nanosheets from a space-confined "sauna" reaction for high-performance lithium-sulfur batteries[J]. Adv. Mater., 2015, 27(39): 5936-5942.
[18] WANG J L,YANG J, XIE J Y, et al. Sulfur-carbon nano-composite as cathode for rechargeable lithium battery based on gel electrolyte[J]. Electrochem. Commun., 2002, 4(6): 499-502.
[19] MANTHIRAM A, FU Y, CHUNG S H, et al. Rechargeable lithium-sulfur batteries[J]. Chem. Rev., 2014, 114(23): 11751-11787.
[20] ZHENG G,YANG Y, CHA J J, et al. Hollow carbon nanofiber-encapsulated sulfur cathodes for high specific capacity rechargeable lithium batteries[J]. Nano Lett., 2011, 11(10): 4462-4467.
[21] GUO J, XU Y, WANG C. Sulfur-impregnated disordered carbon nanotubes cathode for lithium-sulfur batteries[J]. Nano Lett., 2011, 11(10): 4288-4294.
[22] MA X Z, JIN B, XIN P M, et al. Multiwalled carbon nanotubes-sulfur composites with enhanced electrochemical performance for lithium/sulfur batteries[J]. Appl. Surf. Sci., 2014, 307(15): 346-350.
[23] JI L, RAO M, ALONI S, et al. Porous carbon nanofiber-sulfur composite electrodes for lithium/sulfur cells[J]. Energy Environ. Sci., 2011, 4(12): 5053.
[24] YU M, LI R, WU M, et al. Graphene materials for lithium-sulfur batteries[J]. Energy Storage Materials, 2015, 1: 51-73.
[25] LV W, LI Z, DENG Y, et al. Graphene-based materials for electrochemical energy storage devices: Opportunities and challenges[J]. Energy Storage Materials, 2016, 2: 107-138.
[26] YAN B, LI X, BAI Z, et al. A review of atomic layer deposition providing high performance lithium sulfur batteries[J]. J. Power Sources, 2017, 338(15): 34-48.
[27] ZHAO M Q, ZHANG Q, HUANG J Q, et al. Unstacked double-layer templated graphene for high-rate lithium-sulphur batteries[J]. Nat. Commun., 2013, 5: 3410-3417.
[28] LI B, LI S, LIU J, et al. Vertically aligned sulfur-graphene nanowalls on substrates for ultrafast lithium-sulfur batteries[J]. Nano Lett., 2015, 15(5): 3073-3079.
[29] DUAN X, HAN Y, HUANG L, et al. Improved rate ability of low cost sulfur cathodes by using ultrathin graphite sheets with self-wrapped function as cheap conductive agent[J]. J. Mater. Chem. A, 2015, 3(15): 8015-8021.
[30] XU H, DENG Y, SHI Z, et al. Graphene-encapsulated sulfur (GES) composites with a core-shell structure as superior cathode materials for lithium-sulfur batteries[J]. J. Mater. Chem. A, 2013, 1(47): 15142.
[31] JIN J, WEN Z, MA G, et al. Flexible self-supporting graphene-sulfur paper for lithium sulfur batteries[J]. RSC Adv., 2013, 3(8): 2558.
[32] WANG H, YANG Y, LIANG Y, et al. Graphene-wrapped sulfur particles as a rechargeable lithium-sulfur battery cathode material with high capacity and cycling stability[J]. Nano Lett., 2011, 11(7): 2644-2647.
[33] LEE J, KIM J, HYEON T. Recent progress in the synthesis of porous carbon materials[J]. Adv. Mater., 2006, 18(16): 2073-2094.
[34] 张松涛, 郑明波, 曹洁明, 等. 锂硫电池用多孔碳/硫复合正极材料的研究[J]. 化学进展, 2016, 28(8): 1148-1155.
ZHANG Songtao, ZHNEG Mingbo, CAO Jieming, et al. Porous carbon/sulfur composite cathode materials for lithium-sulfur batteries[J].Progress in Chemistry, 2016, 28(8): 1148-1155.
[35] LI Z, HUANG Y, YUAN L, et al. Status and prospects in sulfur-carbon composites as cathode materials for rechargeable lithium-sulfur batteries[J]. Carbon, 2015, 92: 41-63.
[36] XIN S, GU L, ZHAO N H, et al. Smaller sulfur molecules promise better lithium-sulfur batteries[J]. J. Am. Chem. Soc., 2012, 134(45): 18510-18513.
[37] LI Z, YUAN L, YI Z, et al. Insight into the electrode mechanism in lithium-sulfur batteries with ordered microporous carbon confined sulfur as the cathode[J]. Adv. Energy Mater., 2014, 4(7): 1301473.
[38] WANG D W, ZHOU G M, LI F, et al. A microporous-mesoporous carbon with graphitic structure for a high-rate stable sulfur cathode in carbonate solvent-based Li-S batteries[J]. Phys. Chem. Chem. Phys., 2012, 14(24): 8703-8710.
[39] SCHUSTER J, HE G, MANDLMEIER B, et al. Spherical ordered mesoporous carbon nanoparticles with high porosity for lithium-sulfur batteries[J]. Angew. Chem. Int. Ed., 2012, 51(15): 3591-3595.
[40] LIANG C, DUDNEY N J, HOWE J Y. Hierarchically structured sulfur/carbon nanocomposite material for high-energy lithium battery[J]. Chem. Mater., 2009, 21(19): 4724-4730.
[41] CHEN R, ZHAO T, LU J, et al. Graphene-based three-dimensional hierarchical sandwich-type architecture for high-performance Li/S batteries[J]. Nano Lett., 2013, 13(10): 4642-4649.
[42] PU X, YANG G, YU C. Liquid-type cathode enabled by 3D sponge-like carbon nanotubes for high energy density and long cycling life of Li-S batteries[J]. Adv. Mater., 2014, 26(44): 7456-7461.
[43] ZHOU G, PEI S, LI L, et al. A graphene-pure-sulfur sandwich structure for ultrafast, long-life lithium-sulfur batteries[J]. Adv. Mater., 2014, 26(4): 625-631, 664.
[44] FANG R, ZHAO S, HOU P, et al. 3D interconnected electrode materials with ultrahigh areal sulfur loading for Li-S batteries[J]. Adv. Mater., 2016, 28(17): 3374-3382.
[45] ZHOU G, YIN L, WANG D, et al. Fibrous hybrid of graphene and sulfur nanocrystals for high-performance lithium sulfur batteries[J]. ACS Nano, 2013, 7(6): 5367-5375.
[46] FENG X, SONG M K, STOLTE W C, et al. Understanding the degradation mechanism of rechargeable lithium/sulfur cells: A comprehensive study of the sulfur-graphene oxide cathode after discharge-charge cycling[J]. Phys. Chem. Chem. Phys., 2014, 16(32): 16931-16940.
[47] GUO J, YANG Z, YU Y, et al. Lithium-sulfur battery cathode enabled by lithium-nitrile interaction[J]. J. Am. Chem. Soc., 2013, 135(2): 763-767.
[48] MA L, HENDRICKSON K E, WEI S, et al. Nanomaterials: Science and applications in the lithium-sulfur battery[J]. Nano Today, 2015, 10(3): 315-338.
[49] JI L, RAO M, ZHENG H, et al. Graphene oxide as a sulfur immobilizer in high performance lithium/sulfur cells[J]. J. Am. Chem. Soc., 2011, 133(46): 18522-18525.
[50] TAO X, WANG J, YING Z, et al. Strong sulfur binding with conducting Magneli-phase TiO2n-1nanomaterials for improving lithium-sulfur batteries[J]. Nano Lett., 2014, 14(9): 5288-5294.
[51] CHENG H, WANG S. Recent progress in polymer/sulphur composites as cathodes for rechargeable lithium-sulphur batteries[J]. J. Mater. Chem. A, 2014, 2: 13783-13794.
[52] 李高然, 李洲鹏, 林展. 锂硫电池中碳质材料的研究进展[J]. 储能科学与技术, 2016, 5(2): 135-148.
LI Gaoran, LI Zhoupeng, LIN Zhan. Carbon-based materials for advanced lithium-sulfur batteries[J]. Energy Storage Science and Technology, 2016, 5(2): 135-148.
[53] 万文博, 蒲薇华, 艾德生. 锂硫电池最新研究进展[J]. 化学进展, 2013, 25(11): 1830-1841.
WAN Wenbo, PU Weihua, AI Desheng. Research progress in lithium sulfur battery[J]. Progress in Chemistry, 2013, 25(11): 1830-1841.
[54] ZU C, MANTHIRAM A. Hydroxylated graphene-sulfur nanocomposites for high-rate lithium-sulfur batteries[J]. Adv. Energy Mater., 2013, 3(8): 1008-1012.
[55] XU J, SHUI J, WANG J, et al. Sulfur graphene nanostructured cathodesball-milling for high-performance lithium sulfur batteries[J]. Acs Nano, 2015, 8(10): 10920-10930.
[56] WU F, CHEN J, CHEN R, et al. Sulfur/polythiophene with a core/shell structure: Synthesis and electrochemical properties of the cathode for rechargeable lithium batteries[J]. J. Phys. Chem. C, 2011, 115(13): 6057-6063.
[57] XU G, DING B, NIE P, et al. Porous nitrogen-doped carbon nanotubes derived from tubular polypyrrole for energy-storage applications[J]. Chem. Eur. J., 2013, 19(37): 12306-12312.
[58] YIN L, WANG J, LIN F, et al. Polyacrylonitrile/graphene composite as a precursor to a sulfur-based cathode material for high-rate rechargeable Li-S batteries[J]. Energy Environ. Sci., 2012, 5(5): 6966-6972.
[59] DING K, BU Y, LIU Q, et al. Ternary-layered nitrogen-doped graphene/sulfur/polyaniline nanoarchitecture for the high-performance of lithium-sulfur batteries[J]. J. Mater. Chem. A, 2015, 3: 8022-8027.
[60] XIAO L, CAO Y, XIAO J, et al. A soft approach to encapsulate sulfur: Polyaniline nanotubes for lithium-sulfur batteries with long cycle life[J]. Adv. Mater., 2012, 24(9): 1176-1181.
[61] ZHOU G, ZHAO Y, MANTHIRAM A. Dual-confined flexible sulfur cathodes encapsulated in nitrogen-doped double-shelled hollow carbon spheres and wrapped with graphene for Li-S batteries[J]. Adv. Energy Mater., 2015, 5(9): 1402263.
[62] WANG X, ZHANG Z, QU Y, et al. Nitrogen-doped graphene/sulfur composite as cathode material for high capacity lithium-sulfur batteries[J]. J. Power Sources, 2014, 256: 361-368.
[63] WANG C, SU K, WAN W, et al. High sulfur loading composite wrapped by 3D nitrogen-doped graphene as a cathode material for lithium-sulfur batteries[J]. J. Mater. Chem. A, 2014, 2(14): 5018.
[64] TANG C, ZHANG Q, ZHAO M Q, et al. Nitrogen-doped aligned carbon nanotube/graphene sandwiches: facile catalytic growth on bifunctional natural catalysts and their applications as scaffolds for high-rate lithium-sulfur batteries[J]. Adv. Mater., 2014, 26(35): 6100-6105.
[65] LI L, ZHOU G, YIN L, et al. Stabilizing sulfur cathodes using nitrogen-doped graphene as a chemical immobilizer for Li-S batteries[J]. Carbon, 2016, 108: 120-126.
[66] YANG C P, YIN Y X, YE H, et al. Insight into the effect of boron doping on sulfur/carbon cathode in lithium-sulfur batteries[J]. Acs Appl. Mater. Interfaces, 2014, 6(11): 8789-8795.
[67] XING L, XI K, LI Q, et al. Nitrogen, sulfur-codoped graphene sponge as electroactive carbon interlayer for high-energy and -power lithium-sulfur batteries[J]. J. Power Sources, 2016, 303(30): 22-28.
[68] BALACH J, SINGH H K, GOMOLL S, et al. Synergistically enhanced polysulfide chemisorption using a flexible hybrid separator with N and S dual-doped mesoporous carbon coating for advanced lithium-sulfur batteries[J]. Acs Appl. Mater. Interfaces, 2016, 8(23): 14586-14595.
[69] LI Y, MI R, LI S, et al. Sulfur-nitrogen doped multi walled carbon nanotubes composite as a cathode material for lithium sulfur batteries[J]. Int. J. Hydrogen Energ., 2014, 39(28): 16073-16080.
[70] ZHOU G, PAEK E, HWANG G S, et al. Long-life Li/polysulphide batteries with high sulphur loading enabled by lightweight three-dimensional nitrogen/sulphur-codoped graphene sponge[J]. Nat. Commun., 2015, 6: 7760-7771.
[71] QIU Y, LI W, ZHAO W, et al. High-rate, ultralong cycle-life lithium/sulfur batteries enabled by nitrogen-doped graphene[J]. Nano Lett., 2014, 14(8): 4821-4827.
[72] SONG J, GORDIN M L, XU T, et al. Strong lithium polysulfide chemisorption on electroactive sites of nitrogen-doped carbon composites for high-performance lithium-sulfur battery cathodes[J]. Angew. Chem. Int. Ed., 2015, 54(14): 4325-4329.
[73] YIN L C, LIANG J, ZHOU G M, et al. Understanding the interactions between lithium polysulfides and N-doped graphene using density functional theory calculations[J]. Nano Energy, 2016, 25: 203-210.
[74] HOU T, PENG H, HUANG J, et al. The formation of strong-couple interactions between nitrogen-doped graphene and sulfur/lithium (poly)sulfides in lithium-sulfur batteries[J]. 2D Materials, 2015, 2(1): 14011.
[75] DING B, SHEN L, XU G, et al. Encapsulating sulfur into mesoporous TiO2host as a high performance cathode for lithium-sulfur battery[J]. Electrochim. Acta., 2013, 107(30): 78-84.
[76] LIANG X H, YE C C, SHI L, et al. Impact of C-S-TiO2composite material coated by graphene on the conductive properties of sulfur cathode material[J]. Int. J. Electrochem. Sci., 2014, 9: 6677-6685.
[77] MA X Z, JIN B, WANG H Y, et al. S-TiO2composite cathode materials for lithium/sulfur batteries[J]. J. Electroanal. Chem., 2015, 736(1): 127-131.
[78] KIM H, LEE J T, LEE D C, et al. Plasma-enhanced atomic layer deposition of ultrathin oxide coatings for stabilized lithium-sulfur batteries[J]. Adv. Energy Mater., 2013, 3(10): 1308-1315.
[79] TAO Y, WEI Y, LIU Y, et al. Kinetically-enhanced polysulfide redox reactions by Nb2O5nanocrystals for high-rate lithium-sulfur battery[J]. Energy Environ. Sci., 2016, 9: 3230-3239.
[80] KIM M S, SHIN E S, KIM J S, et al. The effect of V2O5/C additive on the suppression of polysulfide dissolution in Li-sulfur batteries[J]. J. Electroceram., 2014, 33(3/4): 142-148.
[81] YU M, MA J, SONG H, et al. Atomic layer deposited TiO2on a nitrogen-doped graphene/sulfur electrode for high performance lithium-sulfur batteries[J]. Energy Environ. Sci., 2016, 9: 1495-1503.
[82] LIANG X, HART C, PANG Q, et al. A highly efficient polysulfide mediator for lithium-sulfur batteries[J]. Nat. Commun., 2015, 6: 5682.
[83] PANG Q, KUNDU D, CUISINIER M, et al. Surface-enhanced redox chemistry of polysulphides on a metallic and polar host for lithium-sulphur batteries[J]. Nat. Commun., 2014, 5: 4759-4767.
[84] ZHOU J, LIN N, CAI W L, et al. Synthesis of S/CoS2nanoparticles-embedded N-doped carbon polyhedrons from polyhedrons ZIF-67 and their properties in lithium-sulfur batteries[J]. Electrochim. Acta, 2016, 218(10): 243-251.
[85] SEH Z W, YU J H, LI W, et al. Two-dimensional layered transition metal disulphides for effective encapsulation of high-capacity lithium sulphide cathodes[J]. Nat. Commun., 2014, 5: 5017.
[86] HAO Z, YUAN L, CHEN C, et al. TiN as a simple and efficient polysulfide immobilizer for lithium-sulfur batteries[J]. J. Mater. Chem. A, 2016, 4: 17711-17717.
[87] SUN Z, ZHANG J, YIN L, et al. Conductive porous vanadium nitride/graphene composite as chemical anchor of polysulfides for lithium-sulfur batteries[J]. Nat. Commun., 2017, 8: 14627-14635.
[88] JIANG J, ZHU J, AI W, et al. Encapsulation of sulfur with thin-layered nickel-based hydroxides for long-cyclic lithium-sulfur cells[J]. Nat. Commun., 2015, 6: 8622-8631.
[89] NIU X Q, WANG X L, XIE D, et al. Nickel hydroxide-modified sulfur/carbon composite as a high-performance cathode material for lithium sulfur battery[J]. Acs Appl. Mater. Interfaces, 2015, 7(30): 16715-16722.
[90] QIAN X, JIN L, WANG S, et al. Zn-MOF derived micro/meso porous carbon nanorod for high performance lithium-sulfur battery[J]. RSC Adv., 2016, 6: 94629-94635.
[91] XU G, DING B, SHEN L, et al. Sulfur embedded in metal organic framework-derived hierarchically porous carbon nanoplates for high performance lithium-sulfur battery[J]. J. Mater. Chem. A, 2013, 1(14): 4490.
[92] ZHOU J, LI R, FAN X, et al. Rational design of a metal-organic framework host for sulfur storage in fast, long-cycle Li-S batteries[J]. Energy Environ. Sci., 2014, 7(8): 2715.
[93] ZHENG J, TIAN J, WU D, et al. Lewis acid-base interactions between polysulfides and metal organic framework in lithium sulfur batteries[J]. Nano Lett., 2014, 14(5): 2345-2352.
[94] ZHAO Y, SONG Z, LI X, et al. Metal organic frameworks for energy storage and conversion[J]. Energy Storage Materials, 2016, 2: 35-62.
[95] SONG J, XU T, GORDIN M L, et al. Nitrogen-doped mesoporous carbon promoted chemical adsorption of sulfur and fabrication of high-areal-capacity sulfur cathode with exceptional cycling stability for lithium-sulfur batteries[J]. Advanced Functional Materials, 2014, 24 (9): 1243-1250.
Cathode hybrid materials for lithium-sulfur battery: The interaction between the host and polysulfide
1,2,1,1,1,2,1
(1Institute of Metal Research, Chinese Academy of Sciences, Shenyang 110016, Liaoning, China;2Shandong University of Technology, Institute of Chemical Engineering, Zibo 255091, Shandong, China)
With the increasing demand for efficient and economic energy storage, lithium-sulfur (Li-S) batteries have become attractive candidates for the next-generation high-energy rechargeable batteries because of their high theoretical energy density and cost effectiveness. However, practical applications of the Li-S battery are hindered by poor cycle life, low coulombic efficiency, self-discharge, et al. Main reason of these issues is the polysulfide shuttle, which caused by the dissolution of polysulfides into the electrolyte and deposition on the lithium anode. Several strategies have been proposed in order to tackle these issues and improve the overall electrochemical performance of the Li-S batteries. In particular, among them, the preparation of sulfur hybrid materials by different carbon materials or various functional carbon based materials is frequently used. In this review, we present fundamental studies and technological development of various cathode materials for Li-S batteries, including their preparation, structure, morphology and battery performance. Based on the adsorption characteristics between the host and polysulfide, the materials are divided into two types: physical adsorption and chemical adsorption. Adjusting or functionalizing the electrode materials can effectively promote the performance of the Li-S batteries, and the mechanism is further revealed to gain a better understanding of the characteristics between the host and polysulfide. Finally, we give insights on the relation between the structure of the cathode materials and the electrochemical performance of the Li-S batteries and the critical research directions needed for lithium sulfur batteries to be addressed are summarized.
lithium-sulfur batteries; physical adsorption; chemical adsorption; sulfur-based composite cathode
10.12028/j.issn.2095-4239.2017.0018
O 646.21
A
2095-4239(2017)03-345-15
2017-03-06;
2017-03-26。
国家重大科学研究计划项目(2014CB93240,2016YFA0200100,2016YFB0100100),国家自然科学基金项目(51525206,51521091,51372253,U1401243),中科院先导专项(XDA01020304)。
唐晓楠(1987—),女,博士研究生,研究方向为锂硫电池电极材料,E-mail:xntang@imr.ac.cn;
李峰,研究员,研究方向为电化学储能材料及器件,E-mail:fli@imr.ac.cn。
