不同强度运动对骨骼肌纤维MHC亚型转化及CaN/NFATc1信号通路的影响*
2017-10-14尹丽琴李范玲汤长发刘文锋黄洪波
尹丽琴, 李范玲, 汤长发, 陶 霞, 刘文锋, 黄洪波, 邓 勇, 汤 林
(1. 湖南师范大学体育学院, 长沙 410012; 2. 湖南省人民医院, 长沙 410005; 3. 湖南工业大学体育学院, 株洲 412008; 4. 湖南商学院体育部, 长沙 410018)
不同强度运动对骨骼肌纤维MHC亚型转化及CaN/NFATc1信号通路的影响*
尹丽琴1,3, 李范玲2+, 汤长发1△, 陶 霞4, 刘文锋1, 黄洪波1, 邓 勇1, 汤 林1
(1. 湖南师范大学体育学院, 长沙 410012; 2. 湖南省人民医院, 长沙 410005; 3. 湖南工业大学体育学院, 株洲 412008; 4. 湖南商学院体育部, 长沙 410018)
目的研究不同强度运动对骨骼肌纤维MHC亚型转化及钙调神经磷酸酶(CaN)/活化T细胞核因子1(NFATc1)信号通路的影响。方法雄性SD大鼠(2月龄)24只,随机分为3组(n=8):正常对照组(NC)、中等强度组(ME)、大强度组(HE),进行8周跑台训练。采用ATP酶染色法测定I、II型肌纤维,凝胶电泳技术分离肌球蛋白重链(MHC)亚型,比色法测定骨骼肌中CaN活性,免疫印迹技术测定骨骼肌NFATc1蛋白含量。结果①肌纤维密度变化:股四头肌ME组I、II型纤维数密度均显著增加(P<0.05),HE组仅II型纤维面密度显著增加(P<0.05);比目鱼肌HE、ME组I型纤维数密度均显著增加(P<0.05);②肌纤维MHC亚型百分比变化:股四头肌ME组MHCI、IIa百分比升高(P<0.05),而MHCIIb百分比降低(P<0.05);比目鱼肌MHCI百分比升高,MHCIIa、IIb百分比降低;③ME组大鼠CaN活性、NFAT1蛋白含量均显著升高(P<0.05)。结论大、中等强度运动可诱导骨骼肌MHC快型向慢型转化,同时伴随肌纤维亚型变化骨骼肌中CaN活性增加、NFATc1蛋白表达增加。
钙调神经磷酸酶;肌球蛋白重链;活化T细胞核因子;大、中强度运动; 大鼠
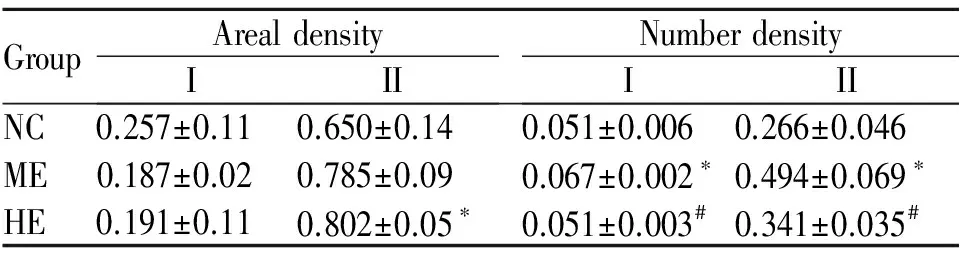
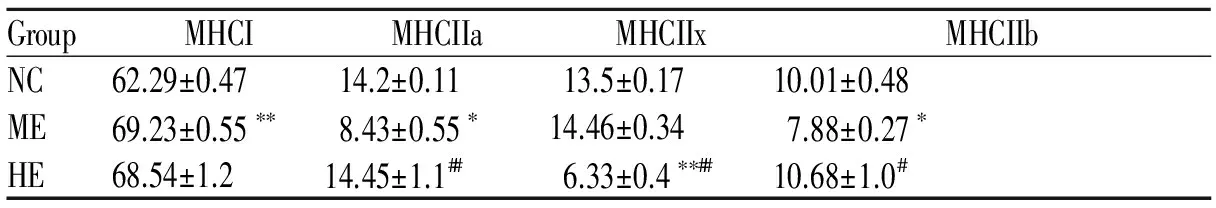
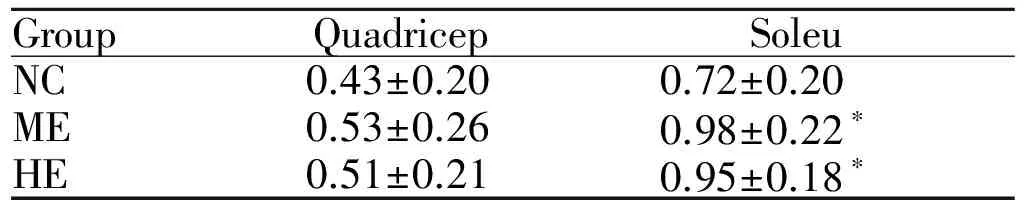
肌纤维类型与废用性肌萎缩、骨骼肌老龄化等情况密切相关,同时肌纤维比例还关系到运动员的耐力和爆发力水平[1]。目前,哺乳动物骨骼肌主要分为I型、IIa型、IId/x型和IIb型[2]。MHC作为骨骼肌收缩的主要成分,其收缩速度排序:MHC-I 目前对骨骼肌MHC亚型转化的机理存在多种解释,如肌源性调节因子(myogenic regulatory factor, MRFs)[6]途径、PGC-1α/β、AMPK和PPARδ[7]信号通路等。研究较多的两条途径为CaN/NFAT和MRFs途径。CaN/NFAT广泛参与T细胞分化成熟、血管平滑肌细胞增殖、肌细胞肥大、神经元突触传递和细胞因子产生等[8],CaN被认为是骨骼肌重塑的重要信号分子,且研究证实它也参与骨骼肌分化、纤维转型。本实验通过对大鼠进行8周中、大强度的跑台运动,观察不同强度运动中骨骼肌CaN活性及NFATc1蛋白表达的变化以及对骨骼肌纤维类型的影响,以期进一步分析探讨CaN/NFAT信号通路在对有氧运动适应过程中的可能机制提供理论解释。 1.1 实验动物 SD健康雄性大鼠(2月龄)24只,购自湖南农业大学动物实验中心。动物购买适应饲养3 d后,先进行适应性训练1周(跑台坡度递增到10°,持续时间递增到40 min,速度递增到26.8 m/min)。实验期间按国家动物饲养标准进行喂养。 1.2 实验分组与运动方案 动物随机分为3组(n=8):正常对照组(NC)、中强度运动组(ME)、大强度运动组(HE)。采用杭州立泰科技有限公司PT动物实验跑台,参照Bedford[9]、丁树哲[10]的运动负荷强度标准。中强度运动组:坡度5°,速度18 m/min,运动持续时间60 min。大强度运动组:跑台速度3 min左右升到26.8 m/min,坡度10°,运动时间为40 min[11]。训练时间每天15: 00~17: 00,每周训练5 d,休息2 d,共8周。 1.3 样品采集与处理 8周训练结束后,以10%的水合氯醛腹腔麻醉,断头处死。迅速取大鼠右后肢股四头肌和比目鱼肌,冰生理盐水洗去残留血迹,去掉脂肪和结缔组织,放入-80℃超低温冰箱中保存备用。 肌组织冰冻切片:从超低温冰箱(-80℃)中取出大鼠肌组织,先置于常温冰箱-20℃复温15~20 min,再放入4℃环境复温10~15 min, 最后常温复温10~15 min。复温后进行OCT包埋速冻,同时将冰冻切片机开机预冷到-18℃~-20℃;将速冻好的标本制作切片(厚度8 μm),每个组织切3张切片。切好后平整地粘附到经过多聚赖氨酸处理的载玻片上。 1.4 指标检测 1.4.1 ATP酶染色 ATP酶染色是研究肌纤维的重要的组织化学方法之一,将切片置室温干燥30~60 min后再进行ATP酶染色。pH 10.4的碱性环境中预孵大鼠肌纤维冰冻切片,Ⅰ型肌纤维显浅棕色或不显色,Ⅱ型肌纤维显深棕色或黑色。封固后,组织切片在同一天进行拍照,拍照采用Motic Med 6.013数码医学图像分析系统,每张切片至少分析4个独立区域,计算Ⅰ、Ⅱ型肌纤维的目标个数、目标面积比例[12]等。 1.4.2 聚丙烯酰胺凝胶电泳(SDS-PAGE) 采用BCA试剂盒测定匀浆上清液的蛋白浓度,浓缩胶和分离胶的浓度分别为4%和8%, 均含30 %的甘油。电极缓冲液中含0.1%的SDS(十二烷基硫酸钠), 其它步骤按常规实验步骤进行[13]。取各样蛋白20 μg,并加等体积的样品缓冲液,在100℃沸水中水浴3~6 min, 恒压70 V, 在4℃冰箱中电泳38 h。电泳结束后将凝胶放入考马斯亮兰(G-250)染色液中37℃染色1 h。染色完毕后,置于脱色液中多次脱色,直至凝胶的蓝色背景褪清、蛋白质条带清晰为止。待凝胶脱色后,用Tanon凝胶图像拍摄系统扫描并计算MHC亚型的灰度值和百分比[14]。由于分子量的差异不同可将肌凝蛋白重链被分离成四条清晰的条带(条带分布呈以下势:MHCⅠ>MHCⅡb>MHCⅡx>MHCⅡa)[15]。 1.4.3 钙调神经磷酸酶活性检测 采用比色法(上海杰美基因医药科技有限公司CaN活性试剂盒)测定骨骼肌组织中CaN的活性。按照说明书操作测定比目鱼肌与股四头肌中CaN活性,实验重复3次(n=5)。 1.4.4 骨骼肌组织NFATc1的表达检测 采用免疫印迹方法检测骨骼肌组织中NFATc1的表达,首先加400 μl单去污剂裂解液裂(含PMSF)入骨骼肌组织中匀浆裂解,后采用BCA法测定各样品蛋白浓度;随后进行SDS-聚丙烯酸胺凝胶电泳4~5 h,转膜用 1×丽春红染液染色5 min。一抗孵育:Actin抗体(1∶500稀释)/NPR-C抗体(1∶100稀释);酶标:二抗孵育加入5%脱脂奶粉稀释的辣根过氧化物酶标记的第二抗体(1∶4 000)孵育1.5 h;最后将膜置于ECL 显色工作液中进行显色。将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值[16,17]。 1.5 统计学分析 2.1训练强度对骨骼肌I型和II型肌纤维密度变化的影响 2.1.1 股四头肌I型和II型肌纤维密度变化 训练后股四头肌肌纤维密度变化与对照组相比,大强度组II型肌纤维数密度显著增加(P<0.05),I型肌纤维数密度及II型肌纤维面密度均有所增加,但差异不显著;中等强度组I、II型肌纤维数密度显著增加(P<0.05),且与大强度运动组相比I、II型肌纤维数密度显著增加(P<0.05,表1,图1)。 GroupArealdensityIIINumberdensityIIINC0.257±0.110.650±0.140.051±0.0060.266±0.046ME0.187±0.020.785±0.090.067±0.002∗0.494±0.069∗HE0.191±0.110.802±0.05∗0.051±0.003#0.341±0.035# NC: Normal control group; ME: Moderate intensity exercise group; HE: Heavy intensity exercise group *P<0.05vsNC;#P<0.05vsME Fig.1Quadricep's ATPase staining figure(×100) A: Normal control group; B: Moderate intensity exercise group; C: Heavy intensity exercise group 2.1.2 比目鱼肌I型和II型肌纤维密度变化 训练后比目鱼肌肌纤维密度变化与对照组相比,中等强度组和大强度运动组比目鱼肌I型肌纤维面密度均增加, 差异无显著性。中等强度运动组和大强度运动组比目鱼肌I型纤维数密度均增加(P<0.05),II型纤维数密度均减少,差异不显著(表2,图2)。 2.2 训练强度对骨骼肌MHC亚型百分比的影响 2.2.1 股四头肌MHC亚型百分比变化情况 与对照组相比,大强度组MHC亚型IIa百分比、IIb百分比显著降低(P<0.05),IIx百分比显著升高(P<0.05);中等强度组MHC亚型IIb百分比显著降低(P<0.05),I百分比、IIa百分比显著升高(P<0.05)。大强度组与中等强度组相比,MHC亚型I、IIa纤维百分比显著降低(P<0.05),MHCIIx百分比显著升高(P<0.05, 表3)。 GroupArealdensityIIINumberdensityIIINC0.709±0.0140.241±0.0120.168±0.0420.149±0.057ME0.814±0.0480.198±0.110.322±0.025∗0.126±0.076HE0.767±0.0470.211±0.130.289±0.011∗0.132±0.041 NC: Normal control group; ME: Moderate intensity exercise group; HE: Heavy intensity exercise group *P<0.05vsNC;#P<0.05vsHE Fig.2Soleu's ATPase staining figure(×100) A: NC group; B: ME group; C: HE group Tab. 3 Quadricep's MHC subtype percentage change(%, ±s, n=8) NC: Normal control group; ME: Moderate intensity exercise group; HE: Heavy intensity exercise group *P<0.05vsNC;#P<0.05vsME 2.2.2 比目鱼肌MHC亚型百分比变化情况 与对照组相比,中等强度组MHC亚型I百分比显著升高(P<0.01),IIa、IIb肌百分比显著降低(P<0.05);大强度组MHC亚型I型肌纤维百分比显著升高(P<0.01),IIx百分比显著降低(P<0.01);大强度组与中等强度组相比,MHC亚型IIa百分比升高、MHCIIx百分比显著降低(P<0.01),IIb百分比显著升高(P<0.05,表4)。 GroupMHCIMHCIIaMHCIIxMHCIIbNC62.29±0.4714.2±0.1113.5±0.1710.01±0.48ME69.23±0.55∗∗8.43±0.55∗14.46±0.347.88±0.27∗HE68.54±1.214.45±1.1##6.33±0.4∗∗##10.68±1.0# NC: Normal control group; ME: Moderate intensity exercise group; HE: Heavy intensity exercise group **P<0.01vsNC;#P<0.05,##P<0.01vsME 2.3训练强度对骨骼肌钙调神经磷酸酶活性的影响 8周训练后,大、中等强度组与对照组相比大鼠股四头肌钙调神经磷酸酶(CaN)活性升高。与对照组相比,大、中等强度组大鼠比目鱼肌CaN活性显著升高(P<0.05,表5)。 GroupQuadricepSoleuNC0.43±0.200.72±0.20ME0.53±0.260.98±0.22∗HE0.51±0.210.95±0.18∗ *P<0.05vsNC 2.4 训练强度对骨骼肌NFATc1蛋白表达的影响 中等强度组股四头肌与比目鱼肌NFATc1蛋白含量均显著升高(P<0.05),大强度组NFATc1蛋白含量升高。中等强度组与大强度组相比,NFATc1蛋白含量略有升高,但无统计学意义(表6)。 GroupQuadricepSoleuNC0.877±0.0981.003±0.142ME1.325±0.146∗1.457±0.076∗HE0.762±0.09781.107±0.166 *P<0.05vsNC 本研究结果显示:运动可使骨骼肌I、II型肌纤维密度增加,即可使骨骼肌肥大。这与众多研究结果一致,Terje等[18]研究发现自愿者进行训练后肌纤维Ⅰ型、Ⅱ型横截面积均显著增加;Pilar等[19]研究显示,12周高强度间歇速度训练后大鼠股直肌Ⅰ、ⅡA、ⅡX纤维的相对横截面积显著增大。同时这种变化与运动训练强度、肌纤维类型有关。本研究中大鼠肌四头肌II型肌纤维、比目鱼肌I型肌纤维选择性肥大;Hostler等[20]研究显示,18周大强度递增负荷训练可使肌纤维适应性肥大,同时在肌纤维类型比例上可使快肌纤维向慢肌纤维转化。 肌纤维转化不是从一个极端快速(快肌纤维)跨越到另一个极端(慢肌纤维),而是在分子水平中逐级过渡转化的,即肌原纤维蛋白亚型的转变。根据本研究中MHC亚型百分比的变化,可推测中等强度运动可诱导股四头肌MHC亚型IIb向I、IIa转化,比目鱼肌MHC亚型IIa、IIb向I转化;而大强度运动可诱导股四头肌MHC亚型IIa、IIb向IIx转化,比目鱼肌MHC亚型IIx向I转化。与大部分学者研究结果相似,Bruton[21]研究发现耐力训练可以引起骨骼肌纤维MHC亚型Ⅱx向Ⅱa转变,MHCⅠ表达增加。逄金柱等[22]研究发现耐力训练后,股四头肌MHC亚型IIx、IIa基因表达显著增加,但快型MHCIIb和慢型MHCI基因表达没有发生显著变化。与前人研究也存在一定的差异,张宇[23]等研究发现小强度运动可引起,即由快型向慢型变化;而中、大强度运动可引起MHC亚型肌纤维向I、IIa、向IIx、Ⅱb方向变化,即由慢型向快型变化。究其原因可能与实验采取的运动方案有关,本文中等强度运动为坡度5°,速度18 m/min,而张宇研究中小强度为19 m/min;本研究大强度运动为坡度10°,速度26.8 m/min,而张宇研究中等强度为26 m/min。由此可推断依据丁树哲[10]运动负荷标准,大、中等强度运动有诱导骨骼肌MHC亚型发生快型向慢型转化的趋势。 CaN在骨骼肌细胞培养中有选择性的上调慢肌纤维启动子表达,以及可诱导骨骼肌纤维由慢向快转化[23]。本研究可推测:中等强度运动可以激活CaN活性,引起NFATc1蛋白表达增加;伴随着运动引起的骨骼肌快型MHC向慢型MHC转化过程中,CaN同样发生了相应的变化,CaN信号途径与运动诱导的骨骼肌纤维类型转化确实存在一定的关联。Delling等[24]通过成肌细胞培养研究证实钙调神经磷酸酶信号途径参与骨骼肌MHCI型的分化与表达,且对促进骨骼肌MHCII型向MHCI型转化具有明显作用。CaN可以刺激MHCI基因启动子和MHCI肌纤维分化[25]。有研究表明NFAT可做为神经活动的感受器,可对慢型小α运动神经元活动有选择性的应答[25];NFAT在心肌、骨骼细胞分化与肥大中均有较大的作用,在骨骼肌纤维类型分化NFAT作用主要是基于NFATc1[26]。由此可提示CaN/NFATc1信号对骨骼肌细胞分化及运动诱导肌纤维转化具有重要生理学作用,主要角色为促进慢肌生长、修复,抑制快肌MHC基因表达等。 [1] 于 亮, 陈晓萍, 王瑞元. 4周红景天、红景天苷灌胃对小鼠骨骼肌纤维类型的影响及机制[J]. 北京体育大学学报, 2014, 37(6): 54-58. [2] 于 亮, 陈晓萍, 王瑞元. 骨骼肌纤维类型转化的分子调控机制研究进展[J]. 中国运动医学杂志, 2014, 5(33): 470-475. [3] Zhang MY, Zhang WJ, Medler S. The continuum of hybrid IIX/IIB fibers in normal mouse muscles:MHC isoform proportions and spatial distribution within single fibers[J].AmJPhysiolRegulIntegrCompPhysiol, 2010, 299(6): R1582-1591. [4] 魏安奎, 危小焰, 史仍飞, 等. 振动训练对大鼠骨骼肌最大力量和肌纤维形态结构的影响[J]. 中国运动医学杂志, 2009, 28(1): 83-84. [5] 满维祥. 不同强度运动对大鼠骨骼肌肌纤维类型的影响[D]. 长沙, 湖南师范大学: 2010. [6] Daou N, Lecolle S, Lefebvre S,etal. A new role for the calcineurin/NFAT pathway in neonatal myosin heavy chain expression via the NFATc2/MyoD complex during mouse myogenesis[J].Development, 2013, 140(24): 4914-4925. [7] 袁 媛, 刘月光, 史新娥, 等. 调控骨骼肌纤维类型转化的信号通路[J]. 中国生物化学与分子生物学报, 2010, 26(9): 796-801. [8] Bassel-Duby R, Olson ENEN. Signaling pathways in skeletal muscle remodeling[J].AnnuRevBiochem, 2006, 75: 19 -37. [9] Bedford TG, Tipton CM, Wilson NC ,etal. Maximum oxygen consumption of rats and its changes with various experimental procedures[J].ApplPhysiol, 1979, 47(6): 1278-1283. [10]丁树哲, 陈彩珍, 漆正堂, 等. 不同强度训练对大鼠骨骼肌p53 和细胞色素氧化酶I亚基基因和蛋白表达的影响[J]. 中国运动医学杂志, 2008, 27(4): 454-457. [11]任昭君. 不同强度的运动训练对大鼠骨骼肌自由基的影响[J]. 中国应用生理学杂志, 2006, 22(3): 367-368. [12]张 宇, 满维祥, 汤长发. 不同强度运动训练对大鼠比目鱼肌肌纤维类型与MHC 亚型的影响[J]. 北京体育大学学报, 2011, 8(34): 48-53. [13]何忠效, 张树政. 电泳[M]. 北京: 科学出版社, 1999: 5-186. [14]李江华, 邓树勋, 汤长发. 运动诱导的大鼠腓肠肌细胞凋亡与肌纤维类型百分比构成关系的研究[J]. 中国运动医学杂志, 2008, 3(27): 344-347. [15]Talmadge RJ, Roy RR.Electro pho reticseparatio n of rat skeletal muscle my osin heavy-chain isoforms[J].JApplPhysiol, 1993, 75(11): 2337-2340. [16]廖八根, 徐 勇, 薛耀明. 钙调神经磷酸酶在耐力运动大鼠骨骼肌纤维类型和大小转变中的作用[J]. 中国运动医学杂志, 2008, 27(5): 551-555. [17]宋卫红, 汤长发, 刘文锋. 离心运动对大鼠骨骼肌细胞凋亡和增殖的影响[J]. 中国应用生理学杂志, 2013, 29(1): 86-90. [18]Gjφvaag TF, Dahl HA.DahlEVect of training with diVerent intensities and volumes on muscle Wbre enzyme activity and cross sectional area in the m. triceps Brachii[J].EurJApplPhysiol, 2008, 103(4): 399-409. [19]Diaz-Herrera P, García-Castellano JM, Torres A,etal. Effect of high-intensity running in rectus femoris muscle fiber in rats[J].JOrthopRes, 2001, 19(2): 229-232. [20]Hostler D, Schwirian CI, Campos G,etal. Skeletal muscle adaptations in elastic resistance-trained young men and women[J].EurJApplPhysiol, 2011, 86(2): 112-118. [21]Bruton A.Muscle plasticity: Response to training and detraining[J].Physiotherapy, 2012, 88(7): 398-408. [22]逄金柱, 王瑞元. 2周耐力训练对大鼠骨骼肌肌动蛋白和肌球蛋白重链基因表达的影响[J]. 中国运动医学杂志, 2005, 24(4): 415-418. [23]Chin ER, Olson EN, Richardson JA,etal. A calcineurin-dependent transcript-tional pathway controls skeletal muscle fiber type[J].GenesDev, 1998, 12(16): 2499-2509. [24]Delling U, Tureckova J, Lim HW,etal. A calcineurin-NFATc3-dependent pathway regulates skeletal muscle differentiation and slow myosin heavy-chain expression[J].MolCellBiol, 2015, 20(17): 6600-6611. [25]Swoap SJ, Hunter RB, Stevenson EJ,etal. The calcineurin-NFAT pathway and muscle fiber-type gene expression[J].AmJPhysiolCellPhysiol, 2014, 279(4): C915-924. [26]李范玲. 运动对大鼠骨骼肌纤维类型的影响以及CaN/NFAT信号机制初步研究[D]. 长沙: 湖南师范大学, 2011. TheeffectofdifferentintensityexerciseonskeletalmusclefiberMHCsubtypetransformationandCaN/NFATc1signalingpathways YIN Li-qin1, 3, LI Fan-ling2+, TANG Chang-fa1△, TAO Xia4, LIU Wen-feng1, HUANG Hong-bo1, DENG Yong1, TANG Lin1 (1. Physical Education, Hunan Norma University Changsha 410012; 2. People's Hospital of Hunan Province, Changsha 410005; 3. Physical Education, Hunan University of Technology, Zhuzhou 412008; 4. Hunan University of Commerce Sports Department, Changsha 410018, China) Objective: To study the effect of different intensity exercise on skeletal muscle fiber myosin heavy chain(MHC) subtype transformation and CaN/NFATc1 signaling pathways.MethodsTwenty-four Male SD rats (2-month old) were randomly divided into normal control group (NC), moderate intensity exercise group (ME, grade 5°, speed 18 m/min), heavy intensity exercise group (HE, grade 10°, 26.8 m/min). The rats in exercise groups were treated with treadmill training for eight weeks. The type I and type II muscle fibers were determined by ATPase staining method. MHC subtype was separated by SDS-PAGE. The activity of CaN was determined by colorimetric method. The content of NFATc1 protein in skeletal muscle was detected by immune imprinting technology.Results①Skeletal muscle fiber density changes: the type I and II fiber number density of quadriceps in ME group were increased significantly (P<0.05), but in HE group, only the type II fiber surface density was increased significantly (P<0.05). The type I fiber number density of soleus in ME and HE group was increased significantly (P<0.05). ②The changes of fibers MHC subtype percentage in skeletal muscle: the percentages of MHC I and type IIa of quadriceps in ME group were increased (P<0.05), while the percentage of MHC IIb was decrease (P<0.05). The percentage of MHC I in soleus was increased, while the percentages of MHCIIa and IIb were decreased. ③The activity of CaN and the content of NFATc1 protein in ME group were increased significantly (P<0.05).ConclusionThe heavy and moderate intensity exercise may induce skeletal muscle MHC type transforming from fast to slow. At the same time, the activity of CaN and the expression of NFATc1 protein are increased accompanying the changes of skeletal muscle fibers subtype. calcineurin; myosin heavy chain; nfat; heavy、moderate intensity exercise; rat G804.2 A 1000-6834(2017)04-360-05 湖南省自然科学基金资助(14JJ7035);湖南省研究生科研创新项目课题资助(CX2014B229) 2016-06-03 2016-12-05 △ Tel: 0731-88713700; E-mail: Tangchangfa@sina.com;+: 并列第一作者 10.12047/j.cjap.5462.2017.0871 材料与方法
2 结果










3 讨论
